Method Article
Especificación de progenitores hepáticos a partir de células madre pluripotentes utilizando un sistema de diferenciación definida
En este artículo
Resumen
El objetivo de este artículo es proporcionar un enfoque estandarizado para inducir la diferenciación de progenitores hepáticos humanos a partir de células madre pluripotentes. El desarrollo de este procedimiento con formulaciones de medios listas para usar ofrece al usuario un sistema fácil para generar células hepáticas humanas para la investigación biomédica y la traducción.
Resumen
La enfermedad hepática es un problema de salud mundial en aumento. Si bien el trasplante de hígado es un modo efectivo de terapia, la mortalidad de los pacientes ha aumentado debido a la escasez de disponibilidad de órganos de donantes. La escasez de órganos también afecta el suministro rutinario de hepatocitos humanos para la investigación básica y la clínica. Por lo tanto, el desarrollo de fuentes renovables de células progenitoras del hígado humano es deseable y es el objetivo de este estudio. Para poder generar y desplegar eficazmente progenitores hepáticos humanos a gran escala, se desarrolló un sistema de diferenciación de progenitores hepáticos reproducibles. Este protocolo ayuda a la reproducibilidad experimental entre usuarios en una variedad de formatos de software de cultivo celular y permite diferenciaciones utilizando líneas de células madre pluripotentes embrionarias humanas e inducidas. Estas son ventajas importantes sobre los sistemas de diferenciación actuales que mejorarán la investigación básica y pueden allanar el camino hacia el desarrollo de productos clínicos.
Introducción
La enfermedad hepática representa un desafío de salud global, causando aproximadamente 2 millones de muertes por año en todo el mundo1. Aunque existen varios sistemas modelo para estudiar enfermedades hepáticas e intervenir clínicamente, el uso rutinario de sistemas basados en células está limitado por inconvenientes significativos (para una revisión ver Szkolnicka et al.2). Los métodos avanzados de cultivo de células madre pluripotentes humanas (hPSC) y de diferenciación de células somáticas representan tecnologías prometedoras para desarrollar herramientas para la investigación biomédica básica y fuentes renovables de células diferenciadas para la clínica3,4.
Hasta la fecha, se han desarrollado múltiples protocolos para la diferenciación de células similares a hepatocitos (HLC)5,6,7,8. Estos protocolos intentan recrear aspectos del desarrollo del hígado humano mediante el uso de una combinación de moléculas pequeñas y factores de crecimiento9,10. La mayoría de los protocolos consisten en un proceso de diferenciación gradual, donde las hPSC se preparan para el endodermo definitivo, seguido de la especificación de progenitor hepático11,12,13y terminando con la especificación HLC. Los HHLC producidos por estos protocolos muestran una mezcla de fenotipos fetales y adultos. Esto incluye la expresión de alfa fetoproteína (AFP), como marcadores de hepatocitos como HNF4α y albúmina (ALB), así como la capacidad de metabolización de fármacos14,15,16. Entre laboratorios, la diferenciación de HLC puede variar; por lo tanto, es necesario el desarrollo de protocolos estandarizados. Esto permitirá a los investigadores generar y aplicar eficazmente HHLC derivados de células madre a gran escala para la investigación básica y clínica.
Se desarrolló un sistema de diferenciación de progenitores hepáticos que se puede aplicar tanto a líneas de células madre embrionarias humanas como pluripotentes inducidas utilizando pautas fáciles de seguir. Este procedimiento produce poblaciones homogéneas de progenitores hepáticos en diferentes formatos de cultivo, que van desde matraces de cultivo celular hasta placas de 96 pomos. A continuación se proporciona el protocolo para producir progenitores hepáticos derivados de células madre en formatos de 24 y 96 pozos.
La densidad celular utilizada en el protocolo presentado a continuación se especifica para un pozo de una placa de 24 y 96 pozos respectivamente (ver Tabla 1). Se requiere la optimización del número de células de partida para los diferentes formatos de placas de cultivo celular y líneas celulares. La densidad de celdas de partida sugerida para la optimización del protocolo es de 2 x10 5 celdas/cm2. Para la optimización de la densidad, se pueden probar varias densidades celulares agregando ± 50,000 celdas / cm2 a la vez.
Protocolo
1. Mantenimiento de células madre pluripotentes humanas (hPSC) en laminina-521
- Mantener las células pluripotentes humanas (hPSCs) a 37 °C y 5% de CO2 en una placa de 6 pomos en laminina-521 (LN-521). Alimente las células diariamente con 2 ml de medio de mantenimiento de células madre (es decir, medio mTeSR1) por pozo de una placa de 6 pozos hasta el día de siembra elegido para la diferenciación (día 0).
- Asegúrese de que se logre la confluencia celular deseada del 70-80% antes de la recolección celular.
2. Preparación multiflorante laminina-521 y siembra hPSC para diferenciación
NOTA: Para las hPSC no mantenidas con LN-521 (por ejemplo, matrigel o fibronectina), divida las hPSC en LN-521 y cultve durante 1 semana antes del paso y provoque la diferenciación para mejorar la eficiencia del proceso15,17,18.
- Preparación de placas recubiertas de laminina
- Descongele un vial de LN-521 recombinante (100 μg/ml) a 4 °C durante 2 h o durante la noche.
- Prepare una solución de 8 μg/ml diluyendo el LN-521 descongelado en 1x DPBS helado con Ca2+/Mg2+.
- Agregue 0.25 mL de la solución LN-521 de 8 μg/mL a cada pozo de una placa de 24 pozos o 0.05 mL a cada pozo de una placa de 96 pozos. Balancee la placa suavemente de lado a lado para cubrir uniformemente los pozos con la solución LN-521.
NOTA: Para el formato de placa de 96 pozos, la dispensación de volumen, la siembra de celdas y los cambios de medio se pueden realizar utilizando una tubería semiautomatizada. Para más detalles, véase Meseguer-Ripolles et al.19. - Selle las placas recubiertas LN-521 con una película semitransparente y flexible y guárdela a 4 °C durante la noche antes de su uso.
NOTA: Las placas recubiertas de LN-521 se pueden usar hasta por 2 semanas cuando se almacenan a 4 ° C. Evite cualquier secado de los pozos recubiertos de laminina.
- El día de la siembra celular, caliente las placas prerecubiertas en una incubadora de cultivo celular a 37 °C durante 30-60 min.
- Aspire la solución LN-521.
NOTA: Evite el contacto directo del aspirador con el fondo del pozo para evitar daños en el recubrimiento LN-521. - Dispensar 0,5 ml de medio de mantenimiento de células madre con un inhibidor de la quinasa asociada a Rho (ROCK) de 10 μM recién suplementado y27632 a cada pozo de una placa de 24 pozos o 0,05 ml a cada pozo de una placa de 96 pozos. Coloque la placa en la incubadora hasta que esté lista para la siembra celular.
- En el día de siembra programado (día 0) y con una confluencia de hPSC entre el 70-80%, marque cualquier región de diferenciación espontánea en el fondo de los pomos de la placa de 6 pomos.
NOTA: La diferenciación espontánea se puede visualizar mediante un cambio bruto en el tamaño de la célula y / o la presencia de diferentes morfologías celulares utilizando microscopía de contraste de fase. - Aspirar y descartar las regiones marcadas de diferenciación y el medio gastado de los pozos. Lavar cada pozo con 1 ml de DPBS sin Ca2+/Mg2+ a temperatura ambiente (RT).
- Añadir 1 ml de reactivo de disociación libre de enzimas (ver Tabla de materiales)a cada pozo e incubar a 37 °C durante 8-10 min hasta que las células se desprendan visiblemente de la placa.
- Use un raspador de celdas para separar suavemente las células de los pozos. Pipetear el contenido de cada pozo hacia arriba y hacia abajo 2–4x con una pipeta P1000 para producir una suspensión de una sola celda. Para cada línea celular, acose las células de todos los pozos de mantenimiento en un tubo estéril de 50 ml.
- Lave cada pozo vaciado con 1 ml del medio de mantenimiento de células madre. Añadir los lavados al tubo correspondiente que contiene las celdas agrupadas de la línea celular apropiada.
- Para cada línea celular, realice tres recuentos de células viables en las muestras agrupadas. Calcule el recuento promedio de células vivas (células vivas/ml) para cada línea celular.
- Centrifugar las muestras agrupadas a 250 x g durante 5 min en RT. Aspire el sobrenadante, luego resuspenda la bolita celular en 1-3 ml de medio de mantenimiento de células madre RT, recién complementado con el inhibidor de ROCK de 10 μM Y27632.
- Para cada línea celular, calcule el número de celdas necesario según el número de pozos preparados en el paso 2.4 (ver Tabla 1). Resuspend el número de célula requerido con medio de mantenimiento de células madre recién suplementado con 10 μM inhibidor de ROCK Y27632.
- Agregue los volúmenes calculados en los pozos de las placas preparadas y precubiertas del paso 2.4 sin quitar el volumen agregado anteriormente. El volumen total por pozo será de 1 mL para una placa de 24 pozos y de 0,1 mL para una placa de 96 pozos. Balancee suavemente las placas de lado a lado y hacia adelante y hacia atrás para garantizar una dispersión uniforme de las células en todo el pozo.
NOTA: Una distribución celular uniforme a través del pozo es clave para garantizar la siembra celular homogénea y la diferenciación exitosa. - Coloque las placas secuedradas en la incubadora e inmediatamente balancee las placas secuedradas suavemente hacia adelante y hacia atrás y de lado a lado para distribuir uniformemente las células y mantener los cultivos a 37 ° C y 5% de CO2.
3. Diferenciación de hPSCs a progenitores hepáticos en laminina-521
- Preparar los medios para la inducción definitiva del endodermo (etapa 1) utilizando el medio basal Endoderm suplementado con los aditivos correctos.
- El día 0, descongele la botella del Endoderm Basal Medium durante la noche a 4 °C.
- Prepare la Etapa 1 Media 1 (para usar el día 1) según sea necesario.
- Descongelar suplemento MR y suplemento CJ sobre hielo.
- Suplemento diluido MR y Suplemento CJ 1:100 en el medio basal Endoderm.
- Prepare la Etapa 1 Media 2 para usarla en los días 2-4 según sea necesario.
- Suplemento diluido CJ 1:100 en el medio basal endodermo.
- Preparar los medios para la posterior diferenciación de la especificación de células progenitoras hepáticas (Etapa 2) utilizando el Medio Progenitor Hepático.
- El día 4, descongele la botella del Hepatic Progenitor Medium durante la noche a 4 °C.
NOTA: Para este experimento se utilizó penicilina/estreptomicina al 1% (concentraciones finales de 100 UI/ml y 100 μg/ml, respectivamente). No se requieren antibióticos; el uso de antibióticos queda a discreción del usuario.
- El día 4, descongele la botella del Hepatic Progenitor Medium durante la noche a 4 °C.
- En el día 1 de la diferenciación, retire el medio de mantenimiento de células madre gastado con 10 μM de medio ROCKi Y-27632 de los pozos y reemplácelo con 0.5 mL de Etapa 1 Media completa 1 por pozo de una placa de 24 pozos y 0.1 mL por pozo de una placa de 96 pozos.
- En los días 2, 3 y 4, retire el medio gastado y alimente cada pozo con 0.5 mL de Stage 1 Medium 2 por pozo para una placa de 24 pozos o 0.1 mL por pozo de una placa de 96 pozos.
- El día 5, arregle los pozos para el análisis definitivo de diferenciación del endodermo a través de inmunocitoquímica. Para los pozos restantes, retire el medio gastado y alimente cada pozo con 0,5 ml de medio de diferenciación de progenitores hepáticos por pozo para una placa de 24 pozos o 0,1 ml por pozo de una placa de 96 pozos. Refresque el medio nuevamente en los días 6, 7 y 9.
- El día 10, cosecha los pozos para el análisis de diferenciación de progenitores hepáticos o procede con una mayor diferenciación celular similar a los hepatocitos.
NOTA: En este punto de tiempo, las muestras se fijaron con paraformaldehído al 4% (PFA) para el análisis de inmunocitoquímica o se recolectó sobrenadante para ELISA y se recolectaron células para la cuantificación de proteínas.
4. Caracterización de los cultivos de diferenciación de progenitores hepáticos generados a partir de hPSCs sobre laminina-521
- El día 5, detectar la expresión de marcadores definitivos específicos del endodermo mediante inmunotinción.
- El día 10, detectar la expresión de marcadores hepáticos específicos de progenitores mediante inmunotinción.
- El día 10, mida la secreción de AFP y ALB a través de ELISA utilizando un kit siguiendo las instrucciones del fabricante y normalice por mg de proteína según lo determinado por un ensayo de proteína de ácido bicinconínico (BCA).
- Evaluar la variabilidad del progenitor hepático de la placa de 96 pozos cuantificando el porcentaje de células HNF4α positivas por pozo.
5. Inmunocitoquímica y adquisición de imágenes
- En los días 5 y 10 de la diferenciación, lave las células 3x con 1x DPBS, con 0.5 mL por pozo de una placa de 24 pozos y 0.1 mL por pozo de una placa de 96 pozos. Incubar la placa con agitación suave durante 2-5 min en RT.
NOTA: Use DPSB sin Ca2+/ Mg2+ para inmunocitoquímica. - Fije las células con paraformaldehído (PFA) al 4% en RT durante 15-30 min agregando 0.3 mL de PFA por pozo para una placa de 24 pozos y 0.1 mL por pozo de una placa de 96 pozos.
- Lave 3x con 1x DPBS como se describe en el paso 5.1.
- Permeabilizar la membrana con PBST usando 0.1% Tween, 1x DPBS e incubar durante 20 min a RT agregando 0.3 mL de PBST por pozo de una placa de 24 pozos y 0.1 mL por pozo de una placa de 96 pozos.
- Realice el bloqueo de proteínas incubando las células con 10% de BSA en PBST durante 1 h, agregando 0.3 mL de BSA por pozo de una placa de 24 pozos y 0.1 mL de BSA por pozo de una placa de 96 pozos, agitando suavemente usando un agitador de placas.
- Después del bloqueo de proteínas, reemplace la solución de bloqueo con el anticuerpo primario diluido en BSA al 1% en PBST e incube a 4 ° C con agitación suave durante la noche.
NOTA: No lave entre el bloqueo de proteínas y la adición de anticuerpos. - Después de 24 h, lave los pozos 3 veces con PBST.
- Agregue el anticuerpo secundario en BSA al 1% en PBST. Incubar 1 h en RT en la oscuridad con suave agitación.
- Después de la incubación secundaria de anticuerpos, lave los pocillos 3 veces con 1x DPBS y dispense la tinción de Hoechst de acuerdo con las instrucciones del fabricante durante 10 minutos en RT en la oscuridad con un suave agitación.
- Lavar 3x con 1x DPBS. Las placas ya están listas para la obtención de imágenes.
NOTA: Guarde las placas a 4 °C en la oscuridad hasta la toma de imágenes. - Imagine la placa multipanúbil utilizando un microscopio de imágenes de alto contenido después de la inmunohistoquímica. Se recomienda la adquisición de imágenes de varios campos de visión para obtener una verdadera representación del pozo. La expresión de los diferentes marcadores se evaluó mediante análisis de segmentación celular utilizando software comercial (ver Tabla de Materiales)(Figura 1).
NOTA: La segmentación celular también se puede realizar utilizando un software de código abierto de análisis de imágenes como CellProfiler o Fiji20,21.
Resultados
La diferenciación de progenitores hepáticos de las líneas hESC (H9) e hiPSC (P106) se realizó siguiendo el protocolo paso a paso descrito en la Figura 2. Aquí, las células madre pluripotentes se sembraron como células individuales en placas recubiertas de LN-521 antes del inicio de la diferenciación. La confluencia celular es la clave para una diferenciación robusta y reproducible. Una vez alcanzada la correcta confluencia(Figura 2),se inició la diferenciación. En el día 5, se evaluó la especificación definitiva del endodermo a través de la expresión de Sox17. En ambas líneas celulares, Sox17 fue altamente expresado con 80% ± 0.5% y 87.8% ± 0.5% SEM de células Sox17 positivas para H9 y P106, respectivamente (Figura 3). En el día 10, los progenitores hepáticos mostraron una morfología similar a un adoquín(Figura 2). Además, se evaluó la especificación del progenitor hepático para la expresión de HNF4α, AFP, ALB y citoqueratina-19 (CK19), así como para la secreción de proteínas AFP y ALB10,15,22 (Figura 4). Tanto los cultivos progenitores hepáticos H9 como P106 expresaron marcadores hepáticos fetales como HNF4α (91% ± 0,5% y 90% ± 0,2%), AFP (89,7% ± 1,8% y 86% ± 1,2%) y CK19 (78,5% ± 3,2% y 83,6 ± 1,8%) (Figura 4). La secreción de AFP se detectó en el día 10 en ambas líneas celulares (32,4 ± 1,6 y 47,8 ± 5,9 ng/mL/mg/24 h)(Figura 5). La síntesis de albúmina se observó en niveles más bajos (30,7% ± 1,8% y 27,2% ± 1,1%)(Figura 4)y no se detectó a través de ELISA(Figura 5).
El protocolo permitió la producción estandarizada de progenitores hepáticos de 24 pozos a 96 placas de pozos. Se empleó una tubería semiautomatizada para producir 96 placas de pozos de progenitores hepáticos de líneas celulares H9 y P106 como se describió anteriormente17. La variabilidad del número celular y la eficiencia de la diferenciación de progenitores hepáticos se evaluaron mediante la cuantificación de la expresión de HNF4α. La segmentación celular se realizó para la cuantificación de proteínas mediante inmunofluorescencia utilizando un instrumento de imagen de alto contenido(Figura 1). En el día 10, los progenitores hepáticos no mostraron variabilidad significativa entre las filas con >94% de células HNF4α positivas por pozo para H9 y 97% de células HNF4α positivas para P106 (Figura 6).

Figura 1: Descripción general de la tubería de segmentación celular. (A) Utilizando la imagen original, (B) se utilizó la tinción nuclear para la segmentación de núcleos. (C) Se realizó una etapa de control de calidad de la segmentación nuclear basada en la forma y el tamaño para cuantificar solo núcleos claramente segmentados. (D) A raíz de esto, se cuantificaron los núcleos teñidos con HNF4α positivos. (E) Por último, se empleó un umbral basado en la intensidad para identificar las células que expresan HNF4α. En C y E,los núcleos verdes representan células seleccionadas y los núcleos magenta indican células descartadas. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diferenciación de progenitores hepáticos a partir de hPSCs. (A) Representación esquemática del protocolo de diferenciación de progenitores hepáticos. (B) Imágenes representativas que destacan los cambios morfológicos durante la diferenciación. En el día 0 (D0), las hPSC presentaron una monocapa empaquetada de células. Después de esto, las hPSC se prepararon en endodermo definitivo en el día 5 (D5). Esto fue seguido por la diferenciación del progenitor hepático en el día 10 (D10). Los progenitores hepáticos mostraron una morfología celular similar a la de un adoquín. Barra de escala = 75 μm. Haga clic aquí para ver una versión más grande de esta figura.
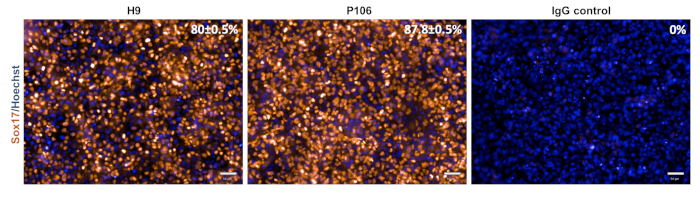
Figura 3: Caracterización de la especificación definitiva del endodermo. En el día 5, las células se tiñeron para Sox17, un marcador de endodermo definitivo. El porcentaje de células Sox17 positivas fue de 80 ± 0,5% para H9 y 87,8 ± 0,5% para P106. La cuantificación porcentual se basó en 10 pozos separados con 6 campos de visión por pozo. Los datos se muestran como el promedio ± SEM. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Caracterización de progenitores hepáticos. En el día 10, los progenitores hepáticos se tiñeron para los marcadores hepáticos (A) HNF4α, (B) AFP y (C) ALB. Para H9, el porcentaje de células positivas fue de 91% ± 0.4%, 89.7% ± 1.8% y 30.7% ± 1.8% para HNF4α, AFP y ALB, respectivamente. Para P106, el porcentaje de células positivas fue de 90% ± 0.2%, 86% +/- 1.2% y 27.2% ± 1.1% para HNF4α, AFP y ALB, respectivamente. (D) El potencial de linaje de colangiocitos se evaluó a través de la expresión de CK19; Los progenitores hepáticos derivados de H9 expresaron un 78,5% ± un 3,2% de células CK19 positivas, mientras que el 83,6% ± el 1,8% de las células CK19 positivas se observaron para los progenitores hepáticos P106. La tinción de inmunoglobulina G (IgG) se utilizó como control de tinción. La cuantificación porcentual se basó en 10 pozos separados con 6 campos de visión por pozo. Los datos se muestran como el promedio ± SEM. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Análisis de secreción de proteínas progenitoras hepáticas. La secreción de alfa fetoproteína (AFP) y albúmina (ALB) se analizó en cultivos progenitores hepáticos en el día 10 en H9 y P109. Los datos representan tres réplicas biológicas y las barras de error representan la SD. Las proteínas secretadas se cuantificaron a partir de un medio de cultivo de 24 h como nanogramos de proteína secretada por ml por mg de proteína, n = 3; ND = no detectado. Haga clic aquí para ver una versión más grande de esta figura.
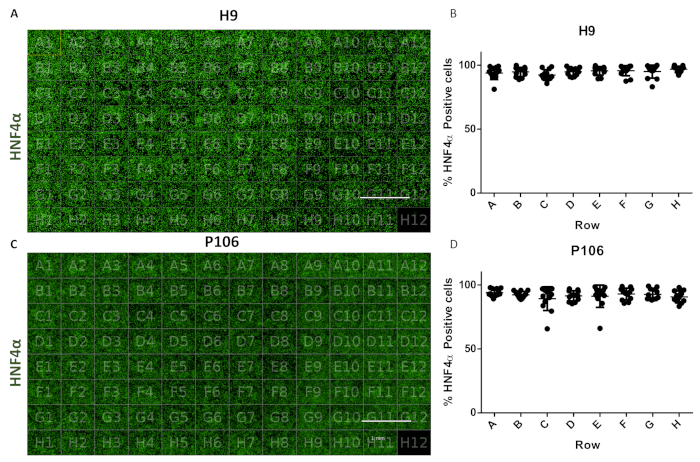
Figura 6: Evaluación de la variabilidad de pozo a pozo en la placa de 96 pozos. (A) Visualización de una vista de placa de 96 pozos de progenitores hepáticos derivados de H9 teñidos con HNF4α. (B) Cuantificación de las células HNF4α-positivas. Promedio de número de celdas por pozo en filas, de seis campos de visión por pozo cuantificado. El número promedio de células en toda la placa fue de 94.81% ± 0.22 células SEM HNF4α positivas por pozo. No se observaron diferencias estadísticamente significativas entre los pozos. (C) Visualización de una vista de placa de 96 pozos de progenitores hepáticos derivados de P106 teñidos con HNF4α. (D) Cuantificación de células HNF4α positivas. El número medio de celdas por pozos en filas, de seis campos de visión por pozo y cuantificado. El número promedio de células en toda la placa fue de 97.7% ± 0.57 células SEM HNF4α positivas por pozo. No se observaron diferencias estadísticamente significativas entre las filas. Well H12 se utilizó como un control de tinción de inmunoglobulina G (IgG). Barra de escala = 1 mm. Se empleó ANOVA unidireccional con las pruebas estadísticas post-hoc de Tukey. Haga clic aquí para ver una versión más grande de esta figura.
| Formato de placa | Superficie (cm2) | Celdas por cm2 | Total de células por pozo | Volumen de dispensación (ml) | Concentración celular (células/ml) |
| Placa de 24 pozos | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| Placa de 96 pozos | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
Tabla 1: Densidad celular recomendada para los diferentes formatos de placa para las líneas celulares hPSC utilizadas en este protocolo.
Discusión
La generación de células progenitoras hepáticas humanas a partir de células madre pluripotentes a gran escala podría representar una alternativa prometedora al material derivado de cadáveres. La estandarización y reproducibilidad de protocolos son clave para garantizar la traducción de la tecnología y el impacto en la investigación biomédica. Para abordar esto, el trabajo previo se ha centrado en desarrollar un protocolo de diferenciación escalonada a partir de hESC e iPSC utilizando aditivos y matrices definidos15,23,24,25,26,27,28. De este manera, se ha mejorado el fenotipo y la reproducibilidad de los hepatocitos, permitiendo la semiautomatización del proceso de diferenciación19. El sistema presentado se ve reforzado por su combinación con medios de cultivo celular listos para usar y un sistema de diferenciación de hepatocitos fácil.
Anteriormente, se destacaba la densidad celular pluripotente previa al inicio del protocolo de diferenciación como variable clave para conseguir una población homogénea de células progenitoras hepáticas26. Utilizando este procedimiento más refinado, es posible generar un gran número de progenitores hepáticos derivados de células madre de manera gradual utilizando un rango de densidades celulares iniciales (Tabla 1). En el día 5, la inducción definitiva del endodermo fue validada por tinción Sox17(Figura 3). La diferenciación eficiente y robusta en endodermo definitivo se logró con las líneas ESC e iPSC probadas, con más del 80% expresando Sox17(Figura 3). En el día 10, los progenitores hepáticos mostraron una morfología uniforme similar a un adoquín, y los marcadores de células madre hepáticas fueron altamente enriquecidos tanto para AFP como para HNF4α (>86%, Figura 4). Utilizando una combinación de tecnologías manuales y semiautomatizadas fue posible realizar la diferenciación en múltiples formatos de placas19.
En su forma actual, la diferenciación celular es adecuada para la experimentación in vitro. Sin embargo, es probable que se requiera enriquecimiento celular antes de la aplicación clínica para garantizar que una población homogénea de progenitores hepáticos esté preparada para la entrega.
En conclusión, el protocolo descrito aquí proporciona al campo un enfoque estandarizado para producir progenitores hepáticos a gran escala. El trabajo futuro se centrará en la producción de un nuevo medio para la posterior diferenciación, maduración y mantenimiento de HLC.
Divulgaciones
David C. Hay es cofundador y accionista de Stemnovate Ltd. El resto de los autores certifican que no tienen conflictos de interés en el tema o materiales tratados en este artículo.
Agradecimientos
Este estudio fue apoyado con premios de la Asociación de Formación Doctoral de MRC (MR/K501293/1), la Plataforma de Medicina Regenerativa del Reino Unido (MRC MR/L022974/1 y MR/K026666/1), la Oficina científica principal (TCS/16/37).
Materiales
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
Referencias
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados