Method Article
מפרט פרוגניטור בכבד מתאי גזע פלוריפוטנטים באמצעות מערכת בידול מוגדרת
In This Article
Summary
מטרת מאמר זה היא לספק גישה סטנדרטית כדי לגרום בידול אב האדם בכבד מתאי גזע פלוריפוטנטים. הפיתוח של הליך זה עם ניסוחים מדיה מוכנים לשימוש מציעים למשתמש מערכת facile כדי ליצור תאי כבד אנושיים למחקר ותרגום ביו-רפואי.
Abstract
מחלת כבד היא בעיה בריאותית עולמית הולכת וגוברת. בעוד השתלת כבד היא מצב יעיל של טיפול, תמותת המטופל גדלה עקב מחסור בזמינות איברים תורם. מחסור באיברים משפיע גם על האספקה השגרתית של הפאטוציטים אנושיים למחקר בסיסי ולקליניקה. לכן, פיתוח מקורות מתחדשים של תאי אב כבד אנושיים הוא רצוי והוא המטרה של מחקר זה. כדי להיות מסוגל ביעילות ליצור ולפרוס אבות כבד אנושי בקנה מידה גדול, מערכת בידול כבד לשחזור פותחה. פרוטוקול זה מסייע לשחזור ניסיוני בין משתמשים במגוון פורמטים של כלי תרבות של תאים ומאפשר הבחנות באמצעות שניהם, קווי תאי גזע עובריים אנושיים ומושרים. אלה הם יתרונות חשובים על פני מערכות בידול נוכחיות שישפרו את המחקר הבסיסי ועשויים לסלול את הדרך לפיתוח מוצרים קליניים.
Introduction
מחלת כבד מייצגת אתגר בריאותי עולמי, גרימת כ -2 מיליון מקרי מוות בשנה ברחבי העולם1. למרות שקיימות מספר מערכות מודל לחקר מחלות כבד והתערבות קלינית, השימוש השגרתי במערכות מבוססות תאים מוגבל על ידי חסרונות משמעותיים (לסקירה ראו Szkolnicka et al.2). תרבות תאי גזע פלוריפוטנטיים אנושיים מתקדמים (hPSC) ושיטות בידול תאים סומטיים מייצגים טכנולוגיות מבטיחות לפיתוח כלים למחקר ביו-רפואי בסיסי ומקורות מתחדשים של תאים מובחנים למרפאה3,4.
עד כה, פרוטוקולים מרובים לבידול תאים דמויי hepatocyte (HLC) פותחו5,6,7,8. פרוטוקולים אלה מנסים לשחזר היבטים של התפתחות הכבד האנושי באמצעות שילוב של מולקולות קטנות וגורמי גדילה9,10. רוב הפרוטוקולים מורכבים מתהליך בידול צעדים, שבו hPSCs מוכנים אנדודרם סופי, ואחריו מפרט אבות בכבד11,12,13, ומסתיים עם מפרט HLC. HLCs המיוצרים על ידי פרוטוקולים אלה מציגים תערובת של פנוטיפים עובריים ומבוגרים. זה כולל את הביטוי של אלפא fetoprotein (AFP), כגון סמני hepatocyte כגון HNF4α ו אלבומין (ALB), כמו גם יכולת חילוף חומרים סמים14,15,16. בין מעבדות, בידול HLC יכול להשתנות; לכן, יש צורך בפיתוח פרוטוקולים סטנדרטיים. זה יאפשר לחוקרים לייצר וליישם ביעילות HLCs שמקורם בתאי גזע בקנה מידה גדול למחקר בסיסי וקליני.
פותחה מערכת בידול אבות בכבד שניתן ליישם הן על קווי תאי גזע עובריים אנושיים והן על קווי תאי גזע פלוריפוטנטיים המושרים באמצעות הנחיות קלות למעקב. הליך זה מניב אוכלוסיות הומוגניות של אבות בכבד בפורמטים שונים של כלי תרבות, החל מבקבוקי תרבית תאים ועד 96 לוחות באר. להלן הפרוטוקול לייצור אבות הכבד שמקורם בתאי גזע בפורמטים של 24 ו-96 בארות.
צפיפות התא המשמש בפרוטוקול המוצג להלן מצוינת עבור באר אחת של צלחת באר 24 ו - 96 בהתאמה (ראה טבלה 1). מיטוב של מספר התא ההתחלתי נדרש עבור תבניות לוח תרבית התאים השונות וקווי התא. צפיפות התא ההתחלתית המוצעת עבור מיטוב פרוטוקול היא 2 x 105 תאים / ס"מ2. עבור אופטימיזציה צפיפות, מספר צפיפות תאים ניתן לבדוק על ידי הוספת ± 50,000 תאים / ס"מ2 בכל פעם.
Protocol
1. תחזוקת תאי גזע פלוריפוטנטיים אנושיים (hPSC) על למינין-521
- לשמור על תאים פלוריפוטנטים אנושיים (hPSCs) ב 37 °C (5% CO2 בצלחת 6 באר על למינין-521 (LN-521). להאכיל את התאים מדי יום עם 2 מ"ל של אמצעי תחזוקת תאי גזע (כלומר, mTeSR1 בינוני) לכל באר של צלחת 6 טוב עד יום הזריעה שנבחר לבידול (יום 0).
- ודא כי המפגש התא הרצוי של 70-80% מושגת לפני קצירת התא.
2. למינין-521 הכנה רב-וולית וזריעת hPSC לבידול
הערה: עבור hPSCs לא נשמר על LN-521 (למשל, מטריג'ל או פיברונקטין), לפצל hPSCs על LN-521 ותרבות במשך שבוע אחד לפני עובר ועורר בידול כדי לשפר את היעילות של התהליך15,17,18.
- הכנת צלחת מצופה למין
- להפשיר מקטורינה של LN-521 רקומביננטי (100 מיקרוגרם / מ"ל) ב 4 °C (75 °F) עבור 2 שעות או לילה.
- הכן פתרון 8 מיקרוגרם / מ"ל על ידי דילול LN-521 מופשר בקרח קר 1x DPBS עם Ca2 +/ Mg2 +.
- הוסף 0.25 מ"ל של פתרון LN-521 8 מיקרוגרם / מ"ל לכל באר של צלחת 24 היטב או 0.05 מ"ל לכל באר של צלחת 96 היטב. מנענעים את הצלחת בעדינות מצד לצד כדי לכסות באופן שווה את הבארות בתמיסת LN-521.
הערה: עבור תבנית צלחת 96 היטב, חלוקת נפח, זריעת תאים ושינויים בינוניים ניתן לבצע באמצעות צינור אוטומטי למחצה. לפרטים ראו מסגר-ריפולס ואח'19. - אטמו את הצלחות מצופות LN-521 עם סרט חצי שקוף וגמיש וחסנו ב-4 מעלות צלזיוס למשך הלילה לפני השימוש.
הערה: LN-521 צלחות מצופות ניתן להשתמש עד 2 שבועות כאשר מאוחסן ב 4 °C (70 °F). יש להימנע מכל ייבוש של בארות מצופות למינין.
- ביום זריעת התא, לחמם את הלוחות precoated באינקובטור תרבית התא ב 37 °C (30 °F) במשך 30-60 דקות.
- שאף את פתרון LN-521.
הערה: יש להימנע ממגע ישיר של השאפתן עם תחתית הבאר כדי למנוע נזק לציפוי LN-521. - יש לפזר 0.5 מ"ל של מדיום תחזוקת תאי גזע עם מעכב קינאז (ROCK) הקשור ל-10 מיקרומטר(ROCK) Y27632 לכל באר של צלחת 24 באר או 0.05 מ"ל לכל באר של צלחת 96 באר. מניחים את הצלחת באינקובטור עד מוכן לזריעת תאים.
- ביום הזריעה המתוכנן (יום 0) ועם מפגש hPSC בין 70-80%, לסמן כל אזורים של בידול ספונטני בתחתית בארות של צלחת 6 באר.
הערה: הבחנה ספונטנית יכולה להיות חזותית על ידי שינוי גס בגודל התא ו /או נוכחות של מורפולוגיות תאים שונות באמצעות מיקרוסקופיה ניגודיות פאזה. - שאפו והשליכו את אזורי הבידול המסומנים ואת המדיום המבוזבז מהבארות. לשטוף כל טוב עם 1 מ"ל של DPBS ללא Ca2 +/ מ"ג2 + בטמפרטורת החדר (RT).
- הוסיפו מ"ל אחד של ריאגנט דיסוציאציה ללא אנזימים (ראו טבלת חומרים)לכל באר ודגרו ב-37 מעלות צלזיוס למשך 8-10 דקות עד שתאים יתנתקו מהצלחת.
- השתמש מגרד תאים כדי לנתק בעדינות את התאים מהבארות. Pipette התוכן של כל באר למעלה ולמטה 2-4x עם פיפטה P1000 כדי להניב מתלה תא אחד. עבור כל קו תא, תאי בריכה מכל בארות התחזוקה לתוך צינור סטרילי 50 מ"ל.
- לשטוף כל אחד מרוקן היטב עם 1 מ"ל של אמצעי תחזוקת תאי גזע. הוסף את הכביסות לצינור המתאים המכיל את התאים המאוחסנים מקו התא המתאים.
- עבור כל שורת תא, בצע שלוש ספירות תאים מעשיות בדגימות המאגדות. חשב את ספירת התאים החיים הממוצעת (תאים חיים/מ"ל) עבור כל שורת תא.
- צנטריפוגה הדגימות במאגר ב 250 x g במשך 5 דקות ב RT. לשאוף supernatant, ולאחר מכן resuspend את גלולה התא ב 1-3 מ"ל של אמצעי תחזוקת תאי גזע RT, טרי בתוספת עם 10 μM רוק מעכב Y27632.
- עבור כל שורת תא, חשב את מספר התא הדרוש לפי מספר הבארות שהוכנו בשלב 2.4 (ראה טבלה 1). Resuspend מספר התא הנדרש עם תחזוקת תאי גזע מדיום טרי בתוספת עם 10 μM רוק מעכב Y27632.
- הוסף את אמצעי האחסון המחושב לבארות של הלוחות המוכנים והמקודמים מהשלב 2.4 מבלי להסיר את אמצעי האחסון שנוסף קודם לכן. הנפח הכולל לבאר יהיה 1 מ"ל עבור צלחת 24 היטב ו 0.1 מ"ל עבור צלחת 96 היטב. מנענעים בעדינות את הלוחות מצד לצד וקדימה וקדימה וקדימה כדי להבטיח פיזור תאים אחיד בכל הבאר.
הערה: התפלגות תאים זוגית על פני הבאר היא המפתח להבטחת זריעת תאים הומוגניים ובידול מוצלח. - מניחים את הצלחות המוזרעות באינקובטור ומיד מנענעים את הצלחות המוזרעות בעדינות הלוך ושוב ומצד לצד כדי להפיץ באופן שווה את התאים ולשמור על תרביות ב 37 מעלות צלזיוס ו 5% CO2.
3. הבחנה hPSCs אבות בכבד על למינין-521
- הכן מדיה עבור אינדוקציה אנדודרם סופית (שלב 1) באמצעות אנדודרם בסל מדיום בתוספת תוספים הנכונים.
- ביום 0, להפשיר את הבקבוק של אנדודרם בזאל מדיום לילה ב 4 °C (5 °F).
- הכן שלב 1 בינוני 1 (לשימוש ביום 1) לפי הצורך.
- הפשרת תוספת MR ותוספת CJ על קרח.
- לדלל תוספת MR ותוספת CJ 1:100 ב אנדודרם בזאל מדיום.
- הכן שלב 1 בינוני 2 לשימוש בימים 2-4 לפי הצורך.
- לדלל תוספת CJ 1:100 ב אנדודרם בזלת מדיום.
- הכן מדיה עבור מפרט תא הכבד הבא (שלב 2) בידול באמצעות מדיום פרוגנטור הכבד.
- ביום 4, להפשיר את הבקבוק של האב הקדמון הכבד מדיום לילה ב 4 °C (5 °F).
הערה: 1% פניצילין / סטרפטומיצין (ריכוזים סופיים של 100 IU / mL ו 100 מיקרוגרם / מ"ל, בהתאמה) שימש לניסוי זה. אין צורך באנטיביוטיקה; השימוש באנטיביוטיקה הוא על פי שיקול דעת המשתמש.
- ביום 4, להפשיר את הבקבוק של האב הקדמון הכבד מדיום לילה ב 4 °C (5 °F).
- ביום 1 של ההבחנה, להסיר את מדיום תחזוקת תאי גזע בילה עם 10 μM ROCKi Y-27632 בינוני מן בארות ולהחליף עם 0.5 מ"ל של שלב מלא שלב 1 בינוני 1 לבאר של צלחת 24 היטב 0.1 מ"ל לבאר של צלחת 96 טוב.
- בימים 2, 3 ו -4, להסיר את הבינוני בילה להאכיל כל טוב עם 0.5 מ"ל של שלב 1 בינוני 2 לבאר עבור צלחת 24 טוב או 0.1 מ"ל לבאר של צלחת 96 היטב.
- ביום 5, לתקן את בארות לניתוח בידול אנדודרם סופי באמצעות אימונוציטוכימיה. עבור בארות הנותרות, להסיר את בינוני בילה להאכיל כל טוב עם 0.5 מ"ל של בידול פרג הכבד מדיום לבאר עבור צלחת 24 טוב או 0.1 מ"ל לבאר של צלחת 96 היטב. רענן את המדיום שוב בימים 6, 7 ו- 9.
- ביום 10, לקצור בארות לניתוח בידול האב הכבד או להמשיך עם הבחנה תאים דמויי hepatocyte נוסף.
הערה: בשלב זה, דגימות תוקנו עם 4% paraformaldehyde (PFA) עבור ניתוח אימונוציטוכימיה או supernatant נאסף עבור ELISA ותאים נאספו לכימות חלבון.
4. אפיון תרבויות הבידול של אבות הכבד הנוצרות מ- hPSCs על למינין-521
- ביום 5, לזהות ביטוי של סמנים ספציפיים אנדודרם סופי באמצעות חיסונים.
- ביום 10, לזהות ביטוי של סמנים ספציפיים לאב הכבד באמצעות חיסונים.
- ביום 10, למדוד הפרשת AFP ו- ALB באמצעות ELISA באמצעות ערכה בהתאם להוראות היצרן ולנרמל לפי חלבון מ"ג כפי שנקבע על ידי בדיקת חלבון חומצה בינצ'ונינית (BCA).
- להעריך את השונות של אבות הכבד של צלחת 96 באר על ידי כימות של אחוז של תאים חיוביים HNF4α לבאר.
5. אימונוציטוכימיה ורכישת תמונות
- בימים 5 ו -10 של הבידול, לשטוף תאים 3x עם 1x DPBS, עם 0.5 מ"ל לבאר של צלחת 24 היטב ו 0.1 מ"ל לבאר של צלחת 96 היטב. לדגור על הצלחת עם רועד עדין במשך 2-5 דקות ב RT.
הערה: השתמש ב- DPSB ללא Ca2+/ Mg2+ עבור אימונוציטוכימיה. - תקן את התאים עם 4% paraformaldehyde (PFA) ב RT במשך 15-30 דקות על ידי הוספת 0.3 מ"ל של PFA לבאר עבור צלחת 24 טוב ו 0.1 מ"ל לבאר של צלחת 96 היטב.
- לשטוף 3x עם 1x DPBS כמתואר בשלב 5.1.
- פרמז'יליזם את הממברנה עם PBST באמצעות 0.1% Tween, 1x DPBS ודגרה במשך 20 דקות ב RT על ידי הוספת 0.3 מ"ל של PBST לבאר של צלחת 24 טוב ו 0.1 מ"ל לבאר של צלחת 96 טוב.
- בצע את בלוק החלבון על ידי דגירה של התאים עם 10% BSA ב PBST במשך 1 שעה, הוספת 0.3 מ"ל של BSA לבאר של צלחת 24 היטב ו 0.1 מ"ל של BSA לכל באר של צלחת 96 היטב, רועד בעדינות באמצעות שייקר צלחת.
- לאחר חסימת חלבונים, החלף את תמיסת החסימה בנוגדן הראשי מדולל ב- 1% BSA ב- PBST ודגר ב-4 °C (7%), עם רעידות עדינות למשך הלילה.
הערה: אין לשטוף בין גוש חלבון לתוספת נוגדנים. - לאחר 24 שעות, לשטוף בארות 3x עם PBST.
- הוסף את הנוגדן המשני ב- 1% BSA ב- PBST. דגירה 1 שעה ב RT בחושך עם רועד עדין.
- לאחר דגירה משנית של נוגדנים, יש לשטוף בארות פי 3 עם DPBS 1x ולחלק כתם הוצ'סט בהתאם להוראות היצרן למשך 10 דקות ב-RT בחושך עם רעד עדין.
- לשטוף 3x עם 1x DPBS. הלוחיות מוכנות כעת להדמיה.
הערה: יש לאחסן לוחות במהירות של 4 °C (75°F) בחושך עד להדמיה. - דמיין את הלוח הרב-וולי באמצעות מיקרוסקופ הדמיה בעל תוכן גבוה לאחר אימונוהיסטוכימיה. רכישת תמונה של מספר תחומי תצוגה מומלצת כדי לקבל ייצוג אמיתי של הבאר. הביטוי של הסמנים השונים הוערך באמצעות ניתוח פילוח תאים באמצעות תוכנה מסחרית(ראה טבלת חומרים ) (איור 1).
הערה: פילוח תאים יכול להתבצע גם באמצעות תוכנת קוד פתוח לניתוח תמונה כגון CellProfiler או פיג'י20,21.
תוצאות
בידול אב בכבד הן מקווי hESC (H9) והן מקווי hiPSC (P106) בוצעה בהתאם לפרוטוקול הצעד המתואר באיור 2. כאן, תאי גזע פלוריפוטנטים נזרעו כתאים בודדים ללוחות מצופים LN-521 לפני תחילת הבידול. השפעה על תאים היא המפתח לבידול חזק ושחזורי. לאחר שהושגה ההשפעה הנכונה (איור 2),החלה בידול. ביום 5, מפרט אנדודרם סופי הוערך באמצעות ביטוי Sox17. בשני קווי התאים, Sox17 התבטא מאוד עם 80% ± 0.5% ו 87.8% ± 0.5% SEM של תאים חיוביים Sox17 עבור H9 ו P106, בהתאמה (איור 3). ביום העשירי הציגו אבות הכבד מורפולוגיה דמוית אבן מרוצפת(איור 2). בנוסף, מפרט אבות הכבד הוערך עבור HNF4α, AFP, ALB, ו cytokeratin-19(CK19) ביטוי, כמו גם הפרשת חלבון AFP ו- ALB10,15,22 (איור 4). הן תרבויות האבות הכבד H9 והן P106 הביעו סמני הכבד העובריים כגון HNF4α (91% ± 0.5% ו -90% ± 0.2%), AFP (89.7% ± 1.8% ו-86% ± 1.2%), ו-CK19 (78.5% ± 3.2% ו-83.6% ± 1.8%)(איור 4). הפרשת AFP התגלתה ביום 10 בשני קווי התא (32.4 ± 1.6 ו-47.8 ± 5.9 ng/mL/mg/24 h)(איור 5). סינתזת אלבומין נצפתה ברמות נמוכות יותר (30.7% ± 1.8% ו-27.2% ± 1.1%)(איור 4)ולא זוהתה באמצעות ELISA(איור 5).
הפרוטוקול אפשר ייצור סטנדרטי של אבות בכבד מ 24 גם ל 96 לוחות באר. צינור אוטומטי למחצה שימש לייצור 96 לוחות באר של אבות בכבד מקווי תא H9 ו- P106 כפי שתואר בעבר17. השתנות מספר התא ויעילות בידול אבות בכבד הוערכו באמצעות כימות של ביטוי HNF4α. פילוח התאים בוצע לכימות חלבונים באמצעות אימונופלואורסצנטיות באמצעות מכשיר הדמיה בעל תוכן גבוה(איור 1). ביום 10, אבות הכבד לא הראו שונות משמעותית בין שורות עם >94% מהתאים החיוביים ל-HNF4α לבאר עבור H9 ו-97% תאים חיוביים HNF4α עבור P106 (איור 6).

איור 1: סקירה כללית של צינור פילוח תאים. (A) באמצעות התמונה המקורית, (B) נעשה שימוש בכתמים גרעיניים עבור פילוח גרעינים. (C)שלב בקרת איכות פילוח גרעיני המבוסס על צורה וגודל בוצע רק כדי לכמת גרעינים מקוטעים בבירור. בעקבותזאת, גרעין מוכתם HNF4α חיובי היו מכמתים. לבסוף,הועסק סף מבוסס עוצמה לזיהוי תאים המביעים HNF4α. ב- C ו- E, גרעינים ירוקים מייצגים תאים נבחרים וגרעין מגנטה מציינים תאים שהושלכו. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: בידול אבותבכבד לבין hPSCs. (A)ייצוג סכמטי של פרוטוקול בידול אבות הכבד. (B)תמונות מייצגות המדגישות את השינויים המורפולוגיים במהלך ההבחנה. ביום 0 (D0), hPSCs הציגו monolayer ארוז של תאים. לאחר מכן, hPSCs היו מוכנים אנדודרם סופי ביום 5 (D5). זה היה ואחריו בידול האבות הכבד ביום 10 (D10). אבות הכבד הציגו מורפולוגיה של תאים דמויי אבןמרוצפים . סרגל קנה מידה = 75 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
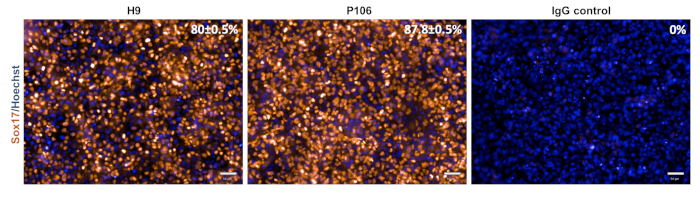
איור 3: אפיון מפרט אנדודרם סופי. ביום 5, תאים היו מוכתמים עבור Sox17, סמן אנדודרם מוחלט. אחוז התאים החיוביים של Sox17 היה 80 ± 0.5% עבור H9 ו 87.8 ± 0.5% עבור P106. כימות האחוזים התבסס על 10 בארות נפרדות עם 6 שדות תצוגה לבאר. הנתונים מוצגים כממוצע ± SEM. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: אפיון אבות בכבד. ביום העשירי, אבות הכבד היו מוכתמים בסמני הכבד (A)HNF4α, (B) AFP, ו - (C) ALB. עבור H9, אחוז התאים החיוביים היה 91% ± 0.4%, 89.7% ± 1.8%, ו 30.7% ± 1.8% עבור HNF4α, AFP, ו- ALB, בהתאמה. עבור P106, אחוז התאים החיוביים היה 90% ± 0.2%, 86% +/- 1.2%, ו 27.2% ± 1.1% עבור HNF4α, AFP ו- ALB, בהתאמה. (D)פוטנציאל שושלת כולנגיוציט הוערך באמצעות ביטוי CK19; אבות הכבד שמקורם ב-H9 הביעו 78.5% ± 3.2% תאים חיוביים ל-CK19, בעוד ש-83.6% ± 1.8% מהתאים החיוביים ל-CK19 נצפו אצל אבות הכבד P106. כתמי אימונוגלובולין G (IgG) שימשו כבקרת כתמים. כימות האחוזים התבסס על 10 בארות נפרדות עם 6 שדות תצוגה לבאר. הנתונים מוצגים כממוצע ± SEM. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: ניתוח הפרשת חלבון מולדת בכבד. הפרשת אלפא פטופרוטאין (AFP) ואלבובין (ALB) נותחה בתרבויות אבות בכבד ביום 10 ב- H9 ו- P109. הנתונים מייצגים שלושה שכפולים ביולוגיים וסרגלי השגיאה מייצגים את ה- SD. חלבונים מופרשים היו מ 24 h תרבית בינוני כמו ננוגרם של חלבון מופרש לכל mL לכל מ"ג של חלבון, n = 3; ND = לא זוהה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
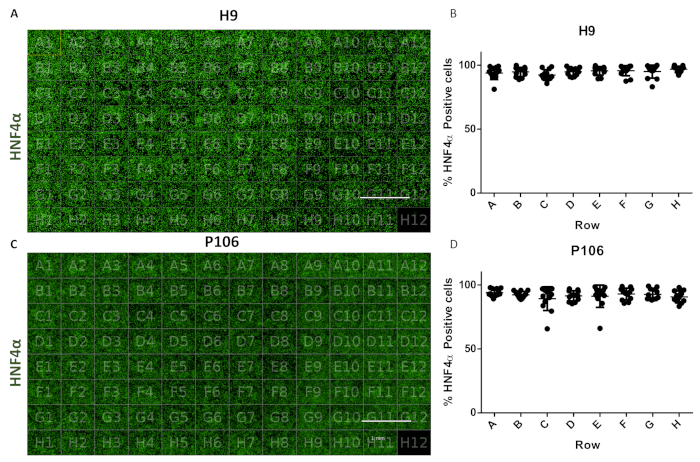
איור 6: הערכת שונות טובהבצלחת 96. (A)הדמיה של 96 תצוגה צלחת היטב של אבות הכבד נגזר H9 מוכתם עם HNF4α. (B)כימות התאים החיוביים HNF4α. ממוצע מספר התא לבאר בשורות, משישה שדות תצוגה לכל כימות היטב. מספר התא הממוצע על פני הלוח היה 94.81% ± 0.22 SEM HNF4α-חיובי תאים לבאר. לא נצפו הבדלים מובהקים סטטיסטית בין בארות. (C)הדמיה של 96 תצוגה צלחת היטב של אבות הכבד נגזר P106 מוכתמים עם HNF4α. (D)כימות של תאים חיוביים HNF4α. מספר התא הממוצע לבארות בשורות, משישה שדות תצוגה לבאר ומכומת. מספר התא הממוצע על פני הלוח היה 97.7% ± 0.57 SEM HNF4α-חיובי תאים לבאר. לא נצפו הבדלים מובהקים סטטיסטית בין שורות. ובכן H12 שימש כשליטה כתמים אימונוגלובולין G (IgG). סרגל קנה מידה = 1 מ"מ. ANOVA בכיוון אחד עם המבחנים הסטטיסטיים שלאחר הוק של טוקי הועסקו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| תבנית לוח | שטח פנים (cm2) | תאים לסמ"ר2 | סה"כ תאים לבאר | מחלק אמצעי אחסון (מ"ל) | ריכוז תאים (תאים/מיליליטר) |
| צלחת 24-באר | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| צלחת 96-באר | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
טבלה 1: צפיפות תאים מומלצת עבור תבניות הלוח השונות עבור קווי התא hPSC המשמשים בפרוטוקול זה.
Discussion
הדור של תאי אבות הכבד האנושיים מתאי גזע פלוריפוטנטיים בקנה מידה גדול יכול לייצג חלופה מבטיחה לחומר שמקורו בגופות. סטנדרטיזציה של פרוטוקולים ושחזור הם המפתח להבטחת תרגום טכנולוגי והשפעה למחקר ביו-רפואי. כדי לטפל בכך, העבודה הקודמת התמקדה בפיתוח פרוטוקול בידול צעדים מ- hESC ו- iPSCs באמצעות תוספים מוגדרים ומטרישות15,23,24,25,26,27,28. על ידי כך, פנוטיפ hepatocyte ושחזור שופרו, המאפשר את האוטומציה למחצה של תהליך הבידול19. המערכת המוצגת מתחזקת על ידי השילוב שלה עם מדיה של תרבית תאים מחוץ למדף ומערכת בידול הפטוצית.
בעבר, צפיפות תאים pluripotent לפני תחילת פרוטוקול הבידול הודגש כמשתנה מפתח כדי להשיג אוכלוסייה הומוגנית של תאי אבות בכבד26. באמצעות הליך מעודן יותר זה, ניתן ליצור מספר גדול של אבות הכבד שמקורם בתאי גזע באופן צעד באמצעות מגוון של צפיפות תאים מתחילים (טבלה 1). ביום 5, אינדוקציה אנדודרמית מוחלטת אומתה על ידי כתמי Sox17(איור 3). בידול יעיל וחזק לאנדודרם סופי הושג הן עם קווי ESC ו- iPSC שנבדקו, עם יותר מ -80% המבטאות את Sox17 (איור 3). ביום העשירי הציגו אבות כבד מורפולוגיה אחידה דמוית אבן-אבן, וסמני תאי גזע בכבד הועשרו מאוד הן עבור AFP והן עבור HNF4α (>86%, איור 4). באמצעות שילוב של טכנולוגיות ידניות ואוטומטיות למחצה ניתן היה לבצע בידול בפורמטים מרובים של לוחות19.
בצורתו הנוכחית, בידול תאים מתאים לניסויים מבוססי במבחנה. עם זאת, העשרת תאים צפויה להידרש לפני יישום קליני כדי להבטיח כי אוכלוסייה הומוגנית של אבות הכבד מוכנים למסירה.
לסיכום, הפרוטוקול המתואר כאן מספק לתחום גישה סטנדרטית לייצור אבות בכבד בקנה מידה גדול. עבודה עתידית תתמקד בייצור מדיום חדש לבידול, התבגרות ותחזוקה של HLC הבאים.
Disclosures
דוד חי הוא מייסד שותף ובעל מניות של Stemnovate בע"מ שאר המחברים מאשרים כי אין להם ניגודי עניינים בנושא או בחומרים הנדונים במאמר זה.
Acknowledgements
מחקר זה נתמך בפרסים של שותפות הכשרת הדוקטורט MRC (MR/K501293/1), פלטפורמת הרפואה המתחדשת בבריטניה (MRC MR/L022974/1 ו- MR/K026666/1), משרד המדען הראשי (TCS/16/37).
Materials
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved