A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في المختبر تقييم التحول Oncogenic في الخلايا الظهارية ماماري الإنسان
In This Article
Summary
يوفر هذا البروتوكول أدوات تجريبية في المختبر لتقييم تحول الخلايا الثديية البشرية. ويرد وصف الخطوات التفصيلية لمتابعة معدل انتشار الخلايا، والقدرة على النمو المستقلة للرسو، وتوزيع أنساب الخلايا في الثقافات ثلاثية الأبعاد مع مصفوفة غشاء الطابق السفلي.
Abstract
ورم نيجنيسيس هو عملية متعددة الخطوات التي الخلايا اكتساب القدرات التي تسمح نموها, البقاء على قيد الحياة, ونشرها في ظل ظروف عدائية. وتسعى الاختبارات المختلفة إلى تحديد هذه السمات المميزة للخلايا السرطانية وتحديدها كمياً؛ ومع ذلك، فإنها غالباً ما تركز على جانب واحد من التحول الخلوي، وفي الواقع، هناك حاجة إلى اختبارات متعددة لتوصيفها الصحيح. والغرض من هذا العمل هو تزويد الباحثين بمجموعة من الأدوات لتقييم التحول الخلوي في المختبر من منظور واسع، مما يجعل من الممكن استخلاص استنتاجات سليمة.
إن تنشيط الإشارات التكاثرية المستمرة هو السمة الرئيسية للأنسجة السرطانية ويمكن مراقبته بسهولة في ظروف في المختبر عن طريق حساب عدد مضاعفة السكان التي تحققت مع مرور الوقت. الى جانب ذلك ، فإن نمو الخلايا في الثقافات 3D يسمح تفاعلها مع الخلايا المحيطة بها ، تشبه ما يحدث في الجسم الحي. وهذا يمكّن من تقييم التجميع الخلوي، و، جنبا إلى جنب مع وضع العلامات المناعية من علامات الخلوية المميزة، للحصول على معلومات عن سمة أخرى ذات صلة من التحول الورمي: فقدان التنظيم السليم. سمة أخرى ملحوظة من الخلايا المحولة هي قدرتها على النمو دون التعلق بالخلايا الأخرى وإلى المصفوفة خارج الخلية ، والتي يمكن تقييمها مع مقايسة المرسى.
يتم توفير إجراءات تجريبية مفصلة لتقييم معدل نمو الخلايا ، لأداء وضع العلامات المناعية لعلامات نسب الخلايا في الثقافات ثلاثية الأبعاد ، واختبار نمو الخلايا المستقلة للرسو في الأجار الناعم. هذه المنهجيات هي الأمثل لثدى الثدي الأولية الخلايا الظهارية (BPEC) نظرا لصلتها بسرطان الثدي; ومع ذلك، يمكن تطبيق الإجراءات على أنواع الخلايا الأخرى بعد بعض التعديلات.
Introduction
وهناك حاجة إلى أحداث متتالية متعددة لتطوير الأورام. في عام 2011، وصف هاناهان ووانبرغ 10 قدرات تمكن نمو الخلايا المتحولة، والبقاء على قيد الحياة، والنشر: ما يسمى "السمات المميزة للسرطان"1. المنهجية الموصوفة هنا تجمع ثلاث أدوات مختلفة لتقييم التحول الخلوي في المختبر من خلال التركيز على بعض السمات المميزة للخلايا السرطانية. هذه التقنيات تقييم معدل انتشار الخلايا، وسلوك الخلايا عندما مثقف في 3D وقدرتها على تشكيل المستعمرات مع استقلال الرسو.
نماذج الخلايا حاسمة لاختبار الفرضية في المختبر. وقد تم تطوير مناهج مختلفة لتوليد نماذج تجريبية للتحول الخلوي لدراسة السرطان2،3،4. منذ سرطان الثدي هو السرطان الأكثر شيوعا بين النساء في جميع أنحاء العالم، وهو المسؤول عن ما يقرب من 15٪ من وفيات السرطان بين النساء5،وتوفير نماذج الخلوية المناسبة من الخلايا الظهارية ماماري هو في غاية الأهمية لمزيد من التحقيق. في هذه المقالة، وقد أوضحنا إمكانات ثلاث تقنيات لتقييم التحول الخلوي باستخدام نموذج تجريبي من الثدي الأولية الخلايا الظهارية (BPECs) التحول في البداية وصفها إينس وزملاؤه في 20076 وتنفيذها في وقت لاحق في مختبرنا7. ويستند هذا النموذج التجريبي على التغيير التسلسلي من ثلاثة جينات مستهدفة (SV40 T كبيرة وt مستضدات صغيرة يشار إليها هنا باسم Ttag، hTERT، و HRAS) إلى الجينوم من BPECs غير محولة. وعلاوة على ذلك، فإن الطريقة المستخدمة لاشتقاق BPECs تفضل الحفاظ على الخلايا الظهارية الثديية مع علامات اللمعان أو ميوفيتيل، مما يؤدي إلى ثقافة الخلايا غير المتجانسة التي تحتفظ ببعض الصفات الفسيولوجية للغدة الثديية.
في الغدة الثديية، تقع الخلايا الظهارية المامية الإنارةية، المسؤولة عن إنتاج الحليب، بالقرب من التجويف، في حين يتم التخلص من الخلايا العضلية حول الخلايا الإنارة ورعاية حركات الانكماش التي تؤدي الحليب إلى الحلمة. فقدان التنظيم السليم بين هذه النسب الخلية هو سمة من سمات التحول الورمي8 التي يمكن تقييمها في المختبر بعد الكشف المناعي من علامات النسب المميزة في ثقافات الخلايا 3D. ومن الخصائص الرئيسية الأخرى للخلايا السرطانية قدرتها على النمو دون التعلق بالخلايا الأخرى وإلى المصفوفة1خارج الخلية. عندما يتم إجبار الخلايا السليمة على النمو في التعليق، آليات مثل anoikis \u2012 نوع من موت الخلية الناجمة عن استجابة فصيلة من مصفوفة خارج الخلية \u2012 يتم تنشيط9. التهرب من موت الخلايا هي واحدة من السمات المميزة للسرطان، وبالتالي، الخلايا المحولة قادرة على تعطيل anoikis والبقاء على قيد الحياة بطريقة مستقلة عن المرساة. ويمكن تقييم هذه القدرة في المختبر مع المقايسة المستقلة المرسى باستخدام agar لينة. وعلاوة على ذلك، فإن السمة المتأصلة في الأنسجة السرطانية هي قدرتها على الإشارات التكاثرية المستمرة، والتي يمكن رصدها بسهولة في ظروف المختبر عن طريق قياس زيادة عدد الخلايا على طول الوقت، ليس فقط في المقايسات التعليق ولكن أيضا عن طريق رصد معدل نمو الثقافات ذات الطبقات الأحادية.
على الرغم من أن أفضل نموذج لاختبار الإمكانات الأورام هو تلقيح الخلايا السرطانية في نماذج مورين وتقييم تطور الورم في الموقع ، فمن المهم تقليل عدد الحيوانات المستخدمة في الإجراءات التجريبية قدر الإمكان. ولذلك، وجود اختبارات مناسبة لتقييم التحول في المختبر هو أولوية قصوى. هنا، نحن نقدم مجموعة من الأدوات لتقييم الإمكانات الأورام من خلايا الثدي الظهارية جزئياً أو كلياً التي يمكن تنفيذها بسهولة في معظم المختبرات التي تعمل مع نماذج التحول الخلوي.
Protocol
تم الحصول على عينات بشرية مستخدمة في التجارب التالية من عمليات خفض الخضوع للثدي في Clínica Pilar Sant Jordi (Barcelona) بموجب موافقة الإجراء المعياري. يتم تنفيذ جميع الإجراءات في مجلس وزراء السلامة البيولوجية من الدرجة الثانية ما لم ينص على خلاف ذلك.
1. في الثقافة في المختبر من الخلايا الظهارية mammary الإنسان والنمو منحنى مؤامرة تراكم
-
في زراعة في المختبر من الثدي ظهارية الأولية الخلايا (BPECs): الخلايا passaging
ملاحظة: بالنسبة لاشتقاق BPEC و استزراع الخلايا اتبع الإرشادات التي وصفها Ince وآخرون، 20076.- إعداد متوسط.
- تكملة WIT القاعدية تعريف المتوسطة مع P أو T ملاحق, المقدمة من قبل الشركة المصنعة, اعتمادا على ما إذا كانت بريتيش بتروليوم الأولية أو المحولة مثقف.
- إضافة سم الكوليرا إلى الوسيلة التكميلية لـ WIT إلى التركيز النهائي 100 نانوغرام/مل للمعالجة الأولية أو 25 نانوغرام/مل لـ BPECs المحولة.
تنبيه: يكون سم الكوليرا قاتلًا إذا ابتلع. استخدام معدات الحماية الشخصية. تجنب إصداره إلى البيئة.
- صيانة ثقافة الخلية والمرور.
ملاحظة: للخطوات التالية ضع في اعتبارك أن الخلايا تنمو في قارورة T25. ومع ذلك، يمكن تكييف الأحجام مع أشكال أخرى من أشكال ثقافة الخلية تحافظ على التناسب من حيث المساحة السطحية.- تحقق من التقاء الخلايا كل يوم. عندما تكون الثقافة 90٪ التقاء تنفيذ تمرير الخلية.
- الحصول على 1X PBS، 3x التربسين، المتوسطة و15 مل أنبوب مخروطي يحتوي على 2 مل من مصل البقر الجنين (FBS) لكل قارورة.
- إزالة المتوسطة من القارورة والاحتفاظ بها في أنبوب مخروطي 15 مل تحتوي على FBS.
- شطف الخلايا مع 1X PBS.
- فصل الخلايا عن السطح عن طريق إضافة 1 مل من 3x تريبسين. احتضان لمدة 5 دقائق في 37 درجة مئوية.
- تحقق مما إذا كانت الخلايا قد تم فصلها. تطبيق اهتزاز قوي إذا لم يتم فصل الخلايا تماما.
- إلغاء تنشيط trypsin بإضافة الوسيطة المحجوزة تكمل مع FBS.
- حصاد تعليق الخلوية ووضعها في أنبوب مخروطية 15 مل.
- جهاز طرد مركزي في 500 × ز لمدة 5 دقائق، والقضاء على supernatant، وإعادة تعليق الخلايا بيليت عن طريق نفض الغبار الجزء السفلي من الأنبوب بإصبع.
- إضافة 1-2 مل من وسائل الإعلام الطازجة إلى بيليه وقياس تركيز الخلية باستخدام عداد الخلايا التلقائي أو جهاز قياس الهيموسيت. وسوف تستخدم هذه البيانات في وقت لاحق لحساب مضاعفة عدد السكان ورسم منحنى النمو. بذور 12000 خلية / سم2 (على سبيل المثال، 300،000 خلية لقارورة T25) في قارورة سطح ثقافة الخلية المعدلة (انظر جدول المواد).
ملاحظة: تمييع محلول تعليق الخلية إذا كان التركيز عاليًا جدًا لضمان القياس الكمي المناسب. - إضافة متوسطة إلى حجم النهائي من 5 مل واحتضان الخلايا في 37 درجة مئوية و 5٪ CO2 الغلاف الجوي.
- استبدال خلية ثقافة المتوسطة كل 48 ساعة.
- إعداد متوسط.
-
عدد السكان مضاعفة الحساب وتصور البيانات
- باستخدام بيانات عدد الخلايا التي تم الحصول عليها في الخطوة 1.1.2.10، قم بتطبيق الصيغة التالية للحصول على قيم مضاعفة السكان المتراكمة (PD):
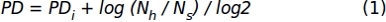
حيث، PDi يشير إلى عدد من مضاعفة السكان التي حققتها الخلايا حتى الثقافة الفرعية السابقة (فإنه يشير إلى PD المتراكمة على الثقافة الفرعية السابقة)، Nح هو عدد من الخلايا المقطوعة، وNs هو عدد الخلايا المصنفة. - تمثل بيانات لفاصل زمني محدد باستخدام رسم بياني س ص حيث يتم تمثيل عدد الأيام في الثقافة (x-axis) و PD المتراكمة(y-axis).
- احصل على أفضل خط مناسب ومعادلة مناسبة:

ملاحظة: يعني زيادة المنحدر (ب) زيادة معدل الانتشار.
- باستخدام بيانات عدد الخلايا التي تم الحصول عليها في الخطوة 1.1.2.10، قم بتطبيق الصيغة التالية للحصول على قيم مضاعفة السكان المتراكمة (PD):
2. ثلاثي الأبعاد (3D) الثقافة في الطابق السفلي مصفوفة غشاء والكشف عن البروتين المناعي
- ثقافة ثلاثية الأبعاد في مصفوفة غشاء الطابق السفلي
ملاحظة: تم تكييف هذا البروتوكول من Debnath وآخرون، 200310 وهو الأمثل ل 24 ألواح الآبار (انظر جدول المواد).- تحضير المواد قبل يوم من التجربة: مصفوفة غشاء الطابق السفلي قبل البرد بين عشية وضحاها في 4 °C والسماح نصائح الماصات، أنابيب microcentrifuge، ولوحات جيدا باردة في الثلاجة.
ملاحظة: يجب أن تبقى المصفوفة عند -20 درجة مئوية للتخزين على المدى الطويل. جعل aliquots لتجنب دورات تجميد ذوبان متعددة. - في يوم التجربة، ضع مواد مُبردة مسبقاً على الجليد.
- شطف الآبار مع الباردة معقمة 1X PBS من أجل الحد من التوتر السطحي.
- تغطية الجزء السفلي من كل بئر مع 100 ميكرولتر من مصفوفة غشاء الطابق السفلي.
ملاحظة: الاستغناء عن المصفوفة ببطء ونشرها في جميع أنحاء البئر؛ فمن الأهمية بمكان لتجنب تشكيل فقاعة في الطبقة السفلى لتجنب نمو ثقافة الخلية أحادية الطبقة. - ضع اللوحة في الحاضنة ، عند 37 درجة مئوية ، للسماح لطبقة المصفوفة بترسخها.
ملاحظة: عادة ما يستغرق حوالي 20 دقيقة لترسيخ. - وفي الوقت نفسه، تبسينيزي الخلايا كما هو موضح سابقا في الخطوة 1.1. أجهزة الطرد المركزي الخلايا في 500 × ز لمدة 5 دقائق و resuspend في المتوسط. إعداد 400،000 خلية / تعليق مل وبلطف أي كتلة الخلية عن طريق الأنابيب.
- إعداد المتوسطة مع 8٪ مصفوفة غشاء الطابق السفلي ومزيج 1:1 (الخامس / الخامس) مع تعليق الخلوية للحصول على 200،000 الخلايا / مل حل في مصفوفة 4٪.
ملاحظة: حساب مقدار الوسيطة اللازمة لتجنب النفايات غير الضرورية المصفوفة. - مكان 500 μL من تعليق الخلية في حل مصفوفة على رأس طبقة مصفوفة متوطدة بالفعل إلى البذور كمية إجمالية من 100،000 الخلايا في المتوسط مع 4٪ مصفوفة غشاء الطابق السفلي.
- احتضان الخلايا في 37 درجة مئوية لبضع دقائق ومن ثم، إضافة 500 μL من المتوسط مع مصفوفة غشاء الطابق السفلي 4٪. احتضان الخلايا في 37 درجة مئوية في حاضنة مع 5٪ CO2 لمدة 14 يوما. الخلايا المصنفة سوف مجموعة وتتكاثر لتنشأ هياكل acini مثل.
ملاحظة: يمكن مراقبة حركية الخلية وتجميعها من خلال الفاصل الزمني أثناء عملية التشكيل ثلاثي الأبعاد. استخدم برنامج تحليل الصور (مثل فيجي/إيمج أو إيماريس) لتقييم هذه الأحداث. يعتمد عدد وحجم acini على عملية التجميع ومعدل الانتشار وقد يختلفان بين أنواع الخلايا. ضبط تركيز مصفوفة الغشاء الطابق السفلي والخلايا المصنفة للحصول على الهياكل 3D المطلوب. - إضافة 500 μL من المتوسط مع 4٪ مصفوفة غشاء الطابق السفلي 2-3 مرات في الأسبوع.
ملاحظة: تجنب إزعاج الطبقات التي تحمل اللوحة بلطف أثناء التلاعب. - إذا رغبت في ذلك، يمكن قياس عدد وحجم acini خلال فترة الثقافة. للقيام بذلك، التقاط صور عشوائية في أوقات مختلفة بعد البذر باستخدام المجهر المقلوب أو DIC مقلوب. استخدام برنامج تحليل الصور لقياس قطر 100-200 هياكل 3D.
- تحضير المواد قبل يوم من التجربة: مصفوفة غشاء الطابق السفلي قبل البرد بين عشية وضحاها في 4 °C والسماح نصائح الماصات، أنابيب microcentrifuge، ولوحات جيدا باردة في الثلاجة.
- مناعة
ملاحظة: شروط معقمة غير مطلوبة أثناء هذا الجزء من البروتوكول.- إزالة الوسيط الثقافة.
- المسيل للدموع مصفوفة غشاء الطابق السفلي باستخدام طرف p200 ماصة مع نهاية قطع. ضع ~ 50 ميكرولتر من مصفوفة مفصلة على رأس شريحة زجاجية ولطختها في مساحة 1-2 سم2.
- دع العينة تجف تمامًا في درجة حرارة الغرفة أو استخدم لوحة تدفئة عند 37 درجة مئوية لتسريع العملية. إصلاح العينات مع الميثانول: الأسيتون (1:1، الخامس / الخامس) في -20 درجة مئوية لمدة 30 دقيقة.
ملاحظة: سيتم مسح إشارة الفلورسنت للعلامات السابقة، مثل البروتينات الفلورية التي تعبر عنها الخلايا.
تنبيه: الميثانول قابل للاشتعال، سام إذا استنشق، ابتلع أو في حالة ملامسة الجلد. ارتداء معدات الحماية الشخصية والعمل داخل غطاء الدخان. - تجاهل حل التثبيت وإزالة الفائض، إن وجد، عن طريق الاستلقاء بالشريحة على ورق التصفية.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. مرة واحدة الجافة، يمكن تخزين الشرائح في -20 درجة مئوية لعدة أشهر. - كتلة عينات epitopes مع مصل الماعز العادي 5٪ و 0.1٪ تريتون-X-100 في 1X PBS (حل الحجب) لمدة 2 ساعة في درجة حرارة الغرفة.
- وفي الوقت نفسه، وإعداد الأجسام المضادة حلول العمل عن طريق تخفيف الأجسام المضادة الأولية أو الثانوية في التركيز المطلوب في حل منع.
ملاحظة: يجب ضبط تركيز الأجسام المضادة بدقة حسب نوع الخلية ومرجع الأجسام المضادة. كدليل، لتحديد الخلايا من النسب الإنارة و myoepithelial في BPEC، الأولية المضادة للسيتوكيراتين 14 ومضادة كلودين الرابع الأجسام المضادة (انظر جدول المواد)يمكن استخدامها. التركيز الحل العمل الموصى بها هو 1:100 لهذه الأجسام المضادة الأولية و 1:500 للأجسام المضادة المضادة ماوس ومضاد الأرنب (انظر جدول المواد). - إضافة 30 ميكرولتر من الأجسام المضادة الأولية حل العمل وتغطية ذلك مع شريط من مختبر لف الفيلم لتجنب التبخر. احتضان بين عشية وضحاها في 4 °C في غرفة رطبة.
- غسل ثلاث مرات مع 1X PBS لمدة 1 ساعة لكل من.
- كرر الخطوة 2.2.7 للأجسام المضادة الثانوية. وينبغي أن يتم الاحتضان في الظلام.
- غسل مع 1X برنامج تلفزيوني لمدة 2 ساعة.
ملاحظة: ضبط تركيز الأجسام المضادة، وحضانة الوقت، وصلابة الغسيل لتحسين نسبة الإشارة/الضوضاء لعينات محددة. - إزالة برنامج تلفزيوني المتبقية، ومرة واحدة الجافة، ومضادة مع DAPI في 0.25 ميكروغرام / مل المخفف في antifade تصاعد المتوسطة. تغطية الشرائح مع غطاء عن طريق السماح لها تسوية دون الضغط. ختم مع طلاء الأظافر.
ملاحظة: يمكن تخزين العينات في 4 درجة مئوية لعدة أسابيع. للتخزين على المدى الطويل، احتفظ بها عند -20 درجة مئوية. - تحليل توزيع إشارة الفلورسنت لكل acinus باستخدام مجهر confocal.
ملاحظة: يجب تحديد تكوين المجهر Confocal بدقة اعتمادا على المعدات المستخدمة والأجسام المضادة المطبقة على العينة. كدليل، مع المعدات والكواشف مفصلة في جدول المواد،واستخدام الهدف 40x وإعدادات الليزر والكشف التالية: لإثارة استخدام DAPI مع ليزر 405 (3٪-5٪)، الكشف مع كاشف PMT (800V، أو Offset: -9) وشريط طيفي من 410 نانومتر إلى 500 نانومتر؛ ل A488 (كلودين-الرابع) استخدام الإثارة مع ليزر 488 (7٪-10٪)، والكشف مع كاشف PMT (800V، الإزاحة: -20) وفرقة طيفية من 490 نانومتر إلى 550 نانومتر؛ وبالنسبة لـ Cy3 (Cytokeratin 14) استخدم الإثارة مع ليزر 555 (2٪-10٪)، والكشف مع كاشف PMT (800V، أوف: -35) وفرقة طيفية من 560 نانومتر إلى 600 نانومتر.
3. انكوراج- مستقل المقايسة، تلطيخ MTT وتكميم مستعمرة التلقائي
- مقايسة مستقلة للرسو: طلاء التعليق الخلوي والأجار
ملاحظة: تم تكييف البروتوكول من Borowicz et al., 201411 لإجراء تجارب في BPECs.- إعداد 1.2٪ agar حل مخففة في الماء فائقة الpure في زجاجة معقمة. اتوماتيف الحل والحفاظ عليه في 42 درجة مئوية خلال التجربة. ويمكن تخزين حل أجار في 4 درجة مئوية; عند الحاجة، تسخين حل أجار حتى يصبح السائل مرة أخرى.
تنبيه: استخدم قفازات مقاومة للحرارة لتجنب الحرق بعد الأوتوكلاف.
ملاحظة: من الآن فصاعدا، يجب الحفاظ على الظروف العقيمة. - إعداد 0.6٪ agar الحل عن طريق خلط 1:1 (v/v) كاملة قبل الدافئة المتوسطة مع 1.2٪ agar الحل. الحفاظ على 42 درجة مئوية لتجنب التصلب المبكر.
ملاحظة: يمكن أن تكون سابقا مزدوجة مكملة مزدوجة للحصول على مكملات كاملة 0.6٪ agar + حل متوسطة مرة واحدة مختلطة. - غطي الجزء السفلي من بئر 35 مم مع 1.5 مل من 0.6٪ أجار في محلول متوسط والسماح لها بترسخ في درجة حرارة الغرفة. تأكد من أن الجزء السفلي من لوحة مغطاة تماما قبل أجار التصلب، وإلا، قد تلتزم الخلايا لوحة وتنمو في monolayer.
ملاحظة: يمكن استخدام الألواح السطحية المُعتمَدة وغير المُعتَمَرة. - وفي الوقت نفسه، والخلايا التربسينيزي، وبمجرد الطرد وإعادة الاعتماد في المتوسط، وإعداد 50،000 خلية / مل حل وبلطف أي كتلة خلية عن طريق الأنابيب مرارا وتكرارا.
- إعداد 0.3٪ أجار + تعليق الخلية في المتوسط بتركيز نهائي من 25،000 الخلايا / مل.
ملاحظة: قد يختلف تركيز الخلايا الأمثل بين أنواع الخلايا. حاول تركيزات مختلفة حتى يتم تشكيل المستعمرات الفردية.- وضع مرشح مصفاة 40 ميكرومتر على رأس أنبوب معقم 50 مل وتصفية 50،000 الخلايا / مل الحل السماح لها قطرة في الجزء السفلي من الأنبوب.
- إزالة مرشح من أنبوب معقم 50 مل، إمالة أنبوب الخلية التي تحتوي على 45 درجة وزاوية إسقاط نفس حجم 0.6٪ agar + حل المتوسطة صب من خلال الجدار الداخلي للأنبوب. وهذا سيسمح حل أجار لتهدئة ما يكفي فقط لعدم تلف الخلايا وتجنب صلابة من السابق لأوانه.
- التجانس الخليط والودائع 1 مل من 0.3٪ أجار + تعليق الخلية في الوسط (التي تحتوي على 25،000 الخلايا) على رأس طبقة أجار السفلية التي تم ترسيخها سابقا.
- تصور الخلايا المصنفة باستخدام المجهر المقلوب للتأكد من أن الخلايا هي فردية. وإلا، ينبغي تكرار التجربة.
- انتظر حتى يتم ترسيخ طبقة agar تماما، ثم إضافة بعناية 1 مل من المتوسطة الطازجة على القمة دون إزعاج طبقات agar الحساسة تحت.
- احتضان الخلايا في 37 درجة مئوية و 5٪ CO2 في حاضنة لمدة 3 أسابيع.
ملاحظة: الوقت المطلوب لتكوين مستعمرة يمكن أن تختلف بين أنواع الخلايا المختلفة، ولكن عادة 3 أسابيع كافية. - تغيير متوسط مرتين في الأسبوع. للقيام بذلك، إمالة بلطف لوحة نحوك، وpirate المتوسطة في الزاوية السفلى، وإضافة 1 مل من المتوسطة الطازجة.
ملاحظة: تجنب لمس طبقات agar لأنها تنفصل بسهولة عن اللوحة.
- إعداد 1.2٪ agar حل مخففة في الماء فائقة الpure في زجاجة معقمة. اتوماتيف الحل والحفاظ عليه في 42 درجة مئوية خلال التجربة. ويمكن تخزين حل أجار في 4 درجة مئوية; عند الحاجة، تسخين حل أجار حتى يصبح السائل مرة أخرى.
- تلطيخ MTT
- إعداد Thiazolyl الأزرق Tetrazolium بروميد (MTT) محلول المخزون في 6 ملغ / مل في المياه فائقة الخطورة في زجاجة معقم وحل مرشح باستخدام مرشحات 0.2 μm. يمكن تخزين هذا الحل MTT لمدة تصل إلى 6 أشهر في -20 درجة مئوية.
تنبيه: قد يسبب MTT تهيج ويشتبه في التسبب في عيوب وراثية. استخدم نظارات السلامة والقفازات وتصفية الجهاز التنفسي.
ملاحظة: تجنب دورات التجميد المتكررة. - إعداد حل العمل من MTT في 1 ملغ / مل عن طريق تخفيف محلول الأسهم مع الماء فائقة الخطورة العقيمة.
- بمجرد انتهاء فترة تكوين المستعمرة ، قم بإزالة الوسيطة من اللوحة وأضف 1 مل من 1 ملغم / مل MTT لكل بئر.
- احتضان لمدة 24 ساعة في الحاضنة. إزالة حل MTT عن طريق التعرق عليه بلطف. يمكن تخزين اللوحات في 4 درجة مئوية لعدة أسابيع.
ملاحظة: تجنب التعرض للضوء لمنع تشكيل البلورات غير المحدد.
- إعداد Thiazolyl الأزرق Tetrazolium بروميد (MTT) محلول المخزون في 6 ملغ / مل في المياه فائقة الخطورة في زجاجة معقم وحل مرشح باستخدام مرشحات 0.2 μm. يمكن تخزين هذا الحل MTT لمدة تصل إلى 6 أشهر في -20 درجة مئوية.
- قياس كمي مستعمرة
- الحصول على صور لكل لوحة باستخدام المجهر المقلوب. ضبط التكبير من أجل الحصول على الحد الأقصى من مجال الرؤية مع عدد أقل من الصور ، ولا يزال قادرا على الكشف عن المستعمرات الصغيرة (عادة 4x أو 10x الأهداف).
ملاحظة: تأكد من أن الصور تقدم خلفية متجانسة. ولا يلزم تباين الطور أو التباين التفاضلي حيث لن يتم تحديد حجم المستعمرات غير الملطخة. - تحميل الصور إلى برنامج ImageJ/ Fiji12 لحساب عدد المستعمرات ومنطقة كل مستعمرة إيجابية MTT.
ملاحظة: يتم توفير برنامج نصي للكمية التلقائية كملف تكميلي. لتنفيذ التعليمات البرمجية، قم بلصقها في محرر الماكرو(الإضافات | | جديدة الماكرو)واتبع الإرشادات.- الحصول على قناع ثنائي من خلال العتبة الصورة الأصلية (صورة | ضبط | العتبة) للحصول على مستعمرات محددة جيداً (الشكل 1).
ملاحظة: الصور 8 أو 16 بت مطلوبة عادةً لتنفيذ هذه الخطوة. يوصى بطريقة "الحد الأدنى للعتبة". - تشغيل محلل الجسيمات الموسعة من البرنامج المساعد Biovoxxel13 (الإضافات | | BioVoxxel موسّع جسيمات محلل) لتحديد MTT المستعمرات الإيجابية (الشكل 2). الشروط التوجيهية الأولية: الحجم (μm2) = 250-إنفينيتي؛ صلابة = 0.75-1.00.
- الحصول على قناع ثنائي من خلال العتبة الصورة الأصلية (صورة | ضبط | العتبة) للحصول على مستعمرات محددة جيداً (الشكل 1).
- تقدير متوسط قطر (D) من كل قيمة منطقة مستعمرة (A) وفقا للصيغة:

- تصفية النتائج عن طريق استبعاد المستعمرات التكاثرية المنخفضة (على سبيل المثال، انخفاض القطر).
- اختر الحد الأدنى لعدد الأقسام في الأسبوع(m)التي سيتم النظر فيها (على سبيل المثال، 1).
- تقدير نصف قطر المستعمرة (R) مع خلايا n وفقًا للصيغة التالية:

حيث، ص هو نصف قطرها متوسط الخلايا الفردية في التعليق، ن هو عدد الخلايا التي تشكل مستعمرة التي عانت الانقسامات م كل أسبوع خلال أسابيع ث في الثقافة. في النمو الأسي: n = 2(m*w). ρ هو كفاءة التعبئة والتغليف. لاحظ أنه في الحركة العشوائية ، وكفاءة التعبئة والتغليف هو ~ 0.64 وكثافة التعبئة الكسر ممكن للمجالات متطابقة هو 0.7414. - تجاهل كافة المستعمرات التي تقدم قطر أقل من 2R كما خلاياها لم تحقق الحد الأدنى لعدد التقسيمات في الخطوة 3.3.4.1.
- الحصول على صور لكل لوحة باستخدام المجهر المقلوب. ضبط التكبير من أجل الحصول على الحد الأقصى من مجال الرؤية مع عدد أقل من الصور ، ولا يزال قادرا على الكشف عن المستعمرات الصغيرة (عادة 4x أو 10x الأهداف).
النتائج
وقد تم اختيار نموذج تجريبي للتحول الخلوي مع إدخال ثلاثة عناصر جينية في البلدان BPECs لتوليد نتائج تمثيلية للتحول على6،7 (الشكل 3). تم اشتقاق BPECs غير المحولة(N)من أنسجة الثدي الخالية من الأمراض كما وصفها Ince وزملاؤه6 وجرى ...
Discussion
10- وتوفر البروتوكولات التجريبية الموصوفة في هذه الورقة أدوات مفيدة لتقييم التحول المُعدي للخلايا المُزَوَّقة في المختبر. كل تقنية تقيم جوانب محددة من عملية التحول، وبالتالي، يجب إيلاء اهتمام خاص عند استخلاص استنتاجات من تحليل واحد. النمو منحنيات بناء هو النهج الذي يتطلب المعلومات المتا?...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويمول مختبر AG المجلس الإسباني للسلامة النووية. ت.أ. و أ. ج. عضوان في مجموعة بحثية معترف بها من قبل جنرالات كاتالونيا (2017-SGR-503). تحمل شركة MT عقدًا ممولًا من المؤسسة العلمية Asociación Española Contra el Cáncer [AECC-INVES19022TERR]. يتم تمويل عقد G.F. من منحة من مؤسسة سيليكس.
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
References
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved