Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Meme Epitel Hücrelerinde Onkojenik Dönüşümün İn Vitro Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, insan meme hücrelerinin dönüşümünü değerlendirmek için deneysel in vitro araçlar sağlar. Hücre çoğalma hızının takibi, ankraj-bağımsız büyüme kapasitesi ve hücre soylarının 3Boyutlu kültürlerde bazal membran matrisi ile dağılımı nın detaylı adımları tanımlanmıştır.
Özet
Tümörigenez, hücrelerin düşmanca koşullar altında büyüme, hayatta kalma ve yayılmaya izin veren yetenekler edindiği çok aşamalı bir süreçtir. Farklı testler belirlemek ve kanserli hücrelerin bu işaretleri ölçmek için aramak; ancak, genellikle hücresel dönüşümün tek bir yönü üzerinde odaklanmak ve, aslında, birden fazla test onların uygun karakterizasyonu için gereklidir. Bu çalışmanın amacı, araştırmacılara hücresel dönüşümü geniş bir perspektiften değerlendirmek için bir dizi araç sağlamak ve böylece sağlam sonuçlar elde etmeyi mümkün kılmaktır.
Sürekli proliferatif sinyal aktivasyonu tümöral dokuların en önemli özelliğidir ve zaman içinde elde edilen popülasyon sayısı nın hesaplanmasıyla in vitro koşullarda kolayca izlenebilir. Ayrıca, 3D kültürlerde hücrelerin büyüme çevreleyen hücreler ile etkileşimsağlar, in vivo oluşur ne benzer. Bu, hücresel agregasyonun değerlendirilmesini ve farklı hücresel belirteçlerin immünororesan etiketlemesi ile birlikte tümöral dönüşümün bir diğer ilgili özelliği hakkında bilgi edinmesini sağlar: uygun organizasyonun kaybı. Dönüştürülmüş hücrelerin bir diğer dikkat çekici özelliği diğer hücrelere bağlanmadan ve hücre dışı matris, hangi ankraj tsay ile değerlendirilebilir olmadan büyümek için kapasiteleridir.
Hücre büyüme hızını değerlendirmek, 3Boyutlu kültürlerde hücre soyundan belirteçlerin immünororesan etiketlemesini gerçekleştirmek ve yumuşak agarlarda ankrajdan bağımsız hücre büyümesini test etmek için ayrıntılı deneysel prosedürler sağlanmaktadır. Bu metodolojiler meme kanserinde alaka nedeniyle Meme Primer Epitel Hücreleri (BPEC) için optimize edilsin; ancak, bazı ayarlamalardan sonra diğer hücre türlerine yordamlar uygulanabilir.
Giriş
Neoplazm gelişimi için birden fazla ardışık olay gereklidir. 2011 yılında Hanahan ve Weinberg dönüştürülmüş hücrelerin büyümesini, hayatta kalmalarını ve yayılmasını sağlayan 10 yeteneği tanımladı: sözde "Kanser Damgaları"1. Burada açıklanan metodoloji, tümör hücrelerinin ayırt edici özelliklerinden bazılarına odaklanarak in vitro hücresel dönüşümü değerlendirmek için üç farklı araç derlemektedir. Bu teknikler hücre çoğalma oranını, 3Boyutlu kültüredildiğinde hücrelerin davranışlarını ve ankraj bağımsızlığı olan koloniler oluşturma kapasitelerini değerlendirir.
Hücre modelleri in in vitro hipotezi test etmek için çok önemlidir. Farklı yaklaşımlar kanser çalışması için hücresel dönüşüm deneysel modeller oluşturmak için geliştirilmiştir2,3,4. Meme kanseri dünya çapında kadınlar arasında en sık görülen kanser olduğundan ve kadınlar arasında kanser ölümlerinin yaklaşık% 15 sorumludur5, meme epitel hücrelerinin uygun hücresel modeller sağlayan daha fazla araştırma için son derece önemlidir. Bu makalede, biz meme primer epitel hücreleri deneysel bir model kullanarak hücresel dönüşümü değerlendirmek için üç teknik potansiyelini resimli var (BPEPs) dönüşüm başlangıçta İnce ve meslektaşları tarafından açıklanan 20076 ve daha sonra bizimlaboratuvardauygulanan 7 . Bu deneysel model üç hedefli genin (SV40 Large T ve küçük t antijenleri burada Ttag, hTERTve HRASolarak anılacaktır) olmayan bpecs genomuna sıralı değişiklik dayanmaktadır. Ayrıca, BPEP'ler türev için kullanılan yöntem, meme bezi fizyolojik özelliklerinin bazılarını koruyan heterojen bir hücre kültürü ile sonuçlanan, luminal veya miyoepitelyal belirteçleri ile meme epitel hücrelerinin bakım yanadır.
Meme bezinde, süt üretiminden sorumlu olan luminal meme epitel hücreleri lümenin yakınında bulunurken, miyoepitelyal hücreler luminal hücrelerin etrafına atılır ve sütü nisine meme ucuna götüren kasılma hareketlerine dikkat eder. Bu hücre soyu arasında uygun organizasyonun kaybedilmesi, 3D hücre kültürlerinde farklı soy belirteçlerinin immünororesan saptanması sonrasında in vitro olarak değerlendirilebilen tümöral transformasyon8'in bir özelliğidir. Tümörhücrelerinin bir diğer önemli özelliği diğer hücrelere bağlanmadan ve hücre dışı matriks1'ebağlanmadan büyüme kapasiteleridir. Sağlıklı hücreler süspansiyon içinde büyümeye zorlandığında, anoikis \u2012 gibi mekanizmalar hücre dışı matris \u2012 ayrılmasına yanıt olarak indüklenen hücre ölümü türü9aktive edilir . Hücre ölümü kaçırma kanserin ayırt edici özelliklerinden biridir ve böylece, dönüştürülmüş hücreler anoikis inaktive ve çapa bağımsız bir şekilde hayatta yeteneğine sahiptir. Bu kapasite, yumuşak agar kullanılarak ankrajdan bağımsız bir teşp ile in vitro olarak değerlendirilebilir. Ayrıca, tümöral dokuların doğal bir özelliği, sadece süspansiyon tahlillerinde değil, aynı zamanda tek katmanlı yapışık kültürlerin büyüme hızını izleyerek, zaman içinde hücre sayısının artışını ölçerek in vitro koşullarda kolayca izlenebilen sürekli proliferatif sinyalizasyon kapasitesidir.
Tümörijenik potansiyeli test etmek için en iyi model murine modellerinde tümör hücrelerinin aşılanması ve yerinde tümör gelişiminin değerlendirilmesi olmasına rağmen, deneysel işlemlerde kullanılan hayvan sayısını mümkün olduğunca en aza indirmek önemlidir. Bu nedenle, in vitro dönüşümü değerlendirmek için uygun testlere sahip olmak en önemli önceliktir. Burada, hücresel dönüşüm modelleri ile çalışan laboratuvarların çoğunda kolayca uygulanabilen kısmen ve tamamen dönüştürülmüş meme epitel hücrelerinin tümörijenik potansiyelini değerlendirmek için bir dizi araç salıyoruz.
Protokol
Aşağıdaki deneylerde kullanılan insan örnekleri clínica Pilar Sant Jordi 'de (Barselona) standart prosedür onayı altında yapılan mammoplastilerden elde edilmiştir. Aksi belirtilmedikçe tüm işlemler Sınıf II Biyolojik Güvenlik Kabini'nde gerçekleştirilir.
1. İnsan meme epitel hücrelerinin in vitro kültür ve büyüme eğrisi arsa birikimi
-
Meme primer epitel hücrelerinin in vitro kültürü (BPEP): hücre geçişi
NOT: BPEC türetme ve hücre kültürü için Ince ve ark., 20076tarafından açıklanan talimatları izleyin.- Orta hazırlık.
- Ek WIT bazal P veya T takviyeleri ile tanımlanan orta, üretici tarafından sağlanan, birincil veya dönüştürülmüş BPECs kültürlü olup olmadığına bağlı olarak.
- Takviye WIT ortamına, birincil veya dönüştürülmüş BPEC'ler için 25 ng/mL için 100 ng/mL'lik son konsantrasyona kolera toksini ekleyin.
DİkKAT: Kolera toksini yutulursa ölümcüldür. Kişisel koruyucu ekipman kullanın. Çevreye salınmasından kaçının.
- Hücre kültürü bakımı ve geçişi.
NOT: Aşağıdaki adımlar için hücrelerin bir T25 şişesinde büyüdüğünü unutmayın. Bununla birlikte, hacimler yüzey alanı açısından orantılılığı koruyan diğer hücre kültürü biçimlerine uyarlanabilir.- Her gün hücre birleşimini kontrol edin. Kültür %90'ı dindiğinde, hücre geçişini gerçekleştirin.
- Her şişe için 1x PBS, 3x tripsin, orta ve 2 mL Fetal Sığır Serumu (FBS) içeren 15 mL konik tüp elde edin.
- Ortamı şişeden çıkarın ve FBS içeren 15 mL konik tüpte saklayın.
- Hücreleri 1x PBS ile durula.
- 1 mL 3x tripsin ekleyerek hücreleri yüzeyden ayırın. 37 °C'de 5 dk kuluçka.
- Hücrelerin ayrılıp ayrılmadığını kontrol edin. Hücreler tamamen ayrılmış değilse güçlü sallayarak uygulayın.
- FBS ile desteklenen ayrılmış ortamı ekleyerek trypsin'i inaktive edin.
- Hücresel süspansiyonu hasat edin ve 15 mL konik tüpe yerleştirin.
- 5 dk için 500 x g santrifüj, supernatant ortadan kaldırmak ve bir parmak ile tüp alt flicking tarafından peletli hücreleri yeniden askıya.
- Pelete 1-2 mL taze ortam ekleyin ve otomatik hücre sayacı veya hemositometre kullanarak hücre konsantrasyonu ölçün. Bu veriler daha sonra popülasyon iki katına hesaplamak ve büyüme eğrisi çizmek için kullanılacaktır. Değiştirilmiş hücre kültürü yüzey şişelerinde 12.000 hücre/cm2 (örneğin, bir T25 şişesi için 300.000 hücre) (Bkz. Malzeme Tablosu).
NOT: Konsantrasyon uygun nicelleştirme sağlamak için çok yüksek ise hücre süspansiyon çözeltisi seyreltin. - 5 mL'lik son hacme orta ekleyin ve hücreleri 37 °C ve %5 CO2 atmosferinde kuluçkaya yatırın.
- Her 48 saatte bir hücre kültür ortamını değiştirin.
- Orta hazırlık.
-
Popülasyon katlama hesaplama ve veri görselleştirme
- 1.1.2.10 adımında elde edilen hücre sayısı verilerini kullanarak, birikmiş popülasyon ikikatına (PH) değerleri elde etmek için aşağıdaki formülü uygulayın:
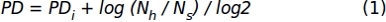
Nerede, PDi önceki alt kültüre kadar hücreler tarafından elde edilen popülasyon ikikatına sayısını gösterir (önceki alt kültürde biriken PD anlamına gelir), Nh hasat edilen hücrelerin sayısı dır ve Ns tohumlu hücrelerin sayısıdır. - Kültürdeki gün sayısının(x-ekseni)ve birikmiş PD'nin(y-ekseni) temsil edildiği xy grafiğini kullanarak belirli bir zaman aralığı için verileri temsil eder.
- En uygun çizgiyi ve montaj denklemini alın:

NOT: Artan eğim (b) artan çoğalma oranı anlamına gelir.
- 1.1.2.10 adımında elde edilen hücre sayısı verilerini kullanarak, birikmiş popülasyon ikikatına (PH) değerleri elde etmek için aşağıdaki formülü uygulayın:
2. Bodrum membran matrisinde üç boyutlu (3D) kültür ve immünfloresan protein tespiti
- Bazal membran matrisinde 3B kültür
NOT: Bu protokol Debnath vd., 200310'dan uyarlanmıştır ve 24 kuyu plakası için optimize edilmiştir (bkz. Malzeme Tablosu).- Deneyden bir gün önce malzemeyi hazırlayın: 4 °C'de bir gecede soğutun ve pipet uçları, mikrosantrifüj tüpleri ve kuyu tabaklarının dondurucuda soğumasını bekleyin.
NOT: Matris uzun süreli depolama için -20 °C'de tutulmalıdır. Birden çok donma-çözülme döngüleri önlemek için aliquots olun. - Deney günü, önceden soğutulmuş malzemeyi buzüzerine yerleştirin.
- Yüzey gerilimini azaltmak için kuyuları soğuk steril 1x PBS ile durula.
- Her kuyunun altını 100 μL'lik bodrum membran matrisi ile kapatın.
NOT: Matrisi yavaşça dağıtın ve kuyuya yaydı; tek katmanlı hücre kültürünün büyümesini önlemek için alt tabakada kabarcık oluşumunu önlemek için çok önemlidir. - Matris tabakasının katılaması için plakayı 37 °C'de kuvöze yerleştirin.
NOT: Genellikle katılaşmak için yaklaşık 20 dakika sürer. - Bu arada, daha önce adım 1.1'de açıklandığı gibi hücreleri trypsinize. 5 dk için 500 x g hücreleri santrifüj ve orta resuspend. 400.000 hücre/mL süspansiyon hazırlayın ve boru lama ile herhangi bir hücre yığınını nazikçe ayrıştırın.
- Orta yı %8'lik bazal membran matrisi ile hazırlayın ve %4 matriste 200.000 hücre/mL çözeltisi elde etmek için 1:1 (v/v) hücresel süspansiyonla karıştırın.
NOT: Matris gereksiz atıkları önlemek için gereken ortam miktarını hesaplayın. - Matris çözeltisine 500 μL'lik hücre süspansiyonunu yerleştirin ve toplam 100.000 hücreyi %4'lük bazal membran matrisi ile orta alanda tohumlayın.
- Hücreleri 37 °C'de birkaç dakika kuluçkaya yatırın ve ardından %4'lük bazal membran matrisi ile ortamın 500°L'sini ekleyin. Hücreleri 37 °C'de bir kuvözde %5 CO2 ile 14 gün kuluçkaya yatırın. Tohumlu hücreler, acinibenzeri yapılardan kaynaklanacak şekilde gruplanır ve çoğalır.
NOT: Hücre hareketliliği ve agregasyonu 3B oluşum işlemi sırasında zaman atlamalı olarak izlenebilir. Bu olayları değerlendirmek için görüntü analizi yazılımLarını (örneğin, Fiji/ImageJ veya Imaris) kullanın. Acini sayısı ve boyutu toplama sürecine ve çoğalma hızına bağlıdır ve hücre tipleri arasında değişebilir. İstenilen 3D yapıları elde etmek için temel membran matris konsantrasyonu ve tohumlu hücreleri ayarlayın. - Haftada 2-3 kez% 4 bodrum membran matris ile orta 500 μL ekleyin.
NOT: Manipülasyon sırasında plakayı hafifçe taşıyan tabakaların bozulmasını önleyin. - İstenirse, acini sayısı ve boyutu kültür döneminde ölçülebilir. Bunu yapmak için, faz kontrastı veya DIC ters mikroskobu kullanarak tohumlamadan sonra farklı zamanlarda rastgele fotoğraflar çekin. 100-200 3B yapıların çapını ölçmek için görüntü analizi yazılımını kullanın.
- Deneyden bir gün önce malzemeyi hazırlayın: 4 °C'de bir gecede soğutun ve pipet uçları, mikrosantrifüj tüpleri ve kuyu tabaklarının dondurucuda soğumasını bekleyin.
- İmmünoboyama
NOT: Protokolün bu bölümünde steril koşullar aranmaz.- Kültür ortamını kaldırın.
- Bodrum membran matrisini p200 pipet ucunu kullanarak, ucu kesilmiş olarak yırtın. Bir cam kaydırak üstüne ~ 50 μL disaggregated matris yerleştirin ve1-2cm 2 bir alana smear .
- Numunenin oda sıcaklığında tamamen kurumasını veya işlemi hızlandırmak için 37 °C'de Bir ısıtma plakası kullanmasına izin verin. 30 dakika boyunca -20 °C'de metanol:aseton (1:1, v/v) ile numuneleri düzeltin.
NOT: Hücreler tarafından ifade edilen floresan proteinler gibi önceki belirteçlerin floresan sinyali silinir.
DİkKAT: Metanol yanıcıdır, solunduğunda, yutulduğunda veya deriyle temas ederse toksiktir. Kişisel koruyucu ekipman giyin ve bir duman başlık içinde çalışmak. - Fiksasyon çözümlerini atın ve varsa fazlalığı filtre kağıdına kaydırarak çıkarın.
NOT: Protokol burada duraklatılabilir. Kurutuldıktan sonra, slaytlar -20 °C'de birkaç ay saklanabilir. - Blok örnekleri epitops % 5 normal keçi serumu ve % 0.1 triton-X-100 1x PBS (bloklama çözeltisi) oda sıcaklığında 2 saat.
- Bu arada, bloklama çözeltisinde istenilen konsantrasyonda birincil veya ikincil antikorları seyrelterek antikorların çalışma çözümlerini hazırlayın.
NOT: Antikor konsantrasyonu hücre tipine ve antikor referansına bağlı olarak doğru bir şekilde ayarlanmalıdır. Kılavuz olarak, BPEC'teki luminal ve miyoepitelyal soylardan hücreleri tanımlamak için primer anti-Sitokeratin 14 ve anti-Claudin-IV antikorları (bkz. Malzeme Tablosu)kullanılabilir. Önerilen çalışma çözeltisi konsantrasyonu bu birincil antikorlar için 1:100 ve anti-Fare ve anti-Rabbit ikincil antikorlar için 1:500'dür (bkz. - 30 μL primer antikorlar çözeltisi ekleyin ve buharlaşmayı önlemek için bir laboratuvar sarma filmi şeridi ile kaplayın. Nemli bir odada 4 °C'de bir gece kuluçkaya yatırın.
- Her biri 1 saat için 1x PBS ile üç kez yıkayın.
- İkincil antikorlar için adım 2.2.7'yi tekrarlayın. Kuluçka karanlıkta yapılmalıdır.
- 2 saat boyunca 1x PBS ile yıkayın.
NOT: Belirli numuneler için sinyal/gürültü oranını artırmak için antikor konsantrasyonunu, kuluçka süresini ve yıkama sertliğini ayarlayın. - Kalan PBS'yi çıkarın ve kurutuldıktan sonra, antifade montaj ortamında seyreltilmiş 0,25 g/mL'de DAPI ile karşı lekesi kurutun. Basınç uygulamadan yerleşmesine izin vererek slaytları bir kapak kayma ile kapatın. Ojeli fok.
NOT: Numuneler 4 °C'de birkaç hafta saklanabilir. Uzun süreli depolama için -20 °C'de saklayın. - Konfokal mikroskop kullanarak her akok için floresan sinyal dağılımını analiz edin.
NOT: Konfokal mikroskop konfigürasyonu, kullanılan ekipmana ve numuneye uygulanan antikorlara bağlı olarak doğru bir şekilde belirlenmelidir. Kılavuz olarak, Malzeme Tablosu'ndaayrıntılı olarak yer alan ekipman ve reaktiflerle 40x objektif ve aşağıdaki lazer ve dedektör ayarlarını kullanın: DAPI için 405 lazer (%3-5) ile uyarma, PMT dedektörü (800V, Ofset: -9) ve 410 nm'den 500 nm'ye kadar spektral bant ile algılama; A488 (Claudin-IV) için 488 lazer (%7-%10) ile uyarma kullanımı, PMT dedektörü (800V, Ofset: -20) ve 490 nm'den 550 nm'ye kadar bir spektral bant; ve Cy3 (Cytokeratin 14) için 555 lazer (%2-10) ile uyarma, PMT dedektörü (800V, Ofset: -35) ve 560 nm'den 600 nm'ye kadar bir spektral bant ile algılama.
3. Ankrajbağımsız test, MTT boyama ve otomatik koloni nicelleştirme
- Anchorage-bağımsız töz: agar ve hücresel süspansiyon kaplama
NOT: Protokol Borowicz ve ark., 201411'den BPEC'lerde deneyler yapmak üzere uyarlanmıştır.- Steril bir şişede ultra saf suda seyreltilmiş %1,2 agar çözeltisi hazırlayın. Çözeltiyi otomatik olarak tökezle ve deney sırasında 42 °C'de muhafaza edin. Agar çözeltisi 4 °C'de saklanabilir; gerektiğinde, agar çözeltisini tekrar sıvı hale gelene kadar ısıtın.
DİkKAT: Otoklav dan sonra yanmayı önlemek için ısıya dayanıklı eldivenler kullanın.
NOT: Bundan sonra steril koşullar korunmalıdır. - 1:1 (v/v) komple önceden ısıtılmış orta ve %1,2 agar çözeltisini karıştırarak %0,6 agar çözeltisi hazırlayın. Erken katılaşmayı önlemek için 42 °C'de koruyun.
NOT: Orta daha önce tam olarak tamamlanmış% 0.6 agar + orta çözelti bir kez karışık elde etmek için çift takviye edilebilir. - Orta çözeltide %0,6 agar ile 35 mm'lik bir kuyunun altını kapatın ve oda sıcaklığında katılamasına izin verin. Agar katılaşmaönce plakanın alt tamamen kaplı olduğundan emin olun, aksi takdirde, hücreler plaka yapışabilir ve monolayer büyüyebilir.
NOT: Yapışık ve yapışmaz yüzey plakaları kullanılabilir. - Bu arada, trypsine hücreleri ve, bir kez santrifüj ve orta yeniden askıya, bir 50.000 hücre / ml çözelti hazırlamak ve yavaşça tekrar tekrar borulama tarafından herhangi bir hücre kümeleri ayrıştırmak.
- 25.000 hücre/mL nihai konsantrasyonda ortamda %0,3 agar + hücre süspansiyonu hazırlayın.
NOT: Optimal hücre konsantrasyonu hücre tipleri arasında farklılık gösterebilir. Bireyselleştirilmiş koloniler oluşana kadar farklı konsantrasyonları deneyin.- 50 mL steril bir tüpün üzerine 40 m'lik bir süzgeç filtresi yerleştirin ve 50.000 hücre/mL çözeltisini filtreleyin ve tüpün dibine düşmesini sağlayan bir filtre uygulayın.
- Filtreyi 50 mL steril tüpten çıkarın, hücre içeren tüpü 45° açıya doğru yatırın ve tüpün iç duvarından dökülen %0,6 agar + orta çözeltihacmini bırakın. Bu, agar çözeltisinin hücrelere zarar vermemek ve erken katılaşmasını önlemek için yeterli derecede soğumasını sağlayacaktır.
- Karışımı homojenize ve mevduat 1 mL 0.3% agar + hücre süspansiyon orta (içeren 25.000 hücreleri) daha önce katılaşmış alt agar tabakasının üstüne.
- Hücrelerin bireyselleştirdiğinden emin olmak için ters bir mikroskop kullanarak tohumlu hücreleri görselleştirin. Aksi takdirde, deneme tekrarlanmalıdır.
- Agar tabakası tamamen katılaşmış kadar bekleyin, sonra dikkatle altında hassas agar katmanları rahatsız etmeden üstüne taze orta 1 mL ekleyin.
- Hücreleri 3 7 °C ve %5 CO2'de bir kuvözde 3 hafta kuluçkaya yatırın.
NOT: Koloni oluşumu için gereken süre farklı hücre tipleri arasında değişebilir, ancak genellikle 3 hafta yeterlidir. - Haftada iki kez orta değiştirin. Bunu yapmak için, yavaşça size doğru plaka yatırın, alt köşesinde orta aspire, ve taze orta 1 mL ekleyin.
NOT: Agar katmanlarına dokunmaktan kaçının, çünkü plakadan kolayca kopabilirler.
- Steril bir şişede ultra saf suda seyreltilmiş %1,2 agar çözeltisi hazırlayın. Çözeltiyi otomatik olarak tökezle ve deney sırasında 42 °C'de muhafaza edin. Agar çözeltisi 4 °C'de saklanabilir; gerektiğinde, agar çözeltisini tekrar sıvı hale gelene kadar ısıtın.
- MTT boyama
- Thiazolyl Blue Tetrazolium Bromür (MTT) stok çözeltisini steril bir şişede ultra saf suda 6 mg/mL'de hazırlayın ve 0,2 μm filtreler kullanarak filtre çözeltisi hazırlayın. Bu MTT çözeltisi -20 °C'de 6 aya kadar saklanabilir.
DİkKAT: MTT tahrişe neden olabilir ve genetik bozukluklara neden olduğundan şüpheleniliyor. Güvenlik gözlüğü, eldiven ve solunum filtresi kullanın.
NOT: Tekrarlanan donma-çözülme döngülerinden kaçının. - Stok çözeltisini steril ultrasaf su ile seyrelterek 1 mg/mL'de MTT'nin çalışma çözeltisini hazırlayın.
- Koloni oluşum süresi sona erdikten sonra, ortayı plakadan çıkarın ve her kuyuya 1 mg/mL MTT 1 mL ekleyin.
- Kuluçka makinesinde 24 saat kuluçka. MTT çözümlerini hafifçe azarlayarak çıkarın. Plakalar 4 °C'de birkaç hafta saklanabilir.
NOT: Spesifik olmayan kristal oluşumunu önlemek için ışığa maruz kalmaktan kaçının.
- Thiazolyl Blue Tetrazolium Bromür (MTT) stok çözeltisini steril bir şişede ultra saf suda 6 mg/mL'de hazırlayın ve 0,2 μm filtreler kullanarak filtre çözeltisi hazırlayın. Bu MTT çözeltisi -20 °C'de 6 aya kadar saklanabilir.
- Koloni nicelleştirme
- Ters bir mikroskop kullanarak her plakanın görüntülerini alın. Daha az görüntüyle maksimum görüş alanını elde etmek ve hala küçük kolonileri (genellikle 4x veya 10x hedefleri) algılayabilmek için büyütmeyi ayarlayın.
NOT: Görüntülerin homojen bir arka plan olduğundan emin olun. Lekeli olmayan koloniler sayısallaştırılamayacağından ne faz-kontrast ne de diferansiyel girişim kontrastı gerekmez. - Koloni sayısını ve her MTT pozitif koloninin alanını saymak için ImageJ/Fiji yazılımı12'ye resim yükleyin.
NOT: Otomatik niceleme için bir komut dosyası Ek Dosyaolarak sağlanır. Kodu yürütmek için makro düzenleyiciye yapıştırın (Eklentiler | Yeni | Makro) ve yönergeleri izleyin.- Orijinal görüntüyü eşleyerek ikili maske elde edin (Resim | | ayarlama Eşik) iyi sınırlı koloniler elde etmek için (Şekil 1).
NOT: Bu adımı gerçekleştirmek için genellikle 8 veya 16 bit lik görüntüler gereklidir. "Minimum eşik" yöntemi önerilir. - Biovoxxel plugin13 'den Genişletilmiş Parçacık Analizörü çalıştırın (Eklentiler | BioVoxxel | Genişletilmiş Parçacık Çözümleyicisi) MTT pozitif kolonileri tanımlamak için(Şekil 2). İlk rehberlik koşulları: Boyut (μm2) = 250–Sonsuzluk; Sağlamlık = 0.75-1.00.
- Orijinal görüntüyü eşleyerek ikili maske elde edin (Resim | | ayarlama Eşik) iyi sınırlı koloniler elde etmek için (Şekil 1).
- Formüle göre her koloni alanı değerinden (A) ortalama çapı (D) tahmin edin:

- Düşük proliferatif kolonileri (örn. düşük çap) dışlayarak filtre sonuçları.
- Değerlendirilmek üzere haftada en az sayıda bölüm(m)seçin (örn. 1).
- Aşağıdaki formüle göre n hücreleri ile bir koloninin(R)yarıçapını tahmin edin:

Nerede, r süspansiyon bireysel hücrelerin ortalama yarıçapı, n kültürde w hafta boyunca her hafta m bölünmeleri acı bir koloni oluşturan hücrelerin sayısıdır. Üstel büyümede: n = 2(m*w). ρ Ambalaj verimliliğidir. Rasgele hareket halinde, ambalaj verimliliği ~ 0,64 ve aynı küreler için en yoğun olası ambalaj fraksiyonu 0,7414olduğunu unutmayın. - Hücreleri adım 3.3.4.1'de kabul edilen en az bölünme sayısını elde etmemiş olduğundan, çapı 2R'dan daha düşük olan tüm kolonileri atın.
- Ters bir mikroskop kullanarak her plakanın görüntülerini alın. Daha az görüntüyle maksimum görüş alanını elde etmek ve hala küçük kolonileri (genellikle 4x veya 10x hedefleri) algılayabilmek için büyütmeyi ayarlayın.
Sonuçlar
BpECs üç genetik elementin tanıtımı ile hücresel dönüşüm deneysel bir model onkojenik dönüşümtemsilisonuçlar üretmek için seçildi 6,7 (Şekil 3). Dönüştürülmeyen BPEC'ler(N),İnce vemeslektaşları tarafından açıklandığı gibi hastalıksız meme dokusundan 6 ve burada belirtilen protokolü takip ederek kültürlü olarak elde edilmiştir. STASIS üstesinden...
Tartışmalar
Bu makalede açıklanan deneysel protokoller in vitro kültür hücrelerinin onkojenik dönüşümünü değerlendirmek için yararlı araçlar sağlar. Her teknik dönüşüm sürecinin belirli yönlerini değerlendirir ve bu nedenle tek bir analizden sonuç çıkarken özel dikkat edilmelidir. Büyüme eğrileri birikme başka amaçlar için hücreleri biriktirme zaman zaten mevcut bilgi gerektiren bir yaklaşımdır. Bu, bu tekniği diğer hücre çoğalma tahlillerine göre daha ucuz ve daha kolay uygulanmasını sa?...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
AG laboratuvarı İspanya Nükleer Güvenlik Konseyi tarafından finanse edilmektedir. T.A. ve A.G. Generalitat de Catalunya (2017-SGR-503) tarafından tanınan bir araştırma grubunun üyeleridir. MT Bilimsel Vakfı Asociación Española Contra el Cáncer [AECC-INVES19022TERR] tarafından finanse edilen bir sözleşme tutar. G.F. sözleşmesi Cellex Vakfı'nın hibesi ile finanse edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
Referanslar
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır