A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכה במבחנה של טרנספורמציה אונקוגנית בתאי אפיתל ממ"ר אנושיים
In This Article
Summary
פרוטוקול זה מספק כלים ניסיוניים במבחנה כדי להעריך את הטרנספורמציה של תאי אם אנושיים. מתוארים שלבים מפורטים לקצב התפשטות תאים, יכולת צמיחה בלתי תלויה בעיגון והפצה של שושלת תאים בתרבויות תלת-מימד עם מטריצת קרום מרתף.
Abstract
Tumorigenesis הוא תהליך רב שלבי שבו תאים לרכוש יכולות המאפשרות הצמיחה שלהם, הישרדות, והפצה בתנאים עוינים. בדיקות שונות מבקשות לזהות ולכרות סימני היכר אלה של תאים סרטניים; עם זאת, לעתים קרובות הם מתמקדים בהיבט אחד של טרנספורמציה תאית, ולמעשה, בדיקות מרובות נדרשות לאפיון הנכון שלהם. מטרת עבודה זו היא לספק לחוקרים סט של כלים להערכת טרנספורמציה תאית במבחנה מנקודת מבט רחבה, ובכך לאפשר להסיק מסקנות קול.
הפעלת איתות מתמשך היא התכונה העיקרית של רקמות הגידול והוא יכול להיות במעקב בקלות תחת תנאים במבחנה על ידי חישוב מספר הכפלות האוכלוסייה שהושגו לאורך זמן. חוץ מזה, הצמיחה של תאים בתרבויות 3D מאפשר האינטראקציה שלהם עם התאים שמסביב, דומה למה שקורה vivo. זה מאפשר הערכה של צבירת תאים, יחד עם תיוג immunofluorescent של סמנים תאיים ייחודיים, כדי לקבל מידע על תכונה רלוונטית אחרת של טרנספורמציה גידולית: אובדן ארגון תקין. מאפיין יוצא דופן נוסף של תאים שהשתנו הוא יכולתם לגדול ללא חיבור לתאים אחרים ולמטריצה החוץ-תאית, אותה ניתן להעריך באמצעות מבחני המעגן.
נהלים ניסיוניים מפורטים להערכת קצב צמיחת התאים, לביצוע תיוג immunofluorescent של סמני שושלת תאים בתרבויות 3D, ולבדוק צמיחת תאים עצמאית מעגן אגר רך מסופקים. מתודולוגיות אלה ממוטבות לתאי אפיתל ראשוניים בשד (BPEC) בשל הרלוונטיות שלה בסרטן השד; עם זאת, ניתן להחיל שגרות על סוגי תאים אחרים לאחר התאמות מסוימות.
Introduction
אירועים רצופים מרובים נדרשים לפיתוח neoplasm. בשנת 2011, חנהאן ויינברג תיארו 10 יכולות המאפשרות צמיחה, הישרדות והפצה של תאים שהשתנו: מה שמכונה "סימני ההיכר של הסרטן"1. המתודולוגיה המתוארת כאן אוספת שלושה כלים שונים להערכת טרנספורמציה תאית במבחנה על ידי התמקדות בכמה מהתכונות הייחודיות של התאים הגידוליים. טכניקות אלה מעריכות את שיעור התפשטות התאים, את התנהגות התאים כאשר הם מתורבתים תלת-מימד ואת יכולתם ליצור מושבות עם עצמאות מעגן.
מודלים של תאים חיוניים לבדיקת השערה במבחנה. גישות שונות פותחו כדי ליצור מודלים ניסיוניים של טרנספורמציה תאית לחקרהסרטן 2,3,4. מאז סרטן השד הוא הסרטן השכיק ביותר בקרב נשים ברחבי העולם והוא אחראי על כ 15% ממקרי המוותמסרטן בקרב נשים 5, מתן מודלים תאיים מתאימים של תאי אפיתל חלבי הוא בעל חשיבות עליונה להמשך חקירה. במאמר זה, ימחצנו את הפוטנציאל של שלוש טכניקות כדי להעריך טרנספורמציה תאית באמצעות מודל ניסיוני של תאים אפיתל ראשי השד (BPECs) טרנספורמציה שתוארה בתחילה על ידי Ince ועמיתיו בשנת 20076 ומאוחר יותר מיושםבמעבדה שלנו 7. מודל ניסיוני זה מבוסס על שינוי רציף של שלושה גנים ממוקדים (SV40 גדול T ואנטיגנים t קטנים המכונה Ttag, hTERT, ו HRAS) לגנום של BPECs שאינם טרנספורמציה. יתר על כן, השיטה המשמשת נגזרת BPECs מעדיף את התחזוקה של תאי אפיתל החלב עם סמנים זוהרים או myoepithelial, וכתוצאה מכך תרבות תאים הטרוגניים ששומרת על חלק מהתכונות הפיזיולוגיות של בלוטת החלב.
בבלוטות החלב, תאי אפיתל החלב הזוהר, האחראים על ייצור החלב, ממוקמים ליד לומן, ואילו תאים myoepithelial מסולקים סביב תאים זוהרים לטפל בתנועות התכווצות המוביל את החלב אל הפטמה. אובדן ארגון תקין בין שושלת תאים אלה הוא תכונה שלטרנספורמציה גידולית 8 שניתן להעריך במבחנה לאחר זיהוי immunofluorescent של סמני שושלת ייחודיים בתרבויות תאים תלת-מימדיים. מאפיין מרכזי נוסף של תאים סרטניים הוא היכולת שלהם לגדול ללא קשר לתאים אחרים ולמטריצה החוץ תאית1. כאשר תאים בריאים נאלצים לגדול בהשעיה, מנגנונים כגון anoikis \u2012 סוג של מוות תאי המושרה בתגובה ניתוק מן מטריצה חוץ תאית \u2012מופעלים 9. התחמקות של מוות תאי הוא אחד סימני ההיכר הייחודיים של סרטן ולכן, תאים שהשתנו מסוגלים להשבית אנויקי ולשרוד באופן בלתי תלוי עוגן. יכולת זו ניתן להעריך במבחנה עם בדיקה עצמאית מעגן באמצעות אגר רך. יתר על כן, תכונה אינהרנטית של רקמות גידולי היא יכולת איתות מתמשך שלהם, אשר ניתן לפקח בקלות תחת תנאים במבחנה על ידי מדידת הגידול של מספר התא לאורך זמן, לא רק בהשעיה assays אלא גם על ידי ניטור קצב הצמיחה של תרבויות חסידות monolayer.
למרות המודל הטוב ביותר לבדיקת פוטנציאל tumorigenic הוא חיסון של תאים סרטניים במודלים מורין והערכת התפתחות הגידול במקום, חשוב למזער את מספר בעלי החיים המועסקים בהליכים ניסיוניים ככל האפשר. לכן, לאחר בדיקות מתאימות כדי להעריך את השינוי במבחנה היא בראש סדר העדיפויות. כאן, אנו מספקים קבוצה של כלים כדי להעריך את הפוטנציאל tumorigenic של תאים אפיתל השד שינוי חלקי לחלוטין שניתן ליישם בקלות ברוב המעבדות שעובדים עם מודלים טרנספורמציה הסלולר.
Protocol
דגימות אנושיות ששימשו בניסויים הבאים התקבלו מהפחתת mammoplasties שבוצעו ב Clínica פילאר סנט ג'ורדי (ברצלונה) בהסכמת הליך סטנדרטי. כל ההליכים מבוצעים בקבינט בטיחות ביולוגית מסוג II אלא אם צוין אחרת.
1. בתרבות במבחנה של תאי אפיתל של אמא אנושית ועלילה עקומת צמיחה הצטברות
-
בתרבות במבחנה של תאי אפיתל ראשוניים בשד (BPECs): מעבר תאים
הערה: עבור נגזרת BPEC ותרבות תאים בצע את ההוראות המתוארות על ידי Ince et al., 20076.- הכנה בינונית.
- תוספת WIT בזל מוגדר בינוני עם תוספי P או T, המסופקים על ידי היצרן, בהתאם אם BPECs ראשי או השתנה הם מתורבתים.
- הוסף רעלן כולרה למדיום WIT בתוספת לריכוז סופי של 100 ננו/מ"ל עבור ראשי או 25 ng/mL עבור BPECs שהשתנו.
התריעה: רעלן כולרה הוא קטלני אם נבלע. השתמש בציוד מגן אישי. הימנע משחרורו לסביבה.
- תחזוקת תרבות תאים והתעלות.
הערה: עבור השלבים הבאים יש לזכור כי התאים גדלים בבקבוק T25. עם זאת, ניתן להתאים כמויות לתבניות אחרות של תרבות התאים תוך שמירה על המידתיות במונחים של שטח פנים.- בדוק את הקונפדרציה הסלולרית כל יום. כאשר התרבות היא 90% confluent, לבצע מעבר תאים.
- לרכוש 1x PBS, טריפסין 3x, בינוני צינור חרוט 15 מ"ל המכיל 2 מ"ל של סרום בקר עוברי (FBS) עבור כל בקבוקון.
- הסר את המדיום מן הבקבוק ולשמור אותו צינור חרוט 15 מ"ל המכיל FBS.
- יש לשטוף תאים באמצעות 1x PBS.
- נתק תאים מפני השטח על-ידי הוספת 1 מ"ל של טריפסין 3x. דגירה במשך 5 דקות ב 37 מעלות צלזיוס.
- בדוק אם התאים נותקו. יש למרוח רעידות נמרצות אם התאים אינם מנותקים לחלוטין.
- בטל את ההפעלה של טריפסין על-ידי הוספת המדיה השמורה בתוספת FBS.
- לקצור את ההשעיה התאית ולמקום אותו צינור חרוט 15 מ"ל.
- צנטריפוגה ב 500 x גרם במשך 5 דקות, לחסל את supernatant, ו resuspend את התאים גלולה על ידי הבהוב החלק התחתון של הצינור עם אצבע.
- הוסף 1-2 מ"ל של מדיה טרייה לכדור ולמדוד את ריכוז התא באמצעות מונה תאים אוטומטי או hemocytometer. נתונים אלה ישמשו מאוחר יותר לחישוב הכפלות האוכלוסיה ולציור עקומת הגידול. זרעים 12,000תאים/ס"מ 2 (לדוגמה, 300,000 תאים עבור בקבוק T25) בבקבוקי משטח של תרבות תאים מותאמים (ראה רשימת חומרים).
הערה: לדלל את פתרון השעיית התא אם הריכוז גבוה מדי כדי להבטיח כימות נאות. - הוסף בינוני לנפח סופי של 5 מ"ל והמדגר את התאים ב 37 °C (69 °F) ו 5% CO2 אטמוספירה.
- החלף את מדיום תרבות התא כל 48 שעות.
- הכנה בינונית.
-
חישוב הכפלת אוכלוסיה ופריטים חזותיים של נתונים
- באמצעות נתוני ספירת התאים שהתקבלו בשלב 1.1.2.10, החל את הנוסחה הבאה כדי להשיג את ערכי הכפלת האוכלוסיה המצטברת (PD) :
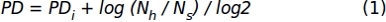
כאשר, PDi מציין את מספר הכפלות האוכלוסיה שהושגו על-ידי התאים עד תת-תרבות הקודמת (הוא מתייחס PD שנצבר בתת-תרבות הקודמת), Nh הוא מספר התאים שנקטפו, ו- Ns הוא מספר התאים שנזרעו. - ייצג נתונים עבור מרווח זמן מסוים באמצעות גרף XY שבומיוצגים מספר הימים בתרבות ( x-axis) וה- PD המצטבר (y-axis).
- קבל את הקו בכושר הטוב ביותר ואת משוואת ההתאמה:

הערה: שיפוע מוגבר (ב) פירושו שיעור התפשטות מוגבר.
- באמצעות נתוני ספירת התאים שהתקבלו בשלב 1.1.2.10, החל את הנוסחה הבאה כדי להשיג את ערכי הכפלת האוכלוסיה המצטברת (PD) :
2. תרבות תלת מימדית (תלת מימדית) במטריצת קרום מרתף וזיהוי חלבונים immunofluorescent
- תרבות תלת מימד במטריצת קרום מרתף
הערה: פרוטוקול זה הותאם מ Debnath et al., 200310 והוא מותאם עבור 24 צלחות באר (ראה רשימת חומרים).- הכינו את החומר יום לפני הניסוי: מטריצת קרום מרתף טרום צמרמורת לילה ב 4 מעלות צלזיוס ולתת טיפים פיפטה, צינורות microcentrifuge, וצלחות גם להתקרר במקפיא.
הערה: יש לשמור את המטריצה ב- -20 °C (60 °F) לאחסון לטווח ארוך. הפוך aliquots כדי למנוע מחזורי הפשרת הקפאה מרובים. - ביום הניסוי, מניחים חומר מקורר מראש על קרח.
- לשטוף בארות עם PBS סטרילי קר 1x על מנת להפחית את מתח פני השטח.
- מכסים את החלק התחתון של כל באר עם 100 μL של מטריצת קרום מרתף.
הערה: לוותר על המטריצה לאט ולהפיץ אותו ברחבי באר; זה חיוני כדי למנוע היווצרות בועה בשכבה התחתונה כדי למנוע צמיחת תרבות תאים monolayer. - מניחים את הצלחת באינקובטור, ב 37 מעלות צלזיוס, כדי לאפשר לשכבת המטריצה להתגבש.
הערה: בדרך כלל לוקח בערך 20 דקות להתגבש. - בינתיים, טריפסין תאים כפי שהוסבר קודם לכן בשלב 1.1. צנטריפוגה התאים ב 500 x גרם במשך 5 דקות לשימוש חוזר בינוני. הכן השעיה של 400,000 תאים/מ"ל ופרק בעדינות כל גוש תא על-ידי צינורות.
- הכינו את המדיום עם מטריצת קרום מרתף של 8% וערבבו 1:1 (v/v) עם מתלים תאיים כדי לקבל פתרון של 200,000 תאים/מ"ל במטריצה של 4%.
הערה: חשב את כמות המדיום הדרושה כדי למנוע פסולת מיותרת מטריצה. - מניחים 500 μL של מתלי תא בת פתרון מטריצה על גבי שכבת מטריצה כבר מוצק לזרוע כמות כוללת של 100,000 תאים במדיום עם 4% מטריצת קרום מרתף.
- דגירה תאים ב 37 °C (69 °F) במשך כמה דקות ולאחר מכן, להוסיף 500 μL של המדיום עם 4% מטריצת קרום מרתף. אינקובט התאים ב 37 °C (69 °F) באינקובטור עם 5% CO2 במשך 14 ימים. תאים זרעים יקבצו ויתרבו כדי שמקורם במבנים דמוייאדיני.
הערה: תנועתיות התא וצבירה ניתן לפקח על ידי זמן לשגות במהלך תהליך היווצרות 3D. השתמש בתוכנה לניתוח תמונות (לדוגמה, Fiji/ImageJ או Imaris) כדי להעריך אירועים אלה. המספר והגודל של האגני תלויים בתהליך הצבירה ובקצב ההתפשטות ועשויים להשתנות בין סוגי תאים. התאימו את ריכוז מטריצת הממברנה במרתף ותאים זרעים כדי להשיג מבנים תלת-מימדיים רצויים. - הוסף 500 μL של המדיום עם 4% מטריצת קרום מרתף 2-3 פעמים בשבוע.
הערה: הימנעו מהפרעה של השכבות הנושאות את הצלחת בעדינות במהלך המניפולציה. - אם תרצה, ניתן למדוד את המספר והגודל של acini במהלך תקופת התרבות. לשם כך, צלם תמונות אקראיות בזמנים שונים לאחר הזריעה באמצעות ניגודיות פאזה או מיקרוסקופ הפוך של DIC. השתמש בתוכנת ניתוח תמונה כדי למדוד את הקוטר של 100–200 מבנים תלת-מימדיים.
- הכינו את החומר יום לפני הניסוי: מטריצת קרום מרתף טרום צמרמורת לילה ב 4 מעלות צלזיוס ולתת טיפים פיפטה, צינורות microcentrifuge, וצלחות גם להתקרר במקפיא.
- חיסון
הערה: תנאים סטריליים אינם נדרשים במהלך חלק זה של הפרוטוקול.- הסר את מדיום התרבות.
- קרע את מטריצת קרום המרתף באמצעות קצה פיפטה p200 עם הקצה מנותק. מניחים ~ 50 μL של מטריצה מפוררת על גבי מגלשת זכוכית ומרוחים אותו באזור של 1-2 ס"מ2.
- תן לדגימה להתייבש לחלוטין בטמפרטורת החדר או להשתמש בצלחת חימום ב 37 °C (69 °F) כדי להאיץ את התהליך. לתקן דגימות עם מתנול:אצטון (1:1, v/v) ב -20 °C (60 °F) במשך 30 דקות.
הערה: אות פלואורסצנטי של סמנים קודמים, כגון זה של חלבונים פלואורסצנטיים המובעים על ידי התאים, יימחק.
התריעה: מתנול הוא דליק, רעיל אם הוא בשאיפה, בלע או במקרה שהוא בא במגע עם העור. ללבוש ציוד מגן אישי ולעבוד בתוך מכסה המנוע אדים. - מחק את פתרון ההתקבעות והסר את העודף, אם קיים, על-ידי שכיבת השקופית על נייר סינון.
הערה: ניתן להשהות את הפרוטוקול כאן. לאחר ייבוש, שקופיות ניתן לאחסן ב -20 °C (60 °F) במשך מספר חודשים. - דגימות בלוק epitopes עם 5% סרום עזים נורמלי ו 0.1% טריטון-X-100 ב 1x PBS (פתרון חסימה) עבור 2 שעות בטמפרטורת החדר.
- בינתיים, הכינו פתרונות עבודה לנוגדנים על ידי דילול נוגדנים ראשוניים או משניים בריכוז הרצוי בתסימת החסימה.
הערה: ריכוז הנוגדנים חייב להיות מותאם במדויק בהתאם לסוג התא ולהפניית הנוגדנים. כמדריך, כדי לזהות תאים משושלת luminal ו myoepithelial ב BPEC, אנטי Cytokeratin העיקרי 14 ו נוגדנים נגד קלודין-IV (ראה רשימת חומרים) ניתן להשתמש. ריכוז פתרון העבודה המומלץ הוא 1:100 עבור נוגדנים ראשוניים אלה ו 1:500 עבור נוגדנים משניים נגד עכבר ואנטי ארנב (ראה רשימת חומרים). - הוסף 30 μL של פתרון עובד נוגדנים ראשוניים לכסות אותו עם רצועה של סרט עטיפה במעבדה, כדי למנוע אידוי. דגירה לילה ב 4 °C (60 °F) בתא לח.
- לשטוף שלוש פעמים עם 1x PBS עבור 1 שעות כל אחד.
- חזור על שלב 2.2.7 לנוגדנים משניים. הדגירה צריכה להתבצע בחשיכה.
- לשטוף עם 1x PBS במשך 2 שעות.
הערה: התאימו את ריכוז הנוגדנים, זמן הדגירה וקשיות הכביסה כדי לשפר את יחס האות/רעש לדגימות ספציפיות. - הסר את PBS הנותרים, פעם יבש, נגדי עם DAPI ב 0.25 מיקרוגרם / מ"ל מדולל במדיום הרכבה נגד חיטוי. לכסות שקופיות עם כיסוי על ידי מתן לו להתיישב מבלי להפעיל לחץ. חותם עם לק ציפורניים.
הערה: ניתן לאחסן דגימות ב-4 מעלות צלזיוס למשך מספר שבועות. לאחסון לטווח ארוך, שמרו עליהם ב-20°C-. - נתח את התפלגות האותות הפלואורסצנטיים עבור כל אצינוס באמצעות מיקרוסקופ קונפוקל.
הערה: יש לקבוע במדויק את תצורת המיקרוסקופ הקונפוקל בהתאם לציוד המשמש ולנוגדנים המוחלים על הדגימה. כמדריך, עם הציוד והריגנטים המפורטים בטבלת החומרים, השתמש במטרה של 40x ובהגדרות הלייזר והגלאי הבאות: לשימוש ב- DAPI בעירור עם לייזר 405 (3%-5%), זיהוי באמצעות גלאי PMT (800V, היסט: -9) ורצועה ספקטרלית מ 410 ננומטר עד 500 ננומטר; עבור A488 (קלודין-IV) להשתמש בהרגשה עם לייזר 488 (7%-10%), זיהוי עם גלאי PMT (800V, היסט: -20) ורצועה ספקטרלית מ-490 ננומטר ל-550 ננומטר; ול-Cy3 (Cytokeratin 14) יש להשתמש בגירוש עם לייזר 555 (2%-10%), זיהוי באמצעות גלאי PMT (800V, היסט: -35) ורצועה ספקטרלית מ-560 ננומטר עד 600 ננומטר.
3. בדיקה עצמאית של אנקורג', כתמי MTT וכמיות מושבה אוטומטי
- בדיקה עצמאית של אנקורג': ציפוי אגר ותלייה סלולרית
הערה: פרוטוקול הותאם מ Borowicz ואח ', 201411 לבצע ניסויים BPECs.- הכינו תסכולת אגר 1.2% מדוללת במים אולטרה-חמים בבקבוק סטרילי. לבודד את הפתרון ולתחזק אותו ב 42 °C (69 °F) במהלך הניסוי. פתרון אגר ניתן לאחסן ב 4 °C (60 °F); כאשר נדרש, לחמם את פתרון אגר עד שהוא נוזלי שוב.
התר לב: השתמש בכפפות עמידות בחום כדי למנוע כוויה לאחר שמירה אוטומטית.
הערה: מעתה והלאה, יש לשמור על תנאים סטריליים. - הכינו פתרון אגר של 0.6% על ידי ערבוב 1:1 (v/v) בינוני מחומם מראש עם 1.2% פתרון אגר. יש לשמור על 42 מעלות צלזיוס כדי למנוע התגבשות מוקדמת.
הערה: בינוני ניתן להוסיף בעבר כפול כדי לקבל תוספת מלאה 0.6% אגר + פתרון בינוני פעם מעורבב. - מכסים את החלק התחתון של באר 35 מ"מ עם 1.5 מ"ל של 0.6% אגר בתמצית בינונית ולתת לו להתגבש בטמפרטורת החדר. ודא כי החלק התחתון של הצלחת מכוסה לחלוטין לפני התגבשות אגר, אחרת, תאים עשויים לדבוק בצלחת לגדול monolayer.
הערה: ניתן להשתמש לוחות משטח חסידים ולא חסידים. - בינתיים, לחץ על תאים, פעם צנטריפוגה ו resuspended במדיום, להכין פתרון 50,000 תאים / מ"ל בעדינות לפרק כל גוש תא על ידי צינורות שוב ושוב.
- הכן 0.3% אגר + תא השעיה במדיום בריכוז סופי של 25,000 תאים / מ"ל.
הערה: ריכוז תאים אופטימלי עשוי להיות שונה בין סוגי תאים. נסה ריכוזים שונים עד שנוצרות מושבות אינדיבידואליות.- מניחים מסנן מסננת 40 מיקרומטר על גבי צינור סטרילי 50 מ"ל ולסנן את פתרון 50,000 תאים / מ"ל ומאפשר לו לרדת לתחתית הצינור.
- הסר את המסנן מן הצינור סטרילי 50 מ"ל, להטות את הצינור המכיל תאים לזווית של 45 ° ולשחרר את אותו נפח של 0.6% אגר + פתרון בינוני לשפוך אותו דרך הקיר הפנימי של הצינור. זה יאפשר פתרון אגר להתקרר בדיוק מספיק כדי לא לפגוע בתאים ולהימנע התמצגות מוקדמת שלה.
- הומוגניזציה של התערובת והפקדה 1 מ"ל של 0.3% אגר + השעיית תא במדיום (המכיל 25,000 תאים) על גבי שכבת אגר התחתון מוצק בעבר.
- דמיין תאים זרעים באמצעות מיקרוסקופ הפוך כדי לוודא שהתאים מותאמים אישית. אחרת, הניסוי צריך לחזור על עצמו.
- המתן עד שכבת אגר הוא מוצק לחלוטין, ולאחר מכן בזהירות להוסיף 1 מ"ל של המדיום הטרי על גבי מבלי להפריע שכבות אגר עדין מתחת.
- הדגירה את התאים ב 37 °C (69 °F) ו 5% CO2 באינקובטור במשך 3 שבועות.
הערה: הזמן הנדרש להיווצרות מושבה יכול להשתנות בין סוגי תאים שונים, אך בדרך כלל 3 שבועות מספיקים. - שינוי בינוני פעמיים בשבוע. כדי לעשות זאת, בעדינות להטות את הצלחת לכיוון שלך, שאף בינוני בפינה התחתונה, ולהוסיף 1 מ"ל של מדיום טרי.
הערה: הימנע מנגיעה בשכבות אגר כפי שהם בקלות להתנתק מהצלחת.
- הכינו תסכולת אגר 1.2% מדוללת במים אולטרה-חמים בבקבוק סטרילי. לבודד את הפתרון ולתחזק אותו ב 42 °C (69 °F) במהלך הניסוי. פתרון אגר ניתן לאחסן ב 4 °C (60 °F); כאשר נדרש, לחמם את פתרון אגר עד שהוא נוזלי שוב.
- כתמי MTT
- הכינו את פתרון המלאי Thiazolyl Blue Tetrazolium Bromide (MTT) ב-6 מ"ג/מ"ל במים אולטרה-חיוורים בבקבוק סטרילי ופתרון סינון באמצעות מסנני μm 0.2. פתרון MTT זה ניתן לאחסן עד 6 חודשים ב -20 °C (69 °F).
התראה: MTT עלול לגרום לגירוי והוא חשוד בגרימת פגמים גנטיים. השתמש במשקפי בטיחות, כפפות ומסנן נשימה.
הערה: הימנע ממחזורי הפשרה חוזרים ונשנים. - הכן פתרון עבודה של MTT ב 1 מ"ג / מ"ל על ידי דילול פתרון המלאי עם מים סטריליים ultrapure.
- לאחר תקופת היווצרות המושבה הסתיימה, להסיר את המדיום מהצלחת ולהוסיף 1 מ"ל של 1 מ"ג / מ"ל MTT לכל באר.
- דגירה במשך 24 שעות באינקובטור. הסר את פתרון MTT על-ידי שאספירה עדין. צלחות ניתן לאחסן ב 4 °C (60 °F) במשך מספר שבועות.
הערה: הימנע מחשיפה לאור כדי למנוע היווצרות גבישים לא ספציפית.
- הכינו את פתרון המלאי Thiazolyl Blue Tetrazolium Bromide (MTT) ב-6 מ"ג/מ"ל במים אולטרה-חיוורים בבקבוק סטרילי ופתרון סינון באמצעות מסנני μm 0.2. פתרון MTT זה ניתן לאחסן עד 6 חודשים ב -20 °C (69 °F).
- כימות המושבה
- השג תמונות של כל לוח באמצעות מיקרוסקופ הפוך. התאם את ההגדלה כדי להשיג את שדה התצוגה המרבי עם פחות תמונות ועדיין להיות מסוגל לזהות מושבות קטנות (בדרך כלל 4x או 10x מטרות).
הערה: ודא שהתמונות מציגות רקע הומוגני. לא נדרשת ניגודיות פאזה ולא ניגודיות הפרעה דיפרנציאלית מכיוון שלא יתכרתו מושבות שאינן מוכתמות. - העלה תמונות לתוכנת ImageJ/Fiji12 כדי לספור את מספר המושבות ואת האזור של כל מושבה חיובית MTT.
הערה: קובץ Script לכמות אוטומטי מסופק כקובץ משלים. כדי לבצע את הקוד, הדבק אותו בעורך המאקרו (תוספים | דף | מאקרו) ובצע את ההוראות.- השג מסיכה בינארית באמצעות סף התמונה המקורית (תמונה | התאם | סף) כדי להשיג מושבות מופרדות היטב (איור 1).
הערה: תמונות של 8 או 16 סיביות נדרשות בדרך כלל לביצוע שלב זה. מומלץ להשתמש בשיטה "סף מינימלי". - הפעל את מנתח החלקיק המורחבת מ תוסף Biovoxxel13 (תוספים | ביובוסל | מנתח חלקיקים מורחב ) לזיהוימושבות חיוביות MTT (איור 2). תנאי הנחיה ראשוניים: גודל (μm2) = 250–אינסוף; מוצקות = 0.75–1.00.
- השג מסיכה בינארית באמצעות סף התמונה המקורית (תמונה | התאם | סף) כדי להשיג מושבות מופרדות היטב (איור 1).
- להעריך את הקוטר הממוצע (D) מכל ערך אזור מושבה (A) בהתאם לנוסחה:

- סנן תוצאות על-ידי אי-הכללת מושבות בעלות תפוצה נמוכה (לדוגמה, קוטר נמוך).
- בחר מספר מינימלי של חטיבות בשבוע (m) שיש לקחת בחשבון (לדוגמה, 1).
- הערך את הרדיוס של מושבה (R) עם n תאים בהתאם לנוסחה הבאה:

איפה, r הוא הרדיוס הממוצע של תאים בודדים בהשעיה, n הוא מספר התאים ויוצרים מושבה שסבלה מחלוקות m בכל שבוע במהלך w שבועות בתרבות. בצמיחה מעריכית: n = 2(m * w). ρ היא יעילות האריזה. שים לב כי, בתנועה אקראית, יעילות האריזה היא ~ 0.64 ואת שבר האריזה הצפוף ביותר האפשרי עבור כדורים זהים הוא 0.7414. - השלך את כל המושבות להציג קוטר נמוך מ 2R כמו התאים שלהם לא השיגו את המספר המינימלי של חטיבות נחשב בשלב 3.3.4.1.
- השג תמונות של כל לוח באמצעות מיקרוסקופ הפוך. התאם את ההגדלה כדי להשיג את שדה התצוגה המרבי עם פחות תמונות ועדיין להיות מסוגל לזהות מושבות קטנות (בדרך כלל 4x או 10x מטרות).
תוצאות
מודל ניסיוני של טרנספורמציה תאית עם כניסתה של שלושה אלמנטים גנטיים ב- BPECs נבחר להפיק תוצאות מייצגותשל טרנספורמציה אונקוגנית 6,7 (איור 3). BPECs שאינם משתנים (N) נגזרו רקמת שד ללא מחלות כפי שתואר על ידי Inceועמיתיו 6 ותרבותי...
Discussion
הפרוטוקולים הניסיוניים המתוארים במאמר זה מספקים כלים שימושיים להערכת השינוי האונקוגני של תאים מתורבתים במבחנה. כל טכניקה מעריכה היבטים ספציפיים של תהליך השינוי, ולכן יש להקדיש תשומת לב מיוחדת בעת סיוק מסקנות מניתוח יחיד. הצטברות עקומות צמיחה היא גישה הדורשת מידע שכבר זמין בעת culturing תאים ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מעבדת AG ממומנת על ידי המועצה הספרדית לבטיחות גרעינית. T.A. ו- A.G. הם חברים בקבוצת מחקר המוכרת על ידי Generalitat de Catalunya (2017-SGR-503). MT מחזיקה בחוזה במימון הקרן המדעית Asociación Española Contra el Cáncer [AECC-INVES19022TERR]. החוזה של ג'י.אף ממומן על ידי מענק מקרן סלקס.
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
References
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved