Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
In Vitro Оценка онкогенной трансформации в эпителиальных клетках молочной железы человека
В этой статье
Резюме
Этот протокол предоставляет экспериментальные инструменты in vitro для оценки трансформации клеток молочной железы человека. Описаны подробные шаги по последующей скорости пролиферации клеток, независимой от якорной стоянки способности роста и распределению клеточных линий в 3D-культурах с матрицей мембраны подвала.
Аннотация
Tumorigenesis это многоступенчатый процесс, в котором клетки приобретают возможности, которые позволяют их рост, выживание и распространение во враждебных условиях. Различные тесты направлены на выявление и количественную оценку этих признаков раковых клеток; однако, они часто сосредотачиваются на одном аспекте клеточной трансформации и, по сути, для их надлежащей характеристики требуется несколько тестов. Цель этой работы состоит в том, чтобы предоставить исследователям набор инструментов для оценки клеточной трансформации in vitro с широкой точки зрения, что позволяет сделать хорошие выводы.
Устойчивая активация пролиферативной сигнализации является основной особенностью опухолевых тканей и может быть легко контролироваться в условиях in vitro путем расчета количества удвоений населения, достигнутых с течением времени. Кроме того, рост клеток в 3D культурах позволяет их взаимодействие с окружающими клетками, напоминающими то, что происходит в виво. Это позволяет проводить оценку клеточной агрегации и, вместе с иммунофлуоресцентной маркировкой отличительных клеточных маркеров, получать информацию о другой актуальной особенности опухолевой трансформации: потере надлежащей организации. Еще одной замечательной характеристикой трансформировалированных клеток является их способность расти без привязанности к другим клеткам и к внеклеточной матрице, которую можно оценить с помощью анкориджного анализа.
Предусмотрены подробные экспериментальные процедуры оценки темпов роста клеток, выполнения иммунофлуоресцентной маркировки маркеров клеточной линии в 3D-культурах, а также для проверки анкоридж-независимого роста клеток в мягком агаре. Эти методологии оптимизированы для первичной эпителиальной клетки молочной железы (BPEC) из-за его актуальности в рак молочной железы; однако, процедуры могут быть применены к другим типам клеток после некоторых корректировок.
Введение
Для развития неоплазмы требуется несколько последовательных событий. В 2011 году Шанахан и Вайнберг описали 10 возможностей, которые позволяют трансформировать рост клеток, выживание и распространение: так называемые «Признаки рака»1. Описанная здесь методология составляет три различных инструмента для оценки клеточной трансформации в пробирке, сосредоточив внимание на некоторых отличительных особенностях опухолевых клеток. Эти методы оценивают скорость пролиферации клеток, поведение клеток при культуре в 3D и их способность формировать колонии с независимостью якорной стоянки.
Модели клеток имеют решающее значение для проверки гипотезы in vitro. Разработаны различные подходы для создания экспериментальных моделей клеточной трансформации для изучениярака 2,3,4. Поскольку рак молочной железы является наиболее распространенным раком среди женщин во всем мире и несет ответственность за примерно 15% случаевсмерти от рака среди женщин 5, обеспечивая подходящие клеточные модели клеток млекопитающих эпителиальных клеток имеет первостепенное значение для дальнейшего исследования. В этой статье мы проиллюстрировали потенциал трех методов оценки клеточной трансформации с помощью экспериментальной модели преобразования эпителиальных клеток молочной железы (BPECs), первоначально описанной Ince и коллегами в 20076, а затем реализованной в нашейлаборатории 7. Эта экспериментальная модель основана на последовательном изменении трех целевых генов (SV40 Large T и малых т антигенов, именуемых Ttag, hTERT, и HRAS) к геному не преобразованных BPECs. Кроме того, метод, используемый для производных BPECs способствует поддержанию млекопитающих эпителиальных клеток с люминесцентными или миоэпителиальными маркерами, в результате чего неоднородная культура клеток, которая сохраняет некоторые из физиологических черт молочной железы.
В молочной железе, светящиеся клетки молочной железы эпителиальной, которые отвечают за производство молока, расположены рядом с люменом, в то время как миоэпителиальные клетки удаляются вокруг светящихся клеток и заботиться о сокращениях движений, ведущих молоко к соску. Потеря надлежащей организации между этими клеточными линиями является особенностью опухолевойтрансформации 8, которая может быть оценена в пробирке после иммунофлуоресцентного обнаружения отличительных маркеров линии в культурах 3D-клеток. Другой важной характеристикой опухолевых клеток является их способность расти без привязанности к другим клеткам и к внеклеточной матрице1. Когда здоровые клетки вынуждены расти в подвеске, механизмы, такие как anoikis u2012 тип клеточной смерти, индуцированной в ответ на отделение от внеклеточной матрицы No u2012 активируются9. Уклонение от клеточной смерти является одной из отличительных признаков рака и, таким образом, преобразованные клетки способны инактивировать anoikis и выжить в якорь-независимой манере. Эта емкость может быть оценена в пробирке с якорной независимой анализа с использованием мягкого агара. Кроме того, неотъемлемой особенностью опухолевых тканей является их устойчивая пролиферативная сигнальная способность, которую можно легко контролировать в условиях in vitro путем измерения увеличения количества клеток с течением времени, не только в анализах суспензии, но и путем мониторинга темпов роста монослойных культур адептов.
Несмотря на то, что наилучшей моделью для проверки опухолемного потенциала является прививка опухолевых клеток в моделях мурина и оценка развития опухоли на месте, важно максимально свести к минимуму количество животных, занятых в экспериментальных процедурах. Таким образом, наличие подходящих тестов для оценки трансформации in vitro является главным приоритетом. Здесь мы предоставляем набор инструментов для оценки опухолевых потенциал частично и полностью преобразованных эпителиальных клеток молочной железы, которые могут быть легко реализованы в большинстве лабораторий, которые работают с моделями клеточной трансформации.
протокол
Образцы человека, использованные в следующих экспериментах, были получены в результате сокращения маммопластики, проведенной в Кленице Пилар Сант Хорди (Барселона) в соответствии со стандартным согласием процедуры. Все процедуры выполняются в Кабинете биологической безопасности II класса, если не указано иное.
1. In vitro культуры человеческих млекопитающих эпителиальных клеток и кривой роста участка наращивания
-
В пробирке культуры груди первичных эпителиальных клеток (BPECs): клетка проходит
ПРИМЕЧАНИЕ: Для BPEC производной и клеточной культуры следуйте инструкциям, описанным Ince et al., 20076.- Средняя подготовка.
- Дополнение WIT базально определенной среды с P или T добавки, предоставляемые производителем, в зависимости от того, первичные или преобразованные BPECs являются культурными.
- Добавьте токсин холеры в дополненную среду WIT до конечной концентрации 100 нг/мл для первичных или 25 нг/мл для трансформировавшихся BPECs.
ВНИМАНИЕ: Токсин холеры является смертельным, если проглотить. Используйте средства индивидуальной защиты. Избегайте его выпуска в окружающую среду.
- Обслуживание и пропуск клеточной культуры.
ПРИМЕЧАНИЕ: Для следующих шагов имейте в виду, что клетки растут в колбе T25. Тем не менее, объемы могут быть адаптированы к другим форматам культуры клеток, сохраняя пропорциональность с точки зрения площади поверхности.- Проверяйте слияние клеток каждый день. Когда культура 90% стечения, выполнять клетки проходит.
- Приобрети 1x PBS, 3x трипсин, средний и 15 мл конической трубки, содержащей 2 мл сыворотки плода крупного рогатого скота (FBS) для каждой колбы.
- Снимите среду с колбы и держите ее в конической трубке 15 мл, содержащей FBS.
- Промыть клетки с 1x PBS.
- Отсоедините клетки от поверхности, добавив 1 мл 3x трипсина. Инкубировать в течение 5 минут при 37 градусов по Цельсию.
- Проверьте, были ли ячейки отделены. Нанесите энергичную тряску, если клетки не полностью отделены.
- Инактивировать трипсин, добавив зарезервированную среду, дополненную FBS.
- Урожай клеточной подвески и поместите его в 15 мл конической трубки.
- Центрифуга на 500 х г в течение 5 мин, устранить супернатант, и повторно гранулированных клеток, стряхивая нижней части трубки пальцем.
- Добавьте в гранулы 1-2 мл свежих средств массовой информации и измерьте концентрацию клеток с помощью автоматического счетчика клеток или гемоцитометра. Впоследствии эти данные будут использоваться для расчета удвоения численности населения и прорисовки кривой роста. Семя 12000 клеток / см2 (например, 300000 клеток для колбы T25) в модифицированных поверхностных колбы культуры клеток (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Разбавить решение клеточной подвески, если концентрация слишком высока, чтобы обеспечить надлежащую количественную оценку. - Добавьте средний к окончательному объему 5 мл и инкубировать клетки при 37 градусах Цельсия и 5% CO2 атмосферы.
- Замените среду клеточной культуры каждые 48 ч.
- Средняя подготовка.
-
Расчет удвоения численности населения и визуализация данных
- Используя данные подсчета ячеев, полученные в шаге 1.1.2.10, примените следующую формулу для получения накопившихся значений удвоения численности населения (PD):
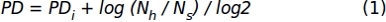
Где, PDi обозначает количество удвоений населения, достигнутых клетками до предыдущей субкультуры (это относится к PD, накопленной на предыдущей субкультуре), Nh - это количество собранных клеток, а Ns- это количество сеяных клеток. - Представление данных для определенного интервала времени с помощью графика XY, где представлено количестводнейв культуре(x-axis) и накопившийсяPD (y-axis).
- Получите наиболее подходящую линию и подходящее уравнение:

ПРИМЕЧАНИЕ: Увеличение наклона (b) означает увеличение скорости распространения.
- Используя данные подсчета ячеев, полученные в шаге 1.1.2.10, примените следующую формулу для получения накопившихся значений удвоения численности населения (PD):
2. Трехмерная (3D) культура в мембранной матрице подвала и обнаружении иммунофлуоресцентного белка
- 3D-культура в мембранной матрице подвала
ПРИМЕЧАНИЕ: Этот протокол был адаптирован из Debnath et al., 200310 и оптимизирован для 24 пластин (см. Таблицу материалов).- Подготовь материал за день до эксперимента: предварительно охладите мембранную матрицу подвала на ночь при 4 градусов по Цельсию и дайте пипеткам кончики, микроцентрифуговые трубки и хорошо пластины остыть в морозильной камере.
ПРИМЕЧАНИЕ: Матрица должна храниться при -20 градусов по Цельсию для длительного хранения. Сделать aliquots, чтобы избежать нескольких циклов замораживания оттепели. - В день эксперимента поместите предварительно охлажденный материал на лед.
- Промыть скважины с холодной стерильной 1x PBS для того, чтобы уменьшить поверхностное натяжение.
- Обложка нижней части каждой хорошо с 100 йл мембранной матрицы подвала.
ПРИМЕЧАНИЕ: Распределить матрицу медленно и распространить его по всему колодец; крайне важно, чтобы избежать образования пузырьков в нижнем слое, чтобы предотвратить рост монослойной клеточной культуры. - Поместите пластину в инкубатор при 37 градусов по Цельсию, чтобы матричный слой затвердело.
ПРИМЕЧАНИЕ: Это обычно занимает около 20 минут, чтобы укрепить. - Между тем, трипсинизировать клетки, как объяснялось ранее в шаге 1.1. Центрифуга клетки на 500 х г в течение 5 мин и повторного перерасхода в среднем. Подготовь 400 000 ячеек/мл подвески и аккуратно дезагрегирование любого клеточного сгустка путем пипетки.
- Подготовьте среду с 8% цокольной мембранной матрицей и смешайте 1:1 (v/v) с клеточной подвеской, чтобы получить раствор 200 000 клеток/мл в 4% матрице.
ПРИМЕЧАНИЕ: Рассчитайте количество среды, необходимое для того, чтобы избежать ненужных отходов матрицы. - Поместите 500 МКЛ клеточной подвески в матричном растворе поверх уже затвердевого матричного слоя, чтобы высеять общее количество 100 000 клеток в среде с 4% матрицы мембраны подвала.
- Инкубировать клетки при 37 градусов по Цельсию в течение нескольких минут, а затем, добавить 500 МКЛ среды с 4% подвал мембранной матрицы. Инкубировать клетки при 37 градусов по Цельсию в инкубаторе с 5% CO2 в течение 14 дней. Семена клетки будут группироваться и размножаться, чтобы возникнуть acini-какструктуры.
ПРИМЕЧАНИЕ: Подвижность и агрегация клеток могут контролироваться с помощью замедленного действия в процессе 3D-образования. Для оценки этих событий используйте программное обеспечение для анализа изображений (например, Fiji/ImageJ или Imaris). Количество и размер acini зависят от процесса агрегирования и скорости распространения и могут варьироваться между типами ячеев. Отрегулируйте концентрацию мембранной матрицы подвала и посеянные клетки для получения желаемых 3D структур. - Добавьте 500 МКЛ среды с 4% цокольной мембранной матрицей 2-3 раза в неделю.
ПРИМЕЧАНИЕ: Избегайте нарушения слоев проведения пластины мягко во время манипуляции. - При желании количество и размер acini можно измерить в период культуры. Для этого делайте случайные снимки в разное время после посева с помощью фазового контраста или инвертированного микроскопа DIC. Используйте программное обеспечение для анализа изображений для измерения диаметра 100-200 3D структур.
- Подготовь материал за день до эксперимента: предварительно охладите мембранную матрицу подвала на ночь при 4 градусов по Цельсию и дайте пипеткам кончики, микроцентрифуговые трубки и хорошо пластины остыть в морозильной камере.
- Иммуностимулятор
ПРИМЕЧАНИЕ: Стерильные условия не требуются во время этой части протокола.- Удалите культурную среду.
- Разорвьте матрицу мембраны подвала с помощью наконечника пипетки p200 с отрезанным концом. Поместите 50 МКЛ дезагрегированной матрицы поверх стеклянной горки и размазайте ее в области 1-2 см2.
- Пусть образец полностью высохнет при комнатной температуре или использовать нагревательной пластины при температуре 37 градусов по Цельсию, чтобы ускорить процесс. Исправить образцы с метанолом:ацетон (1:1, v/v) при -20 градусов по Цельсию в течение 30 мин.
ПРИМЕЧАНИЕ: Флуоресцентный сигнал предыдущих маркеров, таких как флуоресцентные белки, выраженные клетками, будут стерты.
ВНИМАНИЕ: Метанол легковоспламеняющийся, токсичный при вдыхании, проглатывании или в случае контакта с кожей. Носите средства индивидуальной защиты и работа внутри дымового капота. - Откажитесь от решения фиксации и удалите излишки, если таковые имеются, откидывая слайд на фильтровальную бумагу.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. После высыхания слайды могут храниться при -20 градусов по Цельсию в течение нескольких месяцев. - Блок образцов эпитопов с 5% нормальной сыворотки козы и 0,1% тритон-X-100 в 1x PBS (блокирующий раствор) для 2 ч при комнатной температуре.
- Между тем, подготовить антитела рабочих решений путем разбавления первичных или вторичных антител при желаемой концентрации в блокирующий раствор.
ПРИМЕЧАНИЕ: Концентрация антител должна быть точно скорректирована в зависимости от типа клетки и ссылки на антитела. В качестве руководства, для выявления клеток из светящихся и миоэпителиальных линий в BPEC, первичные анти-цитокератин 14 и анти-Claudin-IV антитела (см. Таблица материалов) могут быть использованы. Рекомендуемая концентрация рабочего раствора 1:100 для этих первичных антител и 1:500 для анти-мышь и анти-Rabbit вторичных антител (см. Таблица материалов). - Добавьте 30 МКЛ первичного раствора антител и накройте его полосой лабораторной оберточной пленки, чтобы избежать испарения. Инкубировать на ночь при 4 градусов по Цельсию во влажной камере.
- Вымойте три раза с 1x PBS для 1 ч каждый.
- Повторите шаг 2.2.7 для вторичных антител. Инкубация должна проводиться в темноте.
- Вымойте с 1x PBS для 2 ч.
ПРИМЕЧАНИЕ: Отрегулируйте концентрацию антител, время инкубации и твердость стирки для улучшения соотношения сигнала/шума для конкретных образцов. - Удалите оставшийся PBS и, как только высохнет, counterstain с DAPI на 0,25 мкг / мл разбавленной в антифад монтажа среды. Обложка слайды с крышкой, позволяя ему урегулировать без применения давления. Печать с лаком для ногтей.
ПРИМЕЧАНИЕ: Образцы могут храниться при 4 градусах Цельсия в течение нескольких недель. Для длительного хранения держите их на уровне -20 градусов по Цельсию. - Проанализируйте распределение флуоресцентных сигналов для каждого ацинуса с помощью конфокального микроскопа.
ПРИМЕЧАНИЕ: Конфигурация конфокального микроскопа должна быть точно определена в зависимости от используемого оборудования и антител, применяемых к образцу. В качестве руководства, с оборудованием и реагентами, подробно описанными в таблице материалов,используйте цель 40x и следующие настройки лазера и детектора: для DAPI используйте возбуждение с лазером 405 (3%-5%), обнаружение с детектором ПМТ (800V, Смещение: -9) и спектральная полоса от 410 нм до 500 нм; для A488 (Claudin-IV) используют возбуждение с лазером 488 (7%-10%), обнаружение с детектором ПМТ (800V, Смещение: -20) и спектральная полоса от 490 нм до 550 нм; а для Cy3 (Cytokeratin 14) используют возбуждение с лазером 555 (2%-10%), обнаружение с детектором ПМТ (800V, Offset: -35) и спектральной полосой от 560 нм до 600 Нм.
3. Анкоридж-независимый анализ, Окрашивание MTT и автоматическая квантификация колонии
- Анкоридж-независимый анализ: агар и клеточное покрытие подвески
ПРИМЕЧАНИЕ: Протокол был адаптирован из Борович и др., 201411 для проведения экспериментов в BPECs.- Приготовьте 1,2% агарный раствор, разбавленный в ультрачистой воде в стерильной бутылке. Автоклав раствора и поддерживать его на 42 градусов по Цельсию во время эксперимента. Агар решение может храниться при 4 градусов по Цельсию; при необходимости нагрейте агар раствор, пока он не жидкий снова.
ВНИМАНИЕ: Используйте жаростойкие перчатки, чтобы избежать ожога после автоклава.
ПРИМЕЧАНИЕ: Отныне стерильные условия должны быть сохранены. - Подготовьте 0,6% агар-раствор, смешивая 1:1 (v/v) полную предварительно разогретую среду с 1,2% агарным раствором. Поддерживайте при 42 градусов по Цельсию, чтобы избежать преждевременной затвердевания.
ПРИМЕЧАНИЕ: Средний может быть предварительно двойной добавки для получения полностью дополнены 0,6% агара и среднего раствора после смешивания. - Обложка нижней части 35 мм хорошо с 1,5 мл 0,6% агара в среднем растворе и дайте ему затвердеть при комнатной температуре. Убедитесь, что дно пластины полностью покрыто до затвердевания агара, в противном случае клетки могут прилипать к пластине и расти в монослой.
ПРИМЕЧАНИЕ: Адепт и неприемные поверхностные пластины могут быть использованы. - Между тем, трипсинизировать клетки и, как только центрифугированы и повторно, подготовить 50000 клеток / мл раствор и аккуратно дезагрегировать любой комок клеток путем трубопроводов неоднократно.
- Приготовьте 0,3% агара и клеточной подвески в среде при конечной концентрации 25 000 клеток/мл.
ПРИМЕЧАНИЕ: Оптимальная концентрация клеток может различаться между типами клеток. Попробуйте различные концентрации до тех пор, пока не будут сформированы индивидуальные колонии.- Поместите 40 мкм ситечко фильтр на верхней части 50 мл стерильной трубки и фильтровать 50000 клеток / мл решение позволяя ему упасть в нижней части трубки.
- Удалите фильтр из стерильной трубки объемом 50 мл, наклоните ячейку,содержащую трубку под углом 45 градусов, и опустите тот же объем в 0,6% агара и средний раствор, проливая его через внутреннюю стенку трубки. Это позволит агар решение остыть достаточно, чтобы не повредить клетки и избежать его преждевременной затвердевания.
- Гомогенизировать смесь и депозит 1 мл 0,3% агара и клеточной подвески в среде (содержащей 25000 клеток) на вершине ранее затвердело нижнего слоя агара.
- Визуализуйте сеяные клетки с помощью перевернутого микроскопа, чтобы убедиться, что клетки индивидуализированы. В противном случае эксперимент должен быть повторен.
- Подождите, пока агар слой полностью затвердеет, а затем осторожно добавить 1 мл свежей среды на вершине, не нарушая деликатный агар слоев под.
- Инкубировать клетки при 37 градусов по Цельсию и 5% CO2 в инкубаторе в течение 3 недель.
ПРИМЕЧАНИЕ: Время, необходимое для формирования колонии может варьироваться между различными типами клеток, но обычно 3 недели достаточно. - Изменение среды два раза в неделю. Для этого аккуратно наклоните пластину к вам, аспиратор среды в нижнем углу, и добавить 1 мл свежей среды.
ПРИМЕЧАНИЕ: Избегайте прикосновения к слоям агара, поскольку они легко отсоединяются от пластины.
- Приготовьте 1,2% агарный раствор, разбавленный в ультрачистой воде в стерильной бутылке. Автоклав раствора и поддерживать его на 42 градусов по Цельсию во время эксперимента. Агар решение может храниться при 4 градусов по Цельсию; при необходимости нагрейте агар раствор, пока он не жидкий снова.
- MTT окрашивание
- Приготовьте раствор Thiazolyl Blue Tetrazolium Bromide (MTT) при 6 мг/мл в ультрапурной воде в стерильной бутылке и фильтруемом растворе с использованием фильтров 0,2 мкм. Это решение MTT может храниться до 6 месяцев при -20 градусов по Цельсию.
ВНИМАНИЕ: MTT может вызвать раздражение и подозревается в причинении генетических дефектов. Используйте защитные очки, перчатки и дыхательный фильтр.
ПРИМЕЧАНИЕ: Избегайте повторных циклов замораживания оттепели. - Подготовь рабочий раствор МТТ при 1 мг/мл, разбавляя бульонный раствор стерильной ультрачистой водой.
- После того, как период образования колонии завершен, удалить среду из пластины и добавить 1 мл 1 мг / мл МТТ к каждой хорошо.
- Инкубация в течение 24 ч в инкубаторе. Удалите решение MTT, аспирируя его осторожно. Пластины могут храниться при 4 градусах Цельсия в течение нескольких недель.
ПРИМЕЧАНИЕ: Избегайте воздействия света, чтобы предотвратить неспецифическое кристаллическое образование.
- Приготовьте раствор Thiazolyl Blue Tetrazolium Bromide (MTT) при 6 мг/мл в ультрапурной воде в стерильной бутылке и фильтруемом растворе с использованием фильтров 0,2 мкм. Это решение MTT может храниться до 6 месяцев при -20 градусов по Цельсию.
- Квантификация колонии
- Получить изображения каждой пластины с помощью перевернутого микроскопа. Отрегулируйте увеличение, чтобы получить максимальное поле зрения с меньшим количеством изображений и по-прежнему быть в состоянии обнаружить небольшие колонии (обычно 4x или 10x целей).
ПРИМЕЧАНИЕ: Убедитесь, что изображения представляют однородный фон. Не требуется ни контраста фазового, ни дифференциального интерференции, поскольку неоленные колонии не поддаются количественной оценке. - Загрузите изображения в программное обеспечение ImageJ/Fiji12 для подсчета количества колоний и площади каждой колонии с положительным МТТ.
ПРИМЕЧАНИЕ: Скрипт для автоматической количественной оценки предоставляется в качестве дополнительного файла. Чтобы выполнить код, вставьте его в макроредактор(Plugins | Новые | Macro)и следуйте инструкциям.- Получить бинарную маску через порог исходное изображение(Image | Отрегулируйте | Порог)для получения хорошо делимитных колоний(рисунок 1).
ПРИМЕЧАНИЕ: 8- или 16-битные изображения, как правило, требуется для выполнения этого шага. Рекомендуется метод "Минимальный порог". - Вы запустите расширенный анализатор частиц из плагина Biovoxxel13 (плагины | БиоВоксел | Расширенный анализатор частиц) для идентификации положительных колоний MTT(рисунок 2). Первоначальные руководящие условия: Размер(м 2) 250-Бесконечность; Твердость 0,75-1,00.
- Получить бинарную маску через порог исходное изображение(Image | Отрегулируйте | Порог)для получения хорошо делимитных колоний(рисунок 1).
- Оцените средний диаметр (D) от значения площади каждой колонии (A) по формуле:

- Результаты фильтрации, исключая колонии с низким пролиферативом (например, низкий диаметр).
- Выберите минимальное количество делений внеделю (м),которые будут рассмотрены (например, 1).
- Оцените радиус колонии(R) с n ячейками по следующей формуле:

Где, r средний радиус индивидуальных клеток в подвеске, n число клеток формируя колонию которая вытерпела разделение m каждая неделя во время w неделей в культуре. В экспоненциальном росте: n No 2(м/в). - это эффективность упаковки. Обратите внимание, что при случайном движении эффективность упаковки составляет 0,64 евро, а наиболее плотная часть упаковки для одинаковых сфер — 0,7414. - Отбросьте все колонии, которые представляют диаметр ниже 2R, так как их клетки не достигли минимального количества делений, рассмотренных в шаге 3.3.4.1.
- Получить изображения каждой пластины с помощью перевернутого микроскопа. Отрегулируйте увеличение, чтобы получить максимальное поле зрения с меньшим количеством изображений и по-прежнему быть в состоянии обнаружить небольшие колонии (обычно 4x или 10x целей).
Результаты
Экспериментальная модель клеточной трансформации с введением трех генетических элементов в БПК была выбрана для получения репрезентативных результатов онкогеннойтрансформации 6,7 (рисунок 3). Не преобразованные BPECs(N) были ?...
Обсуждение
Экспериментальные протоколы, описанные в настоящем документе, предоставляют полезные инструменты для оценки онкогенной трансформации культурных клеток in vitro. Каждый метод оценивает конкретные аспекты процесса трансформации, и, таким образом, особое внимание следует уделять при сост?...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Лаборатория AG финансируется Испанским советом по ядерной безопасности. Т.А. и А.Г. являются членами исследовательской группы, признанной генералитатом Каталонии (2017-SGR-503). MT имеет контракт, финансируемый Научным Фондом Asociaci'n Espa'ola Contra el C'ncer (AECC-INVES19022TERR). Контракт G.F. финансируется за счет гранта Фонда Cellex.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
Ссылки
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены