JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 유방 상피 세포에 있는 종양원성 변환의 시험관 내 평가
요약
이 프로토콜은 인간 유방 세포의 변환을 평가하기 위해 실험적인 체외 도구를 제공합니다. 지하 막 매트릭스를 가진 3D 배양에서 세포 증식율, 앵커리지 독립적인 성장 능력 및 세포 혈통의 분포를 후속하는 상세한 단계가 설명되어 있습니다.
초록
종양 발생은 세포가 적대적인 조건하에서 그들의 성장, 생존 및 보급을 허용하는 기능을 취득하는 다단계 프로세스입니다. 다른 시험은 암 세포의 이 특징을 확인하고 정량화하기 위하여 노력합니다; 그러나, 그들은 종종 세포 변환의 단일 측면에 초점을 맞추고, 사실, 여러 테스트는 그들의 적절 한 특성에 대 한 필요. 이 작업의 목적은 연구원에게 광범위한 관점에서 체외의 세포 변환을 평가하는 도구 세트를 제공하여 건전한 결론을 도출 할 수 있도록하는 것입니다.
지속적인 증식 신호 활성화는 종양 조직의 주요 특징이며 시간이 지남에 따라 달성 된 인구 두 배수를 계산하여 체외 조건에서 쉽게 모니터링 할 수 있습니다. 게다가, 3D 배양에 있는 세포의 성장은 생체 내에서 일어나는 무슨을 닮은 주변 세포와의 상호 작용을 허용합니다. 이것은 세포 집계의 평가를 가능하게 하고, 특유한 세포 마커의 면역 형광 표시와 더불어, 종양 변환의 또 다른 관련 특징에 대한 정보를 얻기 위하여: 적당한 조직의 손실. 변형 된 세포의 또 다른 놀라운 특성은 앵커리지 분석으로 평가 할 수있는 다른 세포 및 세포 외 매트릭스에 부착하지 않고 성장하는 능력입니다.
세포 성장속도를 평가하고, 3D 배양에서 세포 계보 마커의 면역형광 라벨링을 수행하고, 연한 한천에서 앵커리지 독립적인 세포 성장을 테스트하는 상세한 실험 절차가 제공됩니다. 이러한 방법론은 유방암에 있는 그것의 관련성 때문에 유방 1 차상피 세포 (BPEC)를 위해 최적화됩니다; 그러나 일부 조정 후 다른 세포 유형에 절차를 적용할 수 있습니다.
서문
신생물 개발에는 여러 개의 연속이벤트가 필요합니다. 2011년 하나한과 웨인버그는 변형된 세포의 성장, 생존 및 보급을 가능하게 하는 10가지 기능을 설명했습니다: 소위 "암의 특징"1. 여기에 설명된 방법론은 종양 세포의 독특한 특징 중 일부에 집중하여 체외 세포 변환을 평가하는 세 가지 다른 도구를 컴파일합니다. 이러한 기술은 세포 증식율, 3D로 배양될 때 세포의 행동 및 앵커리지 독립성을 가진 식민지를 형성하는 능력을 평가합니다.
세포 모델은 시험관 내가설을 테스트하는 데 매우 중요합니다. 암2,3,4의연구를 위한 세포 변환의 실험 모델을 생성하기 위해 상이한 접근법이 개발되었다. 유방암은 전 세계 여성들 사이에서 가장 흔한 암이고 여자 중 암 죽음의 대략 15%를 책임지고 있기 때문에5,유방 상피 세포의 적당한 세포 모형을 제공하는 것은 추가 조사를 위해 가장 중요합니다. 이 문서에서는, 우리는 2007년에 Ince와 동료에 의해 처음에 기술된 유방 1 차상피 세포 (BpECs) 변환의 실험 모형을 사용하여 세포 변환을 평가하는 3개의 기술의 잠재력을 설명하고 나중에 우리의 실험실7에서실행되었습니다. 이러한 실험 모델은 3개의 표적 유전자(SV40 Large T 및 소형 t항원)의 순차적 변화를 기반으로 Ttag, hTERT및 HRAS라고불임) 비변형 BPEC의 게놈에 기초한다. 더욱이, BpECs 파생에 사용되는 방법은 발광 또는 근피성 마커를 가진 유방 상피 세포의 유지보수를 선호하며, 그 결과 일부 유방 선 및 생리적 특성을 유지하는 이질적인 세포 배양의 결과.
유방 선에서, 우유 생산을 담당하는 발광 유방 상피 세포는 루멘 근처에 위치하고, 심근 세포는 발광 세포 주위에 처분되고 젖꼭지로 우유를 이끄는 수축 운동을 돌봅니다. 이러한 세포 계보 사이의 적절한 조직의 손실은 3D 세포 배양에서 독특한 계보 마커의 면역 형광 검출 후 시험관 내에서 평가 될 수있는 종양 변환8의 특징입니다. 종양 세포의 또 다른 주요 특징은 다른 세포와 세포 외 매트릭스1에부착하지 않고 성장하는 능력입니다. 건강한 세포가 현탁액에서 성장하도록 강요될 때, 아노이키스 \u2012와 같은 메커니즘은 세포외 매트릭스 \u2012로부터 분리에 반응하여 유도된 세포 사멸의 유형이활성화되어 9. 세포 사멸의 회피는 암의 독특한 특징 중 하나이며, 따라서 변형 된 세포는 아노이키스를 비활성화하고 앵커 독립적 인 방식으로 살아남을 수 있습니다. 이 용량은 소프트 한천을 사용하여 앵커리지 독립적 인 분석으로 시험관 내에서 평가 할 수 있습니다. 더욱이, 종양 조직의 내재된 특징은 그들의 지속적인 증식 신호 용량이며, 이는 현탁액 검사기뿐만 아니라 단층 부착 배양의 성장 속도를 모니터링하여 시간에 따라 세포 수의 증가를 측정하여 체외 조건에서 쉽게 모니터링 할 수 있습니다.
종양성 잠재력을 시험하는 가장 좋은 모델은 뮤린 모델에서 종양 세포의 접종과 종양 발달의 평가에도 불구하고, 실험 적 절차에서 사용되는 동물의 수를 가능한 한 최소화하는 것이 중요하다. 따라서 시험관 내 변환을 평가하기 위한 적절한 테스트를 갖는 것이 최우선 과제입니다. 여기서, 우리는 세포 변환 모형으로 작동하는 실험실의 대부분에서 쉽게 구현될 수 있는 부분적으로 그리고 완전히 변형된 유방 상피 세포의 종양 성 잠재력을 평가하는 공구세트를 제공합니다.
프로토콜
다음과 같은 실험에 사용된 인간 샘플은 표준 절차 동의하에 클리니카 필라르 산트 조르디(바르셀로나)에서 수행된 감소 유방성형술로부터 수득되었다. 모든 절차는 달리 명시되지 않는 한 클래스 II 생물학적 안전 캐비닛에서 수행됩니다.
1. 인간 유방 상피 세포 및 성장 곡선 플롯 축적의 체외 배양
-
유방 1 차상성 세포의 체외 배양 (BPECs): 세포 통과
참고: BPEC 파생 및 세포 배양의 경우 Ince 외, 20076에의해 기술된 지침을 따릅니다.- 중간 준비.
- P 또는 T 보충제와 보충 WIT 기초 정의 매체, 제조 업체에 의해 제공, 기본 또는 변형 된 BpEC 배양 여부에 따라.
- 변환된 BpEC에 대해 100 ng/mL또는 25 ng/mL의 최종 농도에 보충된 WIT 매체에 콜레라 독소를 추가합니다.
주의: 콜레라 독소는 삼키면 치명적입니다. 개인 보호 장비를 사용합니다. 환경에 대한 릴리스를 피하십시오.
- 세포 배양 유지 및 패시징.
참고: 다음 단계의 경우 T25 플라스크에서 세포가 증가하고 있음을 명심하십시오. 그럼에도 불구하고, 부피가 표면적 측면에서 비례성을 유지하는 다른 세포 배양 형식에 적응할 수 있다.- 매일 세포 소모성을 확인하십시오. 배양이 90% 수렴되면 세포 패시징을 수행합니다.
- 각 플라스크에 대해 1x PBS, 3배 트립신, 중간 및 15mL 원추형 튜브를 획득하여 2mL의 태아 소 세럼(FBS)을 함유하고 있습니다.
- 플라스크에서 배지를 제거하고 FBS를 포함하는 15 mL 원추형 튜브에 보관하십시오.
- 1x PBS로 세포를 헹구는 다.
- 3배 트립신1mL을 추가하여 표면에서 세포를 분리합니다. 37°C에서 5분 동안 배양합니다.
- 셀이 분리되었는지 확인합니다. 세포가 완전히 분리되지 않으면 격렬한 흔들림을 적용하십시오.
- FBS로 보충 된 예약 된 매체를 추가하여 트립신을 비활성화합니다.
- 셀룰러 서스펜션을 수확하고 15 mL 원추형 튜브에 놓습니다.
- 500 x g에서 원심분리기는 5 분 동안 상퍼를 제거하고 손가락으로 튜브의 바닥을 가볍게 하여 펠릿 세포를 다시 중단합니다.
- 펠릿에 신선한 매체1-2mL을 추가하고 자동 세포 카운터 또는 혈류계를 사용하여 세포 농도를 측정합니다. 이 데이터는 나중에 인구 두 배를 계산하고 성장 곡선을 그리는 데 사용됩니다. 종자 12,000 세포/cm2 (예를 들어, T25 플라스크에 대 한 300,000 세포) 변형 된 세포 배양 표면 플라스크에서 (재료의 표참조).
참고: 농도가 너무 높으면 세포 현탁액을 희석하여 적절한 정량화를 보장합니다. - 5mL의 최종 부피에 배지를 추가하고 37°C 및 5% CO2 대기에서 세포를 배양한다.
- 세포 배양 배지를 48h마다 교체한다.
- 중간 준비.
-
계산 및 데이터 시각화를 두 배로 늘리는 인구
- 1.1.2.10 단계에서 얻은 셀 수의 데이터를 사용하여 다음 수식을 적용하여 누적된 인구 두 배(PD) 값을 얻습니다.
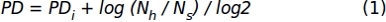
여기서, PDi는 이전 하위 배양(이전 하위 문화에 축적된 PD를 지칭함)까지 세포에 의해 달성된 인구 두 배의 수를 나타내며,Nh는 수확된 세포의 수이며, Ns는 종자 세포의 개수이다. - 배양(x-축)과 축적된 PD(y-축)의 일수가 표시되는 XY 그래프를사용하여 특정 시간 간격에 대한 데이터를 나타냅니다.
- 가장 적합한 선과 피팅 방정식을 가져옵니다.

참고: 경사(b)가 증가하면 증식률이 증가합니다.
- 1.1.2.10 단계에서 얻은 셀 수의 데이터를 사용하여 다음 수식을 적용하여 누적된 인구 두 배(PD) 값을 얻습니다.
2. 지하 막 매트릭스 및 면역 형광 단백질 검출의 3차원 (3D) 배양
- 지하 막 매트릭스의 3D 배양
참고: 이 프로토콜은 Debnath 등, 200310에서 적용되었으며 24 개의 웰 플레이트에 최적화되었습니다 (재료 표참조).- 실험 하루 전에 재료를 준비 : 4 °C에서 밤새 전 냉각 지하 멤브레인 매트릭스와 파이펫 팁, 미세 원심 분리기 튜브, 냉동고에서 냉각 잘 플레이트를 보자.
참고: 매트릭스는 장기 저장을 위해 -20°C로 유지해야 합니다. 여러 동결 해동 주기를 피하기 위해 알리쿼트를 만듭니다. - 실험 당일, 미리 냉각된 재료를 얼음 위에 놓습니다.
- 표면 장력을 줄이기 위해 차가운 멸균 1x PBS로 우물을 헹구십시오.
- 지하 멤브레인 매트릭스의 100 μL로 각 우물의 바닥을 덮습니다.
참고: 매트릭스를 천천히 분배하고 우물 전체에 퍼뜨리십시오. 단층 세포 배양 성장을 피하기 위해 바닥 층의 거품 형성을 피하는 것이 중요합니다. - 플레이트를 인큐베이터에 37°C로 배치하여 매트릭스 층이 고화하게 합니다.
참고: 일반적으로 고형화하는 데 약 20분이 걸립니다. - 한편, 트립시니화 세포는 1.1 단계에서 이전에 설명한 바와 같이. 5 분 동안 500 x g에서 세포를 원심 분리하고 중간에서 다시 중단합니다. 400,000 개의 셀 / mL 현탁액을 준비하고 파이펫팅으로 모든 세포 덩어리를 부드럽게 분해합니다.
- 8% 지하 멤브레인 매트릭스로 배지를 준비하고 세포 현탁액과 1:1 (v/v)을 혼합하여 4% 매트릭스에서 200,000세포/mL 용액을 얻습니다.
참고: 매트릭스 불필요한 낭비를 방지하는 데 필요한 매체의 양을 계산합니다. - 이미 고화화된 매트릭스 층 위에 500μL의 셀 서스펜션을 배치하여 4% 지하 막 매트릭스를 사용하여 배지에 총 100,000개의 세포를 시드한다.
- 세포를 37°C에서 몇 분 동안 배양한 다음, 4% 지하 멤브레인 매트릭스로 배지의 500 μL을 추가합니다. 14일 동안 5%CO2를 가진 인큐베이터에서 37°C에서 세포를 배양한다. 시드 세포는 아시니와같은 구조를 생성하기 위해 그룹화되고 증식합니다.
참고: 세포 운동성 및 응집은 3D 형성 과정에서 시간 경과에 의해 모니터링될 수 있습니다. 이미지 분석 소프트웨어(예: 피지/ImageJ 또는 Imaris)를 사용하여 이러한 이벤트를 평가합니다. 아시니의 수와 크기는 집계 과정과 증식속도에 따라 달라지며 세포 유형마다 다를 수 있다. 원하는 3D 구조를 얻기 위해 지하 막 매트릭스 농도 및 시드 세포를 조정합니다. - 매체의 500 μL을 초당 2~3회 지하 멤브레인 매트릭스로 추가합니다.
참고: 조작 하는 동안 접시를 부드럽게 들고 레이어의 방해를 방지 합니다. - 원하는 경우, 아시니의 수와 크기는 배양 기간 동안 측정될 수 있다. 이렇게하려면 위상 대비 또는 DIC 반전 현미경을 사용하여 시드 후 다른 시간에 임의의 사진을 찍습니다. 이미지 분석 소프트웨어를 사용하여 100~200개의 3D 구조의 직경을 측정합니다.
- 실험 하루 전에 재료를 준비 : 4 °C에서 밤새 전 냉각 지하 멤브레인 매트릭스와 파이펫 팁, 미세 원심 분리기 튜브, 냉동고에서 냉각 잘 플레이트를 보자.
- 면역 염색
참고: 프로토콜의 이 부분에서는 멸균 조건이 필요하지 않습니다.- 배양 배지를 제거합니다.
- 끝이 잘라 p200 파이펫 팁을 사용하여 지하 멤브레인 매트릭스를 찢어. 유리 슬라이드 위에 분해 된 매트릭스의 ~50 μL을 놓고 1-2cm2의영역에 얼룩을 놓습니다.
- 시료를 실온에서 완전히 건조시키거나 37°C의 가열 판을 사용하여 공정을 가속화하십시오. 메탄올:아세톤(1:1, v/v)으로 샘플을 -20°C에서 30분 동안 수정합니다.
참고: 세포에 의해 발현된 형광 단백질과 같은 이전 마커의 형광 신호는 지워질 것입니다.
주의: 메탄올은 인화성, 흡입, 삼킨 경우 또는 피부와 접촉하는 경우에 독성이 있습니다. 개인 보호 장비를 착용하고 연기 후드 내부에서 작업하십시오. - 고정 용액을 버리고 필터 용지의 슬라이드를 기울임으로써 초과 를 제거합니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 일단 건조되면, 슬라이드는 몇 달 동안 -20 °C에 저장할 수 있습니다. - 실온에서 2시간 동안 1x PBS(블로킹 용액)에서 일반 염소 세럼 5%, 트리톤-X-10000을 갖춘 샘플 에피토프를 차단합니다.
- 한편, 차단용액의 원하는 농도에서 1차 또는 이차 항체를 희석시킴으로써 항체 작업 용액을 준비한다.
참고: 항체 농도는 세포 유형 및 항체 참조에 따라 정확하게 조정되어야 합니다. 가이드로서, BPEC에서 발광 및 근피상선으로부터 세포를 식별하기 위해, 1차 항 세포근자(14) 및 항클라우렌-IV 항체(재료표참조)를 사용할 수 있다. 권장 작업 용액 농도는 이러한 1 차형 항체에 대해 1:100, 항마우스 및 항래빗 이차 항체의경우 1:500입니다(재료표 참조). - 1차 항체 작동 용액의 30 μL을 추가하고 증발을 피하기 위해 실험실 포장 필름 스트립으로 덮습니다. 습한 챔버에서 4 °C에서 하룻밤 동안 배양하십시오.
- 1x PBS로 3회 세척하여 각각 1h로 세척합니다.
- 이차 항체에 대한 반복 단계 2.2.7. 인큐베이션은 어둠 속에서 수행되어야 합니다.
- 2 시간 동안 1 x PBS로 씻어.
참고: 항체 농도, 인큐베이션 시간 및 세척 경도를 조정하여 특정 시료의 신호/소음 비율을 개선합니다. - 나머지 PBS를 제거하고, 일단 건조하면, 안티페이드 장착 매체에서 희석 된 0.25 μg / mL에서 DAPI와 카운터 스테인. 압력을 가하지 않고 정착하게 하여 커버슬립으로 슬라이드를 덮습니다. 매니큐어로 밀봉하십시오.
참고: 샘플은 몇 주 동안 4°C에서 저장할 수 있습니다. 장기 보관을 위해 -20°C로 보관하십시오. - 공초점 현미경을 사용하여 각 아시누스에 대한 형광 신호 분포를 분석합니다.
참고: 공초점 현미경 구성은 사용되는 장비와 시료에 적용되는 항체에 따라 정확하게 결정되어야 합니다. 가이드로서, 재료의 표에상세한 장비 및 시약, 40배 목표 및 다음 레이저 및 검출기 설정을 사용: DAPI사용 여기에 405 레이저(3%-5%), PMT 검출기(800V)를 사용한 검출, 오프셋: -9) 및 스펙트럼 대역410 nm에서 500 nm까지; A488 (Claudin-IV)의 경우 488 레이저 (7 %-10%), PMT 검출기 (800V)로 감지된 채 운석을 사용하십시오. 오프셋: -20) 및 490 nm에서 550 nm까지의 스펙트럼 밴드; Cy3 (사이토케라틴 14)는 555 레이저 (2 %-10%), PMT 검출기 (800V, 오프셋 : -35) 및 560 nm에서 600nm까지 의 스펙트럼 밴드와 함께 흥분을 사용합니다.
3. 앵커리지 독립적 인 분석, MTT 염색 및 자동 식민지 정량화
- 앵커리지 독립적 분석: 한천 및 셀룰러 서스펜션 도금
참고: 2014년11일 Borowicz 등에서 BpEC에서 실험을 수행하기 위해 프로토콜이 적용되었습니다.- 멸균 병에 초순수에 희석된 1.2% 원고 용액을 준비한다. 용액을 자동 클로브하고 실험 중에 42 °C에서 유지관리합니다. 이 천용액은 4°C로 저장할 수 있습니다. 필요한 경우, 다시 액체가 될 때까지 천 용액을 가열합니다.
주의: 내열 장갑을 사용하여 오토클레이브 후 화상을 방지하십시오.
참고: 지금부터는 멸균 상태를 유지해야 합니다. - 1:1(v/v) 완전 사전 데운 매체를 1.2% 한천 용액으로 혼합하여 0.6% 한천 용액을 준비합니다. 조기 응고를 피하기 위해 42 °C에서 유지하십시오.
참고: 매체는 이전에 완전히 보충 된 0.6 % 한천 + 중간 용액을 한 번 혼합하기 위해 이중 보충 될 수 있습니다. - 중간 용액에서 0.6 %의 1.5 mL로 35mm의 바닥을 잘 덮고 실온에서 고화시키십시오. 플레이트의 바닥이 화고가 고화되기 전에 완전히 덮여 있는지 확인하십시오, 그렇지 않으면, 세포는 접시에 부착하고 단층에서 성장할 수 있습니다.
참고: 부착 및 비 부착 표면 플레이트를 사용할 수 있습니다. - 한편, 트립시뉴화하고, 원심분리되고 배지에서 재중단되면 50,000개의 세포/ml 용액을 준비하고 반복적으로 파이펫팅으로 모든 세포 덩어리를 부드럽게 분해합니다.
- 25,000세포/mL의 최종 농도에서 배지내 0.3% 천 /세포 현탁액을 준비한다.
참고: 최적의 세포 농도세포 유형 간에 다를 수 있습니다. 개별 식민지가 형성 될 때까지 다른 농도를 보십시오.- 40 μm 스트레이너 필터를 50mL 멸균 튜브 위에 놓고 50,000개의 셀/mL 용액을 필터링하여 튜브 바닥으로 떨어뜨립니다.
- 50mL 멸균 관에서 필터를 제거하고, 세포 함유 튜브를 45° 각도로 기울이고 튜브의 내부 벽을 통해 붓는 0.6% 천 +중간 용액의 동일한 부피를 떨어뜨립니다. 이렇게 하면 한천 용액이 세포를 손상시키지 않고 조기 응고를 피할 수 있을 만큼 식힐 수 있습니다.
- 혼합물을 균질화하고 이전에 고화된 바닥 천 층 위에 배지내0.3% 천 +세포 현탁액(25,000개의 세포 함유)의 혼합물및 침전물 1mL을 균일화한다.
- 반전된 현미경을 사용하여 종자 세포를 시각화하여 세포가 개별화되었는지 확인합니다. 그렇지 않으면 실험을 반복해야 합니다.
- 한천 층이 완전히 굳어질 때까지 기다린 다음, 아래 섬세한 한천 층을 방해하지 않고 신선한 배지 1mL을 조심스럽게 위에 넣습니다.
- 3주 동안 인큐베이터에서 세포를 37°C 및 5% CO2로 배양한다.
참고: 식민지 형성에 필요한 시간은 다른 세포 모형 에 따라 다를 수 있습니다, 그러나 일반적으로 3 주 는 충분합니다. - 일주일에 두 번 매체를 변경합니다. 이렇게하려면 접시를 부드럽게 기울여 아래 모서리에 매체를 흡인하고 신선한 매체 1 mL를 추가합니다.
참고: 접시에서 쉽게 분리할 때 한천 층을 만지지 마십시오.
- 멸균 병에 초순수에 희석된 1.2% 원고 용액을 준비한다. 용액을 자동 클로브하고 실험 중에 42 °C에서 유지관리합니다. 이 천용액은 4°C로 저장할 수 있습니다. 필요한 경우, 다시 액체가 될 때까지 천 용액을 가열합니다.
- MTT 염색
- 0.2 μm 필터를 사용하여 멸균 병 및 필터 용액의 초순수수에 티아졸리블루 테트라졸륨 브로마이움 브로마이드(MTT) 스톡 용액을 6mg/mL로 준비한다. 이 MTT 용액은 -20 °C에서 최대 6 개월 동안 저장할 수 있습니다.
주의: MTT는 자극을 일으킬 수 있으며 유전 적 결함을 일으키는 것으로 의심됩니다. 안전 안경, 장갑 및 호흡기 필터를 사용합니다.
참고: 반복되는 동결 해동 주기를 피하십시오. - 멸균 초순수로 스톡 용액을 희석하여 1 mg/mL에서 MTT의 작업 용액을 준비합니다.
- 식민지 형성 기간이 끝나면 플레이트에서 배지를 제거하고 각 우물에 1 mg /mL MTT의 1 mL을 추가하십시오.
- 인큐베이터에서 24시간 동안 배양합니다. MTT 용액을 부드럽게 흡입하여 제거합니다. 플레이트는 몇 주 동안 4 °C에서 저장할 수 있습니다.
참고: 비특이적 결정 형성을 방지하기 위해 광 노출을 피하십시오.
- 0.2 μm 필터를 사용하여 멸균 병 및 필터 용액의 초순수수에 티아졸리블루 테트라졸륨 브로마이움 브로마이드(MTT) 스톡 용액을 6mg/mL로 준비한다. 이 MTT 용액은 -20 °C에서 최대 6 개월 동안 저장할 수 있습니다.
- 식민지 정량화
- 반전 된 현미경을 사용하여 각 플레이트의 이미지를 가져옵니다. 배율을 조정하여 더 적은 이미지로 최대 시야를 확보하고 작은 식민지(보통 4배 또는 10배 목표)를 감지할 수 있습니다.
참고: 이미지가 균일한 배경을 표시해야 합니다. 얼룩이 없는 식민지가 정량화되지 않기 때문에 위상 대비나 차동 간섭 대비가 필요하지 않습니다. - ImageJ/Fiji 소프트웨어12에 이미지를 업로드하여 식민지 수와 각 MTT 양성 식민지의 면적을 계산합니다.
참고: 자동 정량화를 위한 스크립트는 보충 파일로제공됩니다. 코드를 실행하려면 매크로 편집기(플러그인 | 붙여넣기 새로운 | 매크로)및 지침을 따르십시오.- 원본 이미지(이미지 | 임계값을 사용하여 이진 마스크를가져옵니다. 조정 | 임계값)잘 구분된 식민지를 얻기 위해(그림 1).
참고: 일반적으로 이 단계를 수행하려면 8비트 또는 16비트 이미지가 필요합니다. "최소 임계값" 메서드를 권장합니다. - 바이오볼셀 플러그인13(플러그인 |에서 확장 입자 분석기 실행 바이오볼셀 | 확장 입자 분석기)MTT 양성 식민지를 식별하기 위해(그림 2). 초기 안내 조건: 크기(μm2)= 250-인피니티; 견고성 = 0.75-1.00.
- 원본 이미지(이미지 | 임계값을 사용하여 이진 마스크를가져옵니다. 조정 | 임계값)잘 구분된 식민지를 얻기 위해(그림 1).
- 수식에 따라 각 콜로니 영역 값(A)의 평균 직경(D)을 추정합니다.

- 낮은 증식 식민지(예: 저직경)를 제외하여 결과를 필터링합니다.
- 고려될 주당 최소 구분수(m)를선택합니다(예: 1).
- 다음 수식에 따라 n 세포를 사용하여식민지(R)의반경을 추정합니다.

여기서, r은 현탁액에서 개별 세포의 평균 반경이며, n은 배양에서 w 주 동안 매주 m 분열을 겪은 식민지를 형성하는 세포의 수이다. 기하급수적 성장: n = 2(m *w). 포장 효율입니다. 임의의 움직임에서 포장 효율은 ~0.64이고 동일한 구체에 대한 가장 조밀한 포장 분획은 0.7414이다. - 그들의 세포가 단계 3.3.4.1에서 고려된 분열의 최소 수를 달성하지 않았기 때문에 2R 보다 낮은 직경을 제시하는 모든 식민지를 폐기하십시오.
- 반전 된 현미경을 사용하여 각 플레이트의 이미지를 가져옵니다. 배율을 조정하여 더 적은 이미지로 최대 시야를 확보하고 작은 식민지(보통 4배 또는 10배 목표)를 감지할 수 있습니다.
결과
BPECs에서 3개의 유전적 원소의 도입과 함께 세포 변환의 실험 모델은6,7(그림 3)의대표적인 결과를 생성하도록 선택되었다. 비변형 BPEC(N)는Ince 및동료에 의해 기술된 바와 같이 질병이 없는 유방 조직에서 유래되었다 6 여기에 표시된 프로토콜에 따라 배양되었다. STASIS를 극복한 후 (스트레스 또...
토론
이 논문에 설명된 실험 프로토콜은 체외 배양 세포의 온코겐 변환을 평가하는 유용한 도구를 제공합니다. 각 기술은 변환 프로세스의 특정 측면을 평가하므로 단일 분석에서 결론을 도출할 때 특별한 주의를 기울여야 합니다. 성장 곡선 빌드업은 다른 목적을 위해 세포를 배양할 때 이미 사용할 수 있는 정보를 요구하는 접근 방식입니다. 즉, 이 기술은 다른 세포 증식 에세이에 비해 저렴하고 쉽?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
AG 연구소는 스페인 원자력 안전 위원회의 지원을 받습니다. T.A.와 A.G.는 일반 타탈룬야 (2017-SGR-503)에 의해 인식 연구 그룹의 구성원입니다. MT는 과학 재단 아소시아시온 에스파냐라 콘트라 엘 콘트라 엘 칸서 [AECC-INVES1902TERR]에 의해 투자 계약을 보유하고 있습니다. G.F. 계약은 셀렉스 재단의 보조금으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
참고문헌
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유