需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人类乳腺上皮细胞致癌转化的体外评价
摘要
该协议提供实验体外工具,以评估人类乳腺细胞的转化。介绍了后续细胞增殖率、锚地独立生长能力以及3D培养基中细胞系系与地下室膜基质分布的详细步骤。
摘要
肿瘤生成是一个多步骤的过程,细胞获得能力,允许其生长,生存和传播在敌对条件下。不同的测试试图识别和量化癌细胞的这些特征;然而,他们往往专注于细胞转换的一个方面,事实上,需要多重测试,以适当的表征。这项工作的目的是为研究人员提供一套工具,从广泛的视角评估细胞体外转化,从而有可能得出合理的结论。
持续增殖信号激活是肿瘤组织的主要特征,可以通过计算随着时间的推移实现的种群数量翻倍,在体外条件下可以轻松监测。此外,3D培养物中的细胞生长允许它们与周围细胞的相互作用,类似于体内发生的情况。这能够评估细胞聚集,并结合独特的细胞标记的免疫荧光标记,获得关于肿瘤转化的另一个相关特征的信息:失去适当的组织。转化细胞的另一个显著特征是它们在不附着于其他细胞和细胞外基质的情况下生长的能力,可以通过锚定测定来评估。
提供了详细的实验程序,以评估细胞生长率,在3D培养物中对细胞系系标记进行免疫荧光标记,并测试软糖中与锚系无关的细胞生长。由于乳腺原发性细胞(BPEC)与乳腺癌的相关性,这些方法针对乳原细胞(BPEC)进行了优化;但是,在进行某些调整后,可以应用于其他单元格类型的过程。
引言
肿瘤发育需要多个连续事件。2011年,Hanahan和温伯格描述了10种能够转化细胞生长、存活和传播的能力:所谓的"癌症的霍尔克"1。此处描述的方法汇编了三种不同的工具,通过关注肿瘤细胞的一些显著特征来评估体外细胞转化。这些技术评估细胞增殖率、3D培养细胞的行为及其形成具有锚定独立性的菌落的能力。
细胞模型对于体外检验假说至关重要。为研究癌症2、3、4,开发了不同的方法来生成细胞转化的实验模型。由于乳腺癌是全世界女性最常见的癌症,占5岁女性癌症死亡的15%左右,因此,为乳腺上皮细胞提供合适的细胞模型对于进一步研究至关重要。在这篇文章中,我们说明了三种技术的潜力,评估细胞转化使用实验模型的乳房原发性上皮细胞(BPECs)转化最初描述由因斯和他的同事在2007年6日,后来在我们的实验室7实施。该实验模型基于三个靶向基因(SV40大T和小T抗原(此处称为Ttag、hTERT和HRAS)对非转化BPE的基因组的连续变化。 此外,用于BPECs衍生的方法有利于维持乳腺上皮细胞与发光或骨髓标记,导致异质细胞培养,保留一些乳腺生理特征。
在乳腺中,负责牛奶生产的发光乳腺上皮细胞位于流明附近,而骨髓细胞位于发光细胞周围,并照顾导致乳汁到奶嘴的收缩运动。这些细胞系间失去适当的组织是肿瘤转化8的一个特征,可以在免疫 荧光检测3D细胞培养物中独特的血统标记后进行体外评估。肿瘤细胞的另一个主要特征是它们在不附着其他细胞和细胞外基质1的情况下生长的能力。当健康细胞被迫在悬浮过程中生长时, 阿诺基斯 \u2012等机制因与细胞外基质分离而诱发的细胞死亡类型被激活9。细胞死亡的逃避是癌症的显著特征之一,因此,转化的细胞能够灭活阿 诺基 ,以独立于锚的方式生存。这种能力可以在体外评估与锚地无关的测定使用软阿加。此外,肿瘤组织的一个固有特征是其持续的增殖信号能力,这种能力可以通过测量细胞数随时间的增加,不仅在悬浮测定中,而且通过监测单层粘附培养物的生长速度,在体外条件下易于监测。
尽管测试肿瘤原能的最佳模型是接种穆林模型中的肿瘤细胞和原位肿瘤发育评估,但尽可能减少实验程序中使用的动物数量非常重要。因此,进行适当的测试以评估体外转化是重中之重。在这里,我们提供一套工具来评估部分和完全转化的乳房上皮细胞的肿瘤原位,这些细胞在大多数使用细胞转化模型的实验室中都可以轻松实施。
研究方案
在以下实验中使用的人类样本是从在标准程序同意下在克拉尼卡皮拉尔圣 若尔迪 (巴塞罗那)进行的减少乳腺手术中获得的。除非另有说明,所有程序在 II 类生物安全柜中执行。
1. 人类乳腺上皮细胞的体外培养和生长曲线图的积累
-
乳房原发性上皮细胞(BPECs)的体外培养:细胞传通
注:对于 BPEC 衍生和细胞培养,请遵循 Ince 等人描述的说明,2007年 6月 6 日。- 中等准备。
- 补充WIT基底定义介质与P或T补充剂,由制造商提供,这取决于是否培养初级或转化的BPC。
- 将霍乱毒素加入补充的WIT介质,最终浓度为100纳克/mL,用于原发性浓度或25纳克/mL,用于转化的BPC。
注意:如果吞咽,霍乱毒素是致命的。使用个人防护设备。避免将其释放到环境中。
- 细胞培养维护和传通。
注:对于以下步骤,请记住,细胞生长在T25烧瓶中。尽管如此,卷可以适应其他细胞培养格式,保持表面积的相称性。- 每天检查细胞汇合。当培养为 90% 汇合时,执行细胞传递。
- 获取每个烧瓶含有 1x PBS、3x 胰蛋白素、中等和 15 mL 锥形管,内含 2 mL 的胎儿牛血清 (FBS)。
- 从烧瓶中取下介质,并将其放在含有 FBS 的 15 mL 锥形管中。
- 用 1x PBS 冲洗细胞。
- 通过添加 1 mL 的 3 倍 trypsin,将细胞从表面分离。在37°C下孵育5分钟。
- 检查单元格是否已分离。如果细胞未完全分离,请进行剧烈摇晃。
- 通过添加与 FBS 补充的保留介质来停用 trypsin。
- 收获细胞悬浮液并放在15 mL锥形管中。
- 在 500 x g下离心 5 分钟,消除上清液,用手指轻拂管底,重新增殖颗粒细胞。
- 在颗粒中加入1~2 mL的新鲜介质,并使用自动细胞计数器或血细胞计测量细胞浓度。此数据稍后将用于计算人口翻倍并绘制增长曲线。种子 12,000 细胞/厘米2 (例如,300,000 细胞 T25 烧瓶) 在修改的细胞培养表面烧瓶 ( 见材料表).
注:如果浓度过高,以确保正确定量,稀释细胞悬浮液。 - 将介质加入到5 mL的最终体积中,并在37°C和5%CO2大气中孵育 细胞。
- 每 48 小时更换一次细胞培养培养。
- 中等准备。
-
人口翻倍计算和数据可视化
- 使用步骤 1.1.2.10 中获得的单元格计数数据,应用以下公式获取累积总体量翻倍 (PD) 值:
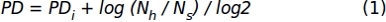
其中 ,PDi 表示细胞在上一个亚培养之前达到的种群数量翻倍(它是指在上一个亚培养中积累的 PD),Nh 表示收获的细胞 数,Ns 表示种子细胞的数量。 - 使用 XY 图形表示特定时间间隔的数据,其中表示区域性(x轴)和累积的 PD(y轴)的天数。
- 获取最佳拟合线和拟合方程:

注:增加坡度(b)意味着增殖率增加。
- 使用步骤 1.1.2.10 中获得的单元格计数数据,应用以下公式获取累积总体量翻倍 (PD) 值:
2. 地下室膜基质和免疫荧光蛋白检测中的三维(3D)培养
- 地下室膜基质中的三元培养
注:此协议已改编自 Debnath 等人,2003年 10 月 10 日,并针对 24 个井板进行了优化( 参见材料表)。- 在实验前一天准备材料:在4°C下过夜,让移液器尖端、微离心管和井板在冰柜中冷却。
注:矩阵必须保持在-20°C,以进行长期存储。制作等分,以避免多个冻结解冻循环。 - 在实验当天,将预冷却材料放在冰上。
- 用冷无菌 1x PBS 冲洗孔,以降低表面张力。
- 用 100 μL 的基底膜基质覆盖每孔底部。
注:缓慢分配矩阵,并在整个井中扩散;避免底层形成气泡,避免单层细胞培养生长至关重要。 - 将板放在 37 °C 的培养箱中,让基质层凝固。
注:凝固通常需要约20分钟。 - 同时,如步骤1.1所述,对细胞进行三试。以500 x g离 心 5分钟,以中等水平重新暂停。准备 400,000 个细胞/mL 悬浮液,然后通过移液轻轻分解任何细胞团。
- 用 8% 的基底膜基质准备介质,将 1:1 (v/v) 与细胞悬浮液混合,在 4% 基质中获得 200,000 个细胞/mL 溶液。
注:计算避免矩阵不必要浪费所需的介质量。 - 将500μL的细胞悬浮液放在基质溶液中,放在已经凝固的基质层上,用4%的基底膜基质在介质中播种100,000个细胞的总量。
- 在37°C下孵育细胞几分钟,然后用4%的基膜基质加入500μL的介质。在37°C的培养箱中用5%CO2孵育细胞 14天。种子细胞将组团和增殖,以产生 阿西尼样结构。
注:在三维形成过程中,可以通过延时来监测细胞的动能和聚集。使用图像分析软件(例如斐济/ImageJ 或 Imaris)评估这些事件。 acini 的数量和大小取决于聚合过程和增殖率,并且可能因细胞类型而异。调整基底膜基质浓度和种子细胞,以获得所需的三D结构。 - 加入500μL的介质与4%的基底膜基质每周2~3次。
注:在操作过程中,避免对轻轻携带板的层造成干扰。 - 如果需要,可以在培养期间 测量阿奇 尼的数量和大小。为此,使用相位对比度或 DIC 倒置显微镜在播种后的不同时间随机拍摄照片。使用图像分析软件测量 100~200 3D 结构的直径。
- 在实验前一天准备材料:在4°C下过夜,让移液器尖端、微离心管和井板在冰柜中冷却。
- 免疫污
注:在协议的这一部分期间,不需要无菌条件。- 删除区域性介质。
- 使用 p200 移液器尖端撕裂地下室膜基质,末端被切断。将 ±50 μL 的分类矩阵放在玻璃幻灯片上,并在 1~2 厘米 2 的面积中涂抹。
- 让样品在室温下完全干燥,或在 37°C 下使用加热板加速工艺。用甲醇:丙酮(1:1,v/v)在-20°C下固定样品30分钟。
注:先前标记的荧光信号,如细胞表达的荧光蛋白信号,将被擦除。
注意:甲醇是易燃的,有毒,如果吸入,吞咽或万一它接触皮肤。穿戴个人防护装备,在烟罩内工作。 - 丢弃固定溶液,通过将幻灯片斜放在滤纸上,去除多余的(如果有)。
注意:可以在这里暂停协议。干燥后,幻灯片可储存在-20°C上几个月。 - 在室温下用5%的正常山羊血清和0.1%的三吨-X-100在1x PBS(阻断溶液)中阻断样品表位,2小时。
- 同时,通过稀释原抗体或二级抗体,在阻断溶液中所需的浓度下,准备抗体工作溶液。
注:抗体浓度必须根据细胞类型和抗体参考进行精确调整。作为指南,可以使用BPEC中发光和脑皮血统的细胞,使用原发性抗细胞素14和抗克劳丁-IV抗体( 见材料表)。推荐的工作溶液浓度为1:100,用于抗小鼠和抗兔子二级抗体(见 材料表)。 - 加入30μL的原抗体工作溶液,用实验室包装膜覆盖,避免蒸发。在4°C下在潮湿室中孵育过夜。
- 用 1x PBS 洗涤三次,每次 1 小时。
- 对二级抗体重复步骤2.2.7。孵育应在黑暗中进行。
- 用 1x PBS 清洗 2 小时。
注:调整抗体浓度、孵育时间和洗涤硬度,以提高特定样品的信号/噪声比。 - 拆下剩余的 PBS,并在干燥后,用 DAPI 在 0.25 μg/mL 处稀释在防淡安装介质中的反污。在不施加压力的情况下让幻灯片沉淀,用盖玻片盖住幻灯片。用指甲油密封。
注:样品可储存在4°C上数周。对于长期存储,请将它们保持在-20°C。 - 使用共和显微镜分析 每种青光 的荧光信号分布。
注:必须根据使用的设备和应用于样品的抗体准确确定共和显微镜配置。作为指南,使用材料表中详细说明 的设备和试剂,使用 40 倍目标以及以下激光和探测器设置:对于 DAPI,使用 405 激光(3%~5%),使用 PMT 探测器检测(800V, 偏移:-9)和光谱带从410纳米到500纳米;对于 A488(克劳丁-IV),使用488激光(7%~10%),使用PMT探测器(800V, 偏移:-20)和光谱带从490纳米到550纳米;对于Cy3(细胞素14),使用555激光(2%~10%),使用PMT探测器(800V,偏移:-35)和光谱带从560纳米到600nm的光谱带使用激发。
3. 与安克雷奇无关的测定、MTT 染色和自动菌落定量
- 独立于锚地的测定:agar 和细胞悬浮电镀
注:《议定书》改编自Borowicz等人,2014年11月11 日,用于在BPC中进行实验。- 在无菌瓶中准备在超纯水中稀释的 1.2% 的阿加溶液。在实验过程中,将溶液自动保存并保持在42°C。加糖溶液可储存在4°C;当需要时,加热加糖溶液,直到它再次是液体。
注意:使用耐热手套,避免在隔风车后烧伤。
注:从现在起,必须保持无菌条件。 - 将 1:1 (v/v) 完整的预热介质与 1.2% 的加糖溶液混合,准备 0.6% 的阿加溶液。保持42°C,避免过早凝固。
注:中可事先双补,获得完全补充的0.6%agar + 中溶液混合后。 - 用中等溶液中 1.5 mL 的 0.6% agar 覆盖 35 mm 井的底部,让它在室温下凝固。在加糖凝固之前,确保板的底部完全覆盖,否则,细胞可能会粘附在板上,并在单层中生长。
注:可以使用粘附和非粘附表面板。 - 同时,对细胞进行三辛化,一旦在培养基中离心和再增,就准备50,000个细胞/毫升溶液,通过反复移液轻轻分解任何细胞团。
- 在最终浓度为25,000细胞/mL时,在培养物中准备0.3%的阿加+细胞悬浮液。
注:最佳细胞浓度可能因细胞类型而不同。尝试不同的浓度,直到形成个性化的殖民地。- 将 40 μm 滤株过滤器放在 50 mL 无菌管的顶部,并过滤 50,000 个细胞/mL 溶液,让它滴入管底。
- 从 50 mL 无菌管中拆下过滤器,将含电池管倾斜至 45° 角,并滴下相同体积的 0.6% agar + 中溶液,将其浇注通过管的内部壁。这将允许果糖溶液冷却到足以不损害细胞,并避免其过早凝固。
- 使混合物均质化,并在先前凝固的底部加糖层顶部将1 mL的0.3%agar + 细胞悬浮液沉积在介质中(包含25,000个细胞)。
- 使用倒置显微镜可视化种子细胞,以确保细胞是个性化的。否则,应重复实验。
- 等待,直到阿加层完全凝固,然后小心地将1 mL的新鲜介质添加到顶部,而不会干扰下面的细腻的阿加层。
- 在37°C和5%CO2下在培养箱中 孵育细胞3周。
注:菌落形成所需的时间可能因细胞类型而异,但通常3周就足够了。 - 每周更换两次介质。为此,轻轻地向您倾斜板,在下角吸气介质,并添加 1 mL 的新鲜介质。
注:避免接触加糖层,因为它们很容易从板上分离。
- 在无菌瓶中准备在超纯水中稀释的 1.2% 的阿加溶液。在实验过程中,将溶液自动保存并保持在42°C。加糖溶液可储存在4°C;当需要时,加热加糖溶液,直到它再次是液体。
- Mtt 染色
- 在无菌瓶中制备 6 mg/mL 的硫醇蓝四氧化硅 (MTT) 库存溶液,使用 0.2 μm 过滤器在超纯水中制备滤芯溶液。此 MTT 解决方案可储存长达 6 个月,温度为 -20 °C。
注意:MTT 可能会引起刺激,并怀疑会导致遗传缺陷。使用安全眼镜、手套和呼吸过滤器。
注:避免重复的冻结解冻循环。 - 使用无菌超纯水稀释库存溶液,以 1 mg/mL 的 MTT 准备工作溶液。
- 一旦菌落形成期结束,从板中去除介质,并在每井中加入1mL的1mg/mL MTT。
- 在孵化器中孵育24小时。轻轻吸气 MTT 溶液,将其拆下。板可以在4°C下储存数周。
注:避免光线照射,防止非特异性晶体形成。
- 在无菌瓶中制备 6 mg/mL 的硫醇蓝四氧化硅 (MTT) 库存溶液,使用 0.2 μm 过滤器在超纯水中制备滤芯溶液。此 MTT 解决方案可储存长达 6 个月,温度为 -20 °C。
- 殖民地量化
- 使用倒置显微镜获取每个板的图像。调整放大倍率,以更少的图像获得最大视野,并且仍然能够检测小殖民地(通常为 4 倍或 10 倍目标)。
注:确保图像呈现均匀的背景。两者都不需要相位对比度或差分干涉对比度,因为非染色菌落不会量化。 - 上传图像到 ImageJ/Fiji 软件12 以计算殖民地的数量和每个 MTT 阳性殖民地的区域。
注:自动量化的脚本作为补充文件 提供。要执行代码,请将其粘贴到宏编辑器(插件|新|宏)并按照说明操作。- 通过设置原始图像(图像图像)的阈值获取二进制|调整|阈值)以获得良好的分隔殖民地(图1)。
注:执行此步骤通常需要 8 位或 16 位图像。建议使用"最小阈值"方法。 - 运行从Biovoxxel插件13(插件 |生物|扩展粒子分析仪 )用于识别 MTT 阳性菌落(图 2)。初始指导条件:尺寸 (μm2) = 250=无限;固体 = 0.75±1.00。
- 通过设置原始图像(图像图像)的阈值获取二进制|调整|阈值)以获得良好的分隔殖民地(图1)。
- 根据公式估计每个菌落面积值 (A) 的平均直径 (D):

- 通过排除低增殖菌落(例如低直径)来过滤结果。
- 选择要考虑的每周最小分部数(米)(例如,1)。
- 根据以下公式估计带n 个单元格 的 殖民地 ( R ) 的半径:

其中 ,r 是悬浮细胞的平均半径 ,n 是形成群体 、在培养的 w 周内每周遭受 m 分裂的细胞数。指数增长: n = 2(m*w)。 • 是包装效率。请注意,在随机移动中,包装效率为 ±0.64,相同球体最密集的包装分数为 0.7414。 - 丢弃直径小于 2R 的所有菌落,因为其细胞未达到步骤 3.3.4.1 中考虑的最低分裂数。
- 使用倒置显微镜获取每个板的图像。调整放大倍率,以更少的图像获得最大视野,并且仍然能够检测小殖民地(通常为 4 倍或 10 倍目标)。
结果
选择在BPECs中引入三种遗传元素的细胞转化实验模型,产生具有代表性的致生转化结果6、7(图3)。非转化的BPEC (N) 来自无病乳房组织,如因斯及其同事6所述,按照此处所示的协议进行培养。在克服STAGSIS(压力或异常信号诱导-衰老,一种通常在体外乳腺上皮细胞中观察到的现象,在细胞培...
讨论
本文描述的实验方案为评估体外培养细胞的致癌转化提供了有用的工具。每种技术都评估转换过程的具体方面,因此,在从单个分析中得出结论时,必须特别注意。生长曲线积累是一种在培养细胞用于其他目的时需要已有信息的方法。与其他细胞增殖测定相比,这使得这项技术更便宜、更容易应用。然而,为了获得有效的结果,每次对细胞进行亚栽培时,必须特别注意其计数和播种。增长率的提?...
披露声明
作者没有什么可透露的。
致谢
AG实验室由西班牙核安全委员会资助。T.A. 和 A.G. 是加泰罗尼亚总分类(2017-SGR-503) 认可的研究小组的成员。MT拥有一份由西班牙科学基金会资助的合同[AECC-INVES19022TERR]。G.F. 合同由 Cellex 基金会的赠款资助。
材料
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
参考文献
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。