このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト乳腺上皮細胞における発癌性転換のインビトロ評価
要約
このプロトコルは、ヒト乳腺細胞の形質転換を評価するための実験的なインビトロツールを提供する。細胞増殖率、アンカレッジ非依存性増殖能、基基膜マトリックスを用いた3D培養における細胞系統の分布をフォローアップするための詳細なステップについて説明する。
要約
腫瘍形成は、細胞が敵対的な条件下で増殖、生存、および普及を可能にする能力を獲得する多段階のプロセスである。異なるテストは、癌細胞のこれらの特徴を同定し、定量化しようとします。しかし、彼らはしばしば細胞の変換の単一の側面に焦点を当て、実際には、それらの適切な特性評価のために複数のテストが必要です。本研究の目的は、広い視野から細胞の形質転換を評価するための一連のツールを研究者に提供し、それによって健全な結論を導き出すことを可能にすることです。
持続的な増殖シグナル伝達活性化は、腫瘍組織の主要な特徴であり、時間の経過とともに達成される倍増する集団数を計算することによって、インビトロ条件下で容易に監視することができる。また、3D培養における細胞の増殖は、生体内で起こることに似た周囲の細胞との相互作用を可能にする。これにより、細胞凝集の評価と、特徴的な細胞マーカーの免疫蛍光標識と共に、腫瘍変態の別の関連する特徴、すなわち適切な組織の喪失に関する情報を得ることが可能になる。形質転換細胞のもう一つの顕著な特徴は、他の細胞および細胞外マトリックスに付着することなく増殖する能力であり、これは、アンカレッジアッセイで評価することができる。
細胞増殖率を評価する詳細な実験手順、3D培養における細胞系分担マーカーの免疫蛍光標識を行う、および軟寒天におけるアンカレッジ非依存性細胞増殖を試験する実験手順が提供される。これらの方法論は乳癌の関連性のために乳癌原発性上皮細胞(BPEC)のために最適化される;ただし、いくつかの調整後に、プロシージャを他のセルの種類に適用できます。
概要
新生物の開発には、複数の連続したイベントが必要です。2011年、ハナハンとワインバーグは、形質転換細胞の成長、生存、普及を可能にする10の機能、いわゆる「がんの特徴」1を説明しました。ここで説明する方法論は、腫瘍細胞の特徴的な特徴のいくつかに焦点を当てることによって、インビトロ細胞変換を評価するための3つの異なるツールをまとめます。これらの技術は、細胞増殖速度、3Dで培養した場合の細胞の挙動、およびアンカレッジ独立性を有するコロニーを形成する能力を評価する。
細胞モデルは、インビトロで仮説をテストするために非常に重要です。癌2,3,4の研究のための細胞変換の実験モデルを生成するために、さまざまなアプローチが開発されている。乳癌は、世界中の女性の間で最も一般的な癌であり、女性5の間で癌死亡の約15%を担っているので、乳腺上皮細胞の適切な細胞モデルを提供することは、さらなる調査のために最も重要である。本稿では、2007年6月6日にInceらの研究チームが最初に説明した乳房一次上皮細胞(BFC)変換の実験モデルを用いて細胞変換を評価する3つの技術の可能性を説明した。この実験モデルは、非形質化されたBFCのゲノムに対する3つの標的遺伝子(SV40 Large Tおよび小さなt抗原をTtag、hTERT、HRASと呼ぶ)の順次変化に基づいています。 さらに、BFC誘導に使用される方法は、乳腺上皮細胞を発光または筋上皮マーカーで維持し、乳腺の生理学的形質の一部を保持する異種細胞培養をもたらす。
乳腺では、乳の生産を担う乳腺上皮細胞は内腔の近くに位置し、筋上皮細胞は発光細胞の周りに配置され、乳首にミルクを導く収縮運動の世話をします。これらの細胞系統間の適切な組織の喪失は、3D細胞培養における特徴的な系統マーカーの免疫蛍光検出後にインビトロで評価することができる腫瘍形変換8 の特徴である。腫瘍細胞のもう一つの主要な特徴は、他の細胞および細胞外マトリックス1に付着することなく増殖する能力である。健康な細胞が懸濁液で増殖することを余儀なくされると、 アノイキス \u2012のようなメカニズムは、細胞外マトリックスからの剥離に応答して誘発される細胞死の一種である\u2012が活性化される9。細胞死の回避は癌の特徴的な特徴の一つであり、したがって、形質転換細胞はア ノイキス を不活性化し、アンカーに依存しない方法で生き残ることができる。この容量は、軟寒天を用いたアンカレッジ非依存アッセイを用いてインビトロで評価することができる。さらに、腫瘍組織の固有の特徴は、その持続的な増殖シグナル伝達能力であり、懸濁アッセイだけでなく、単層接着培養物の増殖速度を監視することによって、時間に沿って細胞数の増加を測定することによって、インビトロ条件下で容易に監視することができる。
腫瘍発生の可能性をテストする最良のモデルは、マウスモデルにおける腫瘍細胞の接種およびその領域における腫瘍の発達の評価であるにもかかわらず、実験手順で使用される動物の数を可能な限り最小限に抑えることが重要である。従って、インビトロでの変換を評価するための適切な試験を有することが最優先事項である。ここでは、細胞変換モデルに作用するほとんどの研究室で容易に実施できる部分的かつ完全に形質転換された乳房上皮細胞の腫瘍発生性を評価するための一連のツールを提供する。
プロトコル
以下の実験で使用したヒト試料は、標準的な手順の同意の下で 、クリニカ・ピラール・サン・ジョルディ (バルセロナ)で行われた還元マンモパラスティから得られた。特に明記されていない限り、すべての手順はクラスII生物学的安全キャビネットで行われます。
1. ヒト乳腺上皮細胞のインビトロ培養と成長曲線プロットの蓄積
-
乳癌原発上皮細胞(BPECs)のインビトロ培養:細胞通過
注: BPEC の派生と細胞培養については、Ince ら、 20076で説明した指示に従ってください。- 中程度の準備。
- P または T サプリメントを使用して WIT 基底定義培地を補足, メーカーによって提供, プライマリまたは変換された BFC が培養されているかどうかに応じて.
- 補充されたWIT培地にコレラ毒素を加えて、1次の場合は100 ng/mL、変換されたBPCSの場合は25 ng/mLの最終濃度にします。
注意:コレラ毒素は飲み込むと致命的です。個人用保護具を使用してください。環境へのリリースを避けます。
- 細胞培養の維持および通過。
注:次の手順では、細胞がT25フラスコで増殖していることを覚えておいてください。それにもかかわらず、体積は表面積の点で比例性を維持する他の細胞培養フォーマットに合わせることができる。- 毎日細胞の合流を確認してください。培養が90%コンフルエントである場合、細胞の通過を行う。
- 1x PBS、3xトリプシン、ミディアム、および各フラスコに対して2mLの胎児ウシ血清(FBS)を含む15 mL円錐管を取得します。
- フラスコから培地を取り出し、FBSを含む15 mL円錐形チューブに保管します。
- 1x PBSで細胞をリンスします。
- 3xトリプシンの1 mLを加えて、表面から細胞を取り外します。37°Cで5分間インキュベートします。
- セルが切り離されているかどうかを確認します。細胞が完全に切り離されていない場合は、激しい揺れを適用します。
- FBSを補充して予約された媒体を加えることによってトリプシンを非活性化しなさい。
- 細胞懸濁液を収穫し、それを15 mL円錐形の管に入れる。
- 500xgで5分間遠心分離し、上清を除去し、指でチューブの底部をフリックしてペレット化した細胞を再懸濁する。
- ペレットに1~2mLの新鮮な培地を加え、自動セルカウンターまたはヘモサイトメーターを使用して細胞濃度を測定します。このデータは、後で人口倍増を計算し、成長曲線を描くために使用されます。改変細胞培養表面フラスコにおけるシード12,000細胞/cm2( 例えば、T25フラスコの30万個の細胞)( 材料表参照)。
注:濃度が高すぎる場合は、セル懸濁液を希釈して適切な定量化を行います。 - 培地を5mLの最終体積に加え、37°Cおよび5%CO2雰囲気で細胞をインキュベートします。
- 細胞培養培地を48時間ごとに交換する。
- 中程度の準備。
-
人口倍増計算とデータ可視化
- ステップ 1.1.2.10 で取得したセル数のデータを使用して、次の式を適用して累積母集団倍数 (PD) 値を取得します。
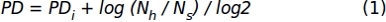
ここで、PDiは、前のサブ培養(前のサブ培養で蓄積されたPDを指す)、Nhは収穫された細胞の数、Nsはシード細胞の数まで細胞によって達成された集団の倍増数を示す。 - 特定の時間間隔のデータを表す XY グラフを使用して、カルチャ(x-軸) と累積 PD (y-軸 ) を表す XY グラフを使用します。
- 最適な線とフィット方程式を取得します。

注: 傾斜角が増加すると(b)、増殖速度が増加します。
- ステップ 1.1.2.10 で取得したセル数のデータを使用して、次の式を適用して累積母集団倍数 (PD) 値を取得します。
2. 基質膜マトリックスの三次元(3D)培養と免疫蛍光タンパク質検出
- 基質膜マトリックスにおける3D培養
注: このプロトコルは Debnath ら、200310 から適応され、24 ウェルプレート用に最適化されています ( 資料表を参照)。- 実験の前日に材料を準備する:4°Cで一晩冷やす前の基底膜マトリックスとピペットの先端、マイクロ遠心チューブ、およびウェルプレートを冷凍庫で冷却させます。
注:マトリックスは、長期保存のために-20°Cに保つ必要があります。複数のフリーズ解凍サイクルを避けるためにアリコートを作ります。 - 実験当日、あらかじめ冷却された材料を氷の上に置きます。
- 表面張力を減らすために、冷たい滅菌1x PBSで井戸をすすいでください。
- 各ウェルの底部を100 μLの基底膜マトリックスで覆います。
注:マトリックスをゆっくりと分配し、井戸全体に広げます。単層細胞培養の成長を回避するために、最下層の泡形成を避けるために重要です。 - プレートをインキュベーターに入れ、37°Cで、マトリックス層を固化させる。
注:固めるのに通常約20分かかります。 - 一方、ステップ1.1で前述したように細胞をトリプシン化する。500 x g で 5 分間遠心分離し、培地で再中断します。400,000個の細胞/mL懸濁液を調製し、ピペット処理によって細胞塊を穏やかに分解します。
- 8%基膜マトリックスで培地を調製し、細胞懸濁液と1:1(v/v)を混合して、4%マトリックスで200,000細胞/mL溶液を得ます。
注:マトリックス不要な無駄を避けるために必要な媒体の量を計算します。 - 500 μL の細胞懸濁液を、すでに固化したマトリックス層の上にマトリックス溶液に入れ、4%基体膜マトリックスを含む培地に合計100,000個の細胞を播種します。
- 37°Cで細胞を数分間インキュベートし、その後、4%基膜マトリックスで培地500μLを加えます。5%CO2のインキュベーターで37°Cの細胞を14日間インキュベートします。播種された細胞は、アキニ様の構造を起源とするようにグループ化し増殖する。
注:細胞の運動性と凝集は、3D形成プロセス中のタイムラプスによって監視することができます。画像解析ソフトウェア (例: フィジー/ImageJ、イマリス) を使用して、これらのイベントを評価します。 acini の数とサイズは、集約プロセスと増殖速度によって異なり、細胞タイプによって異なる場合があります。基体膜マトリックス濃度と播種細胞を調整して、所望の3D構造を得る。 - 4%基膜マトリックスを1週間に2~3回加える培地の500μLを加えます。
注:操作中にプレートを優しく運ぶ層の乱れを避けてください。 - 必要に応じて、培養期間中に アチーニ の数およびサイズを測定することができる。そのためには、位相コントラストまたはDIC反転顕微鏡を用いて播種した後、異なる時間にランダムな写真を撮ります。画像解析ソフトウェアを使用して、100~200個の3D構造の直径を測定します。
- 実験の前日に材料を準備する:4°Cで一晩冷やす前の基底膜マトリックスとピペットの先端、マイクロ遠心チューブ、およびウェルプレートを冷凍庫で冷却させます。
- 免疫染色
注: プロトコルのこの部分では、滅菌状態は必要ありません。- 培養液を取り出します。
- p200ピペットチップを使用して基質膜マトリックスを引き裂き、端を切り落とします。ガラススライドの上に約50μLの分解マトリックスを置き、1〜2cm2の領域に塗りつぶします。
- 試料を室温で完全に乾燥させるか、37°Cの加熱プレートを使用してプロセスを加速します。メタノール:アセトン(1:1、v/v)で-20°Cで30分間サンプルを固定します。
注:細胞によって発現される蛍光タンパク質のような以前のマーカーの蛍光シグナルは消去されます。
注意:メタノールは、吸入、飲み込まれた場合、または皮膚に接触した場合に有毒であり、可燃性である。個人的な保護具を着用し、ヒュームフードの中で動作します。 - 固定液を破棄し、フィルタペーパー上のスライドをリクライニングして、余分な場合は除去します。
注: プロトコルはここで一時停止することができます。乾後、スライドは-20°Cで数ヶ月間保存できます。 - ブロックサンプルは、通常のヤギ血清5%、1x PBS中の0.1%トリトンX-100(ブロッキング溶液)を室温で2時間用いたエピトープを含む。
- 一方、ブロッキング溶液中の所望の濃度で一次または二次抗体を希釈することによって抗体作動溶液を調製する。
注:抗体濃度は、細胞の種類と抗体の基準に応じて正確に調整する必要があります。ガイドとして、BPECにおける発光および筋上皮系から細胞を同定するために、一次抗サイトケラチン14および抗クローディンIV抗体( 表表を参照)が使用できる。推奨される作業溶液濃度は、これらの一次抗体の場合は1:100、抗マウスおよび抗ウサギ二次抗体の場合は1:500です( 材料表を参照)。 - 30 μLの一次抗体作業溶液を加え、蒸着を避けるために、ラボラッピングフィルムのストリップで覆います。湿度の高いチャンバーで4°Cで一晩インキュベートします。
- 1x PBSをそれぞれ1時間3回洗浄します。
- 二次抗体についてステップ2.2.7を繰り返します。インキュベーションは暗闇の中で行われるべきです。
- 1x PBSで2時間洗います。
注:抗体の濃度、インキュベーション時間、洗浄硬度を調整して、特定のサンプルの信号/ノイズ比を改善してください。 - 残りのPBSを取り出し、乾燥したら、0.25 μg/mLでDAPIをアンチフェード実装媒体で希釈してカウンターステインします。圧力をかけずに落ち着かせることで、カバースリップでスライドを覆います。マニキュアでシールします。
注:サンプルは、4 °Cで数週間保存することができます。長期保存の場合は、-20°Cに保ちます。 - 共焦点顕微鏡を用いて各 アキヌの 蛍光シグナル分布を解析します。
注意:共焦点顕微鏡の構成は、使用する機器とサンプルに適用される抗体に応じて正確に決定する必要があります。ガイドとして、 材料表に詳述されている機器および試薬では、40倍の目的と次のレーザーおよび検出器の設定を使用します:DAPI用は405レーザー(3%-5%)で励起を使用します。 PMT検出器(800V、オフセット:-9)と410nmから500nmまでのスペクトルバンドによる検出;A488(クローディン-IV)の場合は488レーザー(7%-10%)で励起を使用し、PMT検出器(800V、 オフセット: -20) および 490 nm から 550 nm までのスペクトルバンド、および Cy3 (Cytokeratin 14) では、555 レーザー (2%–10%) で励起を使用し、PMT 検出器 (800V、 オフセット: -35) と 560 nm から 600 nm までのスペクトルバンドを検出します。
3. アンカレッジ非依存アッセイ、MTT染色、自動コロニー定量
- アンカレッジ非依存アッセイ:寒天と細胞懸濁液めっき
注: プロトコルは、BFCでの実験を行うためにボロヴィッチら、201411 から適応されています。- 滅菌ボトルに超純水で希釈した1.2%寒天溶液を調製します。この溶液をオートクレーブし、実験中に42°Cに維持します。寒天溶液は4°Cで保存することができます。必要に応じて、寒天溶液を再び液体になるまで加熱します。
注意:オートクレーブ後の燃焼を避けるために耐熱手袋を使用してください。
注:今後は、無菌状態を維持する必要があります。 - 1:1 (v/v) 完全な温め培地と 1.2% 寒天溶液を混合して、0.6% 寒天溶液を調製します。42°Cで固化を防ぐよう、維持してください。
注:ミディアムは、完全に補充された0.6%寒天+培地溶液を一度混合するために以前に二重に補充することができます。 - 35mmの底面を0.6%寒天の1.5mLで覆い、室温で固めます。プレートの底部が寒天固化前に完全に覆われていることを確認し、そうでなければ、細胞がプレートに付着して単層に成長する可能性があります。
注: 接着および非接着表面プレートを使用できます。 - 一方、トリプシン化した細胞を、いったん遠心し、培地に再懸濁すると、50,000個の細胞/ml溶液を調製し、繰り返しピペット処理を行うことで細胞塊を穏やかに分解する。
- 25,000細胞/mLの最終濃度で培地に0.3%寒天+細胞懸濁液を調製する。
注: 最適な細胞濃度は、細胞の種類によって異なる場合があります。個別化されたコロニーが形成されるまで、異なる濃度を試してみてください。- 50 mLの滅菌チューブの上に40 μmのストレーナーフィルターを置き、50,000個の細胞/mL溶液をチューブの底に落とします。
- 50 mLの滅菌チューブからフィルターを取り外し、細胞含有チューブを45°の角度に傾け、同じ体積の0.6%寒天+中液をチューブの内壁に流し込みます。これにより、寒天溶液は細胞に損傷を与えないように冷却し、その早期凝固を避けることを可能にします。
- 混合物を均質化し、前に固化した底寒天層の上に培地中に0.3%寒天+細胞懸濁液(25,000個の細胞を含む)の1mLを沈着させる。
- 反転した顕微鏡を使用してシードされた細胞を視覚化し、細胞が個別化されていることを確認します。それ以外の場合は、実験を繰り返す必要があります。
- 寒天層が完全に固まるまで待ってから、下の繊細な寒天層を邪魔することなく、上に新鮮な培地の1 mLを慎重に追加します。
- 37°Cおよび5%CO2で細胞をインキュベーターで3週間インキュベーターでインキュベートする。
注:コロニー形成に必要な時間は、異なる細胞タイプによって異なる場合がありますが、通常3週間で十分です。 - 週に 2 回メディアを変更します。そのためには、プレートをあなたに向かってそっと傾け、下隅に培地を吸引し、新鮮な培地を1mL加えます。
注: プレートから簡単に取り外す寒天レイヤーには触れないようにしてください。
- 滅菌ボトルに超純水で希釈した1.2%寒天溶液を調製します。この溶液をオートクレーブし、実験中に42°Cに維持します。寒天溶液は4°Cで保存することができます。必要に応じて、寒天溶液を再び液体になるまで加熱します。
- MTT染色
- 0.2 μmフィルターを使用して、セチルボトルおよびフィルター液中の超純水中の6mg/mLでチアゾリルブルーテトラゾリウムブロマイド(MTT)ストック液を調製します。このMTT溶液は-20°Cで6ヶ月まで貯えることができる。
注意:MTTは刺激を引き起こす可能性があり、遺伝的欠陥を引き起こす疑いがあります。安全メガネ、手袋、呼吸器フィルターを使用してください。
注: フリーズ解凍サイクルを繰り返さないようにしてください。 - 無菌超純水でストック溶液を希釈することにより、1 mg/mLでMTTの働く溶液を調製します。
- コロニー形成期間が終了したら、プレートから培地を取り出し、各ウェルに1mg/mL MTTの1 mLを加えます。
- インキュベーターで24時間インキュベートする。MTT溶液を軽く吸い取って取り除きます。プレートは、4°Cで数週間保存することができます。
注:非特異的な結晶形成を防ぐために光の露出を避けてください。
- 0.2 μmフィルターを使用して、セチルボトルおよびフィルター液中の超純水中の6mg/mLでチアゾリルブルーテトラゾリウムブロマイド(MTT)ストック液を調製します。このMTT溶液は-20°Cで6ヶ月まで貯えることができる。
- コロニー定量
- 反転顕微鏡を用いて各プレートの画像を取得します。より少ない画像で最大視野を獲得し、小さなコロニー(通常4倍または10倍の目標)を検出できるように、拡大率を調整します。
注: 画像が同種の背景を示していることを確認します。非染色コロニーは定量化されないので、位相コントラストも差差干渉コントラストも必要ありません。 - ImageJ/Fiji ソフトウェア12 に画像をアップロードして、各 MTT 陽性コロニーのコロニー数と面積をカウントします。
メモ: 自動定量のスクリプトは 、補足ファイルとして提供されます。コードを実行するには、マクロエディタ(プラグイン|新しい|マクロ) をクリックし、指示に従います。- 元のイメージをしきい値にしてバイナリ マスクを取得する (イメージ ||を調整する十分に区切られたコロニーを得るためのしきい値(図1)。
注 : この手順を実行するには、通常、8 ビットまたは 16 ビットのイメージが必要です。「最小しきい値」の方法を推奨します。 - Biovoxxel プラグイン13 から拡張粒子分析を実行します (プラグイン|バイオボクセル|MTT陽性コロニーを同定するための拡張粒子分析計(図2)。初期ガイド条件: サイズ (μm2) = 250 –無限大;ソリッド = 0.75 – 1.00。
- 元のイメージをしきい値にしてバイナリ マスクを取得する (イメージ ||を調整する十分に区切られたコロニーを得るためのしきい値(図1)。
- 各コロニー面積値(A)から平均直径(D)を計算式に従って推定します。

- 低増殖コロニー(例えば、低径)を除外して結果をフィルタリングする。
- 考慮する週あたりの最小分割数(m)を選択します (例: 1)。
- 次の式に従ってnセルでコロニーの半径を推定します(R)。

ここで、rは、懸濁中の個々の細胞の平均半径であり、nは、培養中のw週の間に毎週m分裂を患ったコロニーを形成する細胞の数である。指数成長の場合: n = 2(m*w)ρはパッケージング効率です。ランダムな移動では、パッケージング効率は~0.64であり、同一の球の最も密度の高いパッキング率は0.7414であることに注意してください。 - 彼らの細胞がステップ3.3.4.1で考慮された分割の最小数を達成していないとして、2Rより低い直径を示すすべてのコロニーを捨てます。
- 反転顕微鏡を用いて各プレートの画像を取得します。より少ない画像で最大視野を獲得し、小さなコロニー(通常4倍または10倍の目標)を検出できるように、拡大率を調整します。
結果
BFCに3つの遺伝子要素を導入した細胞変換の実験モデルが、発癌性変換6、7の代表的な結果を生成するために選択された(図3)。非形質化されたBFC(N)は、Inceと同僚6によって記載されているように疾患のない乳房組織に由来し、ここで示すプロトコルに従って培養した。STASIS(ストレスまたは異...
ディスカッション
本論文に記載された実験プロトコルは、インビトロ培養細胞の発癌性転換を評価するための有用なツールを提供する。各手法は変換プロセスの特定の側面を評価するため、単一の分析から結論を導き出す際には、特別な注意が必要です。成長曲線の構築は、他の目的のために細胞を培養する際に既に利用可能な情報を要求するアプローチです。これにより、この技術は他の細胞増殖アッセイ?...
開示事項
著者らは開示するものは何もない。
謝辞
AG研究所は、スペイン原子力安全評議会によって資金提供されています。T.A.とA.G.は、 ジェネラリタット・デ・カタルーニャ (2017-SGR-503)が認めた研究グループのメンバーです。MTは、科学財団 アソシアシオン・エスパニョーラ・コントラ・エル・カンセル [AECC-INVES19022TERR]が資金を提供する契約を締結しています。G.F.契約は、セレックス財団からの助成金によって資金提供されています。
資料
| Name | Company | Catalog Number | Comments |
| 1 ml Serological Pipettes | Labclinics | PLC91001 | |
| 1.5 ml Eppendorfs | Thermo Fisher Scientific | 3451 | Dark eppendorfs are preferred for MTT long-term storage |
| 10 μl Pipette tips w/o filter | Biologix | 20-0010 | |
| 100 ml glass bottle | With cap, autoclavable | ||
| 1000 μl Pipette tips w/ filter | Labclinics | LAB1000ULFNL | |
| 1000 μl Pipette tips w/o filter | Biologix | 20-1000 | |
| 15 ml Conical tubes | VWR | 525-0400 | |
| 2 ml Serological Pipettes | Labclinics | PLC91002 | |
| 200 μl Pipette tips w/ filter | Labclinics | FTR200-96 | |
| 5 ml Serological Pipettes | Labclinics | PLC91005 | |
| 50 ml Conical Tubes | VWR | 525-0304 | |
| Acetone | PanReac AppliChem | 211007 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Agar | Sigma-Aldrich | A1296 | Used for anchorage assay |
| Anti-Claudin 4 antibody | Abcam | 15104, RRID:AB_301650 | Working dilution 1:100, host: rabbit |
| Anti-Cytokeratin 14 [RCK107] antibody | Abcam | 9220, RRID:AB_307087 | Working dilution 1:100, host: mouse |
| Anti-mouse Cyanine Cy3 antibody | Jackson ImmunoResearch Inc. | 115-165-146, RRID:AB_2338690 | Working dilution 1:500, host: goat |
| Anti-rabbit Alexa Fluor 488 antibody | Thermo Fisher Scientific | A-11034, RRID:AB_2576217 | Working dilution 1:500, host: goat |
| Autoclave | |||
| BioVoxxel Toolbox | RRID:SCR_015825 | ||
| Cell culture 24-well Plate | Labclinics | PLC30024 | Used for 3D cultures in Matrigel. Flat Bottom |
| Cell culture 6-well Plate | Labclinics | PLC30006 | Used for anchorage assay |
| Cell incubator (37 ºC and 5 % CO2) | |||
| Cell Strainers | Fisherbrand | 11587522 | Mesh size: 40 μm |
| CellSense software | Olympus | Used to image acquisition | |
| Centrifuge | |||
| Cholera Toxin from Vibrio cholerae | Sigma-Aldrich | C8052 | Used to supplement cell culture medium |
| Class II Biological Safety Cabinet | Herasafe | HAEREUS HS12 | |
| Confocal inverted Microscope | Leica | TCS SP5 | |
| Cover glasses | Witeg Labortechnik GmbH | 4600122 | 22 X 22 mm, thickness 0.13 - 0.17 mm |
| DAPI | 2-(4-amidinophenyl)-1H -indole-6-carboxamidine | ||
| Fetal Bovine Serum | Biowest | S1810 | Used to inactivate trypsine action |
| Fiji software (ImageJ) | National Institutes of Health | RRID:SCR_002285 | Free download, no license needed |
| Glass Pasteur Pipettes | |||
| Glass slides | Fisherbrand | 11844782 | |
| Goat Serum | Biowest | S2000 | Used for immunofluorescence of 3D structures |
| Heat-Resistant Gloves | Used for agar manipulation after autoclave | ||
| Heater bath (37 ºC) | Used to temper solutions prior to cell subculture | ||
| Heater bath (42 ºC) | Used to keep agar warm | ||
| Heating plate | Used for Matrigel dehydration | ||
| Humid chamber | Used for the incubation of antibodies during immunofluorescence | ||
| Ice | Used during Matrigel manipulation | ||
| Ice-box | |||
| Inverted Optic Microscope | Olympus | IX71 | |
| Matrigel Matrix | Becton Dickinson | 354234 | Store at -20 ºC and keep cold when in use. Referred to as basement membrane matrix |
| Methanol | PanReac AppliChem | 131091 | Used for 3D structure fixation prior to immunofluorescent labelling |
| Micropipette | p1000, p200 and p10 | ||
| Microsoft Office Excel | Microsoft | RRID:SCR_016137 | Used to calculate population doubling and to obtain growth rate equation |
| MilliQ water | Referred to as ultrapure water | ||
| Nail Polish | Used to seal samples after mounting | ||
| Parafilm M | Bemis | PM-999 | Used to cover antibody solution during incubation |
| PBS pH 7.4 (w/o calcium & magnesium) | Gibco | 10010-056 | Sterile. Used for cell subculture |
| PBS tablets | Sigma-Aldrich | P4417 | Dilute in milliQ water. No sterility required. Used for immunofluorescence |
| Pipette Aid | |||
| Primaria T25 flasks | Corning | 353808 | Used for BPEC culture |
| Scepter Automated Cell Counter | Millipore | PHCC20060 | Alternatively, use an haemocytometer |
| Scissors | Used to cut pipette tips and parafilm | ||
| Sterile filters 0.22 μm | Millipore | SLGP033RS | Used to filter MTT solution |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M2128 | Store at -20 ºC |
| Triton X-100 | Sigma-Aldrich | T8787 | Used for immunofluorescence of 3D structures |
| Trypsin-EDTA 10X | Biowest | X0930 | Dilute in PBS to obtain 3X solution |
| Vectashield Antifade Mounting Medium | Vector Laboratories | H-1000 | |
| WIT-P-NC Culture Medium | Stemgent | 00-0051 | Used for primary BPEC culture |
| WIT-T Culture Medium | Stemgent | 00-0047 | Used for transformed BPEC culture |
参考文献
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Stampfer, M. R., Yaswen, P. Culture models of human mammary epithelial cell transformation. Journal of Mammary Gland Biology and Neoplasia. 5 (4), 365-378 (2000).
- Schinzel, A. C., Hahn, W. C. Oncogenic transformation and experimental models of human cancer. Frontiers in Bioscience : A Journal and Virtual Library. 13 (13), 71 (2008).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nature Communications. 8 (1), 15422 (2017).
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Ince, T. A., et al. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 12 (2), 160-170 (2007).
- Repullés, J., et al. Radiation-induced malignant transformation of preneoplastic and normal breast primary epithelial cells. Molecular Cancer Research. , 1-13 (2019).
- Weigelt, B., Bissell, M. J. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Seminars in Cancer Biology. 18 (5), 311-321 (2008).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochimica et Biophysica Acta. 1833 (12), 3481-3498 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Borowicz, S., et al. The soft agar colony formation assay. Journal of Visualized Experiments. (92), (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Brocher, J. The BioVoxxel Image Processing and Analysis Toolbox. European BioImage Analysis Symposium. 8 (2), 67112 (2015).
- Torquato, S., Truskett, T. M., Debenedetti, P. G. Is random close packing of spheres well defined. Physical Review Letters. 84 (10), 2064-2067 (2000).
- LaBarge, M. A., Garbe, J. C., Stampfer, M. R. Processing of human reduction mammoplasty and mastectomy tissues for cell culture. Journal of Visualized Experiments. (71), (2013).
- Zubeldia-Plazaola, A., et al. Glucocorticoids promote transition of ductal carcinoma in situ to invasive ductal carcinoma by inducing myoepithelial cell apoptosis. Breast Cancer Research. 20 (1), 65 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved