Method Article
استقطاب M1 و M2 الإنسان الخلايا المشتقة من Monocyte وتحليل مع تدفق قياس الخلايا على عدوى السل المتفطرة
In This Article
Summary
يوفر هذا البروتوكول طريقة لدراسة عدوى السل الميكوباكتيريا في الضامة المستقطبة M1 أو M2 البشرية استنادا إلى تمايز خلايا الدم الطرفية الأحادية إلى الخلايا الشبيهة بال الضامة المصابة بالسلالة الخبيثة H37Rv المسماة GFP ، وتحليلها باستخدام قياس التدفق الخلوي باستخدام لوحة من 10 ألوان بما في ذلك التعبير عن علامات M1/M2 المحددة.
Abstract
الضامة البشرية هي الخلايا المضيفة الرئيسية للعدوى بالسل الفطري داخل الخلية (Mtb) وبالتالي لها دور مركزي في السيطرة المناعية على السل (TB). لقد أنشأنا بروتوكولا تجريبيا لمتابعة الاستقطاب المناعي للخلايا المشتقة من النخاع إلى M1 (تنشيط كلاسيكي) أو M2 (تنشيط بديل) الخلايا الشبيهة بال الضامة من خلال التقييم مع لوحة قياس الخلايا التدفقية من 10 ألوان التي تسمح بالتصور والتوصيف العميق للبروتين الأخضر الفلوري (GFP) المسمى Mtb في مجموعات فرعية متنوعة من الضامة. تم استقطاب الخلايا الأحادية التي تم الحصول عليها من المتبرعين بالدم الأصحاء إلى خلايا M1 أو M2 باستخدام التمايز مع عامل تحفيز مستعمرة الضامة الحبيبية (GM-CSF) أو عامل تحفيز مستعمرة الضامة (M-CSF) يليه الاستقطاب مع IFN-γ وlipopolysaccharide (LPS) أو IL-4 على التوالي. أصيبت خلايا M1 و M2 المستقطبة بالكامل ب Mtb-GFP لمدة 4 ساعات قبل أن تلطخ الضامة المنفصلة المصابة ب Mtb ب قياس التدفق الخلوي في 4 أو 24 ساعة بعد العدوى. تم إجراء اكتساب العينة باستخدام قياس التدفق الخلوي وتم تحليل البيانات باستخدام برنامج تحليل قياس التدفق الخلوي. تم إجراء التنغيم اليدوي وكذلك الحد من الأبعاد مع تقريب وإسقاط متعددة موحدة (UMAP) وتحليل phenograph. أدى هذا البروتوكول إلى استقطاب M1/M2 فعال يتميز بمستويات مرتفعة من CD64 و CD86 و TLR2 و HLA-DR و CCR7 على خلايا M1 غير المصابة ، في حين أظهرت خلايا M2 غير المصابة تنظيما قويا لعلامات النمط الظاهري M2 CD163 و CD200R و CD206 و CD80. تحتوي الخلايا المستقطبة M1 عادة على عدد أقل من البكتيريا مقارنة بالخلايا المستقطبة M2. تم إلغاء تنظيم العديد من علامات M1/M2 بعد عدوى Mtb ، مما يشير إلى أن Mtb يمكن أن تعدل الاستقطاب الضام. وبالإضافة إلى ذلك، وجد أن 24 مجموعة خلايا مختلفة من أحجام مختلفة موزعة بشكل فريد بين الخلايا غير المصابة والمصابة ب M2 M1 و MTB على مدار 24 ساعة بعد العدوى. يمكن استخدام بروتوكول قياس التدفق الخلوي M1/M2 هذا كعمود فقري في أبحاث Mtb-macrophage واعتماده لتلبية الاحتياجات الخاصة في مجالات البحث المختلفة.
Introduction
الضامة هي الخلايا المناعية التي تسهم بشكل كبير في تنظيم التوازن النسيجي والالتهاب وأمراض الأمراض. كونها عنصرا أساسيا من المناعة الفطرية، والنسب أحادية الضامة من الخلايا يعبر عن الأنماط الظاهرية غير المتجانسة استجابة للإشارات البيئية المتغيرة، والتي تعكس اللدونة والتكيف مع مختلف المواقع التشريحية والمناعية1. اعتمادا على عوامل النمو، تم تصنيف السيتوكينات وغيرها من الوسطاء الموجودين في البيئة الدقيقة ، الضامة إلى مجموعتين رئيسيتين قابلتين للعكس ، كل منهما له دور مختلف في التحكم البكتيري والتخليص2:الضامة المؤيدة للالتهابات والمفعلة كلاسيكيا M1 المستقطبة والمكبرات المضادة للالتهابات والمفعلة بدلا من ذلك M2 المستقطبة التي سميت في الأصل لمحاكاة تسمية الخلية T helper (Th)3. هذا التجمع من الضامة المستقطبة المناعية غالبا ما يعتبر التبسيط، كما تنشيط الضامة والتمايز ليست خطية، ولكن يتضح بدقة أكبر كسلسلة متصلة حيث كل السكان لها خصائص مختلفة والأدوار الوظيفية في نتيجة تطور المرض والتقدم4،5،6،7. ومع ذلك، هناك العديد من المزايا التجريبية مع نموذج الماكروفاج M1/M2 التي يمكن استخدامها في العديد من مجالات البحث المختلفة.
يعتبر السل الميكوباتريا (Mtb) العامل المسبب للسل (TB) ويقدر أنه يصيب شخصا واحدا كل ثانية ويعتبر أكثر العوامل المعدية فتكا في العالم (تقرير السل العالمي 2019). وبما أن الجهاز التنفسي هو الطريق الرئيسي لعدوى Mtb ، فإن الضامة السنفية هي الخلايا المضيفة المفضلة للإصابة ب Mtb وتمثل كل من الحواجز الرئيسية والخزان المعدي ل Mtb في الرئتين. وقد درس الاستقطاب الضام استجابة لمختلف المحفزات على نطاق واسع على مدى السنوات7 وفي معظم الأعمال المنشورة، يتم تحريض الاستقطاب M1 من الثقافات monocyte في المختبر من قبل عامل تحفيز مستعمرة الحبيبية ماكروفيج (GM-CSF) جنبا إلى جنب مع IFN-γ وLPS8،9، في حين يتم تحريض الاستقطاب M2 مع عامل تحفيز مستعمرة الضامة (M-CSF) وIL-410،11. الضامة M1 هي خلايا فعالة فعالة تتوسط الاستجابات المضادة للميكروبات ضد مسببات الأمراض داخل الخلايا ولها دور أساسي في مناعة مضادة للورم12. من ناحية أخرى ، فإن الضامة M2 لها وظيفة مضادة للالتهابات ، وقدرة فاغوجية عالية وتشارك بشكل رئيسي في التئام الجروح وإصلاح الأنسجة وكذلك في التهابات الطفيليات12. وبناء على ذلك ، ينظر إلى الضامة M1 على أنها أكثر فعالية في التحكم داخل الخلايا في Mtb مقارنة مع الضامة M213. ومع ذلك ، فإن بكتيريا Mtb لديها أيضا القدرة على تعديل الاستقطاب الضام لتخريب المناعة الفطرية14و15و16و17.
في حين أنه من الشائع لتوليد الضامة من التمايز من monocytes التي تم الحصول عليها من الدم المحيطي18، الضامة يمكن أيضا أن تتولد من الخلايا الجذعية المستحثة متعددة القدرات (iPSCs)19 أو من الضامة المشتقة من نخاع العظم من الفئران20،21. هذه هي التقنيات الممكنة لدراسة خلايا الضامة الأولية التي تم الحصول عليها من السلف أحادية / الضامة التي سوف تتكاثر وتفرق إلى مجموعة متجانسة من الخلايا الناضجة الشبيهة بال الضامة. ومع ذلك، نادرا ما توفر هذه البروتوكولات معرفة معمقة حول النمط الظاهري ووظيفة الخلايا التي تم الحصول عليها ولا تفسر التغايرية الطبيعية الملاحظة بين الضامة التي تم الحصول عليها في الجسم الحي. وبما أن Mtb هو ممرض بشري صارم ، فهناك أيضا ميزة لدراسة Mtb في أنظمة النماذج الإنسانية. تدفق قياس الخلايا هي التكنولوجيا القوية التي توفر إمكانية لتقييم الخصائص الظاهرية والوظيفية متعددة من الخلايا المفردة في تعليق22، وهو الأمر الذي يمكن أن يكون تحديا إلى حد ما مع الخلايا الملتصقة مثل الضامة التي من المعروف أيضا أن autofluorescent23،24. بالإضافة إلى الانفصال الكيميائي لل الضامة الملتصقة بقوة ، قد تشكل عدوى Mtb عامل إجهاد كبير للخلايا يضيف مستوى آخر من التعقيد في التحليلات الخلوية التدفقية لل الضامة المصابة ب Mtb.
في هذا البروتوكول التجريبي، استخدمنا نموذج عدوى الضامة البشرية المنشأة سابقا على أساس الاستقطاب المناعي للخلايا الأولية المشتقة من الدم المحيطي الأحادي المصابة بسلالة MTB المختبرية الخبيثة H37Rv، وتحليلها باستخدام قياس التدفق الخلوي باستخدام لوحة من 10 ألوان بما في ذلك التعبير عن علامات M1 و M2 المختارة25. يوفر هذا البروتوكول طريقة فعالة وقابلة للاستنساخ لدراسة الاستجابات للعدوى Mtb في الضامة المستقطبة M1 أو M2 المشتقة من monocyte. بالإضافة إلى ذلك ، فإن استخدام قياس التدفق الخلوي على الضامة المصابة ب Mtb يسمح لنا بدراسة مجموعة متنوعة من العلامات السطحية المرتبطة بال الضامة التقليدية M1 و M2 واستجابتها الطولية لعدوى Mtb. والأهم من ذلك، يمكن بسهولة اعتماد هذا البروتوكول للتحقيقات في العدوى مع مسببات الأمراض الأخرى، في الدراسات المضادة للورم أو في دراسات الحالات الالتهابية، لفحص المخدرات وما إلى ذلك، ويمكن أيضا استغلالها لتقييم الاستقطاب الضام M1/M2 في العينات السريرية البشرية.
Protocol
تم الحصول على الدم المحيطي البشري من المتبرعين بالدم المجهولين الأصحاء من بنك الدم في مستشفى جامعة كارولينسكا، هودينغ، السويد (الموافقة الأخلاقية Dnr 2010/603-31/4). تم تنفيذ جميع الخطوات التجريبية التي تنطوي على Mtb الخبيثة الحية في مختبر السلامة البيولوجية من المستوى 3 (BSL-3) في وكالة الصحة العامة في السويد (FOHM)، سولنا، السويد.
1. إعداد وسائل الإعلام ، والمخازن المؤقتة ، والثقافات البكتيرية
ملاحظة: يتم توفير تفاصيل حول كافة الكواشف والمواد الاستهلاكية في جدول المواد.
- RPMI متوسطة كاملة: ملحق RPMI 1640 مع 1 mM الصوديوم بيروفات, 2 M L-الجلوتامين, 10 MM HEPES, و 10٪ الحرارة المعطل مصل البقر الجنين (FBS). تجنب المضادات الحيوية في وسط زراعة الخلايا عند العمل مع عدوى Mtb.
- RPMI المتوسط الخالي من المصل: الملحق RPMI 1640 مع 1 mM بيروفات الصوديوم، 2 M L-الجلوتامين و 10 M HEPES.
- غسل العازلة: إعداد الفوسفات العازلة المالحة (PBS) التي تحتوي على 0.05٪ (v/v) توين-80.
- FACS العازلة: إعداد برنامج تلفزيوني يحتوي على 2.5٪ (v/v) FBS و 0.5 mM EDTA.
- تثبيت العازلة: إعداد برنامج تلفزيوني يحتوي على 4٪ الفورمالديهايد لبرنامج تلفزيوني. تأكد من إعداده طازجا قبل الاستخدام ، على سبيل المثال ، مختلطا من محلول مخزون من الفورمالديهايد بنسبة 37٪.
- Permeabilization العازلة: إضافة 0.1٪ سيترات الصوديوم و 0.1٪ تريتون X-100 إلى المياه deionized.
- غسل العازلة (لfluorescence المناعي): إعداد برنامج تلفزيوني يحتوي على 0.1٪ BSA و 0.1٪ توين-20.
- حظر العازلة: إعداد برنامج تلفزيوني يحتوي على 0.1٪ BSA و 10٪ مصل الماعز العادي (NGS) لبرنامج تلفزيوني.
- تلطيخ العازلة (لfluorescence المناعي): إعداد برنامج تلفزيوني يحتوي على 0.1٪ BSA إلى برنامج تلفزيوني.
- السل المتوسط الكامل: تكملة ميدل بروك 7H9 مرق مع 0.05٪ (v/v) توين-80، 0.5٪ (v/v) الجلسرين، كاناميسين (20 ميكروغرام / مل)، 10٪ (v/v) حمض الأوليك ميدلبروك، الألبومين، دكستروز وتخصيب الكاتالاس (ميدلبروك الزراعة العضوية في التخصيب).
- الثقافات البكتيرية: استخدم سلالة مختبر Mtb الخبيثة القياسية ، H37Rv ، التي تعبر بشكل أساسي عن البروتين الفلوري الأخضر (GFP) ، لعدوى الخلايا المشتقة من الخلايا الأحادية. تحمل سلالة Mtb هذه بلازميد pFPV2 يحتوي على ترميز جيني GFP ، بالإضافة إلى جين لمقاومة الكاناميسين. المقاومة للمضادات الحيوية تمكن من الاختيار المستمر للبكتيريا البلازميد التعبير في الثقافات التي تحتوي على kanamycin. تخزين البكتيريا في السل المتوسطة كاملة و 70٪ الجلسرين (1:1 تخفيف) في -80 درجة مئوية.
2. عزل خلايا الدم المحيطي أحادية النووية من المعاطف بافي
ملاحظة: تنفيذ جميع الأعمال مع الدم البشري (يحتمل أن تكون معدية) داخل خزانة السلامة البيولوجية من الدرجة الثانية. تعطيل منتجات الدم المتبقية مع المطهرات لمدة 15 دقيقة قبل التخلص منها. تم الحصول على الدم من المتطوعين الأصحاء في هذه الحالة. وقد أنشئ هذا البروتوكول المتمايز في المختبر الكلي ليشمل 10 × 106 مركبات ثنائية الفينيل متعددة البروم المعزولة/المانحة/البئر. من كل متبرع، معطف واحد برتقالي يحتوي على حوالي 50 مل من تعليق الكريات البيض المركزة التي تنشأ من الدم كله، والذي يوفر عادة 500-800 × 106 PBMCs التي يمكن استرداد ما يقرب من 10٪ أو 50-80 × 106 الخلايا الأحادية.
- تحميل 15 مل من الدم معطف بافي على رأس 15 مل من متوسطة الانحدار الكثافة المعدة في أنبوب 50 مل. تراكب الدم ببطء على رأس طبقة الانحدار الكثافة عن طريق يميل طرف ماصة إلى جدار الأنبوب.
- تدور الأنابيب في 600 × ز لمدة 25 دقيقة في درجة حرارة الغرفة (RT) مع تسارع 0 و 0 تباطؤ.
ملاحظة: أغلق الأغطية بعناية قبل الطرد المركزي وتحقق دائما من حاملات الأنبوب بحثا عن احتمال تسربها بعد الطرد المركزي. - إزالة طبقة البلازما العليا مع ماصة باستور معقمة وبعد ذلك جمع بعناية طبقة الخلية أحادية النووية في أنبوب جديد 50 مل باستخدام ماصة باستور معقمة. إضافة مصل خالية من RPMI المتوسطة إلى بيليه PBMC للحصول على حجم النهائي من 50 مل. اخلط بعناية عن طريق قلب الأنبوب عدة مرات قبل الطرد المركزي عند 500 × ز لمدة 5 دقائق في RT.
- تجاهل supernatant بعناية وإعادة إنفاق بيليه الخلية عن طريق التقليب الجزء السفلي من الأنبوب داخل الأصابع.
- لإزالة التلوث المتوسط الانحدار الكثافة من PBMCs، وغسل الخلايا 2-3 مرات مع RPMI خالية من المصل للحصول على حجم النهائي من 50 مل. جهاز الطرد المركزي في 500 × ز لمدة 5 دقائق في RT. غسل حتى يصبح supernatant الخلية شفافة.
- تجاهل supernatant وإعادة إنفاق الخلايا في 20 مل من المتوسط RPMI خالية من المصل.
- عد الخلايا عن طريق تلطيخ الأزرق تريبان، يدويا باستخدام مقياس الدم أو باستخدام عداد الخلية الآلي. تمييع تعليق الخلية في تريبان الأزرق في 1:2 أو 1:10 التخفيف عن طريق خلط عينة زرقاء خلية تريبان في لوحة بئر 96 على سبيل المثال، 50 ميكرولتر + 50 ميكرولتر (لعد مقياس الدم) أو 10 ميكرولتر + 10 ميكرولتر (لعد الخلايا الآلي) وعد الخلايا للحصول على عدد من الخلايا الحية / مل.
تنبيه: تريبان الأزرق سام ويجب التخلص منه في نفايات كيميائية منفصلة.
3. التمايز والاستقطاب من الخلايا المشتقة من monocyte
ملاحظة: للتمايز والاستقطاب من الخلايا المشتقة من monocyte، تم اتباع بروتوكول التي أنشأناها سابقا للخلايا M0، M1 مثل و M2 مثل وكذلك تماما M1 و M2 الخلايا المستقطبة25. للبساطة ، يتم وصف الضامة M1 و M2 المستقطبة بالكامل فقط هنا.
- استخدام الالتزام البلاستيك لعزل الخلايا الأحادية. باختصار، البذور PBMCs معزولة حديثا في لوحة ثقافة 6-جيدا في تركيز مناسب، على سبيل المثال، 10 × 106 PBMCs/ جيدا في 2 مل خالية من مصل RPMI المتوسطة واحتضان في 37 درجة مئوية و 5٪ CO2.
- بعد 2-3 ساعة، وإزالة الخلايا غير الملتصقة مع ماصة وغسل الآبار 3 مرات مع 1 مل وسيط خال من المصل. الخلايا المرفقة هي monocytes وتتألف من حوالي 10 ٪ من إجمالي PBMCs المضافة إلى البئر ، أي 106 monocytes استردادها من 10 × 106 PBMCs المضافة لكل بئر.
- لتمايز الضامة، قم بإعداد حل عمل يحتوي على 50 نانوغرام/مل GM-CSF أو M-CSF للاستقطاب الضام M1 و M2 على التوالي، مضافا في 2 مل من متوسط RPMI الكامل لكل بئر. زراعة الخلايا في حاضنة ثاني أكسيد الكربون5٪ في 37 درجة مئوية لمدة 3 أيام.
- في اليوم 3, إزالة 1 مل من خلية الثقافة المتوسطة بعناية من الطبقة العليا من كل بئر وتكملة الثقافات الخلية مع 1 مل من RPMI جديدة متوسطة كاملة تحتوي على تركيز مزدوج من M-CSF أو GM-CSF للحصول على 50 نانوغرام / مل التركيز النهائي في الآبار. إضافة عوامل النمو في حل العمل مسبقة الصنع من 100 نانوغرام / مل / جيدا.
- في اليوم 6، إضافة محفزات مختلفة لآخر 18-20 ساعة من تمايز الخلايا للحصول على M1 المستقطبة تماما وناضجة (إنترفيرون-γ؛ IFN-γ، والدهون الدهنية؛ LPS (E. coli O55:B5)) أو M2 (إنترلوكين 4؛ الضامة IL-4. بالنسبة للاستقطاب M1، قم بإعداد IFN-γ وLPS في RPMI متوسطة كاملة وإضافة 50 ميكرولتر لكل بئر للحصول على تركيز نهائي قدره 50 نانوغرام/مل IFN-γ و10 نانوغرام/مل ليرة لبنانية في ثقافات الخلايا. للاستقطاب M2، وإعداد IL-4 في RPMI المتوسطة كاملة وإضافة 50 ميكرولتر لكل بئر للحصول على تركيز نهائي من 20 نانوغرام / مل في ثقافات الخلية.
- لتمايز الضامة المستقطبة M0، وتحفيز الخلايا مع M-CSF فقط، دون أي السيتوكينات إضافية (توفير النمط الظاهري M2 مثل)25.
- تحقق من مورفولوجيا ثقافات الخلايا المشتقة من الخلايا الأحادية بانتظام باستخدام المجهر الخفيف لضمان تمييز الخلايا الأحادية الأصغر إلى خلايا أكبر تشبه الضامة. أيضا، رصد الاختلافات المورفولوجية المحتملة بين الاستقطاب M1 و M2، أي الخلايا M1 ممدود وامتدت مقارنة مع خلايا M2 مع شكل أكثر استدارة25.
- في اليوم 7، نقل لوحات مع الخلايا المشتقة من monocyte إلى مختبر BSL-3 للعدوى مع Mtb خبيثة.
4. إعداد ثقافات Mtb
ملاحظة: يجب تنفيذ الخطوات التالية في مرفق BSL-3. لجميع الأعمال مع Mtb خبيثة، واستخدام الملابس الواقية، وحماية الجهاز التنفسي، والقفازات المقاومة للإيثانول.
- تذوب قارورة مع 1 مل من اليكوت البكتيرية وتخلط مع 9 مل من السل المتوسطة كاملة (1:10 التخفيف) في أنبوب غطاء 50 مل تصفيتها. الثقافة تعليق في حاضنة في 37 درجة مئوية و 5٪ CO2.
- بعد 24 ساعة، تدور تعليق البكتيرية في 2300 × ز لمدة 10 دقيقة وتصب بعناية قبالة المتوسطة. Resuspend بيليه البكتيرية مع 15-20 مل من السل الطازج المتوسطة كاملة في أنبوب جديد 50 مل زراعة الغطاء المصفاة واحتضان في 37 درجة مئوية و 5٪ CO2. اخلط البكتيريا المستقرة في الأنبوب كل يومين إلى ثلاثة أيام للحفاظ على إمدادات غذائية متجانسة لجميع الخلايا البكتيرية.
- بعد 7-10 أيام، اخلطي التعليق البكتيري بشكل صحيح عن طريق الأنابيب صعودا وهبوطا قبل نقله إلى أنبوب غطاء المسمار سعة 50 مل.
- إضافة 35-40 مل من العازلة غسل معقمة إلى أنبوب 50 مل وتدور تعليق البكتيرية في 2,300 x غرام لمدة 10 دقيقة. كرر خطوات الغسيل مرة واحدة. Resuspend بيليه البكتيرية في 1 مل من مصل خالية من RPMI المتوسطة عن طريق الأنابيب مع micropipette.
- إضافة 9 مل أخرى من RPMI المتوسطة الخالية من المصل و sonicate تعليق البكتيرية داخل خزانة السلامة البيولوجية من الدرجة الثانية لمدة 5 دقائق في 37 درجة مئوية، لتعطيل الكتل البكتيرية. تراجع أنبوب مرارا وتكرارا (3-4 مرات) في sonicator حمام المياه لضمان أقصى قدر من الاضطراب من الكتل البكتيرية. قياس الكثافة البصرية (OD) من 1 مل من التعليق البكتيري في الطول الموجي 600 نانومتر باستخدام مطياف وضعت داخل خزانة السلامة البيولوجية. استخدام مصل خالية من RPMI المتوسطة لتعيين المرجع.
- حساب عدد وحدات تشكيل المستعمرة (CFU) باستخدام الصيغة: (OD +0.155)/0.161 = Y، و Y x 107= Y x 106 CFU/mL، على سبيل المثال، توفر قيمة OD 0.32 تركيز بكتيري (0.32 + 0.155)/0.161 = 2.95، 2.95 × 107= 29.5 × 106 CFU/mL.
5. عدوى Mtb من الخلايا المشتقة من monocyte
ملاحظة: يجب تنفيذ الخطوات التالية في مرفق BSL-3.
- Resuspend بيليه البكتيرية في المتوسط RPMI خالية من المصل في أنبوب جديد معقم 50 مل وضبط التركيز البكتيري النهائي إلى ما يقرب من 5 × 106 CFU / مل.
- قم بإزالة وسيطة ثقافة الخلية من لوحة (لوحات) البئر 6 التي تحتوي على خلايا مشتقة من أحادية الخلية. أضف 1 مل من وسيط RPMI الخالي من المصل إلى كل بئر. إضافة 1 مل من التعليق البكتيري لكل بئر للحصول على تعدد العدوى (MOI) 5:1، أي 5 × 106 CFU لكل 106 الضامة في 2 مل / جيدا واحتضان لوحات لمدة 4 ساعة في 37 درجة مئوية و 5٪CO2.
- بعد الإصابة، اغسل الخلايا 3 مرات مع 1 مل من عازل الغسيل المعقم لإزالة البكتيريا خارج الخلية. إمالة لوحة وإزالة بعناية المخزن المؤقت غسل كامل من الزوايا. Resuspend الخلايا المشتقة من الخلايا الأحادية المصابة Mtb في 2 مل من RPMI المتوسطة كاملة دون المضادات الحيوية والمضي قدما في تدفق تلطيخ قياس الخلايا أو احتضان الخلايا لمدة 24 ساعة أخرى (أو غيرها من النقاط الزمنية) قبل تدفق قياس الخلايا.
6. تدفق تلطيخ قياس الخلايا من الخلايا المشتقة من الخلايا الأحادية المصابة Mtb
ملاحظة: يجب تنفيذ الخطوات التالية في مرفق BSL-3. يمكن إجراء تلطيخ قياس التدفق الخلوي في لوحة من 96 بئرا بدلا من الأنابيب.
- فصل الخلايا المصابة Mtb (والضوابط غير المصابة) من الآبار في 6 لوحة بئر (ق) عن طريق الحضانة مع 1 مل من العازلة FACS لكل بئر لمدة 30 دقيقة على الأقل في 37 درجة مئوية و 5٪ CO2.
- ماصة بلطف صعودا وهبوطا عدة مرات لضمان فصل الخلايا. إذا كان ذلك ممكنا، تأكد من انفصال الخلية بالمنظار المجهري. نقل تعليق الخلية من كل بئر إلى أنبوب الطرد الدقيق المسمار توج وتدور الأنابيب في 200 × ز لمدة 5 دقائق. تجاهل supernatant بعناية عن طريق pipetting.
- غسل بيليه الخلية في كل أنبوب مرتين مع FACS العازلة وتدور الخلايا في 200 × ز لمدة 5 دقائق.
- وصمة عار الخلايا (حوالي 0.5 × 106 إلى 1 × 106 خلايا / أنبوب) مع ما يقرب من 50 ميكرولتر كوكتيل من الأجسام المضادة للفلوروشروم المقترنة بما في ذلك TLR2 (AF647)، CD206 (APC-Cy7)، CD163 (BV605)، CD80 (BV650)، CCR7 (BV711)، CD86 (BV786)، CD200R (PE)، CD64 (PE-Dazzle 594)، HLA-DR (PE-Cy5) (الجدول 1)بالاقتران مع صبغة القابلية للحياة Zombie-UV لمدة 30 دقيقة عند 4 درجات مئوية (الثلاجة) في الظلام.
- غسل الخلايا الملطخة مرتين مع 400 ميكرولتر من العازلة FACS وتدور الخلايا في 200 × ز لمدة 5 دقائق.
- إصلاح الخلايا الملطخة مع 200 ميكرولتر من العازلة التثبيت (أعدت حديثا) لمدة 30 دقيقة في RT في الظلام لضمان تعطيل كامل من البكتيريا الفطرية.
- غسل الخلايا مرتين مع 400 ميكرولتر من العازلة FACS وتدور في 200 × ز لمدة 5 دقائق لإزالة الزائدة إصلاح العازلة.
- إعادة تشغيل الخلايا الثابتة في 400 ميكرولتر من العازلة FACS ونقل العينات إلى أنابيب جديدة 1 مل الطرد المركزي الدقيق قبل إخراجها من مختبر BSL-3 لقياس التدفق الخلوي في BSL-2. تخزين الخلايا الملطخة في +4 درجة مئوية حتى الحصول على عينة.
ملاحظة: رش الأنابيب بالإيثانول بنسبة 70٪ قبل إخراجها من مختبر BSL-3. الفورمالديهايد سام (مسرطن) ويجب التعامل معه في خزانة السلامة البيولوجية من الدرجة الثانية. تخلص من نفايات الفورمالديهايد في نفايات كيميائية منفصلة.
7. تدفق الحصول على البيانات الخلوية وتحليل الخلايا المشتقة من الخلايا الأحادية المصابة Mtb
ملاحظة: يجب تنفيذ الخطوات 7.1-7.2 قبل تلطيخ قياس التدفق الخلوي الموضح أعلاه. لتجنب المشاكل مع تكتل الخلايا وتفكك الأصباغ جنبا إلى جنب بعد تثبيت الخلية، يتم إجراء الحصول على عينة من كل من الخلايا المصابة Mtb وغير المصابة في غضون 4-10 ساعة بعد تلطيخ الأجسام المضادة الأولية.
- قبل تدفق تلطيخ قياس الخلايا المذكورة أعلاه، تعويض إشارة الفلورسنت لكل الأجسام المضادة المترافقة مع الفلوروشروم المدرجة في لوحةتلطيخ (الجدول 1)باستخدام حبات التعويض (الإيجابية والسلبية على حد سواء).
- تمييع تمييع الجسم المضاد لتلطيخ الضامة البشرية للحصول على الإشارة المثلى لكل فلوروشروم.
- استخدام الخلايا غير الملطخة لتحديد مستوى مضان الخلفية اللازمة لتعيين بوابة للسكان الخلية السلبية مما يسمح للخلايا الملطخة أن يتصور (الضامة هي الفلورسنت السيارات للغاية).
- الحصول على ما لا يقل عن 50،000 الخلايا / عينة في تدفق cytometer باستخدام البرنامج الموصى به للحصول على البيانات.
- تصدير ملفات الاستحواذ من مقياس التدفق الخلوي في تنسيق قياس التدفق الخلوي (FCS) 3.1.
- تحليل ملفات FCS في تدفق برنامج تحليل قياس الخلايا.
- الضامة البوابة وفقا للأمام والجانب مبعثر (FSC وSSC) خصائص واستبعاد الخلايا الميتة عن طريق العيش / الخلية الميتة gating باستخدام صبغة قابلية البقاء غيبوبة الأشعة فوق البنفسجية.
- تصور الضامة H37Rv-GFP المصابة في قناة FITC.
- تحديد وتيرة الخلايا الملطخة إيجابيا وكثافة الفلورسينس المتوسط الهندسية (MFI) لجميع العلامات(الجدول 1).
8. تلطيخ immunofluorescence من الخلايا المشتقة من الخلايا الأحادية المصابة Mtb
ملاحظة: يجب إجراء عدوى Mtb في منشأة BSL-3.
- للحصول على المناعة، والبذور 2 × 105 PBMCs / جيدا في 500 ميكرولتر من المتوسط RPMI خالية من المصل في 8 شرائح غرفة جيدا للحصول على 2 × 104 monocytes / جيدا. بعد التمايز والاستقطاب M1/M2 من monocytes، والمضي قدما مع عدوى Mtb كما هو موضح أعلاه. إصلاح الشرائح بعد 24 ساعة من العدوى Mtb مع تثبيت العازلة لمدة 30 دقيقة. يتم تخزين الشرائح الثابتة في الثلاجة عند -20 درجة مئوية حتى مزيد من التحليلات.
- غسل الخلايا المشتقة من monocyte مرتين مع 200 ميكرولتر من برنامج تلفزيوني لمدة 10 دقيقة لكل منهما.
- Permeabilize الخلايا مع 200 ميكرولتر من المخزن المؤقت permeabilization لمدة 5 دقائق في RT.
- غسل الخلايا 3 مرات مع 200 ميكرولتر من برنامج تلفزيوني لمدة 5 دقائق لكل منهما.
- غسل الخلايا مرتين مع 200 ميكرولتر من العازلة غسل لمدة 5 دقائق لكل منهما.
- كتلة ملزمة غير محددة مع 200 ميكرولتر من العازلة حظر لمدة 30 دقيقة في RT.
- تمييع الأجسام المضادة الأولية 1:100 في العازلة تلطيخ واحتضان الخلايا M1 مع الأجسام المضادة CD64 غير مترافق (استنساخ: 10.1) والخلايا M2 مع الأجسام المضادة CD163 غير مترافق (متعدد النسيلة) لمدة 2 ساعة في RT.
- بعد ذلك ، اغسل الخلايا 3 مرات مع 200 ميكرولتر من مخزن الغسيل لمدة 10 دقائق لكل منها.
- تمييع الفلورسنت المسمى الأجسام المضادة الثانوية 1:1,000 في العازلة تلطيخ واحتضان الخلايا M1 مع IgG-Alexa فلور المضادة للفأرة 594 والخلايا M2 مع IgG-Alexa فلور المضادة للأرنب 594 لمدة 1 ساعة في RT.
- غسل الخلايا 3 مرات مع 200 ميكرولتر غسل العازلة لمدة 10 دقيقة لكل منهما.
- إزالة شبكة الغرفة وإضافة ~ 20 ميكرولتر من DAPI تصاعد المتوسطة في كل بئر ووضع 1.5 ملم coverslip على كل شريحة.
- ختم غطاء مع طبقة من طلاء الأظافر.
- الحصول على الصور باستخدام المجهر confocal مع الليزر تنبعث منها في 486 نانومتر لإثارة GFP (القناة الخضراء)، 402 نانومتر لDAPI (الأزرق) و 560 نانومتر للأجسام المضادة الثانوية (الأحمر) على التوالي.
النتائج
يتم عرض رسم تخطيطي لتحفيز السيتوكين المستخدم في استقطاب الخلايا المشتقة من الخلايا الأحادية إلى M0 (خلايا تشبه M2) و M1 (خلايا M1 المستقطبة بالكامل) و M2 (خلايا M2 المستقطبة بالكامل) في الشكل 1A، في حين يتم عرض الصور التمثيلية لثقافات الخلية M0 و M1 و M2 وكذلك ثقافات M1 في اليوم 0 و 3 و 7 ، في الشكل 1B. واستخدمت خلايا M0 غير المصابة لإظهار استراتيجية الغاتينغ الأساسية(الشكل 2A). في البداية ، والخلايا النخاعية (~ 85 ٪) كانت مسور وفقا لخصائصها المتناثرة الأمامية (FSC) وخصائص التشتت الجانبي (SSC) بما في ذلك الخلايا الأكبر ذات الحبيبية العالية واستبعاد الحطام الصغير الحجم مع SSC و FSC المنخفضين الموجودين في الزاوية اليسرى السفلية من مؤامرة النقطة. وفي المؤامرة الثانية، تم تعريف المزدوجات (أي كتل الخلايا) على أنها ذات مساحة متزايدة ولكن ارتفاع مماثل مقارنة بالخلايا المفردة وتم استبعادها من مزيد من التحليل. لذلك، تم تضمين الخلايا المتناسبة فقط بين FSC-Area و FSC-Height (خلايا مفردة) داخل بوابة الشكل المائلة. بعد ذلك ، تم استخدام صبغة قابلية غيبوبة الأشعة فوق البنفسجية التي تلطخ البروتينات السيتوبلازمية داخل الخلايا الميتة ، لاستبعاد الخلايا الميتة من التحليل اللاحق. كما هو متوقع، كانت خلايا M0 غير المصابة القابلة للتطبيق سلبية لتعبير Mtb-GFP الذي تم تصوره في قناة FITC.
بعد ذلك ، طبقنا نفس استراتيجية التنغيش على الضامة M1 و M2 غير المصابة وكذلك Mtb المصابة في 4 ساعات بعد العدوى (الشكل 2B ، C). تم الكشف عن مجموعتين فرعيتين في بوابة FCS/SSC لل الضامة المستقطبة M1 غير المصابة؛ سكان واحد مع حجم أصغر (FCS) وأعلى الحبيبية (SSC) والسكان الآخرين مع حجم أكبر والحبيبة أقل (الشكل 2B)، في حين أن البوابة الرئيسية للخلايا M2 غير المصابة يبدو أكثر تجانسا (الشكل 2C). كل من M1 و M2 الخلايا المشتق منها monocyte عرض تحول عمودي إلى الحبيبية أعلى وانخفاض حجم الخلية على عدوى Mtb, والتي قد تعكس زيادة التعقيد داخل الخلايا الناجمة عن امتصاص البكتيريا Mtb داخل الخلايا (الشكل 2B, C). وعلاوة على ذلك، كشفت بقعة الجدوى عن موت خلايا معزز (17-22٪) بين خلايا M1 و M2 المصابة ب Mtb في وزارة الداخلية من 5، مقارنة بالخلايا M0 غير المصابة (99٪) (الشكل2A-C)أو خلايا M1 و M2 غير المصابة (البيانات غير مبينة). وأظهرت البيانات التمثيلية أن التعبير MTB-GFP (أي العدوى Mtb) كان أعلى بكثير في M2 (77٪ الخلايا الإيجابية GFP) مقارنة مع M1 (19٪ الخلايا الإيجابية GFP) بعد 4 ساعات من العدوى(الشكل 2B، C). بعد 24 ساعة من العدوى، كان تعبير Mtb-GFP 43٪ و 85٪ في خلايا M1 و M2 على التوالي، مما يشير إلى أن خلايا M1 كان لديها زيادة أعلى نسبيا في التعبير عن GFP من 4-24 ساعة بعد عدوى Mtb مقارنة بخلايا M2، 126٪ مقابل 10.4٪ زيادة في التعبير عن GFP في خلايا M1 و M2 من 4-24 ساعة على التوالي.
لتوصيف فعالية الاستقطاب M1/M2 في الخلايا غير المصابة المشتقة من الخلايا الأحادية، تم استخدام مؤامرات النقطة لتحديد خلايا M1 التي كانت إيجابية مزدوجة لCD64 و CD86 (CD64+CD86+ )وخلايا M2 التي كانت إيجابية مزدوجة لCD163 و CD200R (CD163+CD200R+؛ الشكل 3ألف وباء). تم اختيار علامات M1/M2 في المقام الأول بناء على نتائج عملنا السابق25 ولكن أيضا من دراسات أخرى26،27،28،29. تم تعيين أرباع للخلايا الملطخة ، وذلك باستخدام بوابات المقابلة للخلايا M1 / M2 غير ملطخة (الشكل 3A). لا يتم التعبير عن أي من هذه العلامات حصريا بواسطة خلايا M1 أو M2 ، ولكن نسبة الخلايا الإيجابية بالإضافة إلى كثافة التعبير السطحي مختلفة. وكان هذا واضحا بشكل خاص من وصمة عار M1 حيث كان حوالي 95٪ من خلايا M1 و 79٪ من خلايا M2 CD64+CD86+، ولكن كثافة التلطيخ كانت أعلى بكثير في المجموعة الفرعية M1 (الشكل 3A). في حين أن 27٪ من خلايا M1 كانت إيجابية لCD200R علامة M2، فقط 1٪ كانت إيجابية لCD163، وتوفير 0.5٪ CD163+CD200R+ M1 الخلايا مقارنة مع 63٪ CD163+CD200R+ M2 الخلايا (الشكل 3A). بعد 4 ساعات من العدوى Mtb، لوحظت زيادة في وتيرة CD200R+ الخلايا في MTB-GFP إيجابية M1 الخلايا المستقطبة (16٪)، في حين تم تخفيض CD163-التعبير في خلايا M2(الشكل 3B). توضح الخريطة الحرارية كثافة عالية من التعبير GFP في CD163+CD200R+ M2 الخلايا، ولكن أيضا في CD64+CD86+ M2 فرعية بالمقارنة مع المجموعات الفرعية الخلايا M1 المقابلة (الشكل 3B). بشكل عام، يتم أيضا تصور التحول في التعبير عن علامات M1 و M2 المعنية في المدرجات التكرارية في الشكل 3C. وعلاوة على ذلك، تم تصور البكتيريا MTB-GFP أيضا في خلايا CD64+ M1 وفي خلايا CD163+ M2 عن طريق المجهر confocal، والتي دعمت امتصاص داخل الخلايا المعززة و / أو نمو Mtb داخل M2 بالمقارنة مع الخلايا M1(الشكل 3D).
للتحقق من نتائج gating دليل، قمنا بتطبيق الحد من الأبعاد باستخدام تقريب موحد متعددة وإسقاط (UMAP). أظهر تحليل UMAP أن عدوى Mtb لمدة 4 ساعات لم تكن كافية للتأثير على استقطاب الضامة ، على النقيض من 24 ساعة من العدوى ، مما أدى إلى مجموعات منفصلة بوضوح من M1 و M2 الخلايا غير المصابة والمصابة (الشكل 4A). عرضت الضامة M1 غير المصابة تعبيرا أعلى عن CD64 و CD86 و TLR2 و HLA-DR و CCR7 مقارنة بال الضامة M2 ، في حين أظهرت خلايا M2 غير المصابة تنظيما قويا للعلامات الظاهرية M2 CD163 و CD200R و CD206 و CD80 (الشكل 4B ، C). بالاتفاق مع gating اليدوي ، تسببت عدوى Mtb بعد 24 ساعة في انخفاض واضح في CD163 و CD200R و CD206 على خلايا M2 و upregulation من CD86 و HLA-DR على خلايا M1 (الشكل 4B ، C) ، مما يشير إلى أن Mtb يمكن تعديل الاستقطاب الضام. تحليل phenograph اللاحقة (الشكل 4D-F) حددت 24 مجموعات مختلفة من مختلف الأحجام التي تم توزيعها بشكل فريد بين M1 و M2 الخلايا غير المصابة وMTB المصابة كما هو موضح في الرسوم البيانية UMAP (الشكل 4D), الرسوم البيانية الدائرية (الشكل 4E) والخرائط الحرارية (الشكل 4F). وإجمالا، تظهر هذه النتائج كفاءة واعدة لهذا البروتوكول لتوليد خلايا مستقطبة M1 و M2 متنوعة وظيفيا ووظيفيا في المختبر يتم تحويرها بشكل أكبر بعدوى Mtb.
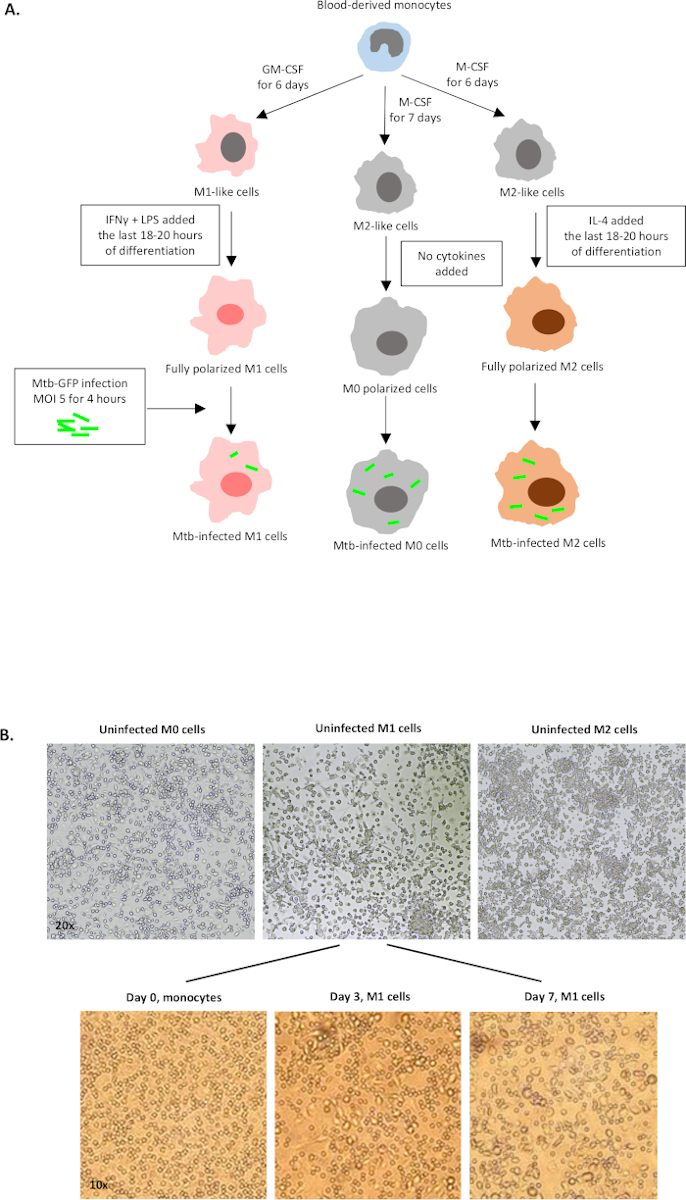
الشكل 1: رسم تخطيطي للتمايز والاستقطاب في المختبر للخلايا المشتقة من النخاع البشري. (أ)يتم تصوير M0 (M2-مثل) و M1 (تنشيط كلاسيكي) و M2 (تنشيط بدلا من ذلك) الخلايا. تم استقطاب Monocytes التي تم الحصول عليها من المتبرعين بالدم الأصحاء مع السيتوكينات المختلفة كما هو موضح في البروتوكول والمصابين بسلالة Mtb المسماة GFP ، H37Rv ، لمدة 4 ساعات قبل التحليل مع قياس الخلايا التدفقي من 10 ألوان. تحتوي الخلايا المستقطبة M1 عادة على عدد أقل من البكتيريا مقارنة بالخلايا المستقطبة M2. (ب)صور مجهرية لخلايا M0 و M1 و M2 المستقطبة بالكامل وغير المصابة في لوحات 6-well في اليوم 7 ، والصور التمثيلية لتمايز الخلية M1 عن الخلايا الأحادية في اليوم 0 و 3 و 7. التكبير هو 20x (اللوحة العليا) و 10x (اللوحة السفلى). لاحظ أن خلايا M1 أكثر استطالة وتمددا مقارنة بخلايا M0 و M2 الأكثر استدارة (اللوحة العلوية). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
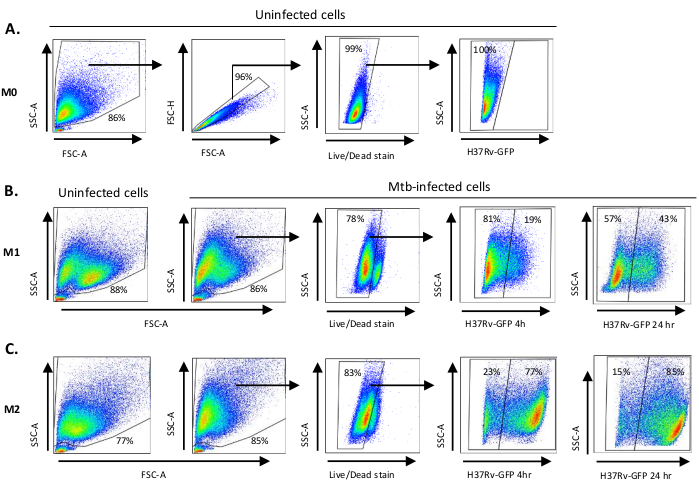
الشكل 2: Gating استراتيجية الاستقطاب التفاضلي الخلايا المشتقة من النخاع. رسم نقطة تمثيلية تظهر (A) مبعثر أمامي (FSC) وخصائص مبعثر جانبي (SSC) لوحدات الماكرو M0 غير المصابة. تظهر مؤامرة FSC-A/FSC-H اللغات اليدوية للخلايا المفردة المتناسبة مع المساحة والارتفاع. استثنت بوابة الخلية الحية الخلايا التي كانت إيجابية ل Zombie-UV (صبغة الجدوى). تم الكشف عن Mtb داخل الخلية عن طريق التعبير GFP في الخلايا الحية لوحظ في قناة FITC. (ب) جاتينج من M1 و (C) M2 الضامة تظهر FCS / SSC نقطة المؤامرات من كل من الخلايا غير المصابة والخلايا المصابة Mtb 4 ح و 24 ساعة بعد العدوى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: فعالية بروتوكول الاستقطاب M1/M2 في المختبر. مؤامرات نقطة تمثيلية وgating رباعية تظهر ترددات فرعية من M1- و M2 المستقطبة الخلايا باستخدام CD64 و CD86 (M1) أو CD163 و CD200R (M2) في (أ) غير ملطخة وملطخة الخلايا غير المصابة و (ب) الخلايا الملطخة Mtb المصابة 4 ساعة بعد العدوى. توضح المؤامرات النقطية في (B) شدة الفلورسينس للتعبير GFP (خريطة الحرارة) في الضامة المستقطبة M1 و M2 التي تم الحصول عليها من بوابات فرعية مختلفة. (ج)يظهر المتوسط الهندسي لشدة الفلورسينس (MFI) في المدرجات التكرارية من متبرع تمثيلي واحد بعد 4 ح من عدوى Mtb. يتم عرض قيم MFI في M1 غير المصابة (الأزرق الفاتح) وخلايا M2 (الأرجواني الفاتح) في اللوحة العلوية ويتم عرض M1 المصابة MTB (الأزرق العميق) وخلايا M2 (الأرجواني العميق) في اللوحة السفلية. (د)يتم عرض صور تمثيلية confocal من الخلايا غير المصابة والمصابة MTB M1- و M2 المستقطبة. كانت خلايا M1 و M2 ملطخة بتعبير CD64 و CD163 ، على التوالي ، باستخدام الفلورة المناعية. يظهر تلطيخ السطح الإيجابي باللون الأحمر وتظهر البكتيريا داخل الخلايا المعبرة عن GFP باللون الأخضر. تظهر النوى الملطخة ب DAPI باللون الأزرق. المقياس – 10 ميكرومتر. تكبير الصور إلى اليمين هو 350x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
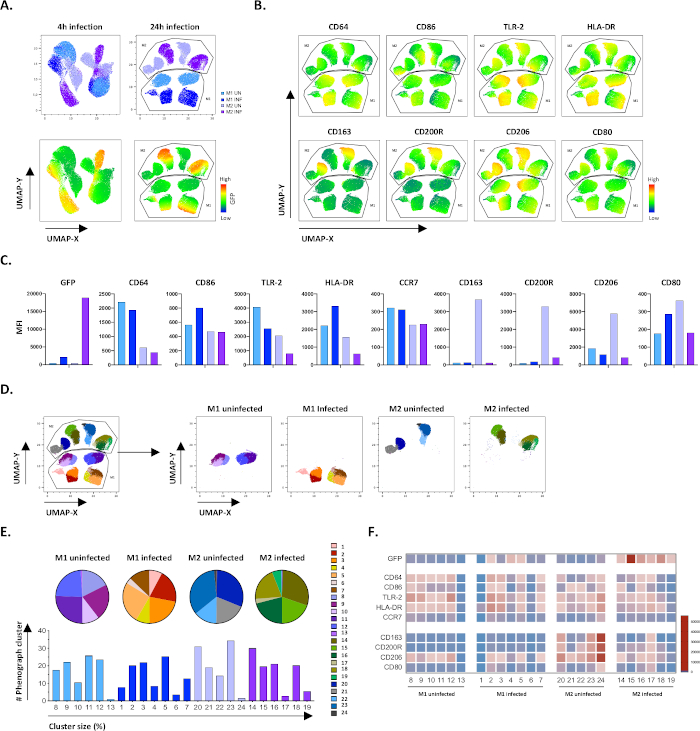
الشكل 4: الحد من الأبعاد مع تقريب وإسقاط متعدد الجوانب (UMAP) وتحليل phenograph للخلايا M1 و M2 غير المصابة والمصابة ب Mtb. (أ)UMAP، التي تم إنشاؤها عن طريق تسلسل 11000 الخلايا الحية من غير المصابة و MTB المصابة M1 و M2 الثقافات الخلية من اثنين من المتبرعين بالدم ممثل، 4 ح (الرسوم البيانية اليسرى) أو 24 ساعة (الرسوم البيانية اليمنى) بعد العدوى. تشير خريطة الحرارة لتعبير GFP (اللوحة السفلية) إلى الخلايا غير المصابة والمصابة ب Mtb. (B-C) MFI من علامات أعرب في M1 غير المصابة و MTB المصابة و M2 الخلايا 24 ساعة بعد العدوى، كما هو مبين(ب)خريطة الحرارة أو (C) شريط المؤامرات. (D-F) حدد تحليل Phenograph 24 مجموعة موزعة بشكل مختلف بين ثقافات M1 و M2 غير المصابة والمصابة ب Mtb. المجموعات 8-13 فريدة من نوعها في خلايا M1 غير المصابة ، والتجمعات 1-7 فريدة من نوعها في خلايا M1 المصابة ب Mtb ، والتجمعات 20-24 فريدة من نوعها في خلايا M2 غير المصابة والتجمعات 14-19 فريدة من نوعها في خلايا M2 المصابة ب Mtb. يظهر MFI لكل علامة في كل مجموعة فينوغرافية في (F). يتم تقديم البيانات على أنها خلايا M1 غير مصابة (أزرق فاتح) و M2 (أرجواني فاتح) و M1 المصابة Mtb (أزرق عميق) و M2 (أرجواني عميق). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: قائمة الأجسام المضادة المستخدمة في قياس التدفق الخلوي.
| ليزر | راووق | فلوروشروم | الظاهري | دالة | استنساخ | كتالوج لا. | شركة |
| 639 | 670/30 | AF647 | TLR2 | مستقبلات التعرف على مسببات الأمراض | TL2.1 | 309714 | بيو ليجيند |
| 639 | 780/60 | APC-Cy7 | CD206 | مستقبلات مانوز | 15-2 | 321120 | بيو ليجيند |
| 405 | 610/20 | BV605 | CD163 | مستقبلات زبال | GHI/61 | 333616 | بيو ليجيند |
| 405 | 670/30 | BV650 | CD80 | جزيء تحفيزي مشترك | 2D10 | 305227 | بيو ليجيند |
| 405 | 710/50 | BV711 | CCR7 | مستقبلات كيموكين | G043H7 | 353228 | بيو ليجيند |
| 405 | 780/60 | بي في 785 | CD86 | جزيء تحفيزي مشترك | IT2.2 | 305442 | بيو ليجيند |
| 488 | 530/30 | GFP | Mtb | البكتيريا داخل الخلايا | |||
| 561 | 586/15 | PE | CD200R | مستقبلات مثبطة | OX-108 | 329306 | بيو ليجيند |
| 561 | 620/14 | PE/انبهار 594 | CD64 | FC غاما مستقبلات-I من IgG | 10.1 | 305032 | بيو ليجيند |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | جزيء MHC من الدرجة الثانية | L243 | 307608 | بيو ليجيند |
| 355 | 450/50 | BUV395 | صبغة الجدوى | علامة خلية حية/ميتة | غيبوبة الأشعة فوق البنفسجية | 423108 | إنفيتروجين |
Discussion
يصف هذا البروتوكول التجريبي الاستقطاب الفعال للخلايا المشتقة من النخاع إلى الأنماط الظاهرية M1 أو M2 بما في ذلك التقييم مع لوحة قياس الخلايا التدفقية من 10 ألوان التي تسمح بالتصور والتوصيف العميق ل Mtb المسمى GFP في مجموعات فرعية متنوعة من الضامة. على الرغم من أن السل هو مرض بشري قديم ، إلا أنه لا يوجد حاليا نموذج معياري ذهبي لدراسة تفاعلات Mtb-macrophage ، ويمكن أن يكون قياس تدفق الخلايا متعدد الألوان لل الضامة معقدا بالمقارنة مع تحليلات استجابات الخلايا الليمفاوية. قليل من البروتوكولات المتاحة للتمايز في المختبر من monocytes الإنسان إلى الضامة تقديم معرفة عميقة لنوع من الضامة المتولدة. بروتوكول أساسي للاستقطاب الضام وتقييم التدفق الخلوي لتنشيط الضامة باستخدام لوحة صلبة من علامات يمكن أن تسهل على الأرجح مثل هذا الوصف وتوفر فرصا لاستكشاف ميزات إضافية من الخلايا المستقطبة تعامل في ظل ظروف مختلفة. ويشمل ذلك تحليلات للخلايا المستزرعة في المختبر وكذلك تحليلات الخلايا في الجسم الحي في العينات السريرية، أي كل من PBMC وتعليق الخلايا المفردة من سوائل الجسم (أي حمم الشعب الهوائية) أو الأنسجة المتجانسة. وبناء على ذلك ، يمكن أن يكون التمايز و / أو حالة التنشيط من monocytes وال الضامة التي تم الحصول عليها من المرضى ذات صلة بنتائج المرض. تم الإبلاغ عن توسع CD16+CD163+ monocytes في الدم المحيطي في مرضى السل الرئوي30. كما تم الكشف عن زيادة وتيرة CD163+ الخلايا في الجلد الملتهبة من مرضى التهاب الجلد التأتبي31. وبالمثل، ثبت CD206+ M2 مثل الضامة لمنع انتشار وتمايز الخلايا في البيئة الدقيقة للأنسجة الدهنية32 وأن تكون غنية في عينات نخاع العظام من المرضى الذين يعانون من سرطان الدم النخاعي الحاد (AML)29. تم العثور على نسبة مرتفعة من CD64 (M1) إلى خلايا CD163 (M2) في الدم كله من المرضى الذين يعانون من هشاشة العظام أن تكون مرتبطة شدة المرض33. واستخدمت دراسة أخرى CD86 (M1) وCD163 (M2) لإثبات أن التعبير M1 عالية في الأنسجة ترتبط أسوأ نتيجة في مجموعة فرعية من أورام الدماغ الخبيثة34.
هناك العديد من المزايا الهامة لهذا البروتوكول التجريبي لقياس التدفق الخلوي M1/M2. يوفر هذا النموذج الفرصة لدراسة الاستجابات المناعية الفطرية للعدوى الخبيثة Mtb ويمكن تطويرها لاحتواء دراسات الاستجابات المناعية التكيفية عن طريق إضافة خلايا T ذاتية التشغيل جنبا إلى جنب مع الضامة M1 أو M2 في ردود الفعل الخلايا الليمفاوية المختلطة (MLRs). كما أن البروتوكول مناسب لفحص واختبار الأدوية لمختلف مركبات المناعة ومضادات الميكروبات. هنا, لقد درسنا سابقا آثار فيتامين (د) وهستون deacetylase مثبط فينيل بوتيرات على الخلايا المشتقة من النخاع بعد عدوى MTB25,35. ويمكن أيضا أن تستخدم M1/M2 تدفق قياس الخلايا لتقييم تنشيط الضامة بعد تكييف مع الخلايا الثقافة الطوافر أو البلازما المريض. وفي حين أن الدراسات الحية للعدوى المشتركة بالسل بفيروس نقص المناعة البشرية أو الديدان الطفيلية أو المراضة المشتركة بين السل والسكري يمكن أن تكون صعبة، فإن نموذج M1/M2 الأقل تعقيدا قد يسهل دراسات الأمراض المشتركة في المختبر. وبالمثل، يمكن استغلال البروتوكول لدراسات الإرسال لفحص عدوى Mtb للخلايا أو للتحقيق في قدرة عرض البلعوسية وكذلك المستضد لخلايا M1/M2 الفردية. كما أن قياس تدفق الخلايا M1/M2 جذاب للاستخدام في دراسات العلامات الحيوية واللقاحات، ومتابعة تشخيص المرض أثناء العلاج واختبار العلاجات التي تستهدف الخلايا المشتقة من النخاع. الأهم من ذلك ، يمكن تطبيق عدد من الطرق المختلفة بالتوازي مع قياس التدفق الخلوي للتقييم المتزامن للأنماط الظاهرية للاستقطاب الضام والاستجابات الوظيفية باستخدام المجهر البؤري(الشكل 3D)، PCR في الوقت الحقيقي ، لطخة الغربية، والمقايسات متعددة و ELISA من العوامل القابلة للذوبان في الثقافة الفائقة، فضلا عن تقييم العدوى البكتيرية داخل الخلايا والنمو باستخدام GFP-التعبير (قياس التدفق الخلوي والمجهر confocal) ووحدات تشكيل مستعمرة (CFU). كما تمكن عدوى خلايا M1 أو M2 ببكتيريا Mtb-GFP من فرز الخلايا غير المصابة والمصابة ب Mtb من نفس العينة لتحليل تسلسل الخلايا الحمض النووي الريبي المفرد.
كما أن البروتوكول الموصوف له بعض القيود بما في ذلك العيوب التقنية والعلمية على حد سواء. العيب باستخدام الضامة المشتقة من monocyte من المتبرعين بالدم البشري هو أن التباين المانح غالبا ما يكون مرتفعا وحقيقة أن الخلايا ليست مستقطبة في البيئة الفسيولوجية للأنسجة البشرية. وقد يؤدي التباين الكبير في فعالية الاستقطاب M1/M2 أو إصابة Mtb بين المانحين إلى مشاكل في كل من الاختلافات داخل وخارج التجريبيات، وانخفاض القوة الإحصائية، والحاجة إلى إشراك العديد من المانحين للحصول على نتائج موثوقة. بالإضافة إلى ذلك ، يؤدي الالتزام البلاستيكي للخلايا الأحادية من PBMCs إلى عدد معتمد على المانحين من الخلايا الأحادية / البئر التي قد توفر في نهاية المطاف وزارة الداخلية التعسفية التي يمكن أن تؤثر على الاستقطاب الضام وقابلية الخلية بعد عدوى Mtb. تتضمن الخطوات الهامة في البروتوكول الغسيل المناسب لمنع أنواع الخلايا الأخرى من تلويث ثقافات الخلايا التي يمكن أن تؤثر أيضا على استقطاب الضامة. في حين أن وزارة الداخلية منخفضة جدا قد تحاكي عدوى السل الكامنة، فإن وزارة الداخلية عالية جدا سوف تقتل الخلايا، وتسليط الضوء على أهمية استخدام وزارة الداخلية المناسبة. وعلاوة على ذلك، قد يكون من الصعب استرجاع الخلايا الملتصقة بقوة عند الانفصال، مما قد يؤدي إلى تمثيل متحيز لبعض مجموعات الضامة الفرعية المستخدمة في تحليل قياس التدفق الخلوي. تتضمن الخطوة الحاسمة في تحليل قياس التدفق الخلوي الاستخدام السليم لمصفوفة تعويض الخرز والضوابط السلبية مثل الخلايا غير الملطخة أو ضوابط FMO (Fluorescence Minus One) لضمان التنغيم اليدوي الصحيح.
وهناك قيد آخر ينطوي على استقطاب الخلايا الأحادية المستمدة من الدم وليس من بيئة الأنسجة المحلية. السمة المميزة للسل البشري هي تكوين الأورام الحبيبية في الأنسجة المصابة ب Mtb ، وبالتالي ، ينبغي دراسة علم الأمراض المناعية في السل بشكل تفضيلي في موقع الأنسجة المحلية. ومع ذلك ، يتم تجنيد الخلايا الأحادية إلى الرئة من الدم المحيطي عند الالتهاب / العدوى ، حيث يمكن للخلايا التفريق إلى الضامة في وجود السيتوكينات الالتهابية مثل GM-CSF12. الأهم من ذلك ، في الوسط الفسيولوجي للأنسجة في الجسم الحي ، من المرجح أن يكون هناك تغاير كبير للاستقطاب الضام بما في ذلك خليط ونسب مختلفة من مجموعات الماكروفاج المتنوعة M1 - و M2 التي تساهم في مصير عدوى السل36. لقد سبق لنا أن وضعت نموذج أنسجة الرئة organotypic الإنسان الذي يتيح 3D دراسات تشكيل الورم الحبيبي بوساطة الضامة في السل37. قد يكون من المثير للاهتمام استغلال بروتوكول الاستقطاب M1/M2 الحالي بالاشتراك مع نموذج أنسجة الرئة لمواصلة دراسة تكوين الورم الحبيبي السل ووظائف التأثير ونسبة M1/M2 في الأنسجة التجريبية.
يمكن بسهولة تكييف بروتوكول قياس التدفق M1/M2 هذا ليشمل لوحة ممتدة من علامات النخاع المفيدة لتقييم الميزات المرتبطة بالاستجابات المثبطة وكذلك الالتهابية. هناك اهتمام بحثي كبير في جزيئات نقطة التفتيش المناعية المثبطة مثل PD-1 و SIRP-α وIDO و arginases التي يمكن أن تعدل استجابات الضامة38. وفي هذا السياق، يمكن أن ينطوي استقطاب الخلايا النخاعية أيضا على محفزات أخرى تعزز الضامة المناعية (Mreg) أو الخلايا المثبطة المشتقة من النخاع (MDSC) التي ثبت أنها متورطة في العديد من الأمراض بما في ذلك السل38. قد تشمل لوحات قياس التدفق الخلوي الأكثر تقدما من مجموعات M1/M2/Mreg الجزئية أيضا تلطيخ السيتوكينات /chemokines IL-1β و TNF-α وIL-10 و MCP-1 أو غيرها من العوامل القابلة للذوبان أو الجزيئات المؤثرة مثل أكسيد النيتريك غير القابل للانقباض (iNOS) والببتيدات المضادة للميكروبات. وهذا يمكن أن يعزز إمكانيات لدراسة استجابات الضامة متعددة الوظائف، على غرار ما تم وصفه على نطاق واسع للخلايا التائية39.
حاليا، يمكن أن تشمل لوحات تلطيخ قياس التدفق ما يصل إلى 30-40 لونا، مما يوفر القدرة على النمط المناعي مجموعات فرعية متعددة من الخلايا والجزيئات في وقت واحد. يمكن استخدام الإعداد التجريبي الأساسي لبروتوكول قياس التدفق الخلوي M1/M2 هذا كعمود فقري متوافق مع معظم مقاييس التدفق القديمة والجديدة ويمكن البناء عليه وتكييفه وفقا للاحتياجات الفردية بما في ذلك التحديات التي يفرضها العمل مع Mtb الخبيث في بيئة BSL-3. في الوقت الحاضر ، تقنيات الحد من الأبعاد مثل UMAP متوفرة في الإصدارات الجديدة من برامج قياس التدفق الخلوي ، والتي تمكن من تحليل عدد كبير من المعلمات التي تم إنشاؤها في دراسات الخلية الواحدة التي تعتبر ضرورية لتحسين التصور وتفسير البيانات عالية الأبعاد40. من المرجح أن تستمر التحسينات التكنولوجية المستمرة في قياس التدفق الخلوي في السنوات القادمة بما في ذلك الجمع بين الفينوتيبينج متعدد البارامتر جنبا إلى جنب مع قدرات فرز الخلايا الحديثة ، حيث يمكن أن يكون هذا البروتوكول مفيدا في العديد من مقايسات عدوى Mtb القائمة على الماكروفاج.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ونشكر زملائنا في وكالة الصحة العامة السويدية، ماتيلدا سفينسون وسليمان غيبريمايكل على المساعدة في مختبر BSL-3.
تم دعم هذا العمل من خلال منح من مؤسسة القلب والرئة السويدية (2019-0299 و 2019-0302 إلى SB) ومجلس البحوث السويدي (2014-02592، 2019-01744 و 2019-04720 إلى SB)، ومؤسسة منع مقاومة المضادات الحيوية (مقاومة)، ومؤسسات معهد كارولينسكا وكيد إلى SB (التمويل الجزئي لتعليم الدكتوراه لماركو لوريتي) من معهد كارولينسكا. تم دعم ML من المؤسسة السويدية لسرطان الأطفال (TJ2018-0128 وPR2019-0100).
Materials
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
References
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved