Method Article
Polarização de Células e Análises Derivadas de Monócitos Humanos M1 e M2 com Citometria de Fluxo sobre Infecção por Mycobacterium tuberculosis
Neste Artigo
Erratum Notice
Resumo
Este protocolo fornece um método para estudar a infecção por Mycobacterium tuberculosis em macrófagos m1 ou M2 polarizados humanos baseados na diferenciação de monócitos periféricos-sanguíneos para células semelhantes a macrófagos que são infectados com a cepa virulenta H37Rv, e analisado com citometria de fluxo usando um painel de 10 cores, incluindo a expressão de marcadores M1/M2 selecionados.
Resumo
Macrófagos humanos são células hospedeiras primárias da infecção por Mycobacterium tuberculosis intracelular (Mtb) e, portanto, têm um papel central no controle imunológico da tuberculose (TB). Estabelecemos um protocolo experimental para seguir a polarização imunológica das células derivadas do mieloide em células meloides derivadas em células semelhantes a M1 (classicamente ativado) ou M2 (alternativamente ativado) através de avaliação com um painel de citometria de fluxo de 10 cores que permite visualização e caracterização profunda de Mtb de proteína verde-fluorescente (GFP) rotulado em diversos subconjuntos de macrófagos. Monócitos obtidos de doadores de sangue saudáveis foram polarizados em células M1 ou M2 usando diferenciação com fator estimulante de colônia de macrófago de granulocito (GM-CSF) ou fator estimulante de colônia macrófago (M-CSF) seguido de polarização com IFN-γ e lipopólise (LPS) ou IL-4, respectivamente. Células M1 e M2 totalmente polarizadas foram infectadas com Mtb-GFP por 4 horas antes que macrófagos infectados por Mtb fossem manchados com citometria de fluxo em 4 ou 24 horas após a infecção. A aquisição da amostra foi realizada com citometria de fluxo e os dados foram analisados por meio de um software de análise de citometria de fluxo. Foi realizada a gating manual, bem como a redução da dimensionalidade com aproximação e projeção uniforme (UMAP) e análise de fenogramas. Este protocolo resultou em uma polarização M1/M2 eficaz caracterizada por níveis elevados de CD64, CD86, TLR2, HLA-DR e CCR7 em células M1 não infectadas, enquanto células M2 não infectadas apresentaram uma forte regulação dos marcadores de fenótipo M2 CD163, CD200R, CD206 e CD80. As células polarizadas em M1 normalmente continham menos bactérias em comparação com células polarizadas por M2. Vários marcadores M1/M2 foram rebaixados após a infecção por Mtb, o que sugere que mtb pode modular a polarização do macrófago. Além disso, 24 diferentes grupos celulares de diferentes tamanhos foram encontrados exclusivamente distribuídos entre as células M1 e M2 não infectadas e infectadas por Mtb em 24 horas após a infecção. Este protocolo de citometria de fluxo M1/M2 poderia ser usado como espinha dorsal na pesquisa Mtb-macrófago e ser adotado para necessidades especiais em diferentes áreas de pesquisa.
Introdução
Macrófagos são células imunes que contribuem significativamente para a regulação de homeostase tecidual, inflamação e patologias da doença. Sendo um componente essencial da imunidade inata, a linhagem monócito-macrófago das células expressa fenótipos heterogêneos em resposta a sinais ambientais alterados, que refletem sua plasticidade e adaptação a diferentes locais anatômicos e imunológicos1. Dependendo dos fatores de crescimento, citocinas e outros mediadores presentes no microambiente, os macrófagos foram categorizados em duas grandes populações reversíveis, cada uma com um papel diferente no controle e liberação bacteriana2: os macrófagos m1 polarizados pró-inflamatórios e classicamente ativados e os macrofagos anti-inflamatórios, alternativamente ativados M2-polarizados que foram originalmente nomeados para imitar a nomenclatura celular T helper (Th)3. Esse agrupamento de macrófagos polarizados imunológicos é muitas vezes considerado simplista, pois a ativação e diferenciação do macrófago não é linear, mas mais precisamente ilustrado como um contínuo onde cada população tem características e papéis funcionais diferentes no resultado do desenvolvimento e progressão da doença4,5,6,7. No entanto, existem inúmeras vantagens experimentais com o modelo de macrófago M1/M2 que podem ser usados em vários campos diferentes de pesquisa.
A micobacterium tuberculosis (Mtb) é o agente causador da tuberculose (TB) e estima-se infectar uma pessoa a cada segundo e é considerada a agente infecciosa mais letal do mundo (Relatório Global de TB 2019). Como o trato respiratório é a principal rota da infecção por Mtb, os macrófagos alveolares são as células hospedeiras preferidas para serem infectados com Mtb e representam tanto as barreiras primárias quanto o reservatório infeccioso para Mtb nos pulmões. A polarização do macrófago em resposta a diferentes estímulos tem sido extensivamente estudada ao longo dos anos7 e na maioria dos trabalhos publicados, A polarização M1 de culturas monocitos in vitro é induzida pelo Fator Estimulante da Colônia Granulocito-Macrófago (GM-CSF) juntamente com IFN-γ e LPS8,9, enquanto a polarização M2 é induzida com fator estimulante da colônia de macrófagos (M-CSF) e IL-410,11. Os macrófagos M1 são potentes células efeitos que mediam respostas antimicrobianas contra patógenos intracelulares e têm um papel essencial na imunidade antitumoral12. Os macrófagos M2, por outro lado, têm função anti-inflamatória, alta capacidade fagocítica e estão principalmente envolvidos na cicatrização de feridas e reparação de tecidos, bem como em infecções por parasitas12. Assim, os macrófagos M1 são vistos como mais eficazes no controle intracelular de Mtb em comparação com os macrófagos M213. No entanto, as bactérias Mtb também têm o potencial de modular a polarização do macrófago para subverter a imunidade inata14,15,16,17.
Embora seja comum gerar macrófagos a partir da diferenciação de monócitos obtidos a partir do sangue periférico18,macrófagos também poderiam ser gerados a partir de células-tronco pluripotentes induzidas (iPSCs)19 ou de macrófagos derivados da medula óssea de camundongos20,21. São técnicas viáveis para estudar células primárias de macrófagos obtidas de progenitores monócitos/macrófagos que se proliferarão e se diferenciarão em uma população homogênea de células maduras semelhantes a macrófagos. No entanto, esses protocolos raramente fornecem conhecimento aprofundado sobre o fenótipo e função das células obtidas nem explicam a heterogeneidade natural observada entre os macrófagos obtidos in vivo. Como o Mtb é um patógeno humano rigoroso, há também uma vantagem em estudar Mtb em sistemas de modelos humanizados. A citometria de fluxo é uma tecnologia poderosa que oferece a possibilidade de avaliar múltiplas características fenotípicas e funcionais de células únicas na suspensão22, algo que poderia ser bastante desafiador com células aderentes, como macrófagos que também são conhecidos por serem autofluorescentes23,24. Além do descolamento químico de macrófagos firmemente aderentes, a infecção por Mtb pode representar um fator de estresse significativo para as células que adiciona outro nível de complexidade nas análises citométricas de fluxo de macrófagos infectados por Mtb.
Neste protocolo experimental, utilizamos um modelo de infecção por macrófago humano previamente estabelecido baseado na polarização imunológica das células derivadas do sangue-sangue primário que são infectadas com a virulenta cepa de Mtb de laboratório H37Rv, e analisada com citometria de fluxo usando um painel de 10 cores, incluindo a expressão dos marcadores M1 e M2 selecionados25. Este protocolo fornece um método eficiente e reprodutível para estudar respostas à infecção por Mtb em macrófagos polarizados de monócitos M1 ou M2. Além disso, o uso de citometria de fluxo em macrófagos infectados por Mtb aderentes nos permite estudar uma variedade de marcadores de superfície associados aos macrófagos M1 e M2 convencionais e sua resposta longitudinal à infecção por Mtb. É importante ressaltar que este protocolo pode ser facilmente adotado para investigações de infecções com outros patógenos, em estudos anê tumores ou em estudos de condições inflamatórias, para rastreamento de medicamentos etc. e também pode ser explorado para avaliação da polarização do macrófago M1/M2 em amostras clínicas humanas.
Protocolo
Sangue periférico humano de doadores de sangue anônimos saudáveis foi obtido do banco de sangue do Karolinska University Hospital, Huddinge, Suécia (aprovação ética Dnr 2010/603-31/4). Todas as etapas experimentais envolvendo Mtb virulento ao vivo foram realizadas no laboratório Biossegurança Nível-3 (BSL-3) da Agência de Saúde Pública da Suécia (FOHM), Solna, Suécia.
1. Preparação de mídia, buffers e culturas bacterianas
NOTA: Detalhes sobre todos os reagentes e consumíveis são fornecidos na Tabela de Materiais.
- Meio completo RPMI: Suplemento RPMI 1640 com piruvato de sódio de 1 mM, 2 mM L-glutamina, 10 mM HEPES e 10% de soro bovino fetal inativado por calor (FBS). Evite antibióticos no meio de cultura celular ao trabalhar com infecção por Mtb.
- Meio RPMI sem soro: Suplemento RPMI 1640 com piruvato de sódio de 1 mM, 2 mM L-glutamina e 10 mM HEPES.
- Tampão de lavagem: Prepare o soro fisiológico tampão de fosfato (PBS) contendo 0,05% (v/v) Tween-80.
- Tampão FACS: Prepare PBS contendo 2,5% (v/v) FBS e 0,5 mM EDTA.
- Tampão de fixação: Prepare PBS contendo 4% de formaldeído para PBS. Certifique-se de que está recém-preparado antes do uso, por exemplo, misturado a partir de uma solução de estoque de 37% de formaldeído.
- Tampão de permeabilização: Adicione 0,1% de citrato de sódio e 0,1% Triton X-100 à água desionizada.
- Tampão de lavagem (para imunofluorescência): Prepare PBS contendo 0,1% BSA e 0,1% Tween-20.
- Tampão de bloqueio: Prepare PBS contendo 0,1% BSA e 10% de soro de cabra normal (NGS) para PBS.
- Tampão de coloração (para imunofluorescência): Prepare PBS contendo 0,1% de BSA para PBS.
- TB meio completo: Suplemento Middle Brook 7H9 caldo com 0,05% (v/v) Tween-80, 0,5% (v/v) glicerol, kanamycin (20 μg/mL), 10% (v/v) Ácido oleico middlebrook, albumina, dextrose e enriquecimento catalase (Middlebrook OADC Enrichment).
- Culturas bacterianas: Use a cepa de laboratório padrão virulento de Mtb, H37Rv, expressando constitutivamente proteína fluorescente verde (GFP), para infecção de células derivadas de monócitos. Esta cepa Mtb carrega um plasmídeo pFPV2 que contém um GFP de codificação genética, bem como um gene para resistência à kanamicina. A resistência a antibióticos permite a seleção contínua de bactérias que expressam plasmídeos em culturas que contêm kanamicina. Armazenar bactérias em TB média completa e 70% glicerol (diluição 1:1) a -80 °C.
2. Isolamento de células mononucleares de sangue periférico de casacos buffy
NOTA: Realize todo o trabalho com sangue humano (potencialmente contagioso) dentro de um armário de biossegurança classe II. Inativar produtos sanguíneos residuais com desinfetantes por 15 minutos antes de descartar. O sangue foi obtido de voluntários saudáveis neste caso. Este protocolo de diferenciação de macrófago in vitro foi criado para incluir 10 x 106 PBMCs isolados/doador/bem. De cada doador, um casaco buffy contém cerca de 50 mL de uma suspensão leucócito concentrada originária de sangue inteiro, que normalmente fornece 500-800 x 106 PBMCs dos quais aproximadamente 10% ou 50-80 x 106 monócitos podem ser recuperados.
- Carregue 15 mL de sangue de casaco buffy em cima de 15 mL de gradiente de densidade médio preparado em tubo de 50 mL. Sobreponha lentamente o sangue em cima da camada gradiente de densidade inclinando a ponta da pipeta para a parede do tubo.
- Gire os tubos a 600 x g por 25 min na temperatura da sala (RT) com 0 aceleração e 0 desaceleração.
NOTA: Feche as tampas cuidadosamente antes da centrifugação e verifique sempre os suportes do tubo para possíveis derramamentos após a centrifugação. - Remova a camada de plasma superior com uma pipeta Pasteur estéril e, posteriormente, colete cuidadosamente a camada de célula mononuclear em um novo tubo de 50 mL usando uma pipeta Pasteur estéril. Adicione o meio RPMI sem soro à pelota PBMC para obter um volume final de 50 mL. Misture cuidadosamente invertendo o tubo algumas vezes antes da centrifugação a 500 x g por 5 min no RT.
- Descarte o supernatante cuidadosamente e resuspenque a pelota da célula girando a parte inferior do tubo dentro dos dedos.
- Para remover a contaminação média gradiente de densidade dos PBMCs, lave as células 2-3 vezes com RPMI sem soro para obter um volume final de 50 mL. Centrifugar a 500 x g por 5 min no RT. Lave até que a célula sobrenatante se torne transparente.
- Descarte o supernasce e resuspenque as células em 20 mL de meio RPMI sem soro.
- Conte as células por coloração azul trypan, usando manualmente um hemócito ou usando um contador celular automatizado. Diluir a suspensão celular em azul trypan em 1:2 ou 1:10 diluição misturando a amostra azul de tripano celular em uma placa de 96 poços, por exemplo, 50 μL + 50 μL (para contagem de hemocitômetros) ou 10 μL + 10 μL (para contagem automática de células) e contar as células para obter o número de células vivas/mL.
ATENÇÃO: O azul trypan é tóxico e deve ser descartado em resíduos químicos separados.
3. Diferenciação e polarização de células derivadas de monócitos
NOTA: Para diferenciação e polarização de células derivadas de monócitos, seguiu-seumprotocolo que estabelecemos anteriormente para células m0, semelhantes a M1 e M2, bem como células polarizadas totalmente M1 e M2. Para simplificar, apenas macrófagos M1 e M2 totalmente polarizados são descritos aqui.
- Use adesão plástica para isolamento de monócitos. Brevemente, as sementes recém-isoladas PBMCs em uma placa de cultura de 6 poços em uma concentração apropriada, por exemplo, 10 x 106 PBMCs/well em 2 mL de meio RPMI sem soro e incubam a 37 °C e 5% DE CO2.
- Após 2-3 h, remova as células não aderentes com uma pipeta e lave os poços 3 vezes com meio livre de soro de 1 mL. As células anexadas são monócitos e compreendem cerca de 10% do total de PBMCs adicionados ao poço, ou seja, 106 monócitos recuperados de 10 x 106 PBMCs adicionados por poço.
- Para diferenciação de macrófago, prepare uma solução de trabalho contendo 50 ng/mL GM-CSF ou M-CSF para polarização macrófago M1 e M2, respectivamente, adicionada em 2 mL de RPMI meio completo por poço. Cultume as células em uma incubadora de CO2 de 5% em 37 °C durante 3 dias.
- No dia 3, remova 1 mL do meio de cultura celular cuidadosamente da camada superior de cada poço e suplemente as culturas celulares com 1 mL de meio completo RPMI fresco contendo a dupla concentração de M-CSF ou GM-CSF para obter 50 ng/mL de concentração final nos poços. Adicione os fatores de crescimento em uma solução de trabalho pré-feita de 100 ng/mL/well.
- No dia 6, adicione diferentes estímulos para os últimos 18-20 h de diferenciação celular para obter M1 totalmente polarizado e maduro (interferon-γ; IFN-γ e lipopoliscarídeo; LPS (E. coli O55:B5)) ou M2 (interleucina 4; IL-4) macrófagos. Para a polarização M1, prepare ifn-γ e LPS em RPMI meio completo e adicione 50 μL por poço para obter uma concentração final de 50 ng/mL IFN-γ e 10 ng/mL LPS nas culturas celulares. Para a polarização M2, prepare o IL-4 em meio completo RPMI e adicione 50 μL por poço para obter uma concentração final de 20 ng/mL nas culturas celulares.
- Para diferenciação de macrófagos polarizados M0, estimule as células apenas com M-CSF, sem qualquer citocina adicional (fornecendo um fenótipo semelhante a M2)25.
- Verifique a morfologia das culturas celulares derivadas de monócitos regularmente com microscopia leve para garantir que monócitos menores sejam diferenciados em células maiores semelhantes a macrófagos. Além disso, monitore possíveis diferenças morfológicas entre a polarização M1 e M2, ou seja, células M1 alongadas e esticadas em comparação com células M2 com uma forma mais arredondada25.
- No dia 7, transfira as placas com células derivadas de monocitos para um laboratório BSL-3 para infecção com Mtb virulento.
4. Preparação das culturas Mtb
NOTA: As seguintes etapas devem ser executadas em uma instalação BSL-3. Para todos os trabalhos com Mtb virulento, use roupas protetoras, proteção respiratória e luvas resistentes ao etanol.
- Descongele um frasco com 1 mL de alíquota bacteriana e misture com 9 mL de TB meio completo (diluição de 1:10) em um tubo de tampa filtrada de 50 mL. Cultura a suspensão em uma incubadora a 37 °C e 5% DE CO2.
- Após 24 horas, gire a suspensão bacteriana a 2.300 x g por 10 min e despeje cuidadosamente o meio. Resuspene a pelota bacteriana com 15-20 mL de TB fresca meio completo em um novo tubo de cultura de tampa filtrada de 50 mL e incubar a 37 °C e 5% de CO2. Misture as bactérias estabelecidas no tubo a cada 2 a 3 dias para manter um suprimento de nutrientes homogêneo para todas as células bacterianas.
- Após 7-10 dias, misture a suspensão bacteriana corretamente por tubulação para cima e para baixo antes de transferir para um tubo de tampa de parafuso de 50 mL.
- Adicione 35-40 mL de tampão de lavagem estéril ao tubo de 50 mL e gire a suspensão bacteriana a 2.300 x g por 10 minutos. Repita as etapas de lavagem uma vez. Resuspenque a pelota bacteriana em 1 mL de meio RPMI sem soro por pipetação com uma micropipette.
- Adicione mais 9 mL de meio RPMI sem soro e sonicar a suspensão bacteriana dentro de um armário de biossegurança classe II por 5 min a 37 °C, para interromper os aglomerados bacterianos. Mergulhe o tubo repetidamente (3-4 vezes) no sônico do banho de água para garantir a interrupção máxima dos aglomerados bacterianos. Meça a densidade óptica (OD) de 1 mL de suspensão bacteriana a 600 nm comprimento de onda usando um espectrofotômetro colocado dentro do armário de biossegurança. Use o meio RPMI sem soro para definir a referência.
- Calcule o número de unidades formadoras de colônias (UFC) utilizando a fórmula: (OD+0,155)/0,161 = Y, e Y x 107= Y x 106 UFC/mL, por exemplo, um valor OD 0,32 fornece uma concentração bacteriana de (0,32 + 0,155)/0,161 = 2,95, 2,95 x 107= 29,5 x 106 UFC/mL.
5. Infecção por Mtb de células derivadas de monócitos
NOTA: As seguintes etapas devem ser executadas em uma instalação BSL-3.
- Resuspenque a pelota bacteriana no meio RPMI sem soro em um novo tubo estéril de 50 mL e ajuste a concentração bacteriana final para aproximadamente 5 x 106 UFC/mL.
- Remova o meio de cultura celular das placas de 6 poços que contêm células derivadas de monócitos. Adicione 1 mL de meio RPMI sem soro a cada poço. Adicione 1 mL de suspensão bacteriana por poço para obter uma multiplicidade de infecção (MOI) 5:1, ou seja, 5 x 106 UFC por 106 macrófagos em 2 mL/poço e incubar as placas por 4h em 37 °C e 5% DE CO2.
- Após a infecção, lave as células 3 vezes com 1 mL de tampão de lavagem estéril para remover bactérias extracelulares. Incline a placa e remova cuidadosamente todo o tampão de lavagem dos cantos. Resuspend as células derivadas de moncyte infectados por Mtb em 2 mL de RPMI meio completo sem antibióticos e procede a coloração de citometria de fluxo ou incubar as células por mais 24 h (ou outros pontos de tempo) antes da citometria de fluxo.
6. Coloração de citometria de fluxo de células derivadas de moncidas infectadas por Mtb
NOTA: As seguintes etapas devem ser executadas em uma instalação BSL-3. A coloração da citometria de fluxo poderia ser realizada em uma placa de 96 poços em vez de tubos.
- Retire as células infectadas por Mtb (e controles não infectados) dos poços nas placas de 6 poços por incubação com 1 mL de tampão FACS por poço por poço por pelo menos 30 min a 37 °C e 5% de CO2.
- Pipeta suavemente para cima e para baixo algumas vezes para garantir que as células sejam separadas. Se possível, confirme o desprendimento celular com microscopia. Transfira a suspensão celular de cada poço para um tubo de microcentrifuge tampado e gire os tubos a 200 x g por 5 min. Descarte o supernatante cuidadosamente por pipetação.
- Lave a pelota de célula em cada tubo duas vezes com tampão FACS e gire as células a 200 x g por 5 minutos.
- Manche as células (cerca de 0,5 x 106 a 1 x 106 células/tubo) com aproximadamente 50 μL de anticorpos anti-humanos conjugados fluorocromo, incluindo TLR2 (AF647), CD206 (APC-Cy7), CD163 (BV605), CD80 (BV650), CCR7 (BV711), CD86 (BV786), CD200R (PE), CD64 (PE-Dazzle 594), HLA-DR (PE-Cy5)(Tabela 1)em combinação com tintura de viabilidade Zombie-UV para 30 min a 4 °C (geladeira) no escuro.
- Lave as células manchadas duas vezes com 400 μL de tampão FACS e gire as células a 200 x g por 5 min.
- Fixar as células manchadas com 200 μL de tampão de fixação (recém-preparados) por 30 minutos no RT no escuro para garantir a inativação completa das micobactérias.
- Lave as células duas vezes com 400 μL de tampão FACS e gire a 200 x g por 5 min para remover o excesso de fixação do buffer.
- Resuspenja as células fixas em 400 μL de tampão FACS e transfira as amostras para novos tubos de microcentrífuga de 1 mL antes de tirá-las do laboratório BSL-3 para citometria de fluxo em BSL-2. Armazene as células manchadas em +4 °C até a aquisição da amostra.
NOTA: Pulverize os tubos com 70% de etanol antes de tirá-los do laboratório BSL-3. O formaldeído é tóxico (cancerígeno) e deve ser tratado em um armário de biossegurança classe II. Descarte resíduos de formaldeído em resíduos químicos separados.
7. Aquisição e análise de dados citométricos de fluxo de células derivadas de monícitos infectados por Mtb
NOTA: As etapas 7.1-7.2 devem ser realizadas antes da coloração da citometria de fluxo descrita acima. Para evitar problemas com a aglomeração celular e dissociação de corantes tandem após a fixação celular, a aquisição de amostras de células infectadas pelo Mtb e não infectadas é realizada dentro de 4-10 h após a coloração do anticorpo primário.
- Antes da coloração da citometria de fluxo descrita acima, compense o sinal fluorescente para cada anticorpo conjugado fluorocromo listado no painel de coloração(Tabela 1) utilizando contas de compensação (positivas e negativas).
- Titule a diluição de anticorpos para coloração de macrófagos humanos para obter o sinal ideal para cada fluorocromo.
- Use células não manchadas para determinar o nível de fluorescência de fundo necessário para definir o portão para a população celular negativa permitindo que as células manchadas sejam visualizadas (macrófagos são altamente fluorescentes automáticos).
- Adquira um mínimo de 50.000 células/amostra no citômetro de fluxo usando o software recomendado para aquisição de dados.
- Exporte os arquivos de aquisição do citômetro de fluxo no formato 3.1 do padrão de citometria de fluxo (FCS).
- Analise os arquivos FCS no software de análise de citometria de fluxo.
- Macrófagos de portão de acordo com suas características de dispersão dianteira e lateral (FSC e SSC) e excluem células mortas por gating de células vivas/mortas usando o corante de viabilidade Zumbi-UV.
- Visualize macrófagos infectados por H37Rv-GFP no canal FITC.
- Identifique a frequência de células manchadas positivamente e a intensidade de fluorescência média geométrica (FIM) para todos os marcadores(Tabela 1).
8. Coloração de imunofluorescência de células derivadas de moncidas infectadas por Mtb
NOTA: A infecção por Mtb deve ser realizada em uma instalação BSL-3.
- Para imunostaining, semente 2 x 105 PBMCs/bem em 500 μL de meio RPMI sem soro em 8 slides de câmara de poço para obter 2 x 104 monócitos/bem. Após diferenciação e polarização M1/M2 de monócitos, proceda com a infecção por Mtb como descrito acima. Fixar os slides após 24 horas de infecção por Mtb com tampão de fixação por 30 min. Os slides fixos são armazenados no congelador a -20 °C até novas análises.
- Lave as células derivadas de monócito duas vezes com 200 μL de PBS por 10 minutos cada.
- Permeabilize as células com 200 μL de tampão de permeabilização por 5 min em RT.
- Lave as células 3 vezes com 200 μL de PBS por 5 min cada.
- Lave as células duas vezes com 200 μL de tampão de lavagem por 5 minutos cada.
- Bloqueie a ligação não específica com 200 μL de tampão de bloqueio por 30 minutos no RT.
- Diluir os anticorpos primários 1:100 no tampão de coloração e incubar as células M1 com um anticorpo CD64 não julgado (Clone: 10.1) e as células M2 com um anticorpo CD163 não conjugado (policlonal) por 2 h no RT.
- Em seguida, lave as células 3 vezes com 200 μL de tampão de lavagem por 10 minutos cada.
- Diluir os anticorpos secundários rotulados fluorescentes 1:1.000 no tampão de coloração e incubar as células M1 com um Fluor IgG-Alexa anti-mouse 594 e as células M2 com um Fluor IgG-Alexa anti-coelho 594 por 1 h no RT.
- Lave as células 3 vezes com 200 μL de tampão de lavagem por 10 minutos cada.
- Remova a grade da câmara e adicione ~20 μL de meio de montagem DAPI em cada poço e coloque uma mancha de cobertura de 1,5 mm em cada slide.
- Sele a mancha com uma camada de esmalte.
- Adquira imagens utilizando um microscópio confocal com lasers emitindo a 486 nm para excitação de GFP (canal verde), 402 nm para DAPI (azul) e 560 nm para anticorpo secundário (vermelho), respectivamente.
Resultados
Uma ilustração esquemática das estimulações citocinas usadas para a polarização de células derivadas de monócitos para M0 (células semelhantes a M2), M1 (células M1 totalmente polarizadas) e M2 (células M2 totalmente polarizadas) é apresentada na Figura 1A,enquanto imagens representativas de M0, Culturas celulares M1 e M2, bem como culturas M1 nos dias 0, 3 e 7, são mostradas na Figura 1B. Células M0 não infectadas foram utilizadas para demonstrar a estratégia básica de gating(Figura 2A). Inicialmente, as células mielóides (~85%) foram fechados de acordo com suas propriedades de dispersão dianteira (FSC) e dispersão lateral (SSC), incluindo as células maiores com alta granularidade e excluindo os detritos de pequeno porte com um SSC e FSC baixos que são encontrados no canto inferior esquerdo do gráfico de pontos. No segundo enredo, os doublets (ou seja, aglomerados celulares) foram definidos como tendo uma área aumentada, mas altura semelhante em comparação com células únicas e foram excluídos de análises posteriores. Portanto, apenas células proporcionais entre FSC-Area e FSC-Height (células únicas) foram incluídas dentro do portão de forma inclinada. Em seguida, o corante de viabilidade Zumbi-UV que mancha as proteínas citoplasmáticas dentro das células mortas, foi usado para excluir as células mortas da análise subsequente. Como esperado, as células M0 não infectadas viáveis foram negativas para a expressão Mtb-GFP visualizada no canal FITC.
Em seguida, aplicamos a mesma estratégia de gating para macrófagos M1 e M2 infectados por Mtb em 4 horas após a infecção(Figura 2B,C). Duas subsuperas foram detectadas no portão FCS/SSC de macrófagos polarizados M1 não infectados; uma população com menor tamanho (FCS) e maior granularidade (SSC) e outra população com maior tamanho e menor granularidade(Figura 2B),enquanto o portão principal de células M2 não infectadas parecia mais homogêneo(Figura 2C). Ambas as células derivadas de monícitoS M1 e M2 apresentaram uma mudança vertical para maior granularidade e redução do tamanho celular após a infecção por Mtb, o que pode refletir uma maior complexidade dentro das células causada pela absorção de bactérias Mtb intracelulares(Figura 2B,C). Além disso, a mancha de viabilidade revelou uma morte celular aumentada (17-22%) entre as células M1 e M2 infectadas por Mtb em um MOI de 5, em comparação com células M0 não infectadas (99%) (Figura 2A-C) ou células M1 e M2 não infectadas (dados não mostrados). Dados representativos mostraram que a expressão Mtb-GFP (ou seja, infectividade de Mtb) foi substancialmente maior em células M2 (77% GFP-positive) em comparação com células M1 (19% células GFP positivas) após 4 horas de infecção(Figura 2B,C). Depois de 24 horas de infecção, A expressão Mtb-GFP foi de 43% e 85% em células M1 e M2, respectivamente, sugerindo que as células M1 tiveram um aumento relativamente maior na expressão GFP de 4 a 24 horas após a infecção por Mtb em comparação com as células M2, 126% versus aumento de 10,4% na expressão GFP nas células M1 e M2 de 4 a 24 horas, respectivamente.
Para caracterizar a eficácia da polarização M1/M2 em células derivadas de moncidas não infectadas, foram utilizadas parcelas de pontos para identificar células M1 que foram duplamente positivas para cd64 e CD86 (CD64+CD86+) e células M2 que foram duplamente positivas para CD163 e CD200R (CD163+CD200R+ ; Figura 3A,B). A seleção dos marcadores M1/M2 foi feita principalmente com base nos resultados do nosso trabalho anterior25, mas também de outros estudos26,27,28,29. Os quadrantes das células manchadas foram definidos utilizando portões correspondentes para células M1/M2 não manchadas(Figura 3A). Nenhum desses marcadores é expresso exclusivamente por células M1 ou M2, mas a proporção de células positivas, bem como a intensidade da expressão da superfície é diferente. Isso ficou particularmente evidente a partir da mancha M1, onde cerca de 95% das células M1 e 79% das células M2 eram CD64+CD86+, mas a intensidade de coloração foi substancialmente maior no subconjunto M1(Figura 3A). Enquanto 27% das células M1 foram positivas para o CD200R marcador M200R, apenas 1% foram positivas para as células CD163, fornecendo 0,5% células CD163+CD200R+ M1 em comparação com 63% células CD163+CD200R+ M2(Figura 3A). Após 4 horas de infecção por Mtb, observou-se aumento na frequência de células CD200R+ em células polarizadas Mtb-GFP-positivos M1 (16%), enquanto a expressão CD163 foi reduzida em células M2(Figura 3B). O mapa de calor demonstra uma alta intensidade de expressão GFP nas células CD163+CD200R+ M2, mas também no subconjunto CD64+CD86+ M2 em comparação com os subconjuntos correspondentes das células M1(Figura 3B). No geral, a mudança de expressão dos respectivos marcadores M1 e M2 também é visualizada nos histogramas na Figura 3C. Além disso, as bactérias Mtb-GFP também foram visualizadas em células CD64+ M1 e em células CD163+ M2 por microscopia confocal, que suportava uma maior absorção intracelular e/ou crescimento de Mtb dentro de M2 em comparação com células M1(Figura 3D).
Para verificar os resultados da gating manual, aplicamos redução de dimensionalidade utilizando aproximação e projeção (UMAP) do Manual de Múltiplos. A análise de UMAP mostrou que a infecção por Mtb por 4 horas não foi suficiente para afetar a polarização dos macrófagos, em contraste com 24 horas de infecção, o que resultou em agrupamentos claramente separados de células M1 e M2 não infectadas e infectadas(Figura 4A). Macrófagos M1 não infectados apresentaram maior expressão de CD64, CD86, TLR2, HLA-DR e CCR7 em comparação com macrófagos M2, enquanto as células M2 não infectadas apresentaram uma forte regulação dos marcadores de fenótipo M2 CD163, CD200R, CD206 e CD80(Figura 4B,C). De acordo com a gating manual, a infecção por Mtb após 24 horas causou uma clara regulação do CD163, CD200R e CD206 em células M2 e regulação de CD86 e HLA-DR em células M1(Figura 4B,C),o que sugere que mtb pode modular a polarização do macrofago. A análise de fenogramas subsequentes(Figura 4D-F) identificou 24 diferentes aglomerados de diferentes tamanhos que foram distribuídos exclusivamente entre as células não infectadas por M1 e Mtb e Mtb como ilustrados nos gráficos UMAP(Figura 4D),gráficos de tortas(Figura 4E) e mapas de calor(Figura 4F). Ao todo, esses resultados mostram uma eficiência promissora deste protocolo para gerar células polarizadas M1 e M2 fenotipicamente e funcionalmente diversas in vitro que são ainda mais moduladas pela infecção por Mtb.
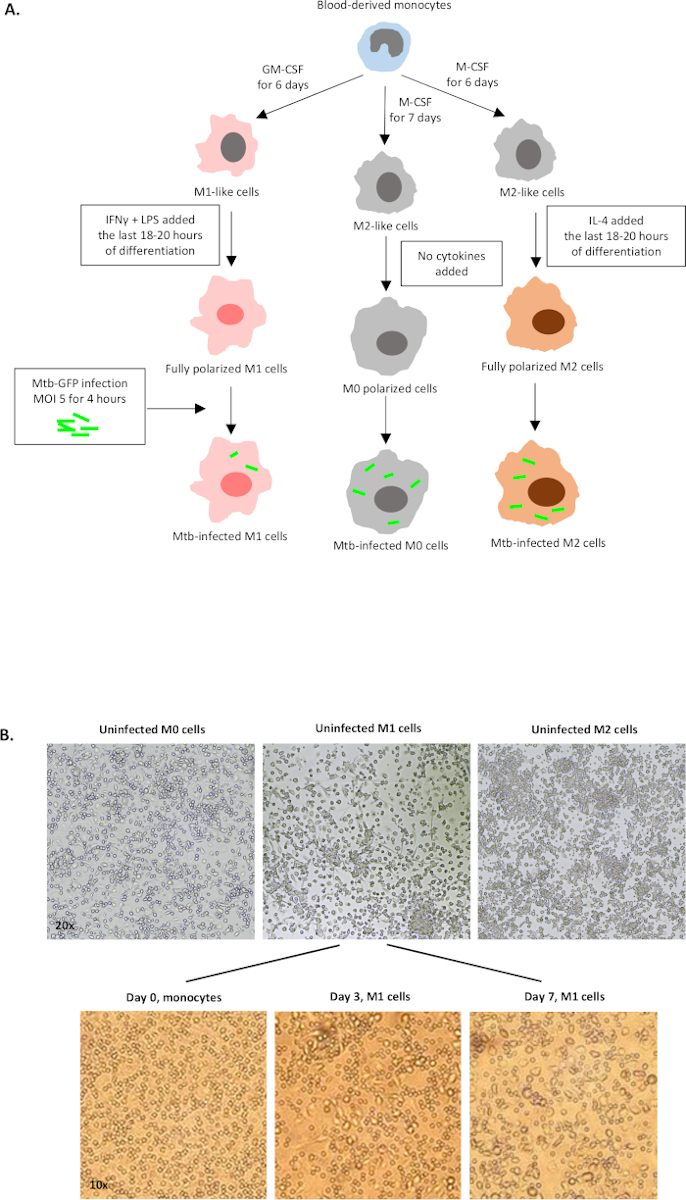
Figura 1: Ilustração esquemática da diferenciação in vitro e polarização das células derivadas do mielóide humano. (A) Células M0 (semelhantes a M2), M1 (classicamente ativadas) e M2 (alternativamente ativadas) são retratadas. Os monócitos obtidos de doadores de sangue saudáveis foram polarizados com diferentes citocinas como descrito no protocolo e infectados com a cepa de Mtb rotulada por GFP, H37Rv, por 4 horas antes da análise com citometria de fluxo de 10 cores. Células polarizadas em M1 normalmente contêm menos bactérias em comparação com células polarizadas por M2. (B) Imagens microscópicas de células M0, M1 e M2 totalmente polarizadas, não infectadas nas placas de 6 poços nos dias 7, e imagens representativas da diferenciação celular M1 dos monócitos nos dias 0, 3 e 7. A ampliação é de 20x (painel superior) e 10x (painel inferior). Observe que as células M1 são mais alongadas e esticadas em comparação com as células M0 e M2 mais arredondadas (painel superior). Clique aqui para ver uma versão maior desta figura.
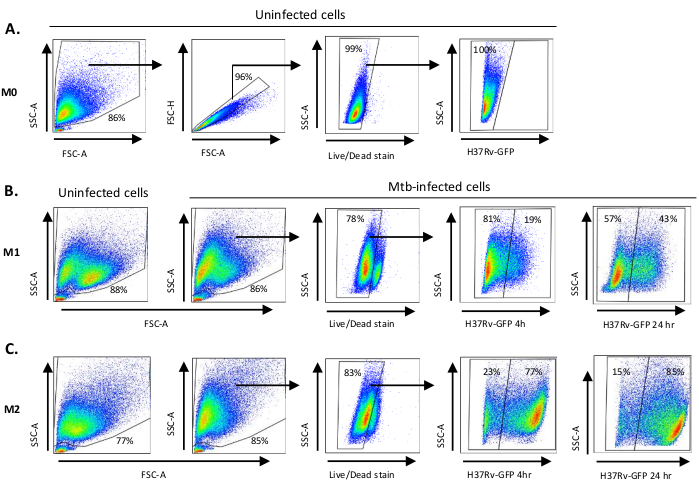
Figura 2: Estratégia de gating de células diferencialmente polarizadas derivadas de mielóides. Gráficos de pontos representativos mostrando(A) Dispersão para a frente (FSC) e propriedades de dispersão lateral (SSC) de macrófagos M0 não infectados. O enredo FSC-A/FSC-H mostra gating manual de células únicas proporcionais para área e altura. O portão de celular ao vivo excluiu células positivas para Zombie-UV (corante de viabilidade). O Mtb intracelular foi detectado pela expressão GFP em células vivas observadas no canal FITC. (B) Gating de macrófagos M1 e (C) M2 mostrando gráficos de pontos FCS/SSC de ambas as células não infectadas e células infectadas por Mtb 4h e 24 h pós-infecção. Clique aqui para ver uma versão maior desta figura.

Figura 3: Eficácia do protocolo de polarização in vitro M1/M2. Gráficos de pontos representativos e gating quadrante mostrando frequências subconjuntas de células polarizadas M1 e M2 usando células manchadas de CD64 e CD86 (M1) ou CD163 e CD200R (M2) em (A)células não infectadas e(B)células manchadas infectadas por Mtb 4h após a infecção. As parcelas de pontos em (B) ilustra a intensidade de fluorescência da expressão GFP (mapa de calor) em macrófagos polarizados M1 e M2 obtidos de diferentes sub-portões. (C) A média geométrica da intensidade da fluorescência (FIM) é mostrada em histogramas de um doador representativo após 4h de infecção por Mtb. Os valores MFI em células M1 não infectadas (azul claro) e M2 (roxo claro) são apresentados no painel superior e as células M1 (azul profundo) e M2 (roxo profundo) são apresentadas no painel inferior. (D) São mostradas imagens confocal representativas de células polarizadas M1 e M2 infectadas por Mtb. As células M1 e M2 foram manchadas para a expressão CD64 e CD163, respectivamente, utilizando imunofluorescência. A coloração positiva da superfície é mostrada em bactérias intracelulares vermelhas e expressas por GFP é mostrada em verde. Os núcleos manchados de DAPI são mostrados na cor azul. Escala – 10 μm. A ampliação das imagens à direita é de 350x. Clique aqui para ver uma versão maior desta figura.
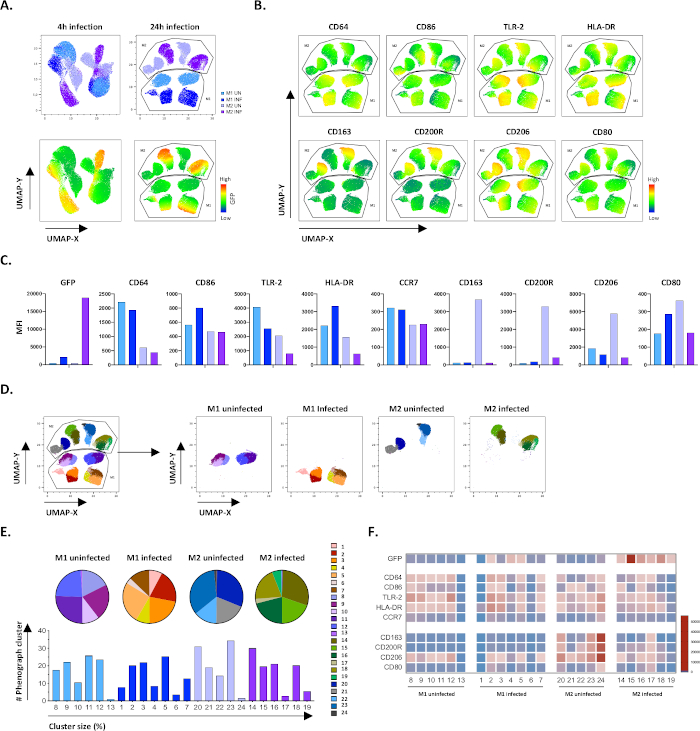
Figura 4: Redução de dimensionalidade com Aproximação e Projeção Uniforme (UMAP) e análise de fenômenos de células M1 e M2 infectadas por Mtb. (A) UMAP, criado pela concatenação de 11000 células vivas de culturas células M1 e M2 não infectadas e infectadas por Mtb de dois doadores de sangue representativos, 4 h (gráficos esquerdos) ou 24 h (gráficos à direita) pós-infecção. O mapa de calor para expressão de GFP (painel inferior) indica células não infectadas e infectadas por Mtb. (B-C) MFI de marcadores expressos em células M1 e M2 infectadas por Mtb 24 h pós-infecção, mostrados como(B) mapa de calor ou(C) parcelas de barras. (D-F) A análise do fenógrafo identificou 24 clusters que estão distribuídos diferencialmente entre as culturas M1 e M2 não infectadas e infectadas por Mtb. Os clusters 8-13 são únicos em células M1 não infectadas, os clusters 1-7 são únicos em células M1 infectadas por Mtb, os clusters 20-24 são únicos em células M2 não infectadas e os clusters 14-19 são únicos em células M2 infectadas por Mtb. O MFI de cada marcador em cada cluster de fenógrafo é mostrado em(F). Os dados são apresentados como células M1 (azul claro) e M2 (roxo claro) e Mtb infectadas células M1 (azul profundo) e M2 (roxo profundo). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Lista de anticorpos utilizados para citometria de fluxo.
| laser | filtro | Fluorochrome | fenótipo | função | clone | Catálogo nº. | companhia |
| 639 | 670/30 | AF647 | TLR2 | Receptor de reconhecimento de patógenos | TL2.1 | 309714 | Biolegend |
| 639 | 780/60 | APC-Cy7 | CD206 | Receptor de mann | 15-2 | 321120 | Biolegend |
| 405 | 610/20 | BV605 | CD163 | Receptor de catadores | GHI/61 | 333616 | Biolegend |
| 405 | 670/30 | BV650 | CD80 | Molécula co-estimulante | 2D10 | 305227 | Biolegend |
| 405 | 710/50 | BV711 | CCR7 | Receptor de quimioterapia | G043H7 | 353228 | Biolegend |
| 405 | 780/60 | BV785 | CD86 | Molécula co-estimulante | IT2.2 | 305442 | Biolegend |
| 488 | 530/30 | GFP | Mtb | Bactérias intracelulares | |||
| 561 | 586/15 | Pe | CD200R | Receptor inibidor | OX-108 | 329306 | Biolegend |
| 561 | 620/14 | PE/DAZZLE 594 | CD64 | Receptor gama-I do IgG | 10.1 | 305032 | Biolegend |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | Molécula classe II MHC | L243 | 307608 | Biolegend |
| 355 | 450/50 | BUV395 | Corante de viabilidade | Marcador de célula ao vivo/morto | UV zumbi | 423108 | Invitrogen |
Discussão
Este protocolo experimental descreve a polarização eficaz das células derivadas de meloides em fenótipos M1 ou M2, incluindo avaliação com um painel de citometria de fluxo de 10 cores que permite visualização e caracterização profunda de Mtb rotulados por GFP em diversos subconjuntos de macrófagos. Embora a TB seja uma doença humana antiga, atualmente não há modelo padrão dourado para estudar interações Mtb-macrófago, e a citometria de fluxo multicolorida dos macrófagos pode ser complicada em comparação com análises de respostas linfócitos. Poucos protocolos disponíveis para diferenciação in vitro de monócitos humanos aos macrófagos apresentam profundo conhecimento do tipo de macrófagos gerados. Um protocolo básico para polarização de macrófagos e avaliação citométrica de fluxo da ativação do macrófago usando um painel sólido de marcadores pode provavelmente facilitar tal caracterização e oferecer oportunidades para explorar características adicionais de células polarizadas tratadas em diferentes condições. Isso inclui análises de células cultivadas in vitro, bem como análises de células in vivo em amostras clínicas, ou seja, suspensões pbmc e unicelulares de fluidos corporais (ou seja, lavagem broncoalveolar) ou tecido homogeneizado. Assim, a diferenciação e/ou o estado de ativação de monócitos e macrófagos obtidos dos pacientes podem estar relacionados ao desfecho da doença. Expansão do CD16+CD163+ monócitos no sangue periférico têm sido relatados em pacientes de TB pulmonar30. Uma frequência aumentada de células CD163+ também foi detectada na pele inflamada de pacientes com dermatite atópica31. Da mesma forma, macrófagos semelhantes a CD206+ M2 têm sido mostrados para inibir a proliferação e diferenciação de células no microambiente do tecido adipócito32 e a ser enriquecido em amostras de medula óssea de pacientes com leucemia mielóide aguda (LMA)29. Uma proporção elevada de células CD64 (M1) a CD163 (M2) no sangue inteiro de pacientes com osteoartrite foi encontrada associada à gravidade da doença33. Outro estudo utilizou CD86 (M1) e CD163 (M2) para demonstrar que a alta expressão M1 no tecido se correlacionava com desfecho pior em um subgrupo de tumores cerebrais malignos34.
Existem várias vantagens significativas deste protocolo experimental de citometria de fluxo M1/M2. Este modelo oferece a oportunidade de estudar respostas imunes inatas à infecção virulenta de Mtb e pode ser desenvolvido para conter estudos de respostas imunes adaptativas adicionando células T autólogas juntamente com macrófagos M1 ou M2 em reações de linfocitos mistos (MLRs). O protocolo também é adequado para triagem de medicamentos e testes de diferentes compostos imunomodulatórios e antimicrobianos. Aqui, estudamos anteriormente os efeitos da vitamina D e do inibidor de histona deacetilase fenilbutirato em células derivadas do mieloide após a infecção por Mtb25,35. A citometria de fluxo M1/M2 também pode ser usada para avaliar a ativação do macrófago após o condicionamento com supernacantes de cultura celular ou plasma do paciente. Embora estudos in vivo de co-infecção por TB com HIV ou helmintos ou co-morbidade tb-diabetes possam ser desafiadores, o modelo M1/M2 menos complexo pode facilitar estudos de co-morbidades in vitro. Da mesma forma, o protocolo poderia ser explorado para estudos de transmissão para examinar a infectividade de Mtb das células ou para investigar a fagocítica, bem como a capacidade de apresentação de antígenos de células M1/M2 individuais. A citometria de fluxo M1/M2 também é atraente para uso em estudos de biomarcadores e vacinas, para seguir o prognóstico da doença durante o tratamento e testar terapias voltadas para células derivadas de meloides. É importante ressaltar que uma série de métodos diferentes poderiam ser aplicados paralelamente à citometria de fluxo para avaliação simultânea de fenótipos de polarização macifá-lo e respostas funcionais usando microscopia confocal(Figura 3D),PCR em tempo real, mancha ocidental, ensaios multiplex e ELISA de fatores solúveis na cultura supernascer, bem como avaliação da infectividade e crescimento bacteriano intracelular usando expressão de GFP (citometria de fluxo e microscopia confocal) e unidades de formação de colônias (UFC). A infecção de células M1 ou M2 com bactérias Mtb-GFP também permite classificar as células não infectadas e infectadas por Mtb da mesma amostra para análise de sequenciamento de RNA de células únicas.
O protocolo descrito também tem algumas limitações, incluindo desvantagens técnicas e científicas. A desvantagem usando macrófagos derivados de monocitos de doadores de sangue humano é que a variabilidade do doador muitas vezes é alta e o fato de que as células não estão polarizadas no ambiente fisiológico dos tecidos humanos. Uma grande variabilidade na eficácia da polarização M1/M2 ou na infecciosidade do Mtb entre os doadores pode resultar em problemas com variações intra e interexperimentais, baixo poder estatístico e necessidade de incluir muitos doadores para obter resultados confiáveis. Além disso, a adesão plástica de monócitos de PBMCs resulta em um número dependente de doadores de monócitos/bem que pode eventualmente fornecer um MOI arbitrário que poderia impactar a polarização do macrófago e a viabilidade celular após a infecção por Mtb. Passos críticos no protocolo envolvem a lavagem adequada para evitar que outros tipos de células contaminem as culturas celulares que também poderiam afetar a polarização do macrófago. Embora um MOI muito baixo possa imitar uma infecção latente de TB, um MOI muito alto matará as células, destacando a importância de usar um MOI apropriado. Além disso, pode ser difícil recuperar células firmemente aderentes após o desprendimento, o que pode resultar em uma representação tendenciosa de certos subconjuntos de macrófagos usados para análises de citometria de fluxo. Um passo crucial na análise da citometria de fluxo envolve o uso adequado da matriz de compensação de contas e controles negativos, como células não manchadas ou controles FMO (Fluorescence Minus One) para garantir a gengização manual correta.
Outra limitação envolve a polarização de monócitos derivados do sangue e não do ambiente de tecido local. A marca registrada da TB humana é a formação de granulomas em tecidos infectados por Mtb e, portanto, a imunopatologia na TB deve ser preferencialmente estudada no local do tecido. No entanto, os monócitos são recrutados para o pulmão a partir do sangue periférico após inflamação/infecção, onde as células podem se diferenciar em macrófagos na presença de citocinas inflamatórias como GM-CSF12. É importante ressaltar que, no meio fisiológico do tecido in vivo, há provavelmente uma grande heterogeneidade da polarização do macrófago, incluindo uma mistura e diferentes proporções de diversas populações de macrófagos semelhantes a M1 e M2 que contribuem para o destino da infecção por TB36. Desenvolvemos anteriormente um modelo de tecido pulmonar organotipado humano que permite estudos 3D de formação de granuloma mediado por macrófago na TB37. Pode ser interessante explorar o atual protocolo de polarização M1/M2 em combinação com o modelo de tecido pulmonar para estudar melhor a formação de granuloma da TB, funções de efeitos e razão M1/M2 em tecido experimental.
Este protocolo de flucittometria de fluxo M1/M2 poderia ser prontamente adaptado para incluir um painel estendido de marcadores mieloides úteis para avaliação de características associadas a respostas inibitórias, bem como inflamatórias. Há um grande interesse de pesquisa em moléculas de ponto de verificação imunológica inibitórias como PD-1, SIRP-α, IDO e arginases que poderiam modular as respostas do macrófago38. Nesse contexto, a polarização das células mielóides também pode envolver outros estímulos que promovam macrófagos imunoregulatórios (Mreg) ou células supressoras derivadas de meloides (MDSC) que tem se mostrado envolvida em diversas doenças, incluindo a TB38. Painéis de citometria de fluxo mais avançados dos subconjuntos de macrófago M1/M2/Mreg também podem incluir coloração intracelular de citocinas/quimiocinas IL-1β, TNF-α, IL-10 e MCP-1 ou outros fatores solúveis ou moléculas de efeitos, como óxido nítrico indutível (iNOS) e peptídeos antimicrobianos. Isso poderia aumentar as possibilidades de estudo de respostas polifuncionais de macrófago, semelhante ao que foi amplamente descrito para as células T39.
Atualmente, os painéis de coloração de citometria de fluxo podem incluir até 30-40 cores, o que fornece a capacidade de imunofenótipo múltiplos subconjuntos celulares e moléculas simultaneamente. A configuração experimental básica deste protocolo de citometria de fluxo M1/M2 pode ser usada como uma espinha dorsal compatível com a maioria dos cítrimetros de fluxo antigos, bem como novos citómetros de fluxo e pode ser construído e adaptado de acordo com as necessidades individuais, incluindo os desafios colocados pelo trabalho com mtb virulento em um ambiente BSL-3. Atualmente, técnicas de redução de dimensionalidade como a UMAP estão disponíveis nas novas versões do software de citometria de fluxo, que permite a análise de um grande número de parâmetros gerados em estudos unicelulares essenciais para uma melhor visualização e interpretação de dados de alta dimensão40. As constantes melhorias tecnológicas na citometria de fluxo provavelmente continuarão nos próximos anos, incluindo a combinação de fenotipagem multi-paramétrica juntamente com as capacidades modernas de classificação celular, onde este protocolo pode ser útil em vários ensaios de infecção por Mtb baseados em macrófagos.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos aos nossos colegas da Agência de Saúde Pública da Suécia, Matilda Svensson e Solomon Ghebremichael pela assistência no laboratório BSL-3.
Este trabalho foi apoiado por subsídios da Swedish Heart and Lung Foundation (HLF) (2019-0299 e 2019-0302 à SB), do Conselho Sueco de Pesquisa (VR) (2014-02592, 2019-01744 e 2019-04720 à SB), Fundação de Prevenção à Resistência a Antibióticos (Resista), Fundação Instituto Karolinska e KID à SB (financiamento parcial da educação de doutorado para Marco Loreti) do Instituto Karolinska. A ML foi apoiada pela Swedish Children's Cancer Foundation (TJ2018-0128 e PR2019-0100).
Materiais
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
Referências
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Erratum
Formal Correction: Erratum: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection
Posted by JoVE Editors on 10/14/2020. Citeable Link.
An erratum was issued for: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection. Author and affiliation information was updated.
The author and affiliation information was updated from:
Akhirunnesa Mily1, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha2, Jagadeeswara Rao Muvva1, Magda Lourda1,3, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
3Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
to:
Akhirunnesa Mily1,2, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha3, Jagadeeswara Rao Muvva1, Magda Lourda1,4, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Infectious Diseases Division, International Centre for Diarrhoeal Disease Research, Bangladesh
3Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
4Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados