Method Article
Polarizzazione delle cellule derivate da monociti umani M1 e M2 e analisi con citometria a flusso sull'infezione da tubercolosi del micobatterio
In questo articolo
Erratum Notice
Riepilogo
Questo protocollo fornisce un metodo per studiare l'infezione da Mycobacterium tuberculosis nei macrofagi polarizzati M1 o M2 umani basati sulla differenziazione dei monociti del sangue periferico alle cellule simili a macrofagi che sono infettate dal ceppo virulento H37Rv etichettato GFP e analizzate con citometria a flusso utilizzando un pannello a 10 colori che include l'espressione di marcatori M1/M2 selezionati.
Abstract
I macrofagi umani sono cellule ospiti primarie dell'infezione da Mycobacterium tuberculosis (Mtb) intracellulare e quindi hanno un ruolo centrale nel controllo immunitario della tubercolosi (TB). Abbiamo stabilito un protocollo sperimentale per seguire la polarizzazione immunitaria delle cellule derivate da mieloidi in cellule simili a macrofagi M1 (attivate classicamente) o M2 (attivate alternativamente) attraverso la valutazione con un pannello citometrico a flusso a 10 colori che consente la visualizzazione e la caratterizzazione profonda di Mtb etichettato verde-proteina fluorescente (GFP) in diversi sottoinsiemi di macrofagi. I monociti ottenuti da donatori di sangue sani sono stati polarizzati in cellule M1 o M2 utilizzando la differenziazione con fattore stimolante della macrofagia granulocita (GM-CSF) o fattore stimolante della macrofagia-colonia (M-CSF) seguita da polarizzazione rispettivamente con IFN-γ e lipoppiosaccaride (LPS) o IL-4. Le cellule M1 e M2 completamente polarizzate sono state infettate da Mtb-GFP per 4 ore prima che i macrofagi infetti da Mtb staccati fossero macchiati di citometria a flusso a 4 o 24 ore dopo l'infezione. L'acquisizione del campione è stata eseguita con citometria a flusso e i dati sono stati analizzati utilizzando un software di analisi della citometria a flusso. Sono state eseguite la gating manuale e la riduzione della dimensionalità con l'analisi UMAP (Uniform Manifold Approximation and Projection) e fenografica. Questo protocollo ha portato a un'efficace polarizzazione M1/M2 caratterizzata da livelli elevati di CD64, CD86, TLR2, HLA-DR e CCR7 su celle M1 non infette, mentre le celle M2 non infette presentavano una forte regolazione dei marcatori fenotipo M2 CD163, CD200R, CD206 e CD80. Le cellule polarizzate M1 in genere contenevano meno batteri rispetto alle cellule polarizzate M2. Diversi marcatori M1/M2 sono stati downregolati dopo l'infezione da Mtb, il che suggerisce che mtb può modulare la polarizzazione dei macrofagi. Inoltre, 24 diversi gruppi cellulari di diverse dimensioni sono stati distribuiti in modo univoco tra le cellule non infette M1 e M2 e infettate da Mtb a 24 ore dopo l'infezione. Questo protocollo di citometria a flusso M1/M2 potrebbe essere utilizzato come spina dorsale nella ricerca mtb-macrofagi ed essere adottato per esigenze speciali in diversi settori di ricerca.
Introduzione
I macrofagi sono cellule immunitarie che contribuiscono in modo significativo alla regolazione dell'omeostasi tissutale, dell'infiammazione e delle patologie delle malattie. Essendo una componente essenziale dell'immunità innata, il lignaggio monocita-macrofago delle cellule esprime fenotipi eterogenei in risposta a segnali ambientali alterati, che riflettono la loro plasticità e adattamento a diverse posizioni anatomiche e immunologiche1. A seconda dei fattori di crescita, delle citochine e di altri mediatori presenti nel microambiente, i macrofagi sono stati classificati in due grandi popolazioni reversibili, ognuna con un ruolo diverso nel controllo batterico e nella clearance2:i macrofagi polarizzati M1 pro-infiammatori, attivati classicamente e i macrofagi polarizzati M2 antinfiammatori e alternativamente attivati che sono stati originariamente nominati per imitare la nomenclatura cellulare T helper (Th)3. Questo raggruppamento di macrofagi polarizzati immunitari è spesso considerato semplicistico, poiché l'attivazione e la differenziazione del macrofago non è lineare, ma più accuratamente illustrata come un continuum in cui ogni popolazione ha caratteristiche e ruoli funzionali diversi nel risultato dello sviluppo e della progressione della malattia4,5,6,7. Tuttavia, ci sono numerosi vantaggi sperimentali con il modello di macrofago M1/M2 che possono essere utilizzati in diversi campi di ricerca.
Mycobacterium tuberculosis (Mtb) è l'agente causale della tubercolosi (TB) ed è stato stimato infettare una persona al secondo ed è considerato il singolo agente infettivo più letale al mondo (Global TB report 2019). Poiché le vie respiratorie sono la via principale dell'infezione da Mtb, i macrofagi alveolari sono le cellule ospiti preferite per essere infettate dalla Mtb e rappresentano sia le barriere primarie che il serbatoio infettivo per mtb nei polmoni. La polarizzazione del macrofago in risposta a diversi stimoli è stata ampiamente studiatanel corso degli anni 7 e nella maggior parte del lavoro pubblicato, La polarizzazione M1 delle colture di monociti in vitro è indotta dal fattore stimolante della colonia di granulociti-macrofagi (GM-CSF) insieme a IFN-γ e LPS8,9 ,mentrela polarizzazione M2 è indotta con fattore stimolante della colonia di macrofagi (M-CSF) e IL-410,11. I macrofagi M1 sono potenti cellule effettori che mediano le risposte antimicrobiche contro gli agenti patogeni intracellulari e hanno un ruolo essenziale nell'immunità antitumorale12. I macrofagi M2, d'altra parte, hanno una funzione antinfiammatoria, alta capacità fagocitica e sono principalmente coinvolti nella guarigione delle ferite e nella riparazione dei tessuti, nonché nelle infezioni parassitarie12. Di conseguenza, i macrofagi M1 sono visti come più efficaci nel controllo intracellulare della Mtb rispetto ai macrofagi M213. Tuttavia, i batteri Mtb hanno anche il potenziale per modulare la polarizzazione dei macrofagi per sovvertire l'immunità innata14,15,16,17.
Mentre è comune generare macrofagi dalla differenziazione dei monociti ottenuti dalsangue periferico 18, i macrofagi potrebbero anche essere generati da cellule staminali pluripotenti indotte (IPSC)19 o da macrofagi derivati dal midollo osseodai topi 20,21. Queste sono tecniche fattibili per studiare le cellule primarie di macrofagi ottenute da progenitori monociti /macrofagi che prolifereranno e si distingueranno in una popolazione omogenea di cellule mature simili a macrofagi. Tuttavia, questi protocolli raramente forniscono conoscenze approfondite sul fenotipo e sulla funzione delle cellule ottenute né tengono conto dell'eterogeneità naturale osservata tra i macrofagi ottenuti in vivo. Poiché mtb è un rigoroso agente patogeno umano, c'è anche un vantaggio nello studio della Mtb nei sistemi modello umanizzati. La citometria a flusso è una potente tecnologia che offre la possibilità di valutare molteplici caratteristiche fenotipiche e funzionali di singole cellule in sospensione22,qualcosa che potrebbe essere abbastanza impegnativo con cellule aderenti come i macrofagi che sono anche noti per essere autofluorescenti23,24. Oltre al distacco chimico di macrofagi saldamente aderenti, l'infezione da Mtb può rappresentare un fattore di stress significativo per le cellule che aggiunge un altro livello di complessità nelle analisi citometriche del flusso dei macrofagi infetti da Mtb.
In questo protocollo sperimentale, abbiamo utilizzato un modello di infezione da macrofagi umani precedentemente stabilito basato sulla polarizzazione immunitaria di cellule primarie derivate da periferici-sangue-monociti che sono infettate dal virulento laboratorio Mtb strain H37Rv, e analizzate con citometria di flusso utilizzando un pannello a 10 colori che include l'espressione di marcatori M1 e M2selezionati 25. Questo protocollo fornisce un metodo efficiente e riproducibile per studiare le risposte all'infezione da Mtb nei macrofagi polarizzati derivati dai monociti M1 o M2. Inoltre, l'uso della citometria di flusso su macrofagi aderenti infettati da Mtb ci consente di studiare una varietà di marcatori superficiali associati ai macrofagi convenzionali M1 e M2 e alla loro risposta longitudinale all'infezione da Mtb. È importante sottolineare che questo protocollo può essere facilmente adottato per le indagini sulle infezioni con altri agenti patogeni, negli studi antitumorali o negli studi sulle condizioni infiammatorie, per lo screening dei farmaci ecc. e potrebbe anche essere sfruttato per la valutazione della polarizzazione del macrofago M1 /M2 in campioni clinici umani.
Protocollo
Il sangue periferico umano proveniente da donatori di sangue anonimi sani è stato ottenuto dalla banca del sangue del Karolinska University Hospital, Huddinge, Svezia (approvazione etica Dnr 2010/603-31/4). Tutte le fasi sperimentali che coinvolgono mtb virulento vivo sono state eseguite presso il laboratorio Biosafety Level-3 (BSL-3) presso l'Agenzia per la Sanità Pubblica di Svezia (FOHM), Solna, Svezia.
1. Preparazione di mezzi, tamponi e colture batteriche
NOTA: I dettagli su tutti i reagenti e i materiali di consumo sono forniti nella tabella dei materiali.
- Supporto completo RPMI: Supplemento RPMI 1640 con 1 mM di piruvato di sodio, 2 mM L-glutammina, 10 mM HEPES e 10% siero bovino fetale inattivato termicamente (FBS). Evitare gli antibiotici nel mezzo di coltura cellulare quando si lavora con l'infezione da Mtb.
- Mezzo RPMI senza siero: Supplemento RPMI 1640 con 1 mM di piruvato di sodio, 2 mM L-glutammina e 10 mM HEPES.
- Tampone di lavaggio: Preparare la salina tampone fosfato (PBS) contenente 0,05% (v/v) Tween-80.
- Buffer FACS: preparare PBS contenente 2,5% (v/v) FBS e 0,5 mM EDTA.
- Buffer di fissazione: preparare pbs contenente formaldeide al 4% a PBS. Assicurarsi che sia preparato al momento prima dell'uso, ad esempio miscelato da una soluzione stock di formaldeide al 37%.
- Tampone di permeabilizzazione: Aggiungere lo 0,1% di citrato di sodio e lo 0,1% di Tritone X-100 all'acqua deionizzata.
- Tampone di lavaggio (per immunofluorescenza): preparare PBS contenente lo 0,1% di BSA e lo 0,1% di Tween-20.
- Tampone di blocco: preparare pbs contenente 0,1% BSA e 10% siero di capra normale (NGS) a PBS.
- Tampone di colorazione (per immunofluorescenza): Preparare pbs contenente 0,1% BSA a PBS.
- Tb supporto completo: Supplemento Middle Brook 7H9 brodo con 0.05% (v/v) Tween-80, 0.5% (v/v) glicerolo, kanamicina (20 μg/mL), 10% (v/v) Middlebrook acido oleico, albumina, destrosio e arricchimento catalasi (Middlebrook OADC Enrichment).
- Colture batteriche: Utilizzare il ceppo di laboratorio standard virulento Mtb, H37Rv, che esprime in modo costitutivo proteina fluorescente verde (GFP), per l'infezione di cellule derivate da monociti. Questo ceppo mtb trasporta un plasmide pFPV2 che contiene un gene che codifica per la GFP, così come un gene per la resistenza alla kanamicina. La resistenza agli antibiotici consente la selezione continua di batteri che esprimono plasmidi in colture contenenti kanamicina. Conservare i batteri in TB mezzo completo e 70% glicerolo (diluizione 1:1) a -80 °C.
2. Isolamento delle cellule mononucleari del sangue periferico dai cappotti buffy
NOTA: Eseguire tutti i lavori con sangue umano (potenzialmente contagioso) all'interno di un armadietto di biosicurezza di classe II. Inattivare gli emoderivati residui con disinfettanti per 15 minuti prima di scartare. Il sangue è stato ottenuto da volontari sani in questo caso. Questo protocollo di differenziazione dei macrofagi in vitro è stato istituito per includere 10 x 106 PBPC/donatori/pozzi isolati. Da ogni donatore, un mantello di buffy contiene circa 50 mL di una sospensione concentrata di leucociti originata da sangue intero, che normalmente fornisce 500-800 x 106 PBBC da cui è possibile recuperare circa il 10% o 50-80 x10 6 monociti.
- Caricare 15 ml di sangue di buffy coat sopra 15 ml di mezzo gradiente di densità preparato in tubo da 50 ml. Sovrapporre lentamente il sangue sopra lo strato di gradiente di densità appoggiando la punta della pipetta alla parete del tubo.
- Ruotare i tubi a 600 x g per 25 minuti a temperatura ambiente (RT) con accelerazione 0 e decelerazione 0.
NOTA: Chiudere attentamente i coperchi prima della centrifugazione e controllare sempre i supporti del tubo per verificarne la potenziale fuoriuscita dopo la centrifugazione. - Rimuovere lo strato plasmatico superiore con una pipetta Pasteur sterile e successivamente raccogliere con cura lo strato di cellule mononucleari in un nuovo tubo da 50 ml utilizzando una pipetta Pasteur sterile. Aggiungere il mezzo RPMI privo di siero al pellet PBMC per ottenere un volume finale di 50 mL. Mescolare con cura invertendo il tubo alcune volte prima della centrifugazione a 500 x g per 5 minuti a RT.
- Scartare attentamente il supernatante e rimescolare il pellet cellulare capovolgendo il fondo del tubo all'interno delle dita.
- Per rimuovere la contaminazione media del gradiente di densità dai PBMC, lavare le celle 2-3 volte con RPMI senza siero per ottenere un volume finale di 50 mL. Centrifugare a 500 x g per 5 minuti a RT. Lavare fino a quando il supernatante cellulare diventa trasparente.
- Scartare il supernatante e rimescolare le cellule in 20 mL di mezzo RPMI privo di siero.
- Contare le cellule mediante colorazione blu tripano, utilizzando manualmente un emocitometro o utilizzando un contatore di celle automatizzato. Diluire la sospensione cellulare in blu trypan in diluizione 1:2 o 1:10 mescolando il campione blu di trypan cellulare in una piastra di 96 pomp pomenti, ad esempio 50 μL + 50 μL (per il conteggio dell'emocitometro) o 10 μL + 10 μL (per il conteggio automatico delle celle) e contare le cellule per ottenere il numero di cellule vive / mL.
ATTENZIONE: Il blu di trypan è tossico e deve essere scartato in uno spreco chimico separato.
3. Differenziazione e polarizzazione delle cellule derivate dai monociti
NOTA: Per la differenziazione e la polarizzazione delle cellule derivate dai monociti, è stato seguito un protocollo che abbiamo precedentemente stabilito per le cellule simili a M0, M1 e M2, nonché per le cellule polarizzate completamente M1 e M225. Per semplicità, qui sono descritti solo i macrofagi M1 e M2 completamente polarizzati.
- Utilizzare l'aderenza plastica per l'isolamento dei monociti. In breve, sementi pbmc appena isolati in una piastra di coltura a 6 pozzi ad una concentrazione appropriata, ad esempio 10 x 106 PBMC/pozzo in mezzo RPMI privo di siero da 2 mL e incubare a 37 °C e 5% CO2.
- Dopo 2-3 ore, rimuovere le cellule non aderenti con una pipetta e lavare i pozzi 3 volte con un mezzo privo di siero da 1 mL. Le cellule attaccate sono monociti e comprendono circa il 10% del totale dei PBBC aggiunti al pozzo, cioè 106 monociti recuperati da 10 x 106 PBBC aggiunti per pozzo.
- Per la differenziazione dei macrofagi, preparare una soluzione di lavoro contenente rispettivamente 50 ng/mL GM-CSF o M-CSF per la polarizzazione del macrofago M1 e M2, aggiunta in 2 mL di mezzo completo RPMI per pozzo. Coltura delle cellule in un incubatore di CO2 al 5% in 37 °C per 3 giorni.
- Il giorno 3, rimuovere con cura 1 mL del mezzo di coltura cellulare dallo strato superiore di ogni pozzo e integrare le colture cellulari con 1 mL di mezzo completo RPMI fresco contenente la doppia concentrazione di M-CSF o GM-CSF per ottenere una concentrazione finale di 50 ng / mL nei pozzi. Aggiungere i fattori di crescita in una soluzione di lavoro prefazione di 100 ng/mL/pozzo.
- Il giorno 6, aggiungere diversi stimoli per gli ultimi 18-20 h di differenziazione cellulare per ottenere M1 completamente polarizzato e maturo (interferone-γ; IFN-γ, e lipolysaccharide; LPS (E. coli O55:B5)) o M2 (interleuchina 4; IL-4) macrofagi. Per la polarizzazione M1, preparare IFN-γ e LPS nel mezzo completo RPMI e aggiungere 50 μL per pozzo per ottenere una concentrazione finale di 50 ng/mL IFN-γ e 10 ng/mL LPS nelle colture cellulari. Per la polarizzazione M2, preparare IL-4 in RPMI mezzo completo e aggiungere 50 μL per pozzo per ottenere una concentrazione finale di 20 ng/mL nelle colture cellulari.
- Per la differenziazione dei macrofagi polarizzati M0, stimolare le cellule solo con M-CSF, senza ulteriori citochine (fornendo un fenotipo simile a M2)25.
- Controllare regolarmente la morfologia delle colture cellulari derivate dai monociti con microscopia ottica per assicurarsi che i monociti più piccoli siano differenziati in cellule macrofagi più grandi. Inoltre, monitorare le potenziali differenze morfologiche tra la polarizzazione M1 e M2, cioè le cellule M1 allungate e allungate rispetto alle cellule M2 con una forma più arrotondata25.
- Il giorno 7, trasferire le piastre con cellule derivate da monociti in un laboratorio BSL-3 per l'infezione da Mtb virulento.
4. Preparazione delle colture mtb
NOTA: I seguenti passaggi devono essere eseguiti in una struttura BSL-3. Per tutti i lavori con Mtb virulento, utilizzare indumenti protettivi, protezione respiratoria e guanti resistenti all'etanolo.
- Scongelare una fiala con 1 ml di aliquota batterica e mescolare con 9 ml di TB mezzo completo (diluizione 1:10) in un tubo filtrato a cappuccio da 50 ml. Coltura la sospensione in un incubatore a 37 °C e 5% CO2.
- Dopo 24 ore, ruotare la sospensione batterica a 2.300 x g per 10 minuti e versare con cura il mezzo. Resopendare il pellet batterico con 15-20 ml di tb fresco mezzo completo in un nuovo tubo di coltura del tappo filtrato da 50 ml e incubare a 37 °C e 5% CO2. Mescolare i batteri sistemati nel tubo ogni 2-3 giorni per mantenere un apporto omogeneo di nutrienti per tutte le cellule batteriche.
- Dopo 7-10 giorni, mescolare correttamente le sospensioni batteriche tubazioni su e giù prima di trasferirsi in un tubo del tappo a vite da 50 ml.
- Aggiungere 35-40 ml di tampone di lavaggio sterile al tubo da 50 ml e ruotare la sospensione batterica a 2.300 x g per 10 min. Ripetere i passaggi di lavaggio una volta. Resuspend il pellet batterico in 1 mL di mezzo RPMI privo di siero pipettando con una micropipetta.
- Aggiungere altri 9 mL di mezzo RPMI privo di siero e sonicare la sospensione batterica all'interno di un armadio di biosicurezza di classe II per 5 minuti a 37 °C, per interrompere i grumi batterici. Immergere ripetutamente il tubo (3-4 volte) nel sonicatore del bagno d'acqua per garantire la massima interruzione dei grumi batterici. Misurare la densità ottica (OD) di 1 mL di sospensione batterica a 600 nm di lunghezza d'onda utilizzando uno spettrofotometro posto all'interno dell'armadio di biosicurezza. Utilizzare un supporto RPMI privo di siero per impostare il riferimento.
- Calcolare il numero di unità di formazione delle colonie (CFU) usando la formula: (OD+0.155)/0,161 = Y e Y x 107= Y x 106 CFU/mL, ad esempio, un valore OD 0,32 fornisce una concentrazione batterica di (0,32 + 0,155)/0,161 = 2,95, 2,95 x 107= 29,5 x 106 CFU/mL.
5. Infezione da mtb di cellule derivate da monociti
NOTA: I seguenti passaggi devono essere eseguiti in una struttura BSL-3.
- Resuspend il pellet batterico in mezzo RPMI privo di siero in un nuovo tubo sterile da 50 ml e regolare la concentrazione batterica finale a circa 5 x 106 CFU/mL.
- Rimuovere il supporto di coltura cellulare dalle 6 lastre di pozzo contenenti cellule derivate da monociti. Aggiungere 1 mL di mezzo RPMI privo di siero ad ogni pozzo. Aggiungere 1 mL di sospensione batterica per pozzo per ottenere una molteplicità di infezione (MOI) 5:1, cioè 5 x 106 CFU per 106 macrofagi in 2 mL / pozzo e incubare le piastre per 4 ore in 37 °C e 5% CO2.
- Dopo l'infezione, lavare le cellule 3 volte con 1 mL di tampone di lavaggio sterile per rimuovere i batteri extracellulari. Inclinare la piastra e rimuovere con cura l'intero tampone di lavaggio dagli angoli. Rimostrare le cellule derivate da monociti infetti da Mtb in 2 mL di mezzo completo RPMI senza antibiotici e procedere alla colorazione citometrica del flusso o incubare le cellule per altri 24 h (o altri punti di tempo) prima della citometria del flusso.
6. Colorazione citometrica a flusso di cellule derivate da monociti infetti da Mtb
NOTA: I seguenti passaggi devono essere eseguiti in una struttura BSL-3. La colorazione citometrica del flusso potrebbe essere eseguita in una piastra da 96 po 'invece che in tubi.
- Staccare le cellule infette da Mtb (e i controlli non infetti) dai pozzi nelle 6 piastre del pozzo per incubazione con 1 mL di tampone FACS per pozzo per almeno 30 minuti a 37 °C e 5% CO2.
- Pipettare delicatamente su e giù alcune volte per assicurarsi che le cellule siano staccate. Se possibile, confermare il distacco cellulare con la microscopia. Trasferire la sospensione cellulare da ogni pozzo a un tubo di microcentrifugo chiuso a vite e ruotare i tubi a 200 x g per 5 min. Scartare attentamente il supernatante pipettando.
- Lavare il pellet di cella in ogni tubo due volte con tampone FACS e ruotare le celle a 200 x g per 5 minuti.
- Macchiare le cellule (circa 0,5 x 10da 6 a 1 x 106 celle/tubo) con circa 50 μL di anticorpi anti-umani coniugati al fluorocromo tra cui TLR2 (AF647), CD206 (APC-Cy7), CD163 (BV605), CD80 (BV650), CCR7 (BV711), CD86 (BV786), CD200R (PE), CD64 (PE-Dazzle 594), HLA-DR (PE-Cy5)(Tabella 1)in combinazione con colorante di vitalità Zombie-UV per 30 min a 4 °C (frigorifero) al buio.
- Lavare le celle macchiate due volte con 400 μL di tampone FACS e far girare le cellule a 200 x g per 5 min.
- Fissare le celle macchiate con 200 μL di tampone di fissazione (appena preparato) per 30 minuti a RT al buio per garantire la completa inattivazione dei micobatteri.
- Lavare le cellule due volte con 400 μL di tampone FACS e girare a 200 x g per 5 minuti per rimuovere il buffer di correzione in eccesso.
- Rimescolare le celle fisse in 400 μL di tampone FACS e trasferire i campioni in nuovi tubi di microcentrifugo da 1 ml prima di esmetterli dal laboratorio BSL-3 per la citometria a flusso in BSL-2. Conservare le celle macchiate in +4 °C fino all'acquisizione del campione.
NOTA: Spruzzare i tubi con etanolo al 70% prima di estenerli dal laboratorio BSL-3. La formaldeide è tossica (cancerogena) e deve essere maneggiata in un armadio di biosicurezza di classe II. Scartare i rifiuti di formaldeide in un rifiuto chimico separato.
7. Acquisizione e analisi di dati citometrici a flusso di cellule derivate da monociti infetti da Mtb
NOTA: I passaggi da 7.1 a 7.2 devono essere eseguiti prima della colorazione citometrica del flusso sopra descritta. Per evitare problemi con il raggruppamento cellulare e la dissociazione dei coloranti tandem dopo la fissazione cellulare, l'acquisizione del campione di cellule infettate da Mtb e non infette viene eseguita entro 4-10 ore dopo la colorazione degli anticorpi primari.
- Prima della colorazione citometrica del flusso sopra descritta, compensare il segnale fluorescente per ogni anticorpo coniugato a fluorocromo elencato nel pannello di colorazione (Tabella 1) utilizzando perline di compensazione (sia positive che negative).
- Titolare la diluizione anticorpale per la colorazione dei macrofagi umani per ottenere il segnale ottimale per ogni fluorocromo.
- Utilizzare celle non macchiate per determinare il livello di fluorescenza di fondo necessario per impostare il gate per la popolazione di cellule negative consentendo la visualizzazione delle celle macchiate (i macrofagi sono altamente fluorescenti auto).
- Acquisire un minimo di 50.000 celle/campione nel citometro di flusso utilizzando il software consigliato per l'acquisizione dei dati.
- Esportare i file di acquisizione dal citometro di flusso nel formato FCS (Flow Cytometry Standard) 3.1.
- Analizzare i file FCS nel software di analisi della citometria a flusso.
- Gate macrofagi in base alle loro caratteristiche di dispersione avanti e laterale (FSC e SSC) ed escludere le cellule morte dalla gating cellulare viva / morta utilizzando il colorante zombie-UV viability.
- Visualizzare macrofagi infetti da H37Rv-GFP nel canale FITC.
- Identificare la frequenza delle cellule macchiate positivamente e l'intensità geometrica media della fluorescenza (IFM) per tutti i marcatori(tabella 1).
8. Colorazione dell'immunofluorescenza delle cellule derivate da monociti infetti da Mtb
NOTA: L'infezione da mtb deve essere eseguita in una struttura BSL-3.
- Per l'immunosocinazione, sementi 2 x10 5 PBMC/pozzo in 500 μL di mezzo RPMI privo di siero in 8 scivoli a camera di pozzo per ottenere 2 x 104 monociti/pozzo. Dopo la differenziazione e la polarizzazione M1/M2 dei monociti, procedere con l'infezione da Mtb come descritto sopra. Fissare le diapositive dopo 24 ore di infezione da Mtb con tampone di fissazione per 30 min. Le diapositive fisse vengono conservate nel congelatore a -20 °C fino a ulteriori analisi.
- Lavare due volte le cellule derivate dai monociti con 200 μL di PBS per 10 minuti ciascuna.
- Permeabilizzare le cellule con 200 μL di tampone di permeabilizzazione per 5 minuti a RT.
- Lavare le cellule 3 volte con 200 μL di PBS per 5 minuti ciascuna.
- Lavare le cellule due volte con 200 μL di tampone di lavaggio per 5 minuti ciascuna.
- Blocca l'associazione non specifica con 200 μL di buffer di blocco per 30 minuti a RT.
- Diluire gli anticorpi primari 1:100 nel tampone di colorazione e incubare le cellule M1 con un anticorpo CD64 non coniugato (Clone: 10.1) e le cellule M2 con un anticorpo CD163 non coniugato (policlonale) per 2 h a RT.
- Quindi, lavare le cellule 3 volte con 200 μL di tampone di lavaggio per 10 minuti ciascuna.
- Diluire gli anticorpi secondari etichettati fluorescenti 1:1,000 nel tampone di colorazione e incubare le cellule M1 con un anti-topo IgG-Alexa Fluor 594 e le cellule M2 con un anti-coniglio IgG-Alexa Fluor 594 per 1 h a RT.
- Lavare le cellule 3 volte con tampone di lavaggio da 200 μL per 10 minuti ciascuna.
- Rimuovere la griglia della camera e aggiungere ~20 μL di supporto di montaggio DAPI in ogni pozzo e mettere un coverslip da 1,5 mm su ogni diapositiva.
- Sigillare il coverslip con uno strato di smalto per unghie.
- Acquisire immagini utilizzando un microscopio confocale con laser che emettono rispettivamente a 486 nm per l'eccitazione di GFP (canale verde), 402 nm per DAPI (blu) e 560 nm per anticorpi secondari (rosso).
Risultati
Un'illustrazione schematica delle stimolazioni citochine utilizzate per la polarizzazione delle cellule derivate dai monociti in M0 (cellule simili a M2), M1 (cellule M1 completamente polarizzate) e M2 (cellule M2 completamente polarizzate) è presentata nella figura 1A, mentre le immagini rappresentative delle colture cellulari M0, M1 e M2 e delle colture M1 al giorno 0, 3 e 7, sono mostrate nella figura 1B. Le celle M0 non infette sono state utilizzate per dimostrare la strategia di base della gating (Figura 2A). Inizialmente, le cellule mieloidi (~85%) sono state gated in base alle loro proprietà di dispersione in avanti (FSC) e dispersione laterale (SSC), comprese le celle più grandi con elevata granularità ed escludendo i detriti di piccole dimensioni con un basso SSC e FSC che si trovano nell'angolo in basso a sinistra del grafico a punti. Nel secondo grafico, i farsa (cioè i grumi cellulari) sono stati definiti come aventi un'area aumentata ma un'altezza simile rispetto alle singole cellule e sono stati esclusi da ulteriori analisi. Pertanto, solo le celle proporzionate tra FSC-Area e FSC-Height (singole celle) sono state incluse all'interno del cancello della forma inclinata. Successivamente, il colorante zombie-UV che macchia le proteine citoplasmatiche all'interno delle cellule morte, è stato utilizzato per escludere le cellule morte dalle analisi successive. Come previsto, le cellule M0 non infette vitali erano negative per l'espressione Mtb-GFP visualizzato nel canale FITC.
Successivamente, abbiamo applicato la stessa strategia di gating ai macrofagi M1 e M2 infetti da Mtb a 4 ore dopo l'infezione(Figura 2B,C). Due sotto-popolazioni sono state rilevate nella porta FCS/SSC di macrofagi polarizzati M1 non infetti; una popolazione con dimensioni più piccole (FCS) e maggiore granularità (SSC) e l'altra popolazione con dimensioni maggiori e granularità inferiore (Figura 2B), mentre la porta principale delle celle M2 non infette è apparsa più omogenea (Figura 2C). Sia le cellule derivate da monociti M1 che M2 hanno mostrato uno spostamento verticale verso una maggiore granularità e una ridotta dimensione cellulare all'infezione da Mtb, che può riflettere una maggiore complessità all'interno delle cellule causata dall'assorbimento di batteri Mtb intracellulari (Figura 2B,C). Inoltre, la macchia di vitalità ha rivelato una morte cellulare migliorata (17-22%) tra le cellule M1 e M2 infettate da Mtb con un MOI di 5, rispetto alle cellule M0 non infette (99%) (Figura 2Celle A-C) o M1 e M2 non infette (dati non visualizzati). I dati rappresentativi hanno mostrato che l'espressione mtb-GFP (cioè l'infettività mtb) era sostanzialmente più alta nelle cellule M2 (77% GFP-positive) rispetto alle cellule M1 (19% cellule positive alla GFP) dopo 4 ore di infezione(figura 2B,C). Dopo 24 ore di infezione, l'espressione mtb-GFP era rispettivamente del 43% e dell'85% nelle cellule M1 e M2, suggerendo che le cellule M1 avevano un aumento relativamente più elevato dell'espressione della GFP da 4 a 24 ore dopo l'infezione da Mtb rispetto alle cellule M2, rispettivamente del 126% contro il 10,4% dell'espressione GFP nelle cellule M1 e M2 da 4 a 24 ore.
Per caratterizzare l'efficacia della polarizzazione M1/M2 in cellule derivate da monociti non infetti, sono stati utilizzati grafici a punti per identificare le cellule M1 che erano double-positive per CD64 e CD86 (CD64+CD86+) e M2 che erano double-positive per CD163 e CD200R (CD163+CD200R+; Figura 3A,B). La selezione dei marcatori M1/M2 è stata effettuata principalmente sulla base dei risultati del nostro precedentelavoro 25 ma anche da altristudi 26,27,28,29. I quadranti per le celle macchiate, sono stati impostati utilizzando cancelli corrispondenti per celle M1/M2 non macchiate (Figura 3A). Nessuno di questi marcatori è espresso esclusivamente da cellule M1 o M2, ma la proporzione di cellule positive e l'intensità dell'espressione superficiale è diversa. Ciò è stato particolarmente evidente dalla macchia M1, dove circa il 95% delle cellule M1 e il 79% delle cellule M2 erano CD64+CD86+, ma l'intensità di colorazione era sostanzialmente più elevata nel sottoinsieme M1(Figura 3A). Mentre il 27% delle cellule M1 era positivo per il CD200R marcatore M2, solo l'1% era positivo per CD163, fornendo lo 0,5% di cellule CD163+CD200R+ M1 rispetto al 63% di cellule CD163+CD200R+ M2(Figura 3A). Dopo 4 ore di infezione da Mtb, è stato osservato un aumento della frequenza delle cellule CD200R+ nelle cellule polarizzate Mtb-GFP-positive M1 (16%), mentre l'espressione cd163 è stata ridotta nelle cellule M2 (Figura 3B). La mappa termica mostra un'alta intensità di espressione GFP nelle celle CD163+CD200R+ M2, ma anche nel sottoinsieme CD64+CD86+ M2 rispetto ai sottoinsiemi di celle M1 corrispondenti (Figura 3B). Nel complesso, lo spostamento nell'espressione dei rispettivi marcatori M1 e M2 viene visualizzato anche negli istogrammi nella figura 3C. Inoltre, i batteri Mtb-GFP sono stati visualizzati anche nelle cellule CD64+ M1 e nelle cellule CD163+ M2 mediante microscopia confocale, che supportava un maggiore assorbimento intracellulare e/o crescita della Mtb all'interno di M2 rispetto alle cellule M1(Figura 3D).
Per verificare i risultati della gating manuale, abbiamo applicato la riduzione della dimensionalità utilizzando UMAP (Uniform Manifold Approximation and Projection). L'analisi dell'UMAP ha mostrato che l'infezione da Mtb per 4 ore non era sufficiente a influenzare la polarizzazione dei macrofagi, a differenza di 24 ore di infezione, il che ha portato a cluster chiaramente separati di cellule non infette e infette da M1 e M2 (Figura 4A). I macrofagi M1 non infetti mostravano un'espressione più elevata di CD64, CD86, TLR2, HLA-DR e CCR7 rispetto ai macrofagi M2, mentre le celle M2 non infette mostravano una forte regolazione dei marcatori fenotipo M2 CD163, CD200R, CD206 e CD80(Figura 4B,C). In accordo con la gating manuale, l'infezione da Mtb dopo 24 ore ha causato una netta downregolazione di CD163, CD200R e CD206 sulle cellule M2 e l'upregolazione di CD86 e HLA-DR su cellule M1 (Figura 4B,C), il che suggerisce che mtb può modulare la polarizzazione del macrofago. La successiva analisi fenografica (figura 4D-F) ha identificato 24 diversi cluster di diverse dimensioni che sono stati distribuiti in modo univoco tra le cellule non infette m1 e M2 e infettate da Mtb, come illustrato nei grafici UMAP (Figura 4D), grafici a torta (Figura 4E) e mappe di calore(figura 4F). Complessivamente, questi risultati mostrano una promettente efficienza di questo protocollo per generare cellule polarizzate M1 e M2 fenotipicamente e funzionalmente diverse in vitro che sono ulteriormente modulate dall'infezione da Mtb.
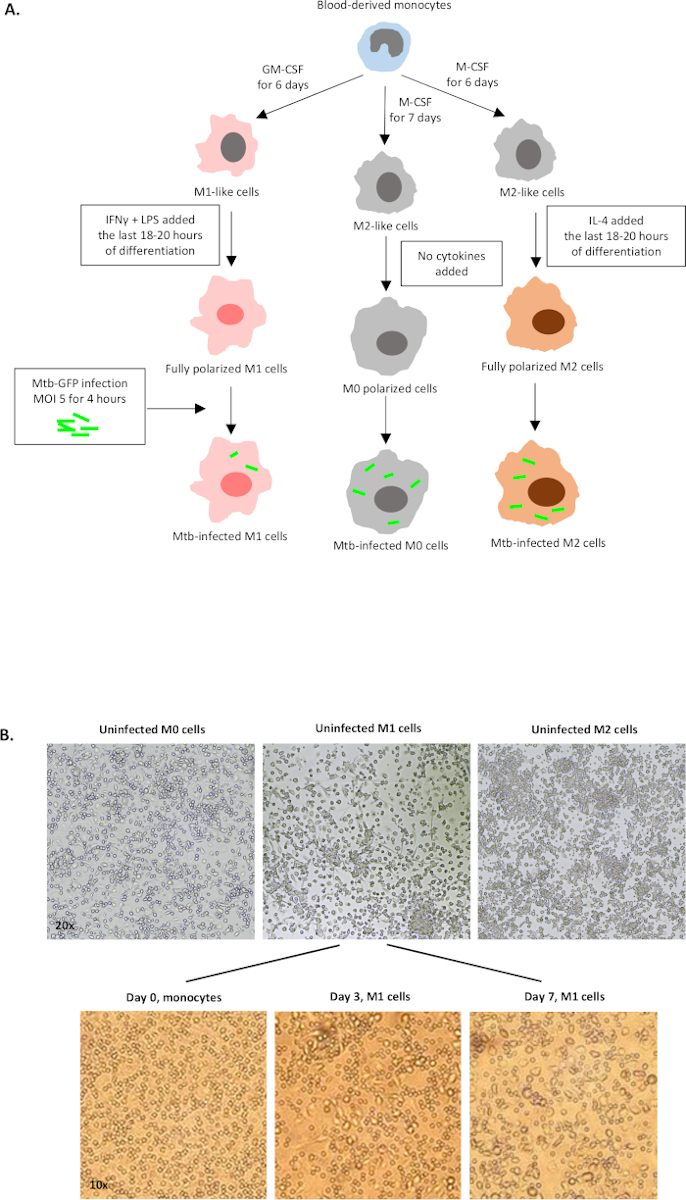
Figura 1: Illustrazione schematica della differenziazione in vitro e della polarizzazione delle cellule derivate dal mieloide umano. (A) Sono raffigurate cellule M0 (simili a M2), M1 (attivate classicamente) e M2 (attivate alternativamente). I monociti ottenuti da donatori di sangue sani sono stati polarizzati con diverse citochine come descritto nel protocollo e infettati dal ceppo mtb etichettato GFP, H37Rv, per 4 ore prima dell'analisi con citometria a flusso a 10 colori. Le cellule polarizzate M1 in genere contengono meno batteri rispetto alle cellule polarizzate M2. (B) Immagini microscopiche di cellule M0, M1 e M2 completamente polarizzate, non infette nelle piastre a 6 pozzi al giorno 7 e immagini rappresentative della differenziazione cellulare M1 dai monociti ai giorni 0, 3 e 7. L'ingrandimento è 20x (pannello superiore) e 10x (pannello inferiore). Si noti che le celle M1 sono più allungate e allungate rispetto alle celle M0 e M2 più arrotondate (pannello superiore). Clicca qui per visualizzare una versione più grande di questa figura.
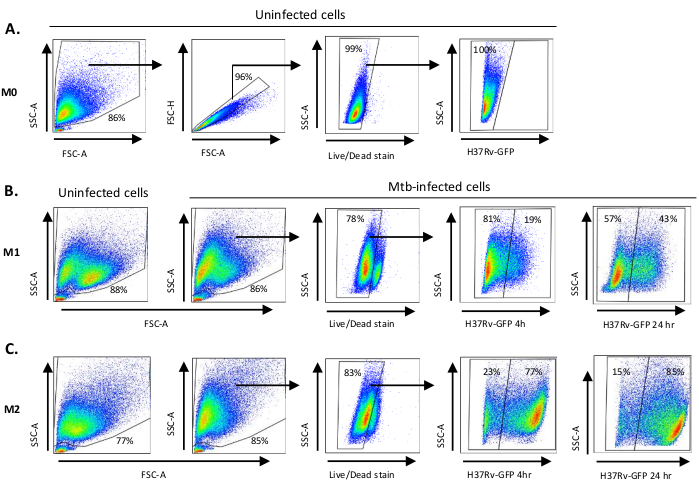
Figura 2: Strategia di Gating delle cellule derivate da mieloidi polarizzate differenzialmente. Grafici rappresentativi dei punti che mostrano le proprietà (A) Forward scatter (FSC) e side scatter (SSC) dei macrofagi M0 non infetti. Il grafico FSC-A/FSC-H mostra la gating manuale di singole cellule proporzionate per area e altezza. Il cancello della cellula viva escludeva le cellule positive per zombie-UV (colorante di vitalità). La Mtb intracellulare è stata rilevata dall'espressione GFP nelle cellule vive osservate nel canale FITC. (B) Gating di macrofagi M1 e (C) M2 che mostrano grafici a punti FCS/SSC sia nelle cellule non infette che nelle cellule infettate da Mtb 4 h e 24 h dopo l'infezione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Efficacia del protocollo di polarizzazione M1/M2 in vitro. Grafici rappresentativi di punti e gating quadrante che mostrano le frequenze sottoinsiemi delle cellule polarizzate M1 e M2 utilizzando cellule non infette CD64 e CD86 (M1) o CD163 e CD200R (M2) in (A) cellule non infette non contaminate e macchiate e(B)cellule macchiate in mtb 4 h dopo l'infezione. I grafici a punti in (B) illustrano l'intensità di fluorescenza dell'espressione GFP (mappa termica) nei macrofagi polarizzati M1 e M2 ottenuti da diverse sottoporte. (C) La media geometrica dell'intensità della fluorescenza (IFM) è indicata negli istogrammi di un donatore rappresentativo dopo 4 ore di infezione da Mtb. I valori delle IFM nelle cellule M1 (azzurro) e M2 non infette (viola chiaro) sono presentati nel pannello superiore e le cellule M1 (blu intenso) e M2 infettate da Mtb (viola intenso) sono presentate nel pannello inferiore. (D) Vengono mostrate immagini confocali rappresentative di cellule polarizzate M1 e M2 non infette e infettate da Mtb. Le cellule M1 e M2 sono state macchiate rispettivamente per l'espressione CD64 e CD163, usando l'immunofluorescenza. La colorazione positiva della superficie è mostrata nei batteri intracellulari rossi e che esprimono GFP è mostrata in verde. I nuclei macchiati di DAPI sono mostrati in colore blu. Scala - 10 μm. L'ingrandimento delle immagini a destra è 350x. Fare clic qui per visualizzare una versione più grande di questa figura.
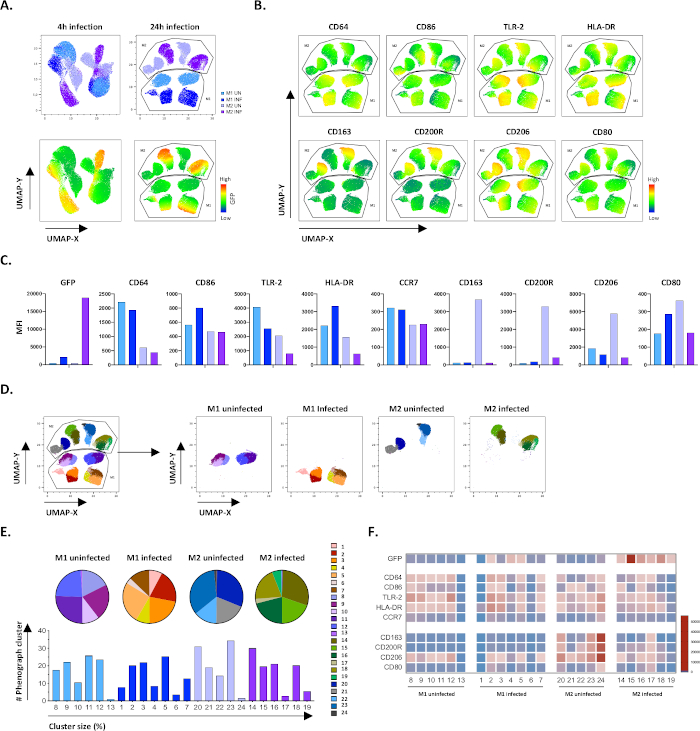
Figura 4: Riduzione della dimensionalità con UMAP (Uniform Manifold Approximation and Projection) e analisi fenografica di cellule M1 e M2 non infettate e infettate da Mtb. (A) UMAP, creato concatenando 11000 cellule vive provenienti da colture cellulari M1 e M2 non infette e infettate da Mtb da due donatori rappresentativi di sangue, 4 ore (grafici a sinistra) o 24 ore (grafici a destra) dopo l'infezione. La mappa termica per l'espressione GFP (pannello inferiore) indica cellule non infette e infettate da Mtb. (B-C) IFM di marcatori espressi in cellule M1 e M2 non infette e infettate da Mtb 24 ore dopo l'infezione, indicate come(B)mappa termica o(C)grafici a barre. (D-F) L'analisi del fenografo ha identificato 24 cluster che sono distribuiti in modo differenziato tra le colture M1 e M2 non infettate e infettate da Mtb. Gli ammassi 8-13 sono unici nelle cellule M1 non infette, gli ammassi 1-7 sono unici nelle cellule M1 infettate da Mtb, i cluster 20-24 sono unici nelle cellule M2 non infette e i cluster 14-19 sono unici nelle cellule M2 infettate da Mtb. Le IFM di ciascun marcatore in ogni cluster di fenografi sono indicate in (F). I dati sono presentati come cellule M1 (azzurro) e M2 non infette (viola chiaro) e M1 (blu intenso) e M2 infettate da Mtb (viola intenso) e M2 (viola intenso). Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Elenco degli anticorpi utilizzati per la citometria del flusso.
| laser | filtro | fluorocromo | fenotipo | funzione | clone | N. catalogo | società |
| 639 | 670/30 | AF647 | TLR2 | Recettore del riconoscimento degli agenti patogeni | TL2.1 | 309714 | BioLegend |
| 639 | 780/60 | APC-Cy7 | Cd206 | Recettore del mannosio | 15-2 | 321120 | BioLegend |
| 405 | 610/20 | BV605 | Cd163 | Recettore degli spazzini | Ghi/61 | 333616 | BioLegend |
| 405 | 670/30 | BV650 | CD80 | Molecola co-stimolante | 2D10 | 305227 | BioLegend |
| 405 | 710/50 | BV711 | CCR7 | Recettore delle chemiochine | G043H7 | 353228 | BioLegend |
| 405 | 780/60 | BV785 | CD86 | Molecola co-stimolante | IT2.2 | 305442 | BioLegend |
| 488 | 530/30 | GFP | Mtb | Batteri intracellulari | |||
| 561 | 586/15 | Pe | CD200R | Recettore inibitorio | OX-108 | 329306 | BioLegend |
| 561 | 620/14 | PE/DAZZLE 594 | Cd64 | Recettore gamma Fc-I di IgG | 10.1 | 305032 | BioLegend |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | Molecola MHC classe II | L243 | 307608 | BioLegend |
| 355 | 450/50 | BUV395 | Colorante di vitalità | Marcatore cellulare vivo/morto | Zombie UV | 423108 | Invitrogeno |
Discussione
Questo protocollo sperimentale descrive l'effettiva polarizzazione delle cellule derivate da mieloidi in fenotipi M1 o M2, inclusa la valutazione con un pannello di citometria a flusso a 10 colori che consente la visualizzazione e la caratterizzazione profonda della Mtb con etichetta GFP in diversi sottoinsiemi di macrofagi. Sebbene la TBC sia un'antica malattia umana, attualmente non esiste un modello standard d'oro per studiare le interazioni Mtb-macrofagi, e la citometria a flusso multicolore dei macrofagi potrebbe essere complicata rispetto alle analisi delle risposte dei linfociti. Pochi protocolli disponibili per la differenziazione in vitro dei monociti umani ai macrofagi presentano una profonda conoscenza del tipo di macrofagi generati. Un protocollo di base per la polarizzazione delle macrofagi e la valutazione citometrica del flusso dell'attivazione del macrofago utilizzando un solido pannello di marcatori può probabilmente facilitare tale caratterizzazione e offrire l'opportunità di esplorare ulteriori caratteristiche delle cellule polarizzate trattate in condizioni diverse. Ciò include analisi di cellule coltivate in vitro e analisi di cellule in vivo in campioni clinici, cioè sia PBMC che sospensioni a cellule singole da fluidi corporei (cioè lavanda broncoalveolare) o tessuto omogeneizzato. Di conseguenza, la differenziazione e/o lo stato di attivazione dei monociti e dei macrofagi ottenuti dai pazienti potrebbero essere correlati all'esito della malattia. L'espansione di CD16+CD163+ monociti nel sangue periferico è stata segnalata in pazienti affetti da TBCpolmonare 30. Una maggiore frequenza di cellule CD163+ è stata rilevata anche nella pelle infiammata dei pazienti con dermatite atopica31. Allo stesso modo, i macrofagi simili a CD206+ M2 hanno dimostrato di inibire la proliferazione e la differenziazione delle cellule nel microambiente del tessuto adipocite32 e di essere arricchiti in campioni di midollo osseo da pazienti con leucemia mieloide acuta (AML)29. Un elevato rapporto tra cellule CD64 (M1) e CD163 (M2) nel sangue intero di pazienti con osteoartrite è stato trovato associato alla gravità della malattia33. Un altro studio ha utilizzato CD86 (M1) e CD163 (M2) per dimostrare che l'alta espressione M1 nei tessuti è correlata a un risultato peggiore in un sottogruppo di tumori maligni alcervello 34.
Ci sono diversi vantaggi significativi di questo protocollo sperimentale di citometria a flusso M1/M2. Questo modello offre l'opportunità di studiare risposte immunitarie innate all'infezione virulente della Mtb e può essere sviluppato per contenere studi sulle risposte immunitarie adattive aggiungendo cellule T autologhe insieme a macrofagi M1 o M2 in reazioni di linfociti misti (MRS). Il protocollo è adatto anche per lo screening dei farmaci e il test di diversi composti immunomodulatori e antimicrobici. Qui, abbiamo precedentemente studiato gli effetti della vitamina D e dell'inibitore della deacetilasi istono fenilbutirrato sulle cellule derivate dal mieloide dopo l'infezione da Mtb25,35. La citometria a flusso M1/M2 potrebbe anche essere utilizzata per valutare l'attivazione dei macrofagi dopo il condizionamento con supernanti di coltura cellulare o plasma del paziente. Mentre gli studi in vivo sulla co-infezione da TBC con HIV o elminti o co-morbilità da TBC-diabete potrebbero essere impegnativi, il modello M1/M2 meno complesso può facilitare gli studi sulle comorbilità in vitro. Allo stesso modo, il protocollo potrebbe essere sfruttato per studi di trasmissione per esaminare l'infettività mtb delle cellule o per studiare la capacità di presentazione fagocitica e antigene delle singole cellule M1/M2. La citometria a flusso M1/M2 è interessante anche per l'uso negli studi sui biomarcatori e sui vaccini, per seguire la prognosi della malattia durante il trattamento e per testare terapie mirate alle cellule derivate da mieloidi. È importante sottolineare che un certo numero di metodi diversi potrebbero essere applicati in parallelo alla citometria del flusso per la valutazione simultanea dei fenotipi di polarizzazione dei macrofagi e delle risposte funzionali utilizzando la microscopia confocale (Figura 3D), PCR in tempo reale, western blot, test multiplex ed ELISA di fattori solubili nel supernatante della coltura, nonché valutazione dell'infettività batterica intracellulare e della crescita utilizzando l'espressione GFP (citometria del flusso e microscopia confocale) e unità di formazione di colonie (CFU). L'infezione delle cellule M1 o M2 con batteri Mtb-GFP consente anche di ordinare le cellule non infette e infettate da Mtb dallo stesso campione per l'analisi del sequenziamento a singolo RNA cellulare.
Il protocollo descritto presenta anche alcune limitazioni, tra cui svantaggi tecnici e scientifici. Lo svantaggio dell'uso di macrofagi derivati dai monociti da donatori di sangue umano è che la variabilità del donatore è spesso elevata e il fatto che le cellule non sono polarizzate nell'ambiente fisiologico dei tessuti umani. Una grande variabilità nell'efficacia della polarizzazione M1/M2 o nell'infettività della mtb tra donatori può causare problemi con variazioni sia intra- che interespanimentali, bassa potenza statistica e la necessità di includere molti donatori per ottenere risultati affidabili. Inoltre, l'aderenza plastica dei monociti dai PBBC si traducono in un numero dipendente dal donatore di monociti / pozzo che può eventualmente fornire un MOI arbitrario che potrebbe influire sulla polarizzazione del macrofago e sulla vitalità cellulare dopo l'infezione da Mtb. I passaggi critici del protocollo comportano un corretto lavaggio per impedire ad altri tipi di cellule di contaminare le colture cellulari che potrebbero anche influenzare la polarizzazione dei macrofagi. Mentre un MOI troppo basso può imitare l'infezione da TBC latente, un MOI troppo alto ucciderà le cellule, evidenziando l'importanza di utilizzare un MOI appropriato. Inoltre, potrebbe essere difficile recuperare cellule saldamente aderenti al distacco, il che può comportare una rappresentazione distorta di alcuni sottoinsiemi di macrofagi utilizzati per le analisi della citometria del flusso. Un passo cruciale nell'analisi della citometria del flusso prevede l'uso corretto della matrice di compensazione delle perline e controlli negativi come le cellule non contaminate o i controlli FMO (Fluorescence Minus One) per garantire una corretta gating manuale.
Un'altra limitazione riguarda la polarizzazione dei monociti derivati dal sangue e non dall'ambiente tissutale locale. Il segno distintivo della TBC umana è la formazione di granulomi nei tessuti infetti da mtb e quindi l'immunopatologia nella TBC dovrebbe essere studiata preferenzialmente nel sito tissutale locale. Tuttavia, i monociti vengono reclutati al polmone dal sangue periferico all'infiammazione / infezione, dove le cellule possono differenziarsi in macrofagi in presenza di citochine infiammatorie come GM-CSF12. È importante sottolineare che, nell'ambiente fisiologico del tessuto in vivo, c'è probabilmente una grande eterogeneità della polarizzazione dei macrofagi tra cui una miscela e diversi rapporti di diverse popolazioni di macrofagi simili a M1 e M2 che contribuiscono al destino dell'infezione da TBC36. In precedenza abbiamo sviluppato un modello di tessuto polmonare organotipico umano che consente studi 3D sulla formazione di granuloma mediato da macrofagi nella TB37. Potrebbe essere interessante sfruttare l'attuale protocollo di polarizzazione M1/M2 in combinazione con il modello del tessuto polmonare per studiare ulteriormente la formazione di granuloma TB, le funzioni dell'effettore e il rapporto M1/M2 nel tessuto sperimentale.
Questo protocollo di citometria di flusso M1/M2 potrebbe essere prontamente adattato per includere un pannello esteso di marcatori mieloidi utili per la valutazione delle caratteristiche associate all'inibitoria e alle risposte infiammatorie. C'è un grande interesse di ricerca per molecole di checkpoint immunitario inibitorie come PD-1, SIRP-α, IDO e arginasi che potrebbero modulare le risposte ai macrofagi38. In questo contesto, la polarizzazione delle cellule mieloidi potrebbe anche comportare altri stimoli che promuovono macrofagi immunoregolatori (Mreg) o cellule soppressori derivate da mieloidi (MDSC) che hanno dimostrato di essere coinvolti in diverse malattie tra cui TB38. Pannelli di citometria a flusso più avanzati di sottoinsiemi di macrofagi M1/M2/Mreg possono anche includere colorazione intracellulare di citochine/chemiochine IL-1β, TNF-α, IL-10 e MCP-1 o altri fattori solubili o molecole di effettore come ossido nitrico induttibile (iNOS) e peptidi antimicrobici. Ciò potrebbe migliorare le possibilità di studiare risposte macrofagi polifunzionali, simili a quelle ampiamente descritte per le cellule T39.
Attualmente, i pannelli di colorazione citometrica a flusso possono includere fino a 30-40 colori, che fornisce la capacità di immunofenotipare più sottoinsiemi e molecole di cellule contemporaneamente. L'impostazione sperimentale di base di questo protocollo di citometria a flusso M1/M2 può essere utilizzata come spina dorsale compatibile con la maggior parte dei citometri a flusso vecchi e nuovi e può essere costruita e su misura in base alle esigenze individuali, comprese le sfide poste dal lavoro con Mtb virulento in un ambiente BSL-3. Al giorno d'oggi, le tecniche di riduzione della dimensionalità come UMAP sono disponibili nelle nuove versioni del software di citometria a flusso, che consente l'analisi di un gran numero di parametri generati in studi a cella singola che è essenziale per una migliore visualizzazione e interpretazione dei dati ad alta dimensione40. I costanti miglioramenti tecnologici nella citometria a flusso continueranno probabilmente nei prossimi anni, inclusa la combinazione di fenotipizzazione multi-parametrica insieme alle moderne capacità di smistamento cellulare, dove questo protocollo potrebbe rivelarsi utile in diversi saggi di infezione mtb basati su macrofagi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo i colleghi dell'Agenzia svedese per la sanità pubblica, Matilda Svensson e Solomon Ghebremichael per l'assistenza fornita nel laboratorio BSL-3.
Questo lavoro è stato supportato da sovvenzioni della Swedish Heart and Lung Foundation (HLF) (2019-0299 e 2019-0302 all'SB), del Consiglio svedese delle ricerche (VR) (2014-02592, 2019-01744 e 2019-04720 a SB), la Fondazione per prevenire la resistenza agli antibiotici (Resist), Karolinska Institutet Foundations e KID alla SB (finanziamento parziale dell'educazione al dottorato per Marco Loreti) dal Karolinska Institutet. ML è stato supportato dalla Swedish Children's Cancer Foundation (TJ2018-0128 e PR2019-0100).
Materiali
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
Riferimenti
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Erratum
Formal Correction: Erratum: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection
Posted by JoVE Editors on 10/14/2020. Citeable Link.
An erratum was issued for: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection. Author and affiliation information was updated.
The author and affiliation information was updated from:
Akhirunnesa Mily1, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha2, Jagadeeswara Rao Muvva1, Magda Lourda1,3, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
3Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
to:
Akhirunnesa Mily1,2, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha3, Jagadeeswara Rao Muvva1, Magda Lourda1,4, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Infectious Diseases Division, International Centre for Diarrhoeal Disease Research, Bangladesh
3Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
4Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon