Method Article
Поляризация клеток M1 и M2 человека моноцитов и анализ с цитометрией потока при микобактериальной туберкулезной инфекции
В этой статье
Erratum Notice
Резюме
Этот протокол предоставляет метод для изучения Mycobacterium туберкулезной инфекции в человеке M1- или M2-поляризованных макрофагов на основе дифференциации периферических-кровь-моноцитов макрофаг-как клетки, которые инфицированы GFP помечены вирулентного штамма H37Rv, и проанализированы с потоком цитометрии с помощью 10-цветной панели, включая выражение выбранных M1/M2 маркеров.
Аннотация
Макрофаги человека являются первичными клетками-хозяинами внутриклеточного микобактерий туберкулеза (Mtb) инфекции и, таким образом, играют центральную роль в иммунном контроле туберкулеза (ТБ). Мы создали экспериментальный протокол для последующей иммунной поляризации клеток миелоидного происхождения в M1 (классически активированные) или M2 (альтернативно активированные) макрофагоподобные клетки путем оценки с 10-цветной цитометрической панелью потока, которая позволяет визуализировать и глубокой характеристикой зелено-флуоресцентного белка (GFP) с маркировкой Mtb в различных подмножествах макрофагов. Моноциты, полученные от здоровых доноров крови, были поляризованы в клетки М1 или М2 с использованием дифференциации с гранулоцитов макрофагов-колоний-стимулирующий фактор (ГМ-CSF) или макрофаг-колония стимулирующий фактор (M-CSF), а затем поляризации с IFN-γ и липополисахарид (LPS) или IL-4, соответственно. Полностью поляризованные клетки M1 и M2 были инфицированы Mtb-GFP в течение 4 часов, прежде чем отдельные макрофаги Mtb были окрашены цитометрией потока в 4- или 24-часовой пост-инфекции. Приобретение образцов было выполнено с помощью цитометрии потока, и данные были проанализированы с помощью программного обеспечения для анализа цитометрии потока. Проведено ручное заготовка, а также уменьшение размерности с помощью единообразного многообразного приближения и проекции (UMAP) и фенографического анализа. Этот протокол привел к эффективной поляризации M1/M2, характеризующейся повышенными уровнями CD64, CD86, TLR2, HLA-DR и CCR7 на неинфицированных клетках M1, в то время как неинфицированные клетки M2 продемонстрировали сильное регулирование маркеров фенотипа M2 CD163, CD200R, CD206 и CD80. M1-поляризованные клетки обычно содержали меньше бактерий по сравнению с M2-поляризованными клетками. Несколько маркеров M1/M2 были вниз регулируется после инфекции Mtb, что свидетельствует о том, что Mtb может модулировать макрофаг поляризации. Кроме того, было установлено, что 24 различных клеточных кластера различных размеров были однозначно распределены между неинфицированными и инфицированными M2 клетками M1 и Mtb в течение 24 часов после инфицирования. Этот протокол цитометрии потока M1/M2 может быть использован в качестве основы в исследовании Mtb-макрофагов и быть принят для особых потребностей в различных областях исследований.
Введение
Макрофаги являются иммунными клетками, которые вносят значительный вклад в регуляции гомеостаза тканей, воспаления и патологий заболеваний. Будучи важным компонентом врожденного иммунитета, моноцитно-макрофаг линии клеток выражает неоднородные фенотипы в ответ на измененные экологические сигналы, которые отражают их пластичность и адаптацию к различным анатомическим и иммунологическимместам 1. В зависимости от факторов роста, цитокинов и других посредников, присутствующих в микрооквидении, макрофаги были разделены на две основные обратимые популяции, каждая из которыхиграет различную роль в бактериальном контроле и очистке 2: провоспалительные, классически активированные макрофаги M1 и противовоспалительные, альтернативно активированные M2-поляризованные макрофаги, которые первоначально были названы, чтобы имитировать T.T. Эта группировка иммунных поляризованных макрофагов часто считается упрощенной, так как активация и дифференциация макрофага не линейна, а более точно иллюстрируется как континуум, где каждая популяция имеет различные характеристики и функциональные роли в исходеразвития и прогрессирования заболевания 4,5,6,7. Тем не менее, существует множество экспериментальных преимуществ с моделью макрофагов M1/M2, которые могут быть использованы в нескольких различных областях исследований.
Микобактерий туберкулеза (МТБ) является причинным агентом туберкулеза (ТБ) и, по оценкам, инфицирует одного человека каждую секунду и считается самым смертоносным инфекционным агентом в мире (Global TB Report 2019). Поскольку дыхательные пути являются основным путем инфекции Mtb, альвеолярные макрофаги являются предпочтительными клетками-хозяинами, которые должны быть инфицированы Mtb и представляют собой как первичные барьеры, так и инфекционный резервуар для Mtb в легких. Макрофаг поляризации в ответ на различные стимулы был широко изучен на протяжениимногих лет 7 и в большинстве опубликованных работ, M1 поляризации моноцитов культур в пробирке индуцируется Гранулоцит-Макрофаг колонии Стимулирующий фактор (GM-CSF) вместе с IFN-γ и LPS8,9, в то время как M2 поляризация индуцируется с макрофаг колонии стимулирующий фактор (M-CSF) и IL-410,11. Макрофаги M1 являются мощными клетками-эффекторами, которые являются посредниками в борьбе с противомикробными реакциями против внутриклеточных патогенов и играют важную роль в противоопухолевомиммунитете 12. Макрофаги M2, с другой стороны, имеют противовоспалительную функцию, высокую фагоцитаную способность и в основном участвуют в заживлении ран и восстановлении тканей, а также впаразитарной инфекции 12. Соответственно, макрофаги M1 рассматриваются как более эффективные во внутриклеточном контроле Mtb по сравнению с макрофагами M213. Тем не менее, Mtb бактерии также имеют потенциал для модулировать макрофаг поляризации для подрыва врожденного иммунитета14,15,16,17.
Хотя он является общим для создания макрофагов от дифференциации моноцитов,полученных из периферической крови 18, макрофаги также могут быть получены из индуцированных плюрипотентныхстволовых клеток (iPSCs) 19 или из костного мозга полученных макрофаговот мышей 20,21. Это осуществимые методы для изучения первичных клеток макрофага, полученных из моноцитов / макрофаг прародителей, которые будут размножаться и дифференцироваться в однородной популяции зрелых макрофагов, как клетки. Однако эти протоколы редко дают углубленые знания о фенотипе и функции полученных клеток и не учитывают естественную неоднородность, наблюдаемую среди макрофагов, полученных in vivo. Поскольку Mtb является строгим патогеном человека, есть также преимущество для изучения Mtb в гуманизированных модельных системах. Цитометрия потока является мощной технологией, которая предлагает возможность оценить несколько фенотипических и функциональных характеристик отдельных клеток вподвеске 22, то, что может быть довольно сложной задачей с приверженцами клеток, таких как макрофаги, которые также известны как аутофторесцентные23,24. В дополнение к химическому отслоему твердо придерживаются макрофагов, Mtb инфекция может представлять собой значительный стресс-фактор для клеток, что добавляет еще один уровень сложности в потоке цитометрических анализов Mtb-инфицированных макрофагов.
В этом экспериментальном протоколе мы использовали ранее созданную модель инфекции макрофага человека, основанную на иммунной поляризации первичных периферических клеток моноцитов, которые заражены вирулентным лабораторным штаммом Mtb H37Rv, и проанализировали с помощью цитометрии потока с помощью 10-цветной панели, включая выражение выбранных маркеров M1 и M225. Этот протокол обеспечивает эффективный и воспроизводимый метод для изучения реакции на инфекцию Mtb в M1 или M2 поляризованных моноцитов полученных макрофагов. Кроме того, использование цитометрии потока на адепте Mtb-инфицированных макрофагов позволяет нам изучать различные поверхностные маркеры, связанные с обычными макрофагами M1 и M2 и их продольной реакцией на инфекцию Mtb. Важно отметить, что этот протокол может быть легко принят для исследования инфекций с другими патогенами, в противоопухолях исследованиях или в исследованиях воспалительных заболеваний, для скрининга наркотиков и т.д., а также может быть использован для оценки макрофаговой поляризации M1/M2 в клинических образцах человека.
протокол
Периферическая кровь человека у здоровых анонимных доноров крови была получена из банка крови в Каролинской университетской больнице, Худдинге, Швеция (этическое одобрение Dnr 2010/603-31/4). Все экспериментальные этапы с участием живого вирулентного Mtb были выполнены в лаборатории Biosafety Level-3 (BSL-3) При Агентстве общественного здравоохранения Швеции (FOHM), Сольна, Швеция.
1. Подготовка средств массовой информации, буферов и бактериальных культур
ПРИМЕЧАНИЕ: Подробная информация обо всех реагентах и расходных материалах представлена в таблице материалов.
- RPMI полная среда: Дополнение RPMI 1640 с 1 мМ пируватом натрия, 2 мМ Л-глутамин, 10 мМ HEPES и 10% тепловая инактивированная сыворотка крупного рогатого скота плода (FBS). Избегайте антибиотиков в среде клеточной культуры при работе с инфекцией Mtb.
- Сыворотка без RPMI среды: Дополнение RPMI 1640 с 1 м натрия пируват, 2 мМ Л-глутамин и 10 мМ HEPES.
- Буфер для мытья: Подготовьте фосфатный буферный солевой раствор (PBS), содержащий 0,05% (v/v) Tween-80.
- Буфер FACS: Подготовье PBS, содержащий 2,5% (v/v) FBS и 0,5 мММ EDTA.
- Буфер фиксации: Подготовьте PBS, содержащий 4% формальдегида для PBS. Убедитесь, что он свежеприготовлен перед использованием, например, смешивается с раствором бульона 37% формальдегида.
- Буфер пермяки: Добавьте 0,1% цитрата натрия и 0,1% Triton X-100 в деионизированную воду.
- Вымойте буфер (для иммунофлуоресценции): Подготовьте PBS, содержащий 0,1% BSA и 0,1% Tween-20.
- Блокирующий буфер: Подготовье PBS, содержащий 0,1% BSA и 10% нормальной сыворотки коз (NGS) к PBS.
- Окрашивание буфера (для иммунофлуоресценции): Подготовка PBS, содержащий 0,1% BSA к PBS.
- ТБ полная среда: Дополнение Средний Брук 7H9 бульон с 0,05% (v/v) Tween-80, 0,5% (v/v) глицерол, канамицин (20 мкг/мл), 10% (v/v) Миддлбрук олеиновой кислоты, альбумин, декстроза и обогащение каталазы (Middlebrook OADC Enrichment).
- Бактериальные культуры: Используйте стандартный вирулентный лабораторный штамм Mtb, H37Rv, составляющий зеленый флуоресцентный белок (GFP), для инфекции клеток, полученных из моноцитов. Этот штамм Mtb содержит плазмиду pFPV2, которая содержит ген, кодирующий GFP, а также ген резистентности к канамицину. Устойчивость к антибиотикам позволяет непрерывно отбор плазмидно-выражающих бактерий в культурах, содержащих канамицин. Храните бактерии в ТБ полной среде и 70% глицерол (1:1 разбавления) при -80 градусов по Цельсию.
2. Периферическая изоляция моноядерных клеток крови от баффи пальто
ПРИМЕЧАНИЕ: Выполните всю работу с человеческой кровью (потенциально заразной) внутри шкафа биобезопасности класса II. Инактивировать остаточные продукты крови дезинфицирующими средствами в течение 15 минут перед отбрасывание. Кровь была получена от здоровых добровольцев в этом случае. Этот протокол дифференциации макрофагов in vitro был создан для включения 10 x 106 изолированных PBMCs/donor/well. От каждого донора, один баффи пальто содержит около 50 мл концентрированной подвески лейкоцитов, происходящих из всей крови, которая обычно обеспечивает 500-800 х10 6 ПКМ, из которых примерно 10% или 50-80 х10 6 моноцитов могут быть извлечены.
- Загрузите 15 мл буйной крови пальто поверх 15 мл градиентной среды плотности, подготовленной в 50 мл трубки. Медленно накладывая кровь поверх градиентного слоя плотности, прислонившись кончиком пипетки к стене трубки.
- Спин трубки на 600 х г в течение 25 мин при температуре комнаты (RT) с 0 ускорение и 0 замедление.
ПРИМЕЧАНИЕ: Закройте крышки тщательно перед центрифугированием и всегда проверяйте держатели трубки на наличие потенциального разлива после центрифугации. - Удалите верхний плазменный слой с помощью стерильной пипетки Pasteur и после этого тщательно соберите моноядерный слой клеток в новую трубку 50 мл с помощью стерильной трубы Pasteur. Добавьте безысовую RPMI-среду к грануле PBMC, чтобы получить окончательный объем 50 мл. Тщательно смешайте, инвертирование трубки несколько раз до центрифугации на 500 х г в течение 5 мин на RT.
- Отбросьте supernatant тщательно и resuspend гранулы клетки путем flipping дно пробки внутри перста.
- Для удаления среднего загрязнения градиента плотности с ПМГМ, мыть клетки 2-3 раза с сывороткой свободной RPMI, чтобы получить окончательный объем 50 мл. Центрифуга при 500 x g в течение 5 мин в RT. Вымойте, пока супернатант клетки не станет прозрачным.
- Откажитесь от супернатанта и будем повторно помекать клетки в 20 мл без сыворотки RPMI среды.
- Подсчитайте клетки путем trypan голубого окрашивания, вручную используя гемоцитометр или используя автоматизированный счетчик клетки. Разбавить клеточной подвески в trypan синий в 1:2 или 1:10 разбавления путем смешивания клеточного трипан синий образец в 96 хорошо пластины, например, 50 йл 50 йл (для подсчета гемоцитометра) или 10 йл й 10 йл (автоматизированный подсчет клеток) и подсчитать клетки, чтобы получить число живых клеток / МЛ.
ВНИМАНИЕ: Трипан синий является токсичным и должны быть отброшены в отдельных химических отходов.
3. Дифференциация и поляризация клеток, полученных из моноцитов
ПРИМЕЧАНИЕ: Для дифференциации и поляризации моноцитов полученных клеток, протокол, который мы ранее установили для M0, M1-как и M2-как клетки, а также полностью M1 и M2 поляризованных клетокпоследовало 25. Для простоты здесь описаны только полностью поляризованные макрофаги M1 и M2.
- Используйте пластиковую приверженность для изоляции моноцитов. Короче говоря, семена свежеисплинутых ПБМТ в 6-колодец культуры пластины при соответствующей концентрации, например, 10х 10 6 PBMCs / хорошо в 2 мл сыворотки свободной RPMI среды и инкубировать при 37 КК и 5% CO2.
- После 2-3 ч удалите непритеняемые клетки с помощью пипетки и промойте колодцы 3 раза с помощью 1 мл без сыворотки среды. Прилагаемые клетки являются моноцитами и составляют около 10% от общего объема ПХМК, добавленных в колодец, т.е. 106 моноцитов, извлеченных из 10 х 106 ПХМК, добавленных на колодец.
- Для дифференциации макрофагов подготовьтесь к рабочему решению, содержащем 50 нг/мл GM-CSF или M-CSF для поляризации макрофагов M1 и M2 соответственно, добавленных в 2 мл полной среды RPMI на колодец. Культура клеток в 5% CO2 инкубатора в 37 градусов по Цельсию в течение 3 дней.
- В день 3, удалить 1 мл клеточной культуры среды тщательно из верхнего слоя каждой скважины и дополнить клеточных культур с 1 мл свежей RPMI полной среды, содержащей двойную концентрацию M-CSF или GM-CSF для получения 50 нг / мл окончательной концентрации в скважинах. Добавьте факторы роста в заранее сделанное рабочее решение 100 нг/мл/колодец.
- В день 6, добавить различные стимулы для последних 18-20 ч дифференциации клеток, чтобы получить полностью поляризованной и зрелой M1 (интерферон-γ; ИВН-γ и липополисахарид; LPS (E. coli O55:B5)) или M2 (интерлейкин 4; Ил-4) макрофаги. Для поляризации M1 приготовьте IFN-γ и LPS в полной среде RPMI и добавьте 50 Л на колодец, чтобы получить окончательную концентрацию 50 нг/мл IFN-γ и 10 нг/мл LPS в клеточных культурах. Для поляризации M2 подготовьйте IL-4 в полной среде RPMI и добавьте 50 йл на колодец, чтобы получить окончательную концентрацию 20 нг/мл в клеточных культурах.
- Для дифференциации М0 поляризованных макрофагов, стимулировать клетки только с M-CSF, без каких-либо дополнительных цитокинов (обеспечивая M2-какфенотип) 25.
- Регулярно проверяйте морфологию клеточных культур, полученных из моноцитов, с помощью световой микроскопии, чтобы убедиться, что мелкие моноциты дифференцированы в более крупные макрофаговые клетки. Кроме того, мониторинг потенциальных морфологических различий между поляризацией M1 и M2, т.е. удлиненными и растянутыми клетками M1 по сравнению с клетками M2 с более округлойформой 25.
- На 7 день, передача пластин с моноцитов полученных клеток в лабораторию BSL-3 для заражения вирулентной Mtb.
4. Подготовка культур Mtb
ПРИМЕЧАНИЕ: Следующие шаги должны быть выполнены в BSL-3 объекта. Для всей работы с вирулентным Mtb, используйте защитную одежду, дыхательную защиту, и этанол устойчивые перчатки.
- Оттепель флакон с 1 мл бактериальной aliquot и смешать с 9 мл ТБ полной среды (1:10 разбавления) в 50 мл фильтрованной крышкой трубки. Культура подвески в инкубаторе при 37 градусов по Цельсию и 5% CO2.
- После 24 ч, спина бактериальной суспензии на 2300 х г в течение 10 минут и осторожно слить среды. Resuspend бактериальной гранулы с 15-20 мл свежего ТБ полной среде в новой 50 мл фильтрованной крышкой культуры трубки и инкубировать при 37 градусов по Цельсию и 5% CO2. Смешайте оседлые бактерии в трубке каждые 2-3 дня, чтобы поддерживать однородное питательное вещество для всех бактериальных клеток.
- После 7-10 дней, смешать бактериальную подвеску правильно, трубя вверх и вниз перед передачей в 50 мл винт крышка трубки.
- Добавьте 35-40 мл стерильного буфера для мытья в трубку 50 мл и вращайте бактериальную суспензию при 2300 х г в течение 10 мин. Повторите шаги стирки один раз. Повторное производство бактериальных гранул в 1 мл без сыворотки RPMI среды путем трубопроводов с микропипютом.
- Добавьте еще 9 мл без сыворотки RPMI среднего и sonicate бактериальной суспензии внутри класса II биобезопасности кабинета в течение 5 мин при 37 градусов по Цельсию, чтобы нарушить бактериальные сгустки. Опустите трубку повторно (3-4 раза) в водяной бане sonicator для обеспечения максимального нарушения бактериальных сгустков. Измерьте оптическую плотность (OD) 1 мл бактериальной суспензии на длине волны 600 нм с помощью спектрофотометра, помещенного внутри шкафа биобезопасности. Используйте без сыворотки RPMI среды установить ссылку.
- Рассчитайте количество единиц формирования колонии (CFU) по формуле: (OD-0.155)/0.161 и Y, и Y x 107й Y x 106 CFU/mL, например, значение OD 0.32 обеспечивает бактериальную концентрацию (0.32 й 0.155)/0.161 и 2.95, 2.95 x 107и 29.5 x 106 CFU/mL.
5. Mtb инфекции моноцитов полученных клеток
ПРИМЕЧАНИЕ: Следующие шаги должны быть выполнены в BSL-3 объекта.
- Перепробовать бактериальные гранулы в сыворотке свободной RPMI среды в новой стерильной 50 мл трубки и настроить окончательную бактериальную концентрацию примерно до 5 х10 6 CFU/mL.
- Удалите клеточной культуры среды из 6 хорошо пластины (ы), содержащие моноцитов полученных клеток. Добавьте 1 мл без сыворотки RPMI среды для каждой хорошо. Добавьте 1 мл бактериальной суспензии на колодец, чтобы получить множественность инфекции (МВД) 5:1, т.е. 5 х10 6 CFU на 106 макрофагов в 2 мл/колодец и инкубировать пластины в течение 4 ч в 37 градусов по Цельсию и 5% CO2.
- После заражения, мыть клетки 3 раза с 1 мл стерильного буфера мытья, чтобы удалить внеклеточные бактерии. Наклоните пластину и аккуратно удалите весь буфер стирки из углов. Resuspend Mtb-инфицированных моноцитов полученных клеток в 2 мл RPMI полной среде без антибиотиков и приступить к потоку цитометрии окрашивания или инкубации клеток еще 24 ч (или других точек времени) до потока цитометрии.
6. Поток цитометрии окрашивания Mtb-инфицированных моноцитов полученных клеток
ПРИМЕЧАНИЕ: Следующие шаги должны быть выполнены в BSL-3 объекта. Окрашивание цитометрии потока может быть выполнено в пластине 96-колодец вместо трубок.
- Отсоедините Mtb-инфицированных клеток (и неинфицированных элементов управления) из скважин в 6 хорошо пластины (ы) путем инкубации с 1 мл буфера FACS на скважину, по крайней мере 30 мин при 37 градусов по Цельсию и 5% CO2.
- Аккуратно пипетки вверх и вниз несколько раз, чтобы убедиться, что клетки отделены. Если возможно, подтвердите отслоение клеток микроскопией. Передача клеточной подвески из каждой хорошо винт ограничен микроцентрифуг трубки и спина трубки на 200 х г в течение 5 мин. Отбросьте supernatant тщательно pipetting.
- Вымойте гранулы клетки в каждой трубке дважды с буфером FACS и спина клетки на 200 х г в течение 5 минут.
- Пятно клеток (около 0,5 х 106 до 1х 10 6 клеток / трубки) с примерно 50 йл коктейль фторхромных конъюгированных анти-человеческих антител, включая TLR2 (AF647), CD206 (APC-Cy7), CD163 (BV605), CD80 (BV650), CCR7 (BV711), CD86 (BV786), CD200R (PE), CD64 (PE-Dazzle 594), HLA-DR (PE-Cy5) (Таблица 1) в сочетании с красителем зомби-УФ в течение 30 мин при 4 градусах по Цельсию (холодильник) в темноте.
- Вымойте окрашенные клетки дважды с 400 МКЛ буфера FACS и спина клеток на 200 х г в течение 5 минут.
- Зафиксировать окрашенные клетки с 200 йл буфера фиксации (свежеприготовленный) в течение 30 минут на RT в темноте, чтобы обеспечить полную инактивацию микобактерий.
- Вымойте клетки дважды с 400 йл буфера FACS и спина на 200 х г в течение 5 минут, чтобы удалить избыток буфера исправить.
- Повторное использование фиксированных клеток в 400 МКЛ буфера FACS и передача образцов в новые 1 мл микроцентрифуг труб, прежде чем принимать их из лаборатории BSL-3 для потока цитометрии в BSL-2. Храните окрашенные клетки в 4 градусов по Цельсию до получения образца.
ПРИМЕЧАНИЕ: Спрей трубки с 70% этанола, прежде чем принимать их из лаборатории BSL-3. Формальдегид является токсичным (канцерогенным) и должен обрабатываться в шкафу биобезопасности класса II. Выбросьте отходы формальдегида в отдельные химические отходы.
7. Приобретение цитометрических данных потока и анализ клеток моноцитов, инфицированных Mtb
ПРИМЕЧАНИЕ: Шаги 7.1-7.2 должны быть выполнены до окрашивания цитометрии потока, описанного выше. Чтобы избежать проблем с слипанием клеток и диссоциацией тандемных красителей после фиксации клеток, выборка приобретения как Mtb-инфицированных, так и неинфицированных клеток выполняется в течение 4-10 ч после первичного окрашивания антител.
- Прежде чем поток цитометрии окрашивания описано выше, компенсировать флуоресцентный сигнал для каждого флуорохрома-конъюгированных антител, перечисленных в окрашивание панели (Таблица 1) с использованием компенсации шарики (как положительные, так и отрицательные).
- Титрат разбавления антителами для окрашивания человеческих макрофагов для получения оптимального сигнала для каждого фторхрома.
- Используйте необложные клетки для определения уровня фоновой флуоресценции, необходимой для установления ворот для отрицательной популяции клеток, позволяющих визуализировать окрашенные клетки (макрофаги являются высоко аутофлуоресцентными).
- Приобрети как минимум 50 000 ячеек/образцов в цитометре потока с помощью рекомендуемого программного обеспечения для сбора данных.
- Экспорт файлов приобретения из цитометра потока в стандартном формате цитометрии потока (FCS) 3.1.
- Проанализируйте файлы FCS в программном обеспечении для анализа цитометрии потока.
- Ворота макрофаги в соответствии с их вперед и стороны рассеяния (FSC и SSC) характеристики и исключить мертвые клетки живых / мертвых клеток gating с помощью зомби-УФ жизнеспособности красителя.
- Визуализация H37Rv-GFP инфицированных макрофагов в канале FITC.
- Определить частоту положительно окрашенных клеток и геометрическую средняю интенсивность флуоресценции (МФО) для всех маркеров(таблица 1).
8. Иммунофлуоресценция окрашивания клеток, полученных из Mtb-инфицированных моноцитов
ПРИМЕЧАНИЕ: Mtb инфекции должны быть выполнены в BSL-3 объекта.
- Для иммуностимляния, семена 2 х10 5 PBMCs / хорошо в 500 йл сыворотки свободной RPMI среды в 8 хорошо камерных слайдов, чтобы получить 2 х 104 моноцитов / хорошо. После дифференциации и M1/M2 поляризации моноцитов, приступить к Mtb инфекции, как описано выше. Исправить слайды после 24 ч инфекции Mtb с буфером фиксации в течение 30 мин. Фиксированные слайды хранятся в морозильной камере при -20 градусов по Цельсию до дальнейшего анализа.
- Вымойте моноцитов полученных клеток в два раза с 200 йЛ PBS в течение 10 минут каждый.
- Перемеабилизировать клетки с 200 МКЛ буфера пермялизации в течение 5 минут на RT.
- Вымойте клетки 3 раза с 200 МКЛ PBS в течение 5 минут каждый.
- Вымойте клетки дважды с 200 йл буфера для мытья в течение 5 минут каждый.
- Блокировка неспецифической привязки с 200 МЛ блокирующего буфера в течение 30 минут на RT.
- Разбавить первичные антитела 1:100 в буфере окрашивания и инкубировать клетки M1 с неконъюгированных антител CD64 (Clone: 10.1) и M2 клетки с неконъюгированных антител CD163 (поликлональный) в течение 2 ч на RT.
- Затем, мыть клетки 3 раза с 200 йл мыть буфера в течение 10 минут каждый.
- Разбавить флуоресцентные помечены вторичные антитела 1:1,000 в окрашивание буфера и инкубировать клетки M1 с анти-мышь IgG-Alexa Fluor 594 и M2 клетки с анти-кролик IgG-Alexa Fluor 594 для 1 ч на RT.
- Вымойте клетки 3 раза с буфером мытья 200 йл в течение 10 минут каждый.
- Удалите сетку камеры и добавьте 20 мкл крепления DAPI среды в каждой хорошо и положить 1,5 мм крышки на каждом слайде.
- Печать крышки с слоем лака для ногтей.
- Приобретайте изображения с помощью конфокального микроскопа с лазерами, излучающими 486 нм для возбуждения GFP (зеленый канал), 402 нм для DAPI (синий) и 560 нм для вторичных антител (красный) соответственно.
Результаты
Схематическая иллюстрация стимуляции цитокинов, используемых для поляризации клеток моноцитов к M0 (M2-как клетки), M1 (полностью поляризованные клетки M1) и M2 (полностью поляризованные клетки M2) представлена на рисунке 1A, в то время как репрезентативные изображения M0, M1 и M2 клеточных культур, а также M1 культур в день 0, 3 и 7, показаны на рисунке 1B. Неинфицированные ячейки M0 были использованы для демонстрации основной стратегии гэтинга(рисунок 2A). Первоначально миелоидные клетки (85%) были закрыты в соответствии с их вперед рассеяния (FSC) и бокового рассеяния (SSC) свойства, включая большие клетки с высокой детализацией и за исключением мелких мусора с низким SSC и FSC, которые находятся в левом нижнем углу точка участка. На втором участке дублеты (т.е. клеточные сгустки) были определены как имеющие увеличенную площадь, но аналогичную высоту по сравнению с одиночными ячейками, и были исключены из дальнейшего анализа. Таким образом, только ячейки, пропорциональные между FSC-Area и FSC-Height (одиночные ячейки) были включены внутри наклонных ворот формы. Далее, зомби-УФ жизнеспособности красителя, который пятна цитоплазмических белков внутри мертвых клеток, был использован, чтобы исключить мертвые клетки из последующего анализа. Как и ожидалось, жизнеспособные неинфицированные клетки M0 были отрицательными для выражения Mtb-GFP, визуализированого в fitC-канале.
Далее, мы применили ту же стратегию закрытого для неинфицированных, а также Mtb-инфицированных M1 и M2 макрофагов на 4 часа после заражения(рисунок 2B,C). Две суб популяции были обнаружены в воротах FCS/SSC неинфицированных поляризованных макрофагов М1; одна популяция с меньшим размером (FCS) и более высокой детализацией (SSC) и другая популяция с большим размером и более низкой детализацией(рисунок 2B),в то время как главные ворота неинфицированных клеток M2 казались более однородными(рисунок 2C). Клетки, полученные из M1 и M2, показали вертикальный сдвиг к более высокой детализации и уменьшенный размер клеток при инфекции Mtb, что может отражать повышенную сложность внутри клеток, вызванную поглощением внутриклеточных бактерий Mtb(рисунок 2B,C). Кроме того, пятно жизнеспособности выявило повышенную гибель клеток (17-22%) среди клеток Mtb-инфицированных M1 и M2 в МВД 5, по сравнению с неинфицированными клетками M0 (99%) (Рисунок 2A-C) или неинфицированные ячейки M1 и M2 (данные не показаны). Репрезентативные данные показали, что экспрессия Mtb-GFP (т.е. инфекционная способность Mtb) была значительно выше в M2 (77% GFP-положительных клеток) по сравнению с M1 (19% GFP-положительных клеток) клетки после 4 часов инфекции (Рисунок 2B,C). После 24 часов инфекции, экспрессия Mtb-GFP была 43% и 85% в клетках M1 и M2 соответственно, предполагая, что клетки M1 имели относительно более высокий рост экспрессии GFP от 4-24 часов после инфекции Mtb по сравнению с клетками M2, 126% против 10,4% увеличение GFP-выражения в клетках M1 и M2 от 4-24 часов, соответственно.
Для характеристики эффективности поляризации M1/M2 в неинфицированных моноцитов полученных клеток, точка участки были использованы для выявления M1 клетки, которые были двойной положительный дляCD64и CD86 (CD64иCD86 ) и M2 клетки, которые были двойной положительный для CD163 и CD200R (CD163-CD200R ) ; Рисунок 3A,B). Выбор маркеров M1/M2 был в первую очередь сделан на основе результатовнашей предыдущей работы 25, но и издругих исследований 26,27,28,29. Квадранты для окрашенных клеток, были установлены с использованием соответствующих ворот для необлитающих клеток M1/M2(рисунок 3A). Ни один из этих маркеров не выражается исключительно клетками M1 или M2, но доля положительных клеток, а также интенсивность выражения поверхности различны. Это было особенно очевидно из пятнаM1,где около 95% клеток M1 и 79% клеток M2 были CD64и CD86 , но интенсивность окрашивания была значительно выше в подмножестве M1 (Рисунок 3A). В то время как 27% клеток M1 были положительными для M2-маркера CD200R, только 1% былиположительными для CD163, обеспечивая 0,5% CD163 и CD200R и M1 клетки по сравнению с 63% CD163и CD200R и M2 клеток (рисунок 3A). После 4 часов инфекции Mtb, увеличение частоты CD200Rи клеток наблюдалось в Mtb-GFP-положительных M1 поляризованных клеток (16%), в то время как CD163-выражение было сокращено в клетках M2(рисунок 3B). Тепловая карта демонстрирует высокую интенсивность GFP-выражения в подмножестве CD163иCD200R, а также в подмножестве клеток CD64 и CD86и M2 по сравнению с соответствующими подмножествами ячеек M1 (рисунок 3B). В целом, сдвиг в выражении соответствующих маркеров M1 и M2 также визуализируется в гистограммах на рисунке 3C. Кроме того, бактерии Mtb-GFP также визуализировались в клетках CD64и M1, а в клетках CD163и M2 с помощью конфокарной микроскопии, которая поддерживала повышенное внутриклеточное поглощение и/или рост Mtb внутри M2 по сравнению с клетками M1(рисунок 3D).
Чтобы проверить результаты ручного gating, мы применили уменьшение размерности с помощью равномерного многообразного приближения и проекции (UMAP). Анализ UMAP показал, что инфекции Mtb в течение 4 часов было недостаточно, чтобы повлиять на поляризацию макрофагов, в отличие от 24 часов инфекции, что привело к четко разделенных кластеров M1 и M2 неинфицированных и инфицированных клеток(рисунок 4A). Неинфицированные макрофаги M1 отображали более высокую экспрессию макрофагов CD64, CD86, TLR2, HLA-DR и CCR7 по сравнению с макрофагами M2, в то время как неинфицированные клетки M2 продемонстрировали сильную регулировку фенотипных маркеров M2 CD163, CD200R, CD206 и CD80 (Рисунок 4B,C). В согласии с ручным gating, Mtb инфекции после 24 часов вызвало четкое downregulation CD163, CD200R и CD206 на M2 клеток и upregulation CD86 и HLA-DR на M1 клеток (Рисунок 4B,C), что свидетельствует о том, что Mtb может модулировать макрофаг поляризации. Последующий фенографический анализ (Рисунок 4D-F) определил 24 различных кластеров различных размеров, которые были однозначно распределены между M1 и M2 неинфицированных и Mtb-инфицированных клеток, как показано на графиках UMAP (Рисунок 4D), пирог диаграммы (Рисунок 4E) и тепловые карты (Рисунок 4F). В целом, эти результаты показывают многообещающую эффективность этого протокола для генерации фенотипически и функционально разнообразны M1 и M2 поляризованных клеток in vitro, которые дополнительно модулируются инфекцией Mtb.
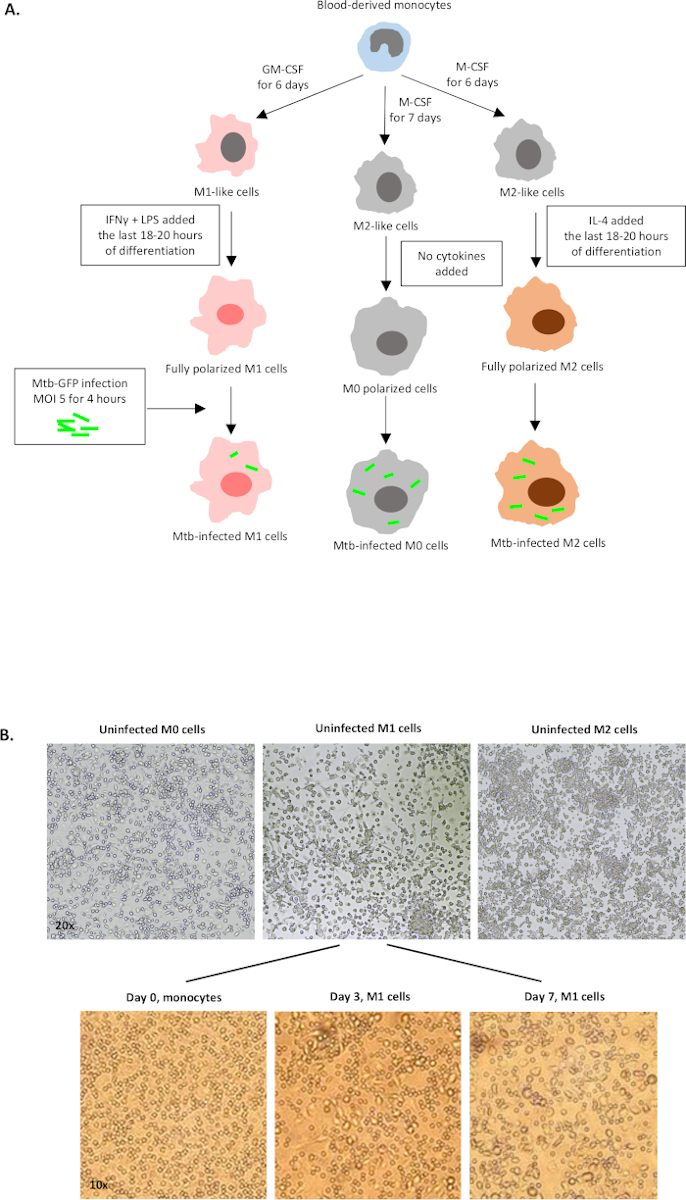
Рисунок 1: Схематическая иллюстрация дифференциации in vitro и поляризации клеток, полученных из миелоидов человека. (A) M0 (M2-как), M1 (классически активированный) и M2 (альтернативно активированные) клетки изображены. Моноциты, полученные от здоровых доноров крови, были поляризованы с различными цитокинами, как описано в протоколе, и инфицированы штаммом Mtb с маркировкой GFP, H37Rv, в течение 4 часов до анализа с цитометрией 10-цветного потока. М1-поляризованные клетки обычно содержат меньше бактерий по сравнению с M2-поляризованными клетками. (B)Микроскопические изображения полностью поляризованных, неинфицированных клеток M0, M1 и M2 в 6-хорошо пластин на 7-й день, и репрезентативные изображения дифференциации клеток M1 от моноцитов в день 0, 3 и 7. Увеличение в 20 раз (верхняя панель) и 10x (нижняя панель). Обратите внимание, что клетки M1 более вытянуты и растянуты по сравнению с более округлыми ячейками M0 и M2 (верхняя панель). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
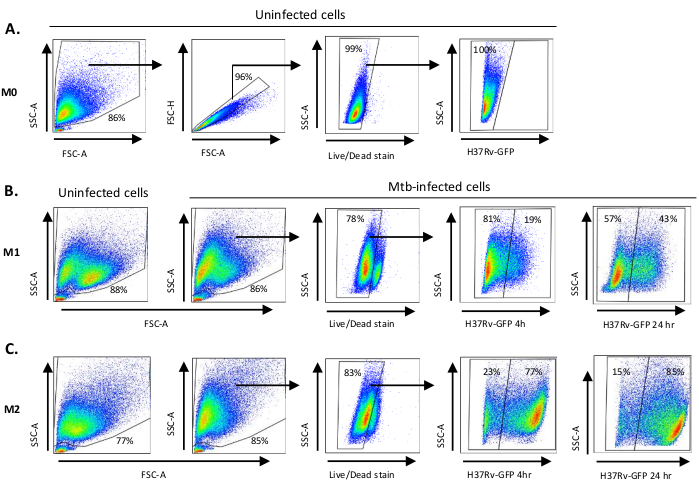
Рисунок 2: Gating стратегии дифференциально поляризованных миелоидных производных клеток. Представитель точка участков,показывающих ( )Вперед рассеяния (FSC) и бокового рассеяния (SSC) свойства неинфицированных M0 макрофагов. В сюжете FSC-A/FSC-H показана ручная заготовки одиночных ячеек, пропорциональных площади и высоте. Ворота живых клеток исключали клетки, которые были положительными для зомби-УФ (краситель жизнеспособности). Внутриклеточный Mtb был обнаружен GFP-выражением в живых клетках, наблюдаемых в канале FITC. (B) Gating M1 и ( C )M2макрофаги, показывающие FCS / SSC точка участков как в неинфицированных клеток и Mtb-инфицированных клеток 4 ч и 24 ч после заражения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Эффективность протокола поляризации in vitro M1/M2. Представитель точка участков и квадрант gating показаны подмножества частот M1- и M2-поляризованных клеток с использованием CD64 и CD86 (M1) или CD163 и CD200R (M2) в ()необитых и окрашенных неинфицированных клеток и (B) Mtb-инфицированных окрашенных клеток 4 ч пост-инфекции. Точечные участки в (B) иллюстрирует интенсивность флуоресценции GFP-выражения (тепловая карта) в M1- и M2-поляризованных макрофагов, полученных из различных суб-ворот. (C)Геометрическое среднее интенсивности флуоресценции (МФО) показано в гистограммах от одного представителя донора после 4 ч инфекции Mtb. Значения МФО в неинфицированных клетках M1 (светло-голубой) и M2 (светло-фиолетовый) представлены в верхней панели, а Mtb-инфицированные M1 (глубоко-синие) и M2 клетки (глубокий фиолетовый) представлены в нижней панели. (D)Показаны конфокальные изображения неинфицированных и инфицированных МТБ М1- и М2-поляризованных клеток. Клетки M1 и M2 были окрашены для выражения CD64 и CD163, соответственно, с использованием иммунофлуоресценции. Положительное окрашивание поверхности показано красным цветом, а внутриклеточные бактерии, выражаюющие GFP, показаны зеленым цветом. Ядра, окрашенные в DAPI, показаны в синем цвете. Шкала - 10 мкм. Увеличение изображения справа составляет 350x. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
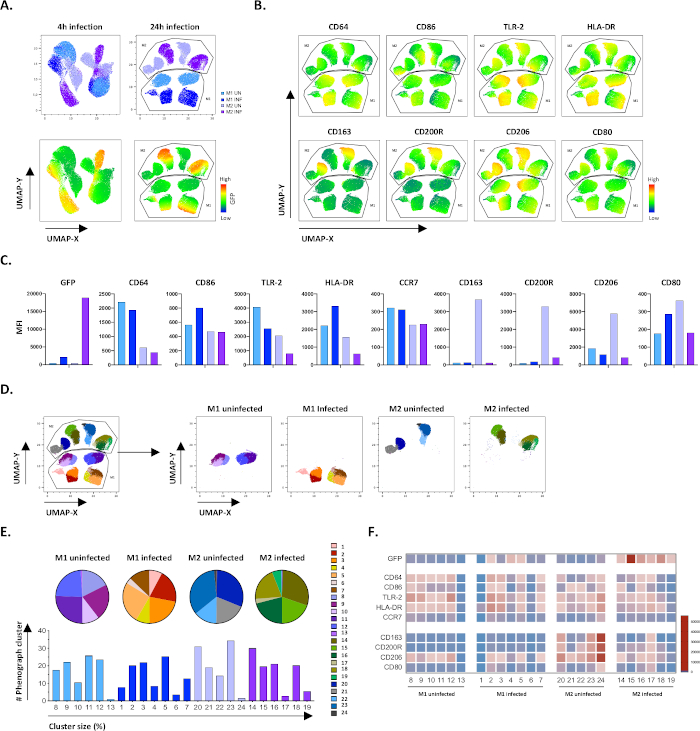
Рисунок 4: Уменьшение размерности с помощью единообразного многообразного приближения и проекции (UMAP) и фенографического анализа неинфицированных и зараженных M1 и M2 клеток M1 и M2. (A) UMAP, созданный путем контатенатации 11000 живых клеток из неинфицированных и Mtb-инфицированных M1 и M2 клеточных культур от двух репрезентативных доноров крови, 4 ч (левые графики) или 24 ч (правые графики) после инфекции. Тепловая карта для GFP-выражения (нижняя панель) указывает на неинфицированные и инфицированные Mtb клетки. (B-C) МФО маркеров, выраженных в неинфицированных и Mtb-инфицированных M1 и M2 клеток 24 ч после инфекции, показано, как (B) тепловой карты или (C) бар участков. (D-F) Фенографический анализ выявил 24 кластера, которые дифференцированно распределены между неинфицированными и инфицированными M1 и M2 культурами M1 и M2. Кластеры 8-13 уникальны в неинфицированных клетках M1, кластеры 1-7 уникальны в Mtb-инфицированных клетках M1, кластеры 20-24 уникальны в неинфицированных клетках M2 и кластеры 14-19 уникальны в Mtb-инфицированных клетках M2. МФО каждого маркера в каждом фенографическом кластере отображается в (F). Данные представлены как неинфицированные M1 (светло-голубые) и M2 клетки (светло-фиолетовый) и Mtb-инфицированных M1 (глубоко синий) и M2 клеток (глубокий фиолетовый). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Таблица 1: Список антител, используемых для цитометрии потока.
| лазер | фильтр | Фторхром | фенотип | функция | клон | Каталог No. | компания |
| 639 | 670/30 | AF647 | TLR2 | Рецептор распознавания патогенов | TL2.1 | 309714 | БиоЛегенд |
| 639 | 780/60 | БТР-Си7 | CD206 | Рецептор маннозы | 15-2 | 321120 | БиоЛегенд |
| 405 | 610/20 | BV605 | CD163 | Рецептор мусорщика | GHI/61 | 333616 | БиоЛегенд |
| 405 | 670/30 | BV650 | CD80 | Молекула состимулятора | 2D10 | 305227 | БиоЛегенд |
| 405 | 710/50 | BV711 | CCR7 | Рецептор химоккина | G043H7 | 353228 | БиоЛегенд |
| 405 | 780/60 | BV785 | CD86 | Молекула состимулятора | IT2.2 | 305442 | БиоЛегенд |
| 488 | 530/30 | GFP | Мтб | Внутриклеточные бактерии | |||
| 561 | 586/15 | PE | CD200R | Ингибиторный рецептор | OX-108 | 329306 | БиоЛегенд |
| 561 | 620/14 | PE/DAZZLE 594 | CD64 | Fc гамма-рецептор-I IgG | 10.1 | 305032 | БиоЛегенд |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | Молекула класса II MHC | L243 | 307608 | БиоЛегенд |
| 355 | 450/50 | BUV395 | Жизнеспособность красителя | Маркер живых/мертвых клеток | Зомби УФ | 423108 | Инвитрог |
Обсуждение
Этот экспериментальный протокол описывает эффективную поляризацию клеток миелоидного происхождения в фенотипы M1 или M2, включая оценку с помощью 10-цветной панели цитометрии потока, которая позволяет визуализировать и глубоко охарактеризовать GFP-маркированную Mtb в различных подмножествах макрофагов. Хотя туберкулез является древним заболеванием человека, в настоящее время нет золотой стандартной модели для изучения Mtb-макрофаг взаимодействия, и многоцветный поток цитометрии макрофагов может быть сложным по сравнению с анализом реакций лимфоцитов. Немногие доступные протоколы для дифференциации моноцитов человека на макрофаги представляют глубокие знания о типе генерируемых макрофагов. Базовый протокол макрофаговой поляризации и цитометрической оценки цитометрической оценки активации макрофагов с использованием твердой панели маркеров, вероятно, может облегчить такую характеристику и предложить возможности для изучения дополнительных особенностей поляризованных клеток, обработанных в различных условиях. Это включает в себя анализ клеток, культурных in vitro, а также анализ клеток in vivo в клинических образцах, т.е. как PBMC, так и одноклеточных суспензий из жидкостей организма (т.е. бронхоалвеолярного лаважа) или гомогенизированных тканей. Соответственно, дифференциация и/или активация моноцитов и макрофагов, полученных от пациентов, могут быть связаны с исходом заболевания. Расширение CD16иCD163моноцитов в периферической крови были зарегистрированы у больных легочным туберкулезом30. Повышенная частота CD163и клеток была также обнаружена в воспаленной коже пациентов с атопическим дерматитом31. Аналогичным образом, CD206и M2-как макрофаги были показаны, чтобы ингибировать пролиферацию и дифференциацию клеток в микроокноронизмежировой ткани 32 и быть обогащены в образцах костного мозга от пациентов с острым миелоидным лейкозом (AML)29. Было установлено, что повышенное соотношение клеток CD64 (M1) и CD163 (M2) в крови пациентов с остеоартритом связано стяжестью заболевания 33. Другое исследование использовало CD86 (M1) и CD163 (M2), чтобы продемонстрировать, что высокое выражение M1 в тканях коррелирует с худшим исходом в подгруппе злокачественныхопухолей головного мозга 34.
Есть несколько существенных преимуществ этого экспериментального протокола цитометрии потока M1/M2. Эта модель дает возможность изучать врожденные иммунные реакции на вирулентную инфекцию Mtb и может быть разработана для сдерживания исследований адаптивных иммунных реакций путем добавления аутологичные Т-клетки вместе с M1 или M2 макрофагов в смешанных лимфоцитных реакций (MLRs). Протокол также подходит для скрининга и тестирования различных иммуномодулирующих и противомикробных соединений. Здесь мы ранее изучали влияние витамина D и ингибитора дицетилазы гистона фенилбутирата на клетки, полученные из миелоида после инфекции Mtb25,35. Цитометрия потока M1/M2 также может быть использована для оценки активации макрофагов после кондиционирования супернатантами клеточной культуры или плазмой пациента. Хотя исследования по совместной инфекции туберкулеза ВИЧ или гельминтами или со-заболеваемость туберкулезом и диабетом могут быть сложными, менее сложная модель М1/М2 может облегчить исследования со-заболеваемости в пробирке. Аналогичным образом, протокол может быть использован для исследования передачи для изучения инфекции Mtb клеток или для исследования фагоцитов, а также антигена презентационой способности отдельных клеток M1/M2. Цитометрия потока M1/M2 также привлекательна для использования в исследованиях биомаркеров и вакцин, для последующего прогноза заболевания во время лечения и для тестирования методов лечения, ориентированных на клетки, полученные из миелоидов. Важно отметить, что параллельно с цитометрией потока можно было бы применять ряд различных методов для одновременной оценки фенотипов макрофагов поляризации и функциональных реакций с использованием конфокаляковой микроскопии(рисунок 3D), ПЦРв режиме реального времени, западная помарка, мультиплексные анализы и ELISA растворимых факторов в культуре супернатанта, а также оценка внутриклеточной бактериальной инфекционности и роста с использованием GFP-экспрессии (цитометрия потока и конфокальная микроскопия) и единиц формирования колоний (CFU). Инфекция клеток М1 или М2 бактериями Mtb-GFP также позволяет сортировать неинфицированные и зараженные Mtb клетки из одного образца для анализа секвенирования одноклеточной РНК.
Описанный протокол также имеет некоторые ограничения, включая как технические, так и научные недостатки. Недостатком использования макрофагов, полученных из моноцитов, от доноров крови человека является то, что изменчивость донора часто высока, и тот факт, что клетки не поляризованы в физиологической среде тканей человека. Большая изменчивость эффективности поляризации М1/М2 или Mtb-инфекции между донорами может привести к проблемам как с внутри-, так и с межсексментальными колебаниями, низкой статистической мощностью и необходимостью включения многих доноров для получения надежных результатов. Кроме того, пластическое присоединение моноцитов от ПБМТ приводит к зависимости от донора количеству моноцитов/хорошо, что в конечном итоге может обеспечить произвольный МВД, который может повлиять на макрофаг поляризации и жизнеспособности клеток после инфекции Mtb. Критические шаги в протоколе включает в себя надлежащее мытье, чтобы предотвратить другие типы клеток, чтобы загрязнить клеточные культуры, которые также могут повлиять на поляризацию макрофагов. В то время как слишком низкий МВД может имитировать скрытую инфекцию туберкулеза, слишком высокий МВД убьет клетки, подчеркивая важность использования соответствующего МВД. Кроме того, может быть трудно получить твердо приверженных клеток при отслоении, что может привести к предвзятому представлению некоторых подмножеству макрофагов, используемых для анализа цитометрии потока. Важным шагом в анализе цитометрии потока включает в себя правильное использование матрицы компенсации бисера и отрицательных элементов управления, таких как необлоленные клетки или FMO (Флуоресценция Минус Один) элементы управления для обеспечения правильного ручного gating.
Другое ограничение включает в себя поляризацию моноцитов, полученных из крови, а не из местной среды тканей. Отличительной чертой туберкулеза человека является образование гранулем в ткани, инфицированных МТБ, и, таким образом, иммунопатологию при туберкулезе следует преимущественно изучать на местном участке тканей. Тем не менее, моноциты набираются в легкие из периферической крови при воспалении/инфекции, где клетки могут дифференцироваться в макрофаги в присутствии воспалительных цитокинов, таких как GM-CSF12. Важно отметить, что в физиологической среде ткани in vivo, существует вероятность большой неоднородности макрофаговой поляризации, включая смесь и различные соотношения различных популяций макрофагов, похожих на M1- и M2, которые способствуют судьбе туберкулезнойинфекции 36. Ранее мы разработали модель органотипической ткани легких человека, которая позволяет 3D-исследования макрофагов опосредованного образования грануломы вТБ 37. Было бы интересно использовать текущий протокол поляризации M1/M2 в сочетании с моделью легочной ткани для дальнейшего изучения образования грануломы туберкулеза, функций эффектора и соотношения M1/M2 в экспериментальной ткани.
Этот протокол M1/M2 flowcytometry можно было бы легко адаптировать к расширенной панели миелоидных маркеров, полезных для оценки функций, связанных с ингибиторными, а также воспалительными реакциями. Существует большой интерес исследований в ингибирующие молекулы иммунной контрольно-пропускной пункт, такие как PD-1, SIRP-α, IDO и аргиназы, которые могли бы модулировать макрофагответы 38. В этом контексте поляризация миелоидных клеток может также включать другие стимулы, которые способствуют иммунорегуляторных макрофагов (Mreg) или миелоидных клеток супрессора (MDSC), который, как было показано, участвует в нескольких заболеваниях, включаяТБ 38. Более продвинутые цитометрические панели потока подмножества макрофагов M1/M2/Mreg могут также включать внутриклеточное окрашивание цитокинов/хемокинов IL-1, TNF-α, IL-10 и MCP-1 или другие растворимые факторы или молекулы-эффекторы, такие как неизгладимый оксид азота (iNOS) и антимикробные пептиды. Это может расширить возможности для изучения полифункциональных реакций макрофагов, аналогичных тому, что было широко описано для Т-клеток39.
В настоящее время цитометрические окрашивающие панели потока могут включать до 30-40 цветов, что обеспечивает возможность иммунофенотипа нескольких клеточных подмножество и молекул одновременно. Базовая экспериментальная настройка этого протокола цитометрии потока M1/M2 может быть использована в качестве основы, которая совместима с большинством старых, а также новых цитометров потока и может быть построена и адаптирована в соответствии с индивидуальными потребностями, включая проблемы, связанные с работой с вирулентным Mtb в среде BSL-3. В настоящее время методы уменьшения размерности, такие как UMAP доступны в новых версиях программного обеспечения цитометрии потока, что позволяет анализ большого количества параметров, генерируемых в одноклеточных исследований, что имеет важное значение для улучшения визуализации и интерпретации высокомерныхданных 40. Постоянные технологические усовершенствования цитометрии потока, вероятно, будут продолжаться и в ближайшие годы, включая сочетание многокатриметрического фенотипирования вместе с современными возможностями сортировки клеток, где этот протокол может оказаться полезным в нескольких анализах инфекции Mtb на основе макрофагов.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим наших коллег из Агентства общественного здравоохранения Швеции Матильду Свенссон и Соломона Гебремихаэля за помощь в лаборатории BSL-3.
Эта работа была поддержана грантами Шведского фонда сердца и легких (HLF) (2019-0299 и 2019-0302 до SB), Шведского исследовательского совета (VR) (2014-02592, 2019-01744 и 2019-04720 до SB), Фонд по предотвращению устойчивости к антибиотикам (сопротивление), Каролинский институт фондов и KID в SB (частичное финансирование докторского образования для Марко Лорети) из Каролинского института. ML была поддержана Шведским детским онкологическим фондом (TJ2018-0128 и PR2019-0100).
Материалы
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
Ссылки
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Erratum
Formal Correction: Erratum: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection
Posted by JoVE Editors on 10/14/2020. Citeable Link.
An erratum was issued for: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection. Author and affiliation information was updated.
The author and affiliation information was updated from:
Akhirunnesa Mily1, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha2, Jagadeeswara Rao Muvva1, Magda Lourda1,3, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
3Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
to:
Akhirunnesa Mily1,2, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha3, Jagadeeswara Rao Muvva1, Magda Lourda1,4, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Infectious Diseases Division, International Centre for Diarrhoeal Disease Research, Bangladesh
3Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
4Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены