Method Article
M1 및 M2 인간 단세포 유래 세포의 편광 및 진균 결핵 감염에 대한 유동 세포측정을 분석
Erratum Notice
요약
본 프로토콜은 MFP 라벨이 부착된 악성 균주 H37Rv에 감염된 대식세포와 말초 혈액 단혈세포의 분화에 기초하여 인간 M1 또는 M2 편광 대식세포에서 진코박테리움 결핵 감염을 연구하고, M1의 마커를 포함한 10색 마커를 사용하여 유동 세포암법으로 분석하는 방법을 제공한다.
초록
인간 대식세포는 세포내 진균 결핵(Mtb) 감염의 1차 숙주 세포이며 따라서 결핵의 면역 조절에 중심적인 역할을 합니다(TB). 우리는 다양한 대시파소에서 녹색 형광 단백질 (GFP)의 시각화 및 깊은 특성화를 허용하는 10 색 유동 세포 측정 패널을 사용하여 평가를 통해 골수성 유래 세포의 면역 편광을 M1 (고전적으로 활성화) 또는 M2 (대안적으로 활성화) 대식세포와 같은 세포로 추적하는 실험 프로토콜을 설립했습니다. 건강한 혈액 기증자로부터 얻은 단세포는 과립구 대식세포-콜로니 자극 인자(GM-CSF) 또는 대식세포 식민지 자극인자(M-CSF)를 이용한 분화를 이용하여 M1 또는 M2 세포로 편광되었고, IFN-γ 및 리포폴리사카라이드(LPS) 또는 IL-4를 이용한 편광이 뒤따랐다. 완전히 편광된 M1 및 M2 세포는 분리된 Mtb-감염 대식세포가 감염 후 4시간 또는 24시간 후 유동 세포형으로 염색되기 전에 4시간 동안 Mtb-GFP에 감염되었다. 샘플 수집은 유동 세포측정을 사용하여 수행되었고 데이터는 유동 세포 분석 소프트웨어를 사용하여 분석하였다. 수동 게이팅뿐만 아니라 균일 한 매니폴드 근사치 및 프로젝션 (UMAP) 및 표현판 분석을 사용하여 치수 감소가 수행되었다. 이 프로토콜은 감염되지 않은 M1 세포에 CD64, CD86, TLR2, HLA-DR 및 CCR7의 높은 수준을 특징으로 하는 효과적인 M1/M2 편광을 초래했으며, 감염되지 않은 M2 세포는 M2 표현형 마커 CD163, CD200R, CD206 및 CD8000의 강력한 업 레귤레이션을 나타냈다. M1 편광 세포는 전형적으로 M2 편광 세포에 비해 적은 박테리아를 포함했다. 몇몇 M1/M2 마커는 Mtb 감염 후에 다운규제되었습니다, 이는 Mtb가 대식세포 편광을 조절할 수 있다는 것을 건의합니다. 또한, 상이한 크기의 24개의 상이한 세포 클러스터는 24시간 감염 후 M1 및 M2 감염 및 Mtb 감염 세포 간에 유일하게 분포되는 것으로 나타났다. 이 M1/M2 유량 세포측정 프로토콜은 Mtb 대식세포 연구의 중추로 사용될 수 있으며 다양한 연구 분야에서 특별한 필요를 위해 채택될 수 있습니다.
서문
대식세포는 조직 항상성, 염증 및 질병 병리학의 조절에 크게 기여하는 면역 세포입니다. 선천성 면역의 필수 성분인 세포의 단핵세포 계보는 다른 해부학 적 및 면역학적 위치에 대한 가소성과 적응을 반영하는 변경된 환경 단서에 대응하여 이질적인 표현형을표현한다. 마이크로 환경에 존재하는 성장 인자, 사이토카인 및 기타 중재자에 따라, 대식세포는 세균 조절 및 클리어런스에 다른 역할을 각각 두 개의 주요 가역 인구로 분류되었습니다2: 프로 염증, 고전적으로 활성화 된 M1 편광 대식세포 및 항 염증, 대안 적으로 활성화 된 M2 편광 거처는 원래 Tcler cell (Tcler cell)을 모방하기 위해 명명되었다. 이러한 면역 편광 대식세포의 그룹화는 대식세포 활성화 및 분화가 선형이 아니기 때문에 종종 단순하게 간주되지만, 각 집단이 질병 발달 및 진행의 결과에 각각의 특성과 기능적 역할을 가지는 연속체로 보다 정확하게 도시화된다4,5,6,7. 그럼에도 불구 하 고, 연구의 여러 다른 분야에서 사용할 수 있는 M1/M2 대식 세포 모델과 수많은 실험 적인 장점이 있다.
진균 결핵 (Mtb)은 결핵 (TB)의 원인 에이전트이며 매 초마다 한 사람을 감염시키는 것으로 추정되며 세계에서 가장 치명적인 단일 전염성 요원으로 간주됩니다 (글로벌 결핵 보고서 2019). 호흡기는 Mtb 감염의 주요 경로이기 때문에 폐포 대식세포는 Mtb에 감염되는 바람직한 숙주 세포이며 폐내 Mtb에 대한 1 차적인 장벽과 전염성 저수지를 모두 나타낸다. 다른 자극에 대응하여 대식세포 편광은7년 동안 광범위하게 연구되었으며 대부분의 출판된 저작물에서, 시험관 내 의 단핵구 배양의 M1 편광은 IFN-γ 및 LPS8,9와함께 과립구-대식체 식민지 자극계(GM-CSF)에 의해 유도되며, M2 편광은 대식세포 식민지 자극계(M-CSF) 및 IL-410,11로유도된다. M1 대식세포는 세포내 병원체에 대한 항균 반응을 중재하고 항종양면역(12)에필수적인 역할을 하는 강력한 이펙터 세포이다. M2 대식세포는, 한편으로, 항염증 기능, 높은 phagocytic 용량을 가지며 주로 상처 치유 및 조직 수리뿐만 아니라 기생충감염(12)에관여한다. 이에 따라, M1 대식세포는 M2대식세포(13)에비해 Mtb의 세포내 대조군에서 보다 효과적인 것으로 여겨진다. 그러나, Mtb 박테리아는 또한 선천성 면역14,15,16,17을전복하기 위하여 대식세포 편광을 조절할 가능성이있다.
말초혈액(18)으로부터얻은 단핵구의 분화로부터 대식세포를 생성하는 것이 일반적이지만, 대식세포는 유도된 다능성 줄기세포(iPSC)19 또는 마우스로부터 골수 유래 대식세포로부터 생성될 수있다( 20,21). 이들은 성숙한 대식세포 같이 세포의 균질한 인구로 증식하고 분화할 단색 세포/대식세포 선조에서 얻은 1차 대식세포 세포를 연구하는 것이 가능한 기술입니다. 그러나, 이들 프로토콜은 생체내에서 수득된 대식세포 사이에서 관찰된 자연 이질성을 고려하여 얻어진 세포의 표현형 및 기능에 대한 심화된 지식을 거의 제공하지 않는다. Mtb는 엄격한 인간 병원체이기 때문에 인간화 모델 시스템에서 Mtb를 연구할 수 있는 이점도 있습니다. 유동 세포측정은서스펜션(22)에서단일 세포의 다중 현상 및 기능적 특성을 평가할 수 있는 가능성을 제공하는 강력한 기술로, 또한 자가형23,24로알려진 대식세포와 같은 부착세포로 상당히 도전적일 수 있다. 단단히 부착 된 대식세포의 화학 적 분리 외에도 Mtb 감염은 Mtb 감염된 대식세포의 유동 세포 측정 분석에서 또 다른 수준의 복잡성을 추가하는 세포에 중요한 스트레스 인자를 제기 할 수 있습니다.
본 실험 프로토콜에서, 우리는 악성 실험실 Mtb 균주 H37Rv에 감염된 1 차말말피 단화 유래 세포의 면역 편광에 기초하여 이전에 확립 된 인간 대식세포 감염 모델을 사용하고, 선택된 M1 및 M2 마커25의발현을 포함하는 10 색 패널을 사용하여 유동 세포측정으로 분석하였다. 이 프로토콜은 M1 또는 M2 편광 단핵구 유래 대식세포에서 Mtb 감염에 대한 반응을 연구하는 효율적이고 재현 가능한 방법을 제공합니다. 또한, 부착된 Mtb-감염된 대식세포에 유동 세포형의 사용은 우리가 기존의 M1 및 M2 대식세포와 관련된 다양한 표면 마커와 Mtb 감염에 대한 그들의 세로 반응들을 연구할 수 있게 한다. 중요한 것은, 이 프로토콜은 다른 병원체와의 감염, 항종양 연구 또는 염증 조건의 연구, 약물 스크리닝 등에 대한 감염의 조사를 위해 쉽게 채택될 수 있으며, 인간 임상 샘플에서 M1/M2 대식세포 편광의 평가를 위해 악용될 수도 있다.
프로토콜
건강한 익명의 혈액 기증자에서 인간 말초 혈액은 스웨덴 후딩데 카롤린스카 대학 병원에서 혈액 은행에서 얻은 (윤리적 승인 Dnr 2010/603-31/4). 스웨덴 의 공중 보건국 (FOHM), 솔나, 스웨덴의 생물 안전 수준 3 (BSL-3) 실험실에서 라이브 악성 Mtb를 포함하는 모든 실험 단계는 수행되었다.
1. 미디어, 완충제 및 세균 배양 준비
참고: 모든 시약 및 소모품에 대한 자세한 내용은 재료 표에제공됩니다.
- RPMI 완전 매체: 보충 RPMI 1640 와 1 mM 나트륨 pyruvate, 2 mM L-글루타민, 10 mM HEPES, 그리고 10% 열 불 활성화 태아 소 소 혈청 (FBS). Mtb 감염으로 작업 할 때 세포 배양 배지에서 항생제를 피하십시오.
- 세럼없는 RPMI 매체 : 보충 RPMI 1640 와 1 mM 나트륨 피루바테, 2 mM L-글루타민과 10 mM HEPES.
- 세척 버퍼: 0.05%(v/v) 트위엔-80을 함유한 인산염 완충식식(PBS)을 준비한다.
- FACS 버퍼: 2.5%(v/v) FBS 및 0.5mM EDTA를 포함하는 PBS를 준비합니다.
- 고정 버퍼: PBS에 4% 포름알데히드가 포함된 PBS를 PBS로 준비합니다. 37% 포름알데히드의 스톡 솔루션과 혼합된 사용 전에 신선하게 준비되었는지 확인하십시오.
- 침투성 버퍼: 구연산 나트륨 0.1%, 트리톤 X-100 0.1%를 첨가하여 탈온화된 물에 넣습니다.
- 세척 버퍼 (면역 불경전): 0.1 % BSA 및 0.1 % Tween-20을 포함하는 PBS를 준비하십시오.
- 차단 버퍼: PBS0.1% BSA 및 10% 일반 염소 혈청(NGS)을 PBS로 준비합니다.
- 염색 버퍼(면역 불면): PBS에 0.1% BSA를 포함하는 PBS를 PBS에 준비합니다.
- TB 완전 매체: 보충 미들 브룩 7H9 국물 0.05% (v/v) Tween-80, 0.5% (v/v) 글리세롤, 카나마이신 (20 μg/mL), 10% (v/v) 미들브룩 올레산, 알부민, 덱스트로스 및 카탈라제 농축 (미들 브룩 ODC 농축).
- 세균 배양: 모노사이클 유래 세포의 감염을 위해 표준 악성 Mtb 실험실 균주인 H37Rv를 사용하여 녹색 형광 단백질(GFP)을 구성적으로 표현합니다. 이 Mtb 균주는 GFP를 코딩하는 유전자뿐만 아니라 카나마이신 저항을위한 유전자를 포함하는 pFPV2 플라스미드를 전달합니다. 항생 저항은 카나마이신을 포함하는 문화에서 플라스미드 표현 박테리아의 지속적인 선택을 가능하게 합니다. 박테리아를 TB 완전 배지 및 70% 글리세롤(1:1 희석)에 -80°C에 저장한다.
2. 버피 코트에서 말초 혈액 단핵 세포 절연
참고: 클래스 II 생물 안전 캐비닛 내에서 인간의 혈액 (잠재적으로 전염성)으로 모든 작업을 수행합니다. 폐기하기 전에 소독제로 잔류 혈액 제품을 15 분 동안 비활성화하십시오. 이 경우 건강한 자원 봉사자로부터 혈액을 얻었습니다. 이러한 체외 대식세포 분화 프로토콜은 10 x 106 개의 격리 된 PBMC / 기증자 / 우물을 포함하도록 설정되었습니다. 각 기증자로부터, 하나의 버피 코트는 일반적으로 약 10% 또는 50-80 x 106 단세포가 회수될 수 있는 500-800 x 106 PBMC를 제공하는 전혈에서 유래하는 집중백혈액 현탁액의 대략 50mL를 포함합니다.
- 50mL 튜브에 제조된 밀도 그라데이션 배지 15mL 위에 버피 코트 혈액 15mL를 적재합니다. 파이프 팁을 튜브 벽에 기대어 밀도 그라데이션 층 위에 혈액을 천천히 오버레이합니다.
- 0 가속과 0 감속으로 실내 온도 (RT)에서 25 분 동안 600 x g에서 튜브를 회전합니다.
참고: 원심 분리 전에 뚜껑을 조심스럽게 닫고 항상 원심 분리 후 유출 가능성에 대해 튜브 홀더를 확인하십시오. - 멸균 파스퇴파이펫으로 상부 플라즈마 층을 제거하고 그 후 신중하게 멸균 파스퇴르 파이펫을 사용하여 새로운 50mL 튜브로 단핵 세포 층을 수집합니다. PBMC 펠릿에 혈청 이없는 RPMI 배지를 추가하여 최종 50mL를 얻습니다. RT에서 5 분 동안 500 x g에서 원심 분리 전에 튜브를 몇 번 반전하여 조심스럽게 섞습니다.
- 상체를 조심스럽게 버리고 손가락 내의 튜브 바닥을 뒤집어 세포 펠릿을 다시 놓습니다.
- PBMC로부터 밀도 그라데이션 배지 오염을 제거하기 위해 혈청이 없는 RPMI로 2-3회 세척하여 50mL의 최종 부피를 얻습니다. RT에서 5분 동안 500 x g의 원심분리기는 셀 상류제가 투명해질 때까지 씻어내라.
- 상체를 버리고 혈청이없는 RPMI 배지의 20 mL에서 세포를 다시 중단하십시오.
- 수동으로 혈전계를 사용하거나 자동화된 셀 카운터를 사용하여, 트라이판 블루 염색으로 세포를 계산합니다. 셀-트라이판 블루 샘플을 96웰 플레이트(예: 50 μL + 50 μL+ 50 μL)또는 10 μL + 10 μL+10 μL(자동 셀 카운팅용)에 혼합하여 1:2 또는 1:10 희석으로 셀 서스펜션을 희석시키고 셀수를 계산하여 셀을 계산합니다.
주의: 트라이판 블루는 독성이 있으며 별도의 화학 폐기물로 버려야 합니다.
3. 단세포 유래 세포의 분화 및 편광
참고: 단화 유래 세포의 분화 및 편광을 위해, 이전에 M0, M1 유사 및 M2와 같은 세포뿐만 아니라 완전 M1 및 M2 편광 셀에 대해 이전에 확립한 프로토콜이25를따랐다. 단순성으로 는 완전히 편광된 M1 및 M2 대식세포만 여기에 설명되어 있습니다.
- 단핵구의 분리를 위해 플라스틱 준수를 사용합니다. 간략하게, 종자 갓 분리된 PBMC는 적절한 농도로 6웰 배양 플레이트에서, 예를 들어, 10 x 106 PBMC/웰 2mL 세럼없는 RPMI 배지 및 37°C 및 5%CO2에서배양한다.
- 2-3 시간 후, 파이펫으로 비 부착 세포를 제거하고 1 mL 혈청없는 배지로 우물을 3 번 세척하십시오. 부착된 세포는 단핵구이며, 우물에 첨가된 총 PBMC의 약 10%를 포함하고 있으며, 즉 106개의 단핵구가 잘 첨가된 10 x 106 PBMC로부터 회수된다.
- 대식세포 분화의 경우, M1 및 M2 대식세포 편광에 대해 각각 50 ng/mL GM-CSF 또는 M-CSF를 포함하는 작업 솔루션을 준비하여 2mL당 RPMI 완성 배지를 추가합니다. 3일 동안 37°C에서 5%CO2 인큐베이터로 세포를 배양한다.
- 3일에는, 각 우물의 상부 층으로부터 세포 배양 배지의 1mL를 신중하게 제거하고 우물에서 50 ng/mL 최종 농도를 얻기 위해 M-CSF 또는 GM-CSF의 이중 농도를 포함하는 신선한 RPMI 완전 배지 1mL로 세포 배양을 보완한다. 100 ng/mL/웰의 미리 만들어진 작업 솔루션에 성장 요인을 추가합니다.
- 6일째에, 세포 분화의 마지막 18-20 h에 대해 다른 자극을 추가하여 완전히 편광되고 성숙한 M1(인터페론-γ; IFN-γ, 리포폴리사카라이드; LPS (대장균 O55:B5) 또는 M2 (인터류신 4; IL-4) 대식세포. M1 편광의 경우 RPMI 완전 배지에서 IFN-γ 및 LPS를 준비하고 우물당 50 μL을 추가하여 세포 배양에서 50 ng/mL IFN-γ 및 10 ng/mL LPS의 최종 농도를 얻습니다. M2 편광의 경우, RPMI 완전 배지에서 IL-4를 준비하고 우물당 50 μL을 추가하여 세포 배양에서 20 ng/mL의 최종 농도를 얻습니다.
- M0 편광 대식세포의 분화를 위해, 추가 사이토카인(M2와 같은 표현형을 제공함) 없이 M-CSF만으로 세포를 자극한다(M2와 같은 표현형 제공)(25)
- 더 작은 단핵구가 더 큰 대식세포 같이 세포로 분화되는지 확인하기 위하여 가벼운 현미경 검사법으로 단핵구 유래 세포 배양의 형태를 정기적으로 확인하십시오. 또한, M1과 M2 편광 사이의 잠재적 형태적 차이를 모니터링, 즉, 더 둥근모양(25)을가진 M2 세포에 비해 M1 세포를 길게 늘고 늘게 한다.
- 7일째에, 단핵구 유래 세포를 가진 판을 악성 Mtb를 가진 감염을 위한 BSL-3 실험실로 전송합니다.
4. Mtb 문화 준비
참고: 다음 단계는 BSL-3 시설에서 수행해야 합니다. 악성 Mtb와 함께 모든 작업을 위해, 보호 의류를 사용, 호흡기 보호, 그리고 에탄올 내성 장갑.
- 세균 성 알리쿼트의 1mL로 유리병을 해동하고 50mL 여과 캡 튜브에 9mL의 결핵 완전 매체(1:10 희석)와 혼합한다. 37°C 및 5% CO2에서인큐베이터에서 현탁액을 배양한다.
- 24 시간 후, 세균 현탁액을 2,300 x g에서 10 분 동안 스핀하고 조심스럽게 배지를 부어. 새로운 50mL 여과 캡 배양 튜브에서 15~20mL의 신선한 결핵 완전 배지로 세균펠릿을 재연하고 37°C 및 5%CO2에서배양한다. 모든 세균성 세포에 대한 균질성 영양소 공급을 유지하기 위해 2-3 일마다 튜브에 정착 박테리아를 혼합합니다.
- 7-10일 후에는 50mL 나사 캡 튜브로 이송하기 전에 위아래로 파이프를 사용하여 세균 현탁액을 적절히 섞습니다.
- 멸균 세척 버퍼 35-40mL을 50mL 튜브에 넣고 세균 현탁액을 2,300 x g에서 10분 동안 회전시합니다. 세탁 단계를 한 번 반복합니다. 마이크로 피펫으로 파이펫팅하여 혈청이 없는 RPMI 배지의 1mL에서 세균 펠릿을 재연합니다.
- 또 다른 9mL의 혈청 없는 RPMI 배지를 추가하고 37°C에서 5분 동안 클래스 II 생체 안전 캐비닛 내부의 세균 현탁액을 초음파 처리하여 세균 덩어리를 방해합니다. 세균 덩어리의 최대 중단을 보장하기 위해 수조 초음파 처리기에 튜브를 반복적으로 (3-4 시간)를 찍어. 생물안전 캐비닛 내부에 배치된 분광계를 사용하여 600nm 파장에서 세균 현탁액 1mL의 광학 밀도(OD)를 측정합니다. 세럼이 없는 RPMI 배지를 사용하여 참조를 설정합니다.
- 수식을 사용하여 콜로니 성형 단위(CFU)의 수를 계산합니다: (OD+0.155)/0.161 = Y, 및 Y x 107= Y x 106 CFU/mL, 예를 들어, OD 값 0.32는 세균 농도(0.32 + 0.155)/0.161 = 2.95, 2.95 x 107= 29.5 x 106 CFU/mL을 제공한다.
5. 단핵구 유래 세포의 Mtb 감염
참고: 다음 단계는 BSL-3 시설에서 수행해야 합니다.
- 새로운 멸균 50 mL 튜브에서 혈청없는 RPMI 배지에서 세균 펠릿을 다시 중단하고 최종 세균 농도를 약 5 x 106 CFU /mL로 조정합니다.
- 단세포 유래 세포를 함유하는 6웰 플레이트(s)로부터 세포 배양 배지를 제거한다. 각 웰에 1mL의 세럼 프리 RPMI 배지를 추가합니다. 감염(MOI) 5:1, 즉 2mL/웰에서 106대식세포당 5 x 106 CFU를 얻고 37°C및 5%CO2에서4h의 플레이트를 배양하기 위해 잘 세균현탁액 1mL을 첨가한다.
- 감염 후, 세포 외 박테리아를 제거하기 위해 멸균 세척 버퍼 1 mL로 세포를 3 번 세척하십시오. 접시를 기울이고 모서리에서 전체 세척 버퍼를 조심스럽게 제거합니다. 항생제 없이 RPMI 완전 배지의 2mL에서 Mtb-감염된 단세포 유래 세포를 재중단하고 세포분석의 흐름 세포분석 전에 다른 24시간(또는 다른 시간점)에 대한 세포 분비액을 흐르거나 배양한다.
6. Mtb 감염 단세포 유래 세포의 흐름 세포피질 염색
참고: 다음 단계는 BSL-3 시설에서 수행해야 합니다. 유동 세포질 염색은 튜브 대신 96웰 플레이트에서 수행될 수 있습니다.
- Mtb-감염 된 세포 (및 감염 되지 않은 컨트롤) 6 웰 플레이트에서 우물에서 분리 하 여 37°C에서 적어도 30 분 동안 잘 당 FACS 버퍼의 1 mL와 배양하 37 °C 및 5% CO2.
- 셀이 분리되도록 몇 번 부드럽게 피펫을 위아래로 피펫합니다. 가능하면 현미경으로 세포 분리를 확인하십시오. 각 웰에서 나사 로 덮인 미세 원심 분리기 튜브로 셀 서스펜션을 옮기고 튜브를 5 분 동안 200 x g로 회전시하십시오. 피펫팅으로 상체를 조심스럽게 버리십시오.
- FACS 버퍼로 각 튜브의 셀 펠릿을 두 번 세척하고 세포를 200 x g에서 5 분 동안 회전시십시오.
- TLR2(AF647), CD206(APC-Cy7), CD163(BV605), CD80(BV655), CD80(BV655), CD80(BV655) 등 불소크롬-컨쥬게이드 항인간 항체의 약 50μL 칵테일을 가진 세포(약 0.5 x 10 6~ 106세포/튜브)에 스테인 0), CCR7(BV711), CD86(BV786), CD200R(PE), CD64(PE-눈부신 594), HLA-DR(PE-Cy5)(표 1)와함께 4°C(냉장고)에서 30분 동안 생존성 염료 좀비-UV와 함께 한다.
- FACS 버퍼 400 μL로 스테인드 셀을 두 번 씻고 5 분 동안 200 x g에서 세포를 회전시하십시오.
- 진균균의 완전한 불활성화를 보장하기 위해 어둠 속에서 RT에서 30 분 동안 고정 버퍼 (갓 준비)의 200 μL로 스테인드 셀을 수정합니다.
- FACS 버퍼 400 μL로 셀을 두 번 세척하고 200 x g에서 5 분 동안 회전하여 초과 수정 버퍼를 제거하십시오.
- 고정 된 세포를 400 μL의 FACS 버퍼로 재중단하고 BSL-2의 유동 세포측정을 위한 BSL-3 실험실에서 샘플을 꺼내기 전에 새로운 1 mL 미세 원심 분리기 튜브로 샘플을 옮킨다. 염색된 세포를 샘플 수집전까지 +4°C에 저장합니다.
참고: BSL-3 실험실에서 튜브를 70% 에탄올로 분사한 후 튜브를 스프레이합니다. 포름알데히드는 독성 (발암성) 클래스 II 생물 안전 캐비닛에서 처리해야합니다. 별도의 화학 폐기물에 포름알데히드 폐기물을 폐기하십시오.
7. Mtb 감염 단세포 유래 세포의 흐름 세포 측정 데이터 수집 및 분석
참고: 단계 7.1-7.2 전술한 유동 세포측정 얼룩에 앞서 수행해야 한다. 세포 고정 후 탠덤 염료의 세포 덩어리 및 해리에 대한 문제를 피하기 위해, Mtb 감염 및 감염되지 않은 세포의 샘플 수집은 1 차 항체 염색 후 4-10 시간 이내에 수행됩니다.
- 전술한 유동 세포질 염색 전에, 스테인링패널(표 1)에나열된 각 형광-컨쥬게이트 항체에 대한 형광 신호를 보상(양수 및 음수 모두)을 이용하여 보상구슬을 사용한다.
- 인간 대식세포 염색을 위한 항체 희석을 적티프로하여 각 불소크롬에 대한 최적의 신호를 얻습니다.
- 스테인드 세포를 사용하여 염색된 세포가 시각화될 수 있도록 부정적인 세포 집단에 대한 게이트를 설정하는 데 필요한 배경 형광수준을 결정합니다(대식세포는 매우 자동 형광입니다).
- 데이터 수집을 위한 권장 소프트웨어를 사용하여 유동 사이토미터에서 최소 50,000개의 셀/샘플을 획득합니다.
- 유동 세포계(FCS) 형식 3.1에서 획득 파일을 유동 세포계에서 내보냅니다.
- 유동 세포 분석 소프트웨어에서 FCS 파일을 분석합니다.
- 게이트 대식세포는 전방 및 측면 분산(FSC 및 SSC) 특성에 따라 대식세포를 제거하고 좀비-UV 생존성 염료를 사용하여 살아있는/죽은 세포 게이팅에 의해 죽은 세포를 배제한다.
- FITC 채널에서 H37Rv-GFP 감염된 대식세포를 시각화합니다.
- 모든마커(표 1)에대해 양분된 세포 및 기하학적 평균 형광 강도(MFI)의 주파수를 식별한다.
8. Mtb 감염 단세포 유래 세포의 면역 형광 염색
참고: Mtb 감염은 BSL-3 시설에서 수행해야 합니다.
- 면역 염색을 위해, 종자 2 x 105 PBMC/잘 에 500 혈청 없는 RPMI 배지의 500 μL에 8 웰 챔버 슬라이드에 2 x 104 단세포/웰을 얻을 수 있습니다. 단핵구의 분화 및 M1/M2 편광 후, 위에서 설명한 바와 같이 Mtb 감염을 진행한다. 30 분 동안 고정 버퍼로 Mtb 감염24 시간 후 슬라이드를 수정합니다. 고정 슬라이드는 추가 분석이 될 때까지 -20 °C의 냉동실에 저장됩니다.
- 단세포 유래 세포를 PBS 200 μL로 각각 10분 간 세척합니다.
- RT에서 5분 동안 200μL의 투과성 버퍼로 세포를 투과화합니다.
- PBS의 200 μL로 세포를 3회 세척하여 각각 5분 동안 세척합니다.
- 각각 5 분 동안 세척 버퍼의 200 μL로 세포를 두 번 세척합니다.
- RT에서 30분 동안 200μL의 블로킹 버퍼로 비특이적 결합을 차단합니다.
- 1차 항체를 염색 완충제에서 1:100을 희석시키고 M1 세포를 공자 CD64 항체(Clone: 10.1) 및 M2 세포를 RT에서 2h에 대해 수렴되지 않은 CD163 항체(polyclonal)로 배양한다.
- 다음으로, 각각 10 분 동안 세척 버퍼 200 μL로 세포를 3 번 씻으시다.
- 염색 버퍼에서 형광 표시 이차 항체 1:1,000을 희석하고 안티 마우스 IgG-알렉사 플루어 594 및 RT에서 1 h에 대한 안티 래빗 IgG-알렉사 플루어 594M2 세포로 M1 세포를 배양한다.
- 200 μL 세척 버퍼로 셀을 3회 세척하여 각각 10분 동안 세척합니다.
- 챔버 그리드를 제거하고 각 웰에 DAPI 마운팅 매체의 ~20 μL을 추가하고 각 슬라이드에 1.5mm 커버 슬립을 넣습니다.
- 매니큐어 층으로 커버슬립을 밀봉합니다.
- GFP(녹색 채널), DAPI(블루)의 402nm, 이차 항체(red)의 경우 560nm의 발동을 위해 486nm에서 방출되는 레이저가 있는 공초점 현미경을 사용하여 이미지를 획득한다.
결과
M0(M2 유사 세포), M1(완전히 편광된 M1 세포) 및 M2(완전히 편광된 M2 세포)로의 편광에 사용되는 사이토카인 자극의 회로도 그림은 도 1A에제시되며 M0, M1 및 M2 세포 배양뿐만 아니라 M1 배양식의 대표적인 이미지는 0일, 도 1, 3B에서 도 1, 3B로나타났다. 감염되지 않은 M0 세포는 기본 게이팅전략(도 2A)을입증하기 위해 사용되었다. 처음에, 골수성 세포 (~85%) 이들의 전방 분산(FSC) 및 측면 분산(SSC) 특성에 따라 세분성이 높은 더 큰 세포를 포함하고, 점플롯의 왼쪽 하단 모서리에서 발견되는 낮은 SSC 및 FSC를 가진 소형 파편을 제외하였다. 두 번째 플롯에서, 이중(즉, 세포 덩어리)은 단일 세포에 비해 증가된 면적이 있지만 유사한 높이를 갖는 것으로 정의되었고 추가 분석에서 제외되었다. 따라서, FSC-Area와 FSC-Height(단일 세포) 사이에 비례하는 세포만 경사 형상 게이트 내부에 포함되었다. 다음으로, 죽은 세포 내부의 세포질 단백질을 얼룩지게 하는 좀비-UV 생존성 염료는, 후속 분석에서 죽은 세포를 배제하기 위하여 이용되었다. 예상대로, 가능한 미감염M0 세포는 FITC 채널에서 시각화된 Mtb-GFP 발현에 대해 부정적이었다.
다음으로, 감염 후 4시간(그림2B, C)에서Mtb 감염M1 및 M2 대식세포뿐만 아니라 감염되지 않은 것과 동일한 게이팅 전략을 적용했습니다. 감염된 M1 편광 대식세포의 FCS/SSC 게이트에서 2개의 하위 인구가 검출되었습니다. 1개의 인구는 더 작은 크기(FCS) 및 더 높은 세분성(SSC) 및 다른 인구에 더 큰 크기및 낮은 세분성(도2B)을가진 반면, 감염되지 않은 M2 세포의 정문은 더 균일하게나타났다(도 2C). M1 및 M2 단세포 유래 세포모두 Mtb 감염 시 더 높은 세분성 및 감소된 세포 크기로 수직 이동을 나타내었으며, 이는 세포내 Mtb박테리아(도 2B,C)의섭취로 인한 세포 내부의 복잡성을 증가시킬 수 있다. 더욱이, 생존성 얼룩은 향상된 세포 사멸을 밝혔습니다 (17-22%) 5의 MOI에서 Mtb 감염M1 및 M2 세포 중, 감염되지 않은 M0 세포에 비해 (99%) (도2A-C)또는 감염되지 않은 M1 및 M2 세포(데이터가 표시되지 않음). 대표적인 데이터는 Mtb-GFP 발현(즉, Mtb 감염도)이 4시간 후 M1(GFP 양성 세포 19%)에 비해 M2(77% GFP 양성 세포)에서 실질적으로 더 높은 것으로나타났다(그림 2B,C). 24시간 감염 후, Mtb-GFP 발현은 M1 및 M2 세포에서 각각 43%와 85%였으며, M1 세포가 M2 세포에 비해 Mtb 감염 후 4~24시간에서 GFP 발현이 상대적으로 높았으며, M1 및 M2 세포에서 각각 4~24시간 GFP 발현이 126% 증가한 것으로 나타났다.
감염되지 않은 단화 유래 세포에서 M1/M2 편광의 효능을 특성화하기 위해, 점 플롯은 CD64 및 CD86(CD64+CD86+)및 CD200R(CD163+CD200R) 및 M2 세포에 대해 이중 양성인 M1 세포를 식별하는 데 사용되었습니다. 그림 3A,B). M1/M2 마커의 선택은 주로 전작25의 결과에 기초하여 만들어졌지만 다른연구(26,27,28,29)에서도제작되었다. 스테인드 셀에 대한 사분면은, 얼룩지지 않은 M1/M2세포(그림 3A)에대해 해당 게이트를 사용하여 설정하였다. 이러한 마커 중 어느 것도 M1 또는 M2 세포에 의해 독점적으로 발현되지 않지만, 표면 발현의 강도뿐만 아니라 양성 세포의 비율은 다르다. 이것은 M1 세포의 약 95%와 M2 세포의 79%가 CD64+CD86+인M1 얼룩에서 특히 분명했지만, 염색 강도는 M1 서브셋에서 실질적으로 높았다(도3A). M1 셀의 27%는 M2 마커 CD200R에 대해 양성인 반면, CD163에 대해 1%만이 양성반응을 보이며, 63% CD163+CD200R+ M2 셀(그림3A)에비해 0.5% CD163+CD200R+ M1 셀을 제공한다. 4시간 동안 Mtb 감염 후, Mtb-GFP 양성 M1 편광 세포(16%)에서 CD200R+세포의 주파수가 증가하는 반면, CD163 발현은 M2 세포(도3B)에서감소하였다. 히트 맵은 CD163+CD200R+ M2 셀에서 GFP 발현의 고강도를 보여 주지만, 또한 해당 M1 셀 하위 집합(그림3B)에비해 CD64+CD86+ M2 서브세트에서도 보여 준다. 전반적으로, 각각의 M1 및 M2 마커의 발현의 변화도 도 3C의히스토그램에서 시각화된다. 더욱이, Mtb-GFP 박테리아는 또한Cd64+ M1 세포및 공초점 현미경검사법에 의해 CD163+ M2 세포에서 시각화되었으며, 이는 M1 세포에 비해 M2 내부의 Mtb 의 향상된 세포 내 섭취 및/또는 성장을 지원하였다(도3D).
수동 게이팅의 결과를 확인하기 위해 균일 매니폴드 근사치 및 프로젝션(UMAP)을 사용하여 치수 감소를 적용했습니다. UMAP 분석 결과 4시간 동안의 Mtb 감염은 대식세포의 편광에 영향을 미치기에 충분하지 않았으며, 24시간 감염과 는 대조적으로 M1 및 M2의 명백히 분리된 클러스터가 감염되지 않은 및 감염된세포(도 4A)를초래한 것으로 나타났다. 감염되지 않은 M1 대식세포는 M2 대식세포에 비해 CD64, CD86, TLR2, HLA-DR 및 CCR7의 높은 발현을 나타내었으며, 감염되지 않은 M2 세포는 M2 표현형 마커 CD163, CD200R, CD206 및 CD80(그림4,B)의강력한 상향 조절을 나타냈다. 수동 게이팅에 동의하여, 24시간 후에 Mtb 감염은 M2 세포에 CD163, CD200R 및 CD206의 명확한 다운레귤레이션을 일으켰고 M1 세포에 CD86 및 HLA-DR의 강화조절(그림 4B,C)은Mtb이 대식파지 편광을 조절할 수 있음을 시사합니다. 후속 페노그래프분석(도 4D-F)은UMAP 그래프(도 4D), 원형 차트(도4E)및 열맵(도4F)에도시된 바와 같이 M1및 M2 감염 및 Mtb 감염 세포 간에 고유하게 분포된 24개의 상이한 크기의 클러스터를 확인하였다. 전부, 이 결과는 Mtb 감염에 의해 더 변조되는 시험관내의 표현전형 및 기능적으로 다양한 M1 및 M2 편광 세포를 생성하는 이 프로토콜의 유망한 효율성을 보여줍니다.
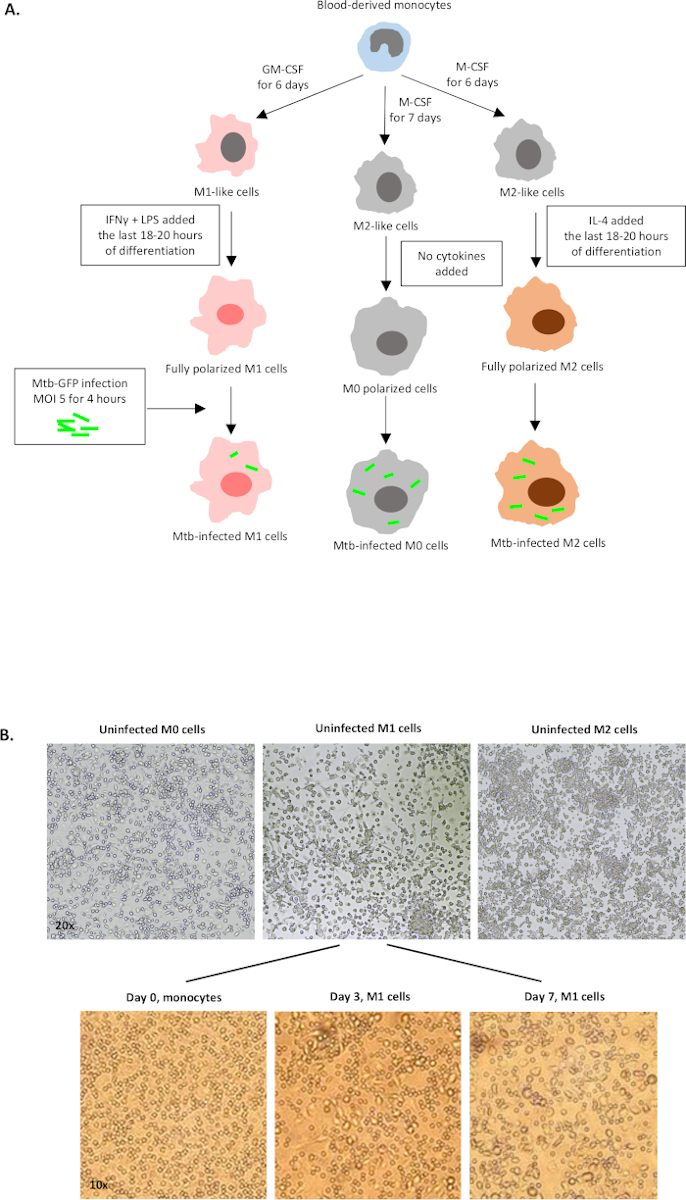
그림 1: 인체 골수성 유래 세포의 체외 분화 및 편광의 회로도 그림. (A)M0(M2 유사), M1(고전적으로 활성화) 및 M2(대안적으로 활성화된) 세포가 묘사된다. 건강한 혈액 기증자로부터 얻은 단핵구는 프로토콜에 기술된 것과 같이 다른 사이토카인으로 편광되었고 GFP 라벨이 부착된 Mtb 균주 인 H37Rv에 감염되어 10색 유동 세포측정을 사용하여 분석하기 4시간 전에 감염되었습니다. M1 편광 세포는 전형적으로 M2 편광 세포에 비해 적은 박테리아를 포함합니다. (B)7일째 6웰 플레이트에서 완전히 편광, 미감염M0, M1 및 M2 세포의 현미경 영상, 0일, 3 및 7일째에 단핵구로부터 M1 세포 분화의 대표적인 영상. 배율은 20배(상부 패널) 및 10배(아래 패널)입니다. M1 셀은 더 둥근 M0 및 M2 셀(상부 패널)에 비해 더 길어지고 늘어나고 늘어납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
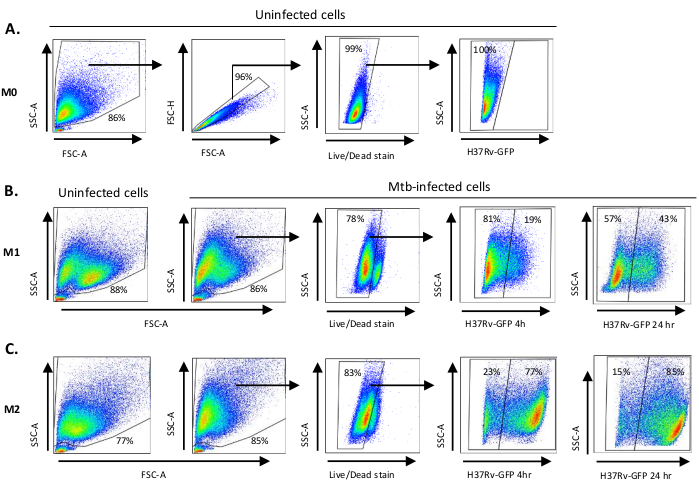
그림 2: 분화 된 골수성 유래 세포의 게이팅 전략. 대표적인 점도 플롯(A)전방 분산(FSC) 및 감염되지 않은 M0 대식세포의 측면 분산(SSC) 특성을 보여 주어. FSC-A/FSC-H 플롯은 면적과 높이에 비례하는 단일 셀의 수동 게이팅을 보여 주어 있습니다. 라이브 셀 게이트는 좀비-UV (생존 성 염료)에 대 한 긍정적인 세포를 제외. 세포 내 Mtb는 FITC 채널에서 관찰된 살아있는 세포에서 GFP 발현에 의해 검출되었다. (B)M1 및(C)M2 대식세포는 감염되지 않은 세포및 Mtb 감염 세포 4h 및 24h 감염 후 모두의 FCS/SSC 도트 플롯을 보여 주어. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 시험관 내 M1/M2 편광 프로토콜의 효능. CD64 및 CD86(M1) 또는 CD163 및 CD200R(M2)을 이용한 M1 및 M2 편광 세포의 하위 집합 주파수를 나타내는 대표적인 도트 플롯 및 사분면게이팅(A)염색 및 염색되지 않은 감염되지 않은 세포 및(B)Mtb 감염 후 감염 세포 4h 포스트 감염. (B)의도트 플롯은 다른 서브 게이트로부터 얻어진 M1 및 M2 편광 대식세포에서 GFP 발현(heat map)의 형광 강도를 보여 준다. (C)형광 강도(MFI)의 기하학적 평균은 4h의 Mtb 감염 후 한 대표 기증자로부터 히스토그램에 나타난다. 감염되지 않은 M1(라이트 블루) 및 M2 세포(라이트 퍼플)의 MFI 값은 상부 패널에 제시되고 Mtb-infected M1(딥 블루) 및 M2 세포(딥 퍼플)는 하부 패널에 제시된다. (D)감염되지 않은 M1-및 M2 편광 세포의 대표적인 공초점 이미지가 나타났다. M1 및 M2 세포는 면역 형광을 사용하여 각각 CD64 및 CD163 발현을 위해 염색되었다. 양성 표면 염색은 빨간색으로 나타내고 GFP를 발현하는 세포내 박테리아는 녹색으로 표시됩니다. DAPI 염색 핵은 청색으로 표시됩니다. 스케일 – 10 μm. 오른쪽에 있는 이미지의 배율은 350배입니다.
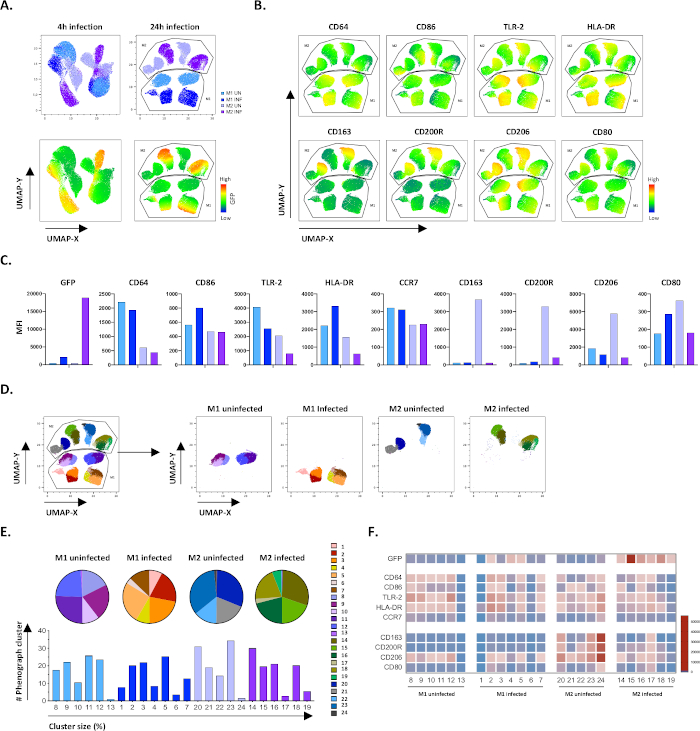
그림 4: 균일한 매니폴드 근사치 및 프로젝션(UMAP) 및 감염되지 않은 M1 및 M2 세포의 피노그래프 분석을 통해 치수 감소. (A)UMAP은 감염되지 않은 M1 및 M2 세포 배양으로부터 11000개의 살아있는 세포를 두 개의 대표적인 혈액 기증자, 4h(왼쪽 그래프) 또는 24h(오른쪽 그래프)로부터 결합하여 생성하였다. GFP 발현(하부 패널)에 대한 히트맵은 감염되지 않은 및 Mtb 감염 세포를 나타냅니다. (B-C) 감염되지 않은 M1 및 M2 세포24h 감염 후,(B)히트맵 또는(C)바 플롯으로 도시된 마커의 MFI. (D-F) Phenograph 분석은 감염되지 않은 M1 및 M2 배양 사이에서 분화되는 24개의 클러스터를 확인했습니다. 클러스터 8-13은 감염되지 않은 M1 세포에서 고유하며, 클러스터 1-7은 Mtb-infected M1 세포에서 고유하며, 클러스터 20-24는 감염되지 않은 M2 세포와 클러스터 14-19에서 고유하여 Mtb에 감염된 M2 세포에서 고유합니다. 각 페노그래프 클러스터의 각 마커의 MFI가(F)에도시된다. 데이터는 감염되지 않은 M1(라이트 블루) 및 M2 세포(라이트 퍼플) 및 Mtb-감염된 M1(딥 블루) 및 M2 세포(딥 퍼플)로 제시된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 유동 세포측정에 사용되는 항체 목록.
| 레이저 | 필터 | 플루오로크롬 | 표현형 | 기능 | 클론 | 카탈로그 번호 | 회사 |
| 639 | 670/30 | AF647 | TLR2 | 병원균 인식 수용체 | TL2.1 | 309714 | 바이오 레전드 |
| 639 | 780/60 | APC-Cy7 | CD206 | 만노스 수용체 | 15-2 | 321120 | 바이오 레전드 |
| 405 | 610/20 | BV605 | CD163 | 스캐빈저 수용체 | GHI/61 | 333616 | 바이오 레전드 |
| 405 | 670/30 | BV650 | CD80 | 공동 자극 분자 | 2D10 | 305227 | 바이오 레전드 |
| 405 | 710/50 | BV711 | CCR7 | 체모키네 수용체 | G043H7 | 353228 | 바이오 레전드 |
| 405 | 780/60 | BV785 | CD86 | 공동 자극 분자 | IT2.2 | 305442 | 바이오 레전드 |
| 488 | 530/30 | GFP | Mtb | 세포 내 박테리아 | |||
| 561 | 586/15 | PE | CD200R | 억제 수용체 | OX-108 | 329306 | 바이오 레전드 |
| 561 | 620/14 | PE/DAZZLE 594 | CD64 | IgG의 Fc 감마 수용체-I | 10.1 | 305032 | 바이오 레전드 |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | MHC 클래스 II 분자 | L243 | 307608 | 바이오 레전드 |
| 355 | 450/50 | BUV395 | 생존염료 | 라이브/데드 셀 마커 | 좀비 UV | 423108 | 인비트로겐 |
토론
이 실험 프로토콜은 다양한 대식세포 하위 세트에서 GFP 라벨 Mtb의 시각화 및 깊은 특성화를 허용하는 10색 유동 세포측정 패널을 사용하여 평가를 포함하여 골수이드 유래 세포의 효과적인 편광을 M1 또는 M2 표현형으로 효과적으로 편광하는 것을 설명합니다. 결핵은 고대 인간 질병이지만, 현재 Mtb 대식세포 상호 작용을 연구하는 황금 표준 모델은 없으며, 대식세포의 다색 유동 세포측정은 림프구 반응의 분석에 비해 복잡할 수 있습니다. 대식세포에 인간 단핵구의 체외 분화를 위한 사용 가능한 프로토콜은 거의 생성된 대식세포의 모형에 대한 깊은 지식을 제시합니다. 마커의 고체 패널을 사용하여 대식 세포 활성화의 대식 세포 극화 및 유량 세포 측정 평가를위한 기본 프로토콜은 가능성이 이러한 특성화를 용이하게하고 다른 조건에서 처리 편광 세포의 추가 기능을 탐구 할 수있는 기회를 제공 할 수 있습니다. 여기에는 체외에서 배양된 세포의 분석뿐만 아니라 임상 샘플에서 생체 내 세포의 분석, 즉 체액(즉, 기관지 알릴라 라베이지) 또는 균질화 조직으로부터 의 PBMC 및 단일 세포 현탁액을 모두 포함한다. 따라서 환자에게서 얻은 단핵구 및 대식세포의 분화 및/또는 활성화 상태는 질병 결과와 관련이 있을 수 있다. 폐 결핵환자(30)에서말초 혈액에서 CD16+CD163+ 단핵구의 팽창이 보고되었다. CD163+ 세포의 증가된 주파수도 아토피성 피부염 환자의 염증피부에서검출되었다(31). 유사하게, CD206+ M2유사 대식세포는 지방분혈구조직(32)의 미세 환경에서 세포의 증식 및 분화를 억제하고 급성 골수성 백혈병(AML) (AML)29환자로부터골수 샘플에서 농축되는 것으로 나타났다. 골관절염 환자의 전혈에서 CD64(M1)에서 CD163(M2) 세포의 높은 비율은 질병심각도(33)와연관된 것으로 나타났다. 또 다른 연구는 CD86 (M1) 및 CD163 (M2)를 사용하여 조직의 높은 M1 발현이 악성 뇌종양34의하위 그룹에서 악화 된 결과와 상관관계가 있음을 입증하였다.
이 실험적인 M1/M2 유량 세포측정 프로토콜에는 몇 가지 중요한 장점이 있습니다. 이 모델은 악성 Mtb 감염에 대한 타고난 면역 반응을 연구할 수 있는 기회를 제공하며 혼합 림프구 반응(MlRs)에서 M1 또는 M2 대식세포와 함께 자가 T 세포를 추가하여 적응성 면역 반응의 연구를 포함하도록 개발될 수 있다. 이 프로토콜은 또한 다른 면역 조절 및 항균 화합물의 약물 선별 및 테스트에도 적합합니다. 여기서, 우리는 이전에 Mtb 감염 후 골수성 유래 세포에 비타민 D와 히스톤 deacetylase 억제제 페닐부티레이트(25,35)의효과를 연구했다. M1/M2 유량 세포측정은 세포 배양 체상제 또는 환자 혈장과 컨디셔닝 한 후 대식 세포 활성화를 평가하는 데 사용될 수 있습니다. HIV 또는 기생충 또는 결핵 당뇨병 공동 이환율을 가진 결핵 공동 감염의 생체 내 연구에서는 어려울 수 있지만, 덜 복잡한 M1/M2 모델은 체외에서 공동 이환율의 연구를 용이하게 할 수 있습니다. 마찬가지로, 프로토콜은 세포의 Mtb 감염성을 검사하거나 개별 M1/M2 세포의 항원 프리젠 테이션 능력뿐만 아니라 phagocytic을 조사하기 위해 전송 연구를 위해 악용 될 수있다. M1/M2 유동 세포측정은 바이오마커 및 백신 연구에서 사용, 치료 중 질병 예후를 따르고 골수성 유래 세포를 대상으로 하는 치료법을 테스트하는 데도 매력적입니다. 중요하게도, 공초점현미경(도 3D),실시간 PCR, 대식세포 편광 표현형 및 기능반응의 동시 평가를 위해 다양한 다른 방법이 동조세포측정을 동시에 평가할 수 있다. 서양 블롯, 멀티플렉스 분석및 배양 상류체에 있는 수용성 인자의 ELISA뿐만 아니라 GFP 발현(유동 세포측정 및 공초점 현미경 검사법) 및 식민지 형성 단위(CFU)를 이용한 세포내 세균 감염 및 성장의 평가. Mtb-GFP 박테리아를 가진 M1 또는 M2 세포의 감염은 또한 단하나 세포 RNA 염기분석 분석을 위한 동일 견본에서 감염되지 않은 및 Mtb 감염한 세포를 분류하는 가능하게 합니다.
설명된 프로토콜에는 기술적 및 과학적 단점을 포함한 몇 가지 제한 사항이 있습니다. 인간의 혈액 기증자로부터 단핵구 유래 대식세포를 이용한 단점은 기증자가 종종 가변성이 높고 세포가 인간 조직의 생리환경에서 편광되지 않는다는 사실이다. 기증자 들 간의 M1/M2 편광 효능 또는 Mtb 감염성의 큰 가변성은 내- 및 상호 실험적 변이, 낮은 통계적 전력 및 신뢰할 수 있는 결과를 얻기 위해 많은 기증자를 포함하는 필요 모두에 문제가 발생할 수 있습니다. 또한, PBMC로부터 단핵구의 플라스틱 준수는 기증자 의존성 모노사이클/웰의 결과로, 결국 Mtb 감염 후 대식세포 편광 및 세포 생존가능성에 영향을 미칠 수 있는 임의의 MOI를 제공할 수 있다. 프로토콜의 중요한 단계는 또한 대식세포 편광에 영향을 미칠 수 있는 세포 배양을 오염시키기 위하여 그밖 세포 모형을 방지하기 위하여 적당한 세척을 관련시킵니다. 너무 낮은 MOI는 잠복 결핵 감염을 모방할 수 있지만, 너무 높은 MOI는 세포를 죽이고 적절한 MOI를 사용하는 것의 중요성을 강조합니다. 더욱이, 분리 시 단단히 부착된 세포를 회수하기 어려울 수 있으며, 이는 유동 세포 분석에 사용되는 특정 대식세포 서브세트의 편향된 표현을 초래할 수 있다. 유동 세포 측정 분석의 중요한 단계는 올바른 수동 게이팅을 보장하기 위해 비스타 보상 매트릭스와 스테인드 셀 또는 FMO (형광 마이너스 원) 제어와 같은 부정적인 컨트롤을 적절히 사용하는 것입니다.
또 다른 제한은 혈액에서 파생된 단핵구의 편광이 아니라 국소 조직 환경에서 분리하는 것을 포함합니다. 인간 결핵의 특징은 Mtb 감염 조직에 있는 육아종의 대형이고 이렇게, 결핵에 있는 면역병리학은 현지 조직 사이트에서 우선적으로 공부되어야 합니다. 그러나, 단핵구는 염증/감염시 말초 혈액으로부터 폐로 모집되며, 여기서 세포는 GM-CSF12와같은 염증성 사이토카인이 있는 경우 대식세포로 분화할 수 있다. 중요한 것은, 생체 내 조직의 생리적 밀리우에서, 결핵 감염의 운명에 기여하는 다양한 M1-및 M2와 같은 대식세포 집단의 혼합물 및 상이한 비율을 포함하는 대식세포 편광의 큰 이질성이 있을 가능성이 있다36. 우리는 이전에 TB 37에서 대식세포 매개 육아종 형성의 3D 연구를 가능하게 하는 인간 organotypic 폐 조직 모형을개발했습니다. 현재 M1/M2 편광 프로토콜을 폐 조직 모델과 결합하여 결핵 과립종 형성, 이펙터 기능 및 M1/M2 비율을 실험 조직에서 추가로 연구하는 것은 흥미로울 수 있다.
이 M1/M2 유량성 프로토콜은 염증 반응뿐만 아니라 억제와 관련된 특징의 평가에 유용한 골수성 마커의 확장 패널을 포함하도록 쉽게 적응될 수 있었다. 대식세포 반응38을조절할 수 있는 PD-1, SIRP-α, IDO 및 아르지나제와 같은 억제 면역 체크포인트 분자에 대한 훌륭한 연구 관심이 있다. 이러한 맥락에서, 골수성 세포의 편광은 또한 TB38을포함한 여러 질병에 관여하는 것으로 나타난 면역 조절 대식세포(Mreg) 또는 골로이드 유래 억제제 세포(MDSC)를 촉진하는 다른 자극을 포함할 수 있다. M1/M2/Mreg 대식세포 서브세트의 고급 유동 세포측정패널에는 세포사내 염색/케모킨 IL-1β, TNF-α, IL-10 및 MCP-1 또는 유도성 산화질소(iNOS) 및 항균성 과 같은 기타 수용성 인자 또는 이펙터 분자를 포함할 수 있다. 이것은 T 세포(39)에대해 광범위하게 설명된 것과 유사한 다기능 대식세포 반응을 연구할 가능성을 향상시킬 수 있다.
현재, 유동 세포역학 염색 패널은 최대 30-40색을 포함할 수 있으며, 이는 면역페노타입 다중 세포 서브세트 및 분자를 동시에 면역할 수 있는 능력을 제공한다. 이 M1/M2 유량 세포측정 프로토콜의 기본 실험 설정은 대부분의 기존 및 새로운 유동 세포계와 호환되는 백본으로 사용할 수 있으며 BSL-3 환경에서 악성 Mtb로 작업하여 야기되는 과제를 포함하여 개별 요구에 따라 구축및 맞춤화될 수 있습니다. 요즘UMAP과 같은 치수 감소 기술은 새로운 버전의 유동 세포측정 소프트웨어에서 사용할 수 있으며, 이는 고차원데이터(40)의시각화 및 해석을 개선하는 데 필수적인 단일 세포 연구에서 생성된 많은 수의 파라미터를 분석할 수 있게 한다. 흐름 세포측정에 있는 일정한 기술 적인 개선은 이 프로토콜이 몇몇 대식세포 기지를 둔 Mtb 감염 분석에서 유용하다는 것을 증명할 수 있던 현대 세포 분류 기능과 함께 다중 파라메트릭 phenotyping의 조합을 포함하여 앞으로 도래할 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 스웨덴의 공중 보건 국, 마틸다 스벤슨과 솔로몬 게브레마이클BSL-3 실험실에서 도움을 준 동료들에게 감사드립니다.
이 작품은 스웨덴 심장 및 폐 재단 (HLF)(2019-0299 및 2019-0302)에서 SB, 스웨덴 연구 위원회 (VR) (2014-02592)의 보조금에 의해 지원되었습니다. 2019-01744 및 2019-04720 SB), 항생제 저항 방지 재단 (저항), 카롤린스카 연구소 재단 및 KID SB (마르코 로레티 박사 교육의 부분 자금 조달) 카롤린스카 연구소에서. ML은 스웨덴 아동 암 재단 (TJ2018-0128 및 PR2019-0100)에서 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
참고문헌
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Erratum
Formal Correction: Erratum: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection
Posted by JoVE Editors on 10/14/2020. Citeable Link.
An erratum was issued for: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection. Author and affiliation information was updated.
The author and affiliation information was updated from:
Akhirunnesa Mily1, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha2, Jagadeeswara Rao Muvva1, Magda Lourda1,3, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
3Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
to:
Akhirunnesa Mily1,2, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha3, Jagadeeswara Rao Muvva1, Magda Lourda1,4, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Infectious Diseases Division, International Centre for Diarrhoeal Disease Research, Bangladesh
3Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
4Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유