Method Article
קיטוב של M1 ו M2 תאים נגזרים מונוציט אנושי וניתוח עם Cytometry זרימה על זיהום שחפת Mycobacterium
In This Article
Summary
פרוטוקול זה מספק שיטה ללמוד זיהום שחפת Mycobacterium במאקרופאגים אנושיים M1- או M2 מקוטבים המבוססים על בידול של מונוציטים היקפיים-דם לתאים דמויי מקרופאג' הנגועים בזן הארסי H37Rv המסומן על ידי GFP, ומנותחים עם ציטומטריית זרימה באמצעות פאנל של 10 צבעים כולל ביטוי של סמני M1/M2 נבחרים.
Abstract
מקרופאגים אנושיים הם תאים מארחים ראשוניים של שחפת מיקובקטריום תאית (Mtb) זיהום ולכן יש תפקיד מרכזי בשליטה החיסונית של שחפת (שחפת). הקמנו פרוטוקול ניסיוני למעקב אחר קיטוב חיסוני של תאים שמקורם במיאלואידים לתוך M1 (מופעל קלאסית) או M2 (לחילופין מופעל) תאים דמויי מקרופאגים באמצעות הערכה עם לוח cytometry זרימה 10 צבעים המאפשר הדמיה ואפיון עמוק של חלבון פלואורסצנטי ירוק (GFP)-labeled Mtb בערכות מאקרו מגוונות. מונוציטים שהתקבלו מתורמי דם בריאים היו מקוטבים לתאי M1 או M2 באמצעות בידול עם גורם מגרה מקרופאג-מושבה גרנולוציטים (GM-CSF) או מקרופאג-מושבה מגרה גורם (M-CSF) ואחריו קיטוב עם IFN-γ ו lipopolysaccharide (LPS) או IL-4, בהתאמה. תאי M1 ו- M2 מקוטבים לחלוטין נדבקו ב- Mtb-GFP במשך 4 שעות לפני שמאקרופגים נגועים ב- Mtb היו מוכתמים בציטומטריית זרימה ב- 4 או 24 שעות לאחר ההדבקה. רכישה לדוגמה בוצעה עם cytometry זרימה והנתונים נותחו באמצעות תוכנת ניתוח cytometry זרימה. גטינג ידני, כמו גם הפחתת ממדיות עם קירוב והקרנה סעפת אחידה (UMAP) וניתוח פנוגרף בוצע. פרוטוקול זה הביא לקיטוב יעיל של M1/M2 המאופיין ברמות גבוהות של CD64, CD86, TLR2, HLA-DR ו- CCR7 בתאי M1 שאינם מושפעים, בעוד שתאי M2 שאינם מושפעים הציגו ויסות חזק של סמני פנוטיפ M2 CD163, CD200R, CD206 ו- CD80. תאים מקוטבים M1 הכילו בדרך כלל פחות חיידקים בהשוואה לתאים מקוטבים M2. כמה סמני M1/M2 היו downregulated לאחר זיהום Mtb, מה שמרמז כי Mtb יכול לווסת קיטוב מקרופאג. בנוסף, נמצאו 24 אשכולות תאים שונים בגדלים שונים המופצים באופן ייחודי בין התאים M1 ו- M2 שאינם נגועים בתאים נגועים Mtb ב 24 שעות לאחר ההדבקה. פרוטוקול cytometry זרימה M1/M2 זה יכול לשמש כעמוד שדרה במחקר Mtb-macrophage ולהיות מאומץ לצרכים מיוחדים בתחומים שונים של מחקר.
Introduction
מקרופאגים הם תאים חיסוניים התורמים באופן משמעותי לוויסות הומאוסטזיס של רקמות, דלקת ופתולוגיות של מחלות. בהיותו מרכיב חיוני של חסינות מולדת, שושלת מונוציט-מקרופאז 'של תאים מבטאת פנוטיפים הטרוגניים בתגובה לרמזים סביבתיים משתנים, המשקפים את הפלסטיות שלהם ואת הסתגלותם למקומות אנטומיים ואימונולוגיים שונים1. בהתאם לגורמי הגדילה, ציטוקינים ומתווכים אחרים הנמצאים במיקרו-ווירוניזציה, מקרופאגים סווגו לשתי אוכלוסיות הפיכות עיקריות, כל אחת עם תפקיד שונה בבקרה וסיווגחיידקיים 2: המקרופאג'ים הפרו-דלקתיים, המופעלים באופן קלאסי M1 והמאקרופאגים האנטי-דלקתיים, המופעלים לחילופין M2-מקוטבים שנקראו במקור לחקות את T helper (Th) nomenclature3. קיבוץ זה של מקרופאגים מקוטבים חיסוניים נחשב לעתים קרובות פשטני, כמו הפעלת מקרופאג ובידול אינו ליניארי, אבל יותר מדויק כמו רצף שבו לכל אוכלוסייה יש מאפיינים שונים ותפקידים תפקודיים בתוצאה של התפתחות המחלה והתקדמות4,5,6,7. עם זאת, ישנם יתרונות ניסיוניים רבים עם מודל מקרופאג M1/M2 שניתן להשתמש בהם במספר תחומי מחקר שונים.
שחפת Mycobacterium (Mtb) הוא הסוכן הסיבתי של שחפת (שחפת) והוערך להדביק אדם אחד בכל שנייה ונחשב לסוכן הזיהומי הקטלני ביותר בעולם (דו"ח שחפת גלובלי 2019). מאז דרכי הנשימה הוא התוואי העיקרי של זיהום Mtb, מקרופאגים מכתש הם התאים המארחים המועדפים להיות נגועים Mtb ומייצגים הן את המחסומים העיקריים ואת המאגר זיהומיות עבור Mtb בריאות. קיטוב מקרופאג בתגובה לגירויים שונים נחקר בהרחבה לאורך השנים7 וברוב העבודה שפורסמה, M1 קיטוב של תרבויות מונוציטים במבחנה הוא המושרה על ידי גרנולוציטים-מקרופאג המושבה מגרה גורם (GM-CSF) יחד עם IFN-γ ו LPS8,9, בעוד קיטוב M2 הוא המושרה עם מקרופאג מושבה מגרה פקטור (M-CSF) ו IL-410,11. מקרופאגים M1 הם תאים משפיעים חזקים המתווכים תגובות מיקרוביאלית נגד פתוגנים תאיים ויש להם תפקיד חיוני בחסינות antitumor12. מקרופאגים M2, לעומת זאת, יש פונקציה אנטי דלקתית, יכולת phagocytic גבוהה מעורבים בעיקר ריפוי פצעים ותיקון רקמות, כמו גם בזיהומים טפיל12. בהתאם לכך, מקרופאגים M1 נתפסים כיעילים יותר בשליטה תאית של Mtb בהשוואה למאקרופאגים M213. עם זאת, חיידקי Mtb יש גם פוטנציאל לווסת קיטוב מקרופאג לחתור תחת חסינות מולדת14,15,16,17.
אמנם זה נפוץ ליצור מקרופאגים מהבחנה של מונוציטים המתקבלים מדם היקפי18, מקרופאגים יכולים להיווצר גם מתאי גזע פלוריפוטנטיים המושרים (iPSCs)19 או מקרופאגים שמקורם במח העצם מעכברים20,21. אלה הן טכניקות אפשריות ללמוד תאי מקרופאג ראשוניים המתקבלים מאבות מונוציטים/מקרופאגים שיהתרבותו ויתבדלו לאוכלוסייה הומוגנית של תאים דמויי מקרופאג' בוגרים. עם זאת, פרוטוקולים אלה לעתים רחוקות לספק ידע מעמיק על פנוטיפ ותפקוד של התאים שהושגו ולא להסביר את ההטרוגניות הטבעית שנצפו בקרב מקרופאגים שהושגו vivo. כמו Mtb הוא פתוגן אנושי קפדני, יש גם יתרון ללמוד Mtb במערכות מודל אנושי. זרימה cytometry היא טכנולוגיה רבת עוצמה המציעה את האפשרות להעריך מאפיינים פנוטיפיים ופונקציונליים מרובים של תאים בודדים בהשעיה22, משהו שיכול להיות מאתגר למדי עם תאים חסידיים כגון מקרופאגים הידועים גם להיות autofluorescent23,24. בנוסף לניתוק כימי של מקרופאגים חסידים היטב, זיהום Mtb עשוי להוות גורם לחץ משמעותי לתאים המוסיף רמה נוספת של מורכבות בניתוחים ציטומטריים זרימה של מקרופאגים נגועים Mtb.
בפרוטוקול ניסיוני זה, השתמשנו במודל זיהום מקרופאג אנושי שהוקם בעבר בהתבסס על קיטוב חיסוני של תאים ראשוניים המופקים מדם-דם-מונוציט הנגועים במעבדה הארסית Mtb strain H37Rv, ונותחו עם ציטומטריית זרימה באמצעות פאנל של 10 צבעים כולל ביטוי של סמני M1 ו- M2 נבחרים25. פרוטוקול זה מספק שיטה יעילה הניתנת לשחזור כדי ללמוד תגובות לזיהום Mtb במקרופאגים M1 או M2 מקוטבים שמקורם במונוציט. בנוסף, השימוש בציטומטריית זרימה על מקרופאגים נגועים Mtb חסידים מאפשר לנו ללמוד מגוון של סמני פני השטח הקשורים M1 ו M2 מקרופאגים קונבנציונאלי ואת התגובה האורך שלהם לזיהום Mtb. חשוב לציין, פרוטוקול זה יכול בקלות להיות מאומץ לחקירות של זיהומים עם פתוגנים אחרים, במחקרים נגד גידולים או במחקרים של תנאים דלקתיים, עבור הקרנת תרופות וכו ', והוא יכול גם להיות מנוצל להערכת קיטוב מקרופאז M1/M2 בדגימות קליניות אנושיות.
Protocol
דם היקפי אנושי מתורמי דם אנונימיים בריאים התקבל מבנק הדם בבית החולים האוניברסיטאי קרולינסקה, Huddinge, שוודיה (אישור אתי Dnr 2010/603-31/4). כל הצעדים הניסיוניים הכרוכים ב-Mtb ארסי חי בוצעו במעבדת Biosafety Level-3 (BSL-3) בסוכנות לבריאות הציבור של שבדיה (FOHM), סולנה, שוודיה.
1. הכנת אמצעי תקשורת, חוצצים ותרביות חיידקים
הערה: פרטים על כל ריאגנטים וחומרים מתכלים מסופקים בטבלת החומרים.
- RPMI להשלים בינוני: תוספת RPMI 1640 עם 1 מ"מ נתרן פירובט, 2 מ"מ L-גלוטמין, 10 mM HEPES, ו 10% חום מומת סרום שור עוברי (FBS). הימנע אנטיביוטיקה במדיום תרבות התא בעת עבודה עם זיהום Mtb.
- מדיום RPMI ללא סרום: תוספת RPMI 1640 עם נתרן פירובאט 1 מ"מ, 2 מ"מ ל-גלוטמין ו-10 מ"מ HEPES.
- מאגר שטיפה: הכן מלוחים של מאגר פוספט (PBS) המכילים 0.05% (v/v) Tween-80.
- מאגר FACS: הכן PBS המכיל FBS של 2.5% (v/v) ו- EDTA של 0.5 מ"מ.
- מאגר קיבוע: הכן PBS המכיל 4% פורמלדהיד ל- PBS. ודא שהוא מוכן טרי לפני השימוש, למשל, מעורבב מפתרון מניות של 37% פורמלדהיד.
- מאגר חדירות: מוסיפים 0.1% נתרן ציטראט ו-0.1% טריטון X-100 למים שעברו דה-יון.
- חיץ כביסה (לחיסון): הכינו PBS המכיל 0.1% BSA ו-0.1% טווין-20.
- חיץ חסימה: הכינו PBS המכיל 0.1% BSA ו-10% סרום עיזים רגיל (NGS) ל-PBS.
- חיץ כתמים (לחיסון): הכינו PBS המכיל 0.1% BSA ל-PBS.
- TB מדיום מלא: תוספת מידל ברוק 7H9 מרק עם 0.05% (v /v) Tween-80, 0.5% (v / v) גליצרול, קנמיצין (20 מיקרוגרם / מ"ל), 10% (v / v) חומצה אולאית מידלברוק, אלבומין, דקסטרוז והעשרה קטאלאז (מידלברוק DCOA העשרה).
- תרביות חיידקים: השתמש בזן המעבדה הארסי הסטנדרטי Mtb, H37Rv, המבטא באופן מכונן חלבון פלואורסצנטי ירוק (GFP), לזיהום של תאים שמקורם במונוציט. זן Mtb זה נושא פלסמיד pFPV2 המכיל GFP קידוד גנים, כמו גם גן להתנגדות kanamycin. עמידות לאנטיביוטיקה מאפשרת מבחר מתמשך של חיידקים המבטאים פלסמיד בתרבויות המכילות קנמיסין. יש לאחסן חיידקים ב-שחפת בינונית מלאה ו-70% גליצרול (דילול של 1:1) ב-80°C(80°C).
2. בידוד תאים מונונוקולרי בדם היקפי ממעילים באפי
הערה: בצע את כל העבודה עם דם אנושי (מדבק) בתוך ארון biosafety מחלקה II. להשבית שאריות מוצרי דם עם חומרי חיטוי במשך 15 דקות לפני ההשלכה. דם הושג ממתנדבים בריאים במקרה זה. פרוטוקול בידול מקרופאז במבחנה זה הוגדר לכלול 10 x 106 מחשבים מבודדים/תורם/באר. מכל תורם, מעיל באפי אחד מכיל כ-50 מ"ל של מתלה לויקוציטים מרוכז שמקורו בדם שלם, אשר בדרך כלל מספק 500-800 x 106 מחשבים אישיים מהם ניתן לאחזר כ-10% או 50-80 x 106 מונוציטים.
- טען 15 מ"ל של דם מעיל באפי על גבי 15 מ"ל של מדיום שיפוע צפיפות מוכן בצינור 50 מ"ל. לאט לאט לכסות דם על גבי שכבת שיפוע צפיפות על ידי הטיה קצה פיפטה לקיר של הצינור.
- לסובב את הצינורות ב 600 x g במשך 25 דקות בטמפרטורת החדר (RT) עם 0 תאוצה ו 0 האטה.
הערה: סגור את המכסים בזהירות לפני צנטריפוגה ותמיד לבדוק את מחזיקי הצינור עבור לשפוך פוטנציאלי מעל לאחר צנטריפוגה. - הסר את שכבת הפלזמה העליונה עם פיפטה פסטר סטרילי ולאחר מכן לאסוף בזהירות את שכבת התא mononuclear לתוך צינור חדש 50 מ"ל באמצעות פיפטה פסטר סטרילי. הוסף בינוני RPMI ללא סרום לכדור PBMC כדי להשיג נפח סופי של 50 מ"ל. מערבבים בזהירות על ידי היפוך הצינור כמה פעמים לפני צנטריפוגה ב 500 x g במשך 5 דקות ב RT.
- להשליך את supernatant בזהירות resuspend גלולת התא על ידי היפוך החלק התחתון של הצינור בתוך האצבעות.
- כדי להסיר את זיהום בינוני הדרגתי צפיפות ממחשבי PCBMCs, לשטוף תאים 2-3 פעמים עם RPMI ללא סרום כדי להשיג נפח סופי של 50 מ"ל. צנטריפוגה ב 500 x g במשך 5 דקות ב RT. לשטוף עד supernatant התא הופך שקוף.
- השלך את supernatant ו resuspend התאים ב 20 מ"ל של מדיום RPMI ללא סרום.
- לספור את התאים על ידי כתמים כחולים trypan, באופן ידני באמצעות hemocytometer או באמצעות מונה תאים אוטומטי. לדלל את ההשעיה התא בכחול trypan ב 1:2 או 1:10 דילול על ידי ערבוב המדגם הכחול תא trypan ב 96 צלחת היטב למשל, 50 μL + 50 μL (לספירת המוציטופומטר) או 10 μL + 10 μL (לספירת תאים אוטומטית) ולספור את התאים כדי לקבל את מספר תאים חיים / מ"ל.
התראה: כחול Trypan הוא רעיל ויש להשליך אותו בפסולת כימית נפרדת.
3. בידול קיטוב של תאים שמקורם במונוציט
הערה: עבור בידול וקיטוב של תאים שמקורם במונוציט, פרוטוקול שקבענו בעבר עבור תאים דמויי M0, M1 ו- M2, כמו גם תאים מקוטבים M1 ו- M2 מלאים היה אחריו25. לפשטות, רק מקרופאגים מקוטבים לחלוטין M1 ו- M2 מתוארים כאן.
- השתמש דבקות פלסטיק לבידוד של מונוציטים. בקצרה, זרעים PBMCs מבודדים טריים בצלחת תרבות 6-באר בריכוז המתאים, למשל, 10 x 106 PBMCs / גם ב 2 mL סרום ללא RPMI בינוני דגירה ב 37 °C (79 °F) ו 5% CO2.
- לאחר 2-3 שעות, להסיר את התאים שאינם חסידים עם פיפטה ולשטוף את בארות 3 פעמים עם 1 מ"ל סרום ללא מדיום. התאים המצורפים הם מונוציטים ומהווים כ-10% מסך המחשבים האישיים שנוספו לבאר, כלומר 106 מונוציטים שאוחזרו מ- 10 x 106 מחשבים שנוספו לבאר.
- לבידול מקרופאג', הכינו פתרון עבודה המכיל 50 ננוגרם/מ"ל GM-CSF או M-CSF לקיטוב מקרופאז M1 ו-M2 בהתאמה, שנוסף ב-2 מ"ל של מדיום מלא של RPMI לבאר. תרבות התאים ב 5% CO2 אינקובטור ב 37 °C (69 °F) במשך 3 ימים.
- ביום 3, להסיר 1 מ"ל של מדיום תרבות התא בזהירות מן השכבה העליונה של כל באר ולהשלים את תרביות התא עם 1 מ"ל של מדיום מלא RPMI טרי המכיל את הריכוז הכפול של M-CSF או GM-CSF כדי להשיג 50 ng/ mL הריכוז הסופי בבארות. הוסף את גורמי הגדילה בפתרון עבודה מוכן מראש של 100 ng/mL/well.
- ביום 6, להוסיף גירויים שונים עבור האחרון 18-20 שעות של בידול התא כדי לקבל M1 מקוטב ובוגר לחלוטין (אינטרפרון-γ; IFN-γ, וליפופולוסכריד; LPS (אי קולי O55:B5)) או M2 (אינטרלוקין 4; IL-4) מקרופאגים. לקיטוב M1, הכינו את IFN-γ ו-LPS במדיום מלא של RPMI והוסיפו 50 μL לבאר כדי להשיג ריכוז סופי של 50 ננוגרם/מ"ל IFN-γ ו-10 ng/mL LPS בתרביות התאים. לקיטוב M2, הכינו IL-4 במדיום מלא RPMI והוסיפו 50 μL לבאר כדי להשיג ריכוז סופי של 20 ng/mL בתרביות התאים.
- להבחנה של מקרופאגים מקוטבים M0, לעורר את התאים עם M-CSF בלבד, ללא ציטוקינים נוספים (מתן פנוטיפ דמוי M2)25.
- בדוק את המורפולוגיה של תרביות תאים שמקורן במונוציטים באופן קבוע באמצעות מיקרוסקופיה קלה כדי לוודא שמונוציטים קטנים יותר מובחנים לתאים גדולים יותר דמויי מקרופאז'. כמו כן, לפקח על הבדלים מורפולוגיים פוטנציאליים בין קיטוב M1 ו M2, כלומר, תאים מוארכים ומתוחים M1 לעומת תאי M2 עם צורה מעוגלה יותר25.
- ביום 7, להעביר את הצלחות עם תאים המופקים monocyte למעבדה BSL-3 לזיהום עם Mtb ארסי.
4. הכנת תרבויות Mtb
הערה: יש לבצע את השלבים הבאים במתקן BSL-3. עבור כל העבודה עם Mtb ארסי, השתמש ביגוד מגן, הגנה נשימתית, ואתנול כפפות עמידות.
- להפשיר בקבוקון עם 1 מ"ל של aliquot חיידקי ומערבבים עם 9 מ"ל של מדיום מלא שחפת (1:10 דילול) בצינור כובע מסונן 50 מ"ל. תרבות ההשעיה באינקובטור ב 37 °C (69 °F) ו 5% CO2.
- לאחר 24 שעות, לסובב את ההשעיה חיידקי ב 2,300 x g במשך 10 דקות בזהירות לשפוך את המדיום. Resuspend גלולה חיידקית עם 15-20 מ"ל של מדיום מלא טרי שחפת בצינור חדש 50 מ"ל מסונן כובע תרבות דגירה ב 37 °C (77 °F) ו 5% CO2. מערבבים את החיידקים שהתיישבו בצינור כל יומיים-שלושה כדי לשמור על אספקת חומרים מזינים הומוגנית לכל תאי החיידקים.
- לאחר 7-10 ימים, מערבבים את המתלה החיידקי כראוי על ידי pipetting למעלה ולמטה לפני המעבר צינור 50 מ"ל כובע בורג.
- מוסיפים 35-40 מ"ל של חיץ שטיפה סטרילי לצינור 50 מ"ל ומסובבים את המתלה החיידקי ב-2,300 x גרם למשך 10 דקות. חזור על שלבי הכביסה פעם אחת. Resuspend גלולה חיידקית ב 1 מ"ל של מדיום RPMI ללא סרום על ידי pipetting עם מיקרופיפט.
- הוסף עוד 9 מ"ל של מדיום RPMI ללא סרום ו sonicate ההשעיה החיידקית בתוך ארון biosafety מחלקה II במשך 5 דקות ב 37 מעלות צלזיוס, כדי לשבש את גושים חיידקיים. טובלים את הצינור שוב ושוב (3-4 פעמים) בסוניקטור אמבט המים כדי להבטיח הפרעה מקסימלית של גושים חיידקיים. למדוד את הצפיפות האופטית (OD) של 1 מ"ל של השעיית חיידקים באורך גל 600 ננומטר באמצעות ספקטרופוטומטר ממוקם בתוך ארון biosafety. השתמש באמצעי RPMI ללא סרום כדי להגדיר את ההפניה.
- חשב את מספר היחידות היוצרות מושבה (CFU) באמצעות הנוסחה: (OD+0.155)/0.161 = Y, ו- Y x10 7= Y x 106 CFU/mL, למשל, ערך OD 0.32 מספק ריכוז חיידקי של (0.32 + 0.155)/0.161 = 2.95, 2.95 x 107= 29.5 x 106 CFU/mL.
5. זיהום Mtb של תאים שמקורם במונוציט
הערה: יש לבצע את השלבים הבאים במתקן BSL-3.
- משענים מחדש את גלולת החיידקים במדיום RPMI ללא סרום בצינור סטרילי חדש של 50 מ"ל ומתאימים את הריכוז החיידקי הסופי לכ-5 x 106 CFU/mL.
- הסר את מדיום תרבית התאים מ-6 הלוחות המכילים תאים שמקורם במונוציט. הוסיפו 1 מ"ל של מדיום RPMI ללא סרום לכל באר. הוסף 1 מ"ל של השעיה חיידקית לבאר כדי לקבל ריבוי של זיהום (MOI) 5:1, כלומר, 5 x 106 CFU לכל 106 מקרופאגים ב 2 מ"ל / באר ולהדגיר את הצלחות עבור 4 שעות ב 37 °C (66 °F) ו 5% CO2.
- לאחר ההדבקה, לשטוף את התאים 3 פעמים עם 1 מ"ל של חוצץ לשטוף סטרילי כדי להסיר חיידקים חוץ תאיים. הטה את הצלחת והסר בזהירות את כל מאגר הכביסה מהפינות. Resuspend את התאים המונוצייטים הנגועים Mtb ב 2 מ"ל של RPMI מדיום שלם ללא אנטיביוטיקה ולהמשיך לזרום כתם ציטומטריה או דגירה התאים עוד 24 שעות (או נקודות זמן אחרות) לפני cytometry זרימה.
6. כתם ציטומטריה זרימה של תאים המונוציטטים הנגועים ב- Mtb
הערה: יש לבצע את השלבים הבאים במתקן BSL-3. הכתם cytometry זרימה יכול להתבצע בצלחת 96-באר במקום צינורות.
- נתק את התאים הנגועים Mtb (ופקדים נגועים) מן הבארות ב 6 לוחות גם על ידי דגירה עם 1 מ"ל של מאגר FACS לכל באר לפחות 30 דקות ב 37 °C (67 °F) ו 5% CO2.
- בעדינות פיפטה למעלה ולמטה כמה פעמים כדי להבטיח כי התאים מנותקים. במידת האפשר, לאשר ניתוק התא עם מיקרוסקופיה. מעבירים את השעיית התא מכל באר לצינור מיקרוצנטריפוגה מכוסה בורג ומסובבים את הצינורות ב-200 x גרם למשך 5 דקות. השלך את supernatant בזהירות על ידי pipetting.
- לשטוף את גלולת התא בכל צינור פעמיים עם מאגר FACS ולסובב את התאים ב 200 x g במשך 5 דקות.
- הכתים את התאים (כ 0.5 x 106 כדי 1 x 106 תאים / צינור) עם כ 50 קוקטייל μL של נוגדנים אנטי אנושיים מצומדים פלואורוכרום כולל TLR2 (AF647), CD206 (APC-Cy7), CD163 (BV605), CD80 (BV650), CCR7 (BV711), CD86 (BV786), CD200R (PE), CD64 (PE-Dazzle 594), HLA-DR (PE-Cy5) (טבלה 1) בשילוב עם צבע הכדאיות זומבי-UV במשך 30 דקות ב 4 °C (מקרר) בחושך.
- לשטוף את התאים המוכתמים פעמיים עם 400 μL של מאגר FACS ולסובב את התאים ב 200 x g במשך 5 דקות.
- לתקן את התאים המוכתמים עם 200 μL של מאגר קיבוע (מוכן טרי) במשך 30 דקות ב RT בחושך כדי להבטיח השבתה מלאה של mycobacteria.
- לשטוף את התאים פעמיים עם 400 μL של מאגר FACS ולסובב ב 200 x g במשך 5 דקות כדי להסיר מאגר תיקון עודף.
- לשים מחדש את התאים הקבועים ב 400 μL של מאגר FACS ולהעביר את הדגימות לתוך צינורות מיקרוצנטריפוגה 1 מ"ל חדש לפני הוצאתם ממעבדת BSL-3 עבור cytometry זרימה ב BSL-2. אחסן את התאים המוכתמים ב- +4 °C (60 °F) עד לרכישת הדגימה.
הערה: לרסס את הצינורות עם 70% אתנול לפני הוצאתם ממעבדת BSL-3. פורמלדהיד רעיל (מסרטן) ויש לטפל בו בארון ביו-רוויה מדרגה 2. השלך פסולת פורמלדהיד בפסולת כימית נפרדת.
7. רכישת נתונים ציטומטריים זרימה וניתוח של תאים נגועים Mtb monocyte נגזר
הערה: יש לבצע את שלבים 7.1-7.2 לפני הכתם של ציטומטריית הזרימה המתואר לעיל. כדי למנוע בעיות עם גוש תאים וניתוק של צבעי טנדם לאחר קיבוע התא, רכישה מדגם של תאים נגועים Mtb ו נגועים מבוצעת בתוך 4-10 שעות לאחר כתמי נוגדן ראשוניים.
- לפני הכתמת ציטומטריה זרימה המתוארת לעיל, לפצות את האות פלואורסצנטי עבור כל נוגדן מצומד פלואורוכרום המפורטים בלוח הכתמים (טבלה 1) באמצעות חרוזי פיצוי (חיוביים ושליליים כאחד).
- Titrate דילול הנוגדן עבור כתמים של מקרופאגים אנושיים כדי לקבל את האות האופטימלי עבור כל פלואורוכרום.
- השתמש בתאים לא מוכתמים כדי לקבוע את רמת פלואורסצנטיות הרקע הדרושה כדי להגדיר שער עבור אוכלוסיית התאים השליליים המאפשרת הדמיה של התאים המוכתמים (מקרופאגים הם פלואורסצנט אוטומטי מאוד).
- לרכוש מינימום של 50,000 תאים / מדגם בציטומטר זרימה באמצעות התוכנה המומלצת לרכישת נתונים.
- יצא את קבצי הרכישה מן cytometer זרימה בפורמט תקן cytometry זרימה (FCS) 3.1.
- לנתח את קבצי FCS בתוכנת ניתוח cytometry זרימה.
- שער מקרופאגים על פי המאפיינים שלהם פיזור קדימה וצד (FSC ו- SSC) ולא לכלול תאים מתים על ידי gating תא חי / מת באמצעות צבע הכדאיות זומבי-UV.
- דמיין מקרופאגים נגועים של H37Rv-GFP בערוץ FITC.
- זהה את התדירות של תאים מוכתמים באופן חיובי ועוצמת פלואורסצנטיות ממוצעת גיאומטרית (MFI) עבור כל הסמנים (טבלה 1).
8. כתמי כשל חיסוני של תאים המונוצייטים הנגועים ב- Mtb
הערה: זיהום Mtb חייב להתבצע במתקן BSL-3.
- עבור immunostaining, זרע 2 x 105 PBMCs / גם ב 500 μL של מדיום RPMI ללא סרום לתוך 8 שקופיות תא היטב כדי להשיג 2 x 104 מונוציטים / גם. לאחר בידול קיטוב M1/M2 של מונוציטים, להמשיך עם זיהום Mtb כמתואר לעיל. לתקן את השקופיות לאחר 24 שעות של זיהום Mtb עם מאגר קיבוע במשך 30 דקות. שקופיות קבועות מאוחסנות במקפיא ב -20 מעלות צלזיוס עד לניתוחים נוספים.
- לשטוף את התאים המונוצייטים פעמיים עם 200 μL של PBS במשך 10 דקות כל אחד.
- לחלחל את התאים עם 200 μL של מאגר חדירה במשך 5 דקות ב RT.
- לשטוף את התאים 3 פעמים עם 200 μL של PBS במשך 5 דקות כל אחד.
- לשטוף את התאים פעמיים עם 200 μL של חוצץ לשטוף במשך 5 דקות כל אחד.
- חסום איגוד לא ספציפי עם 200 μL של מאגר חסימה למשך 30 דקות ב- RT.
- לדלל את הנוגדנים העיקריים 1:100 באגירת כתמים ולהדגיר את תאי M1 עם נוגדן CD64 לא משועבד (שיבוט: 10.1) ואת תאי M2 עם נוגדן CD163 לא מגובש (פוליקלונלי) עבור 2 שעות ב RT.
- לאחר מכן, לשטוף את התאים 3 פעמים עם 200 μL של חוצץ לשטוף במשך 10 דקות כל אחד.
- לדלל את הפלואורסצנט שכותרתו נוגדנים משניים 1:1,000 ב חוצץ כתמים ולהדגיר את תאי M1 עם אנטי עכבר IgG-Alexa Fluor 594 ואת תאי M2 עם אנטי ארנב IgG-Alexa Fluor 594 עבור 1 שעות ב RT.
- לשטוף את התאים 3 פעמים עם 200 μL לשטוף חוצץ במשך 10 דקות כל אחד.
- הסר את רשת התא והוסף ~ 20 μL של מדיום הרכבה DAPI בכל באר ולשים כיסוי 1.5 מ"מ על כל שקופית.
- לאטום את הכיסוי עם שכבה של לק.
- לרכוש תמונות באמצעות מיקרוסקופ confocal עם לייזרים פולטים ב 486 ננומטר עבור עירור של GFP (ערוץ ירוק), 402 ננומטר עבור DAPI (כחול) ו 560 ננומטר עבור נוגדן משני (אדום) בהתאמה.
תוצאות
איור סכמטי של גירויי הציטוקינים המשמשים לקיטוב תאים שמקורם במונוציטים ל-M0 (תאים דמויי M2), M1 (תאי M1 מקוטבים במלואם) ו- M2 (תאי M2 מקוטבים במלואם) מוצג באיור 1A, בעוד תמונות מייצגות של תרביות תאים M0, M1 ו- M2 וכן תרביות M1 ביום 0, 3 ו- 7, מוצגות באיור 1B. תאי M0 שאינם מושפעים שימשו להדגמת אסטרטגיית הג'ינג הבסיסית (איור 2A). בתחילה, התאים המיאלואידיים (~ 85%) היו מגודרים על פי תכונות הפיזור הקדמי (FSC) והפיזור הצדדי (SSC) שלהם, כולל התאים הגדולים יותר עם צפיפות גבוהה ולא כולל הפסולת בגודל קטן עם SSC ו- FSC נמוכים שנמצאים בפינה השמאלית התחתונה של חלקת הנקודות. בחלקה השנייה הוגדרו כפילויות (כלומר גושים בתאים) כשטח מוגבר אך גובה דומה בהשוואה לתאים בודדים והוחרגו מניתוח נוסף. לכן, רק תאים פרופורציונליים בין FSC-Area ו- FSC-Height (תאים בודדים) נכללו בתוך שער הצורה המשופע. לאחר מכן, צבע הכדאיות זומבי-UV שמכתים את החלבונים הציטופלזמיים בתוך התאים המתים, שימש כדי להוציא את התאים המתים מניתוח הבא. כצפוי, תאי M0 שאינם מושפעים קיימא היו שליליים עבור ביטוי Mtb-GFP דמיינו בערוץ FITC.
לאחר מכן, יישמנו את אותה אסטרטגיית גיתינג כדי לא נגועים, כמו גם מקרופאגים M1 ו- M2 נגועים Mtb ב 4 שעות לאחר ההדבקה (איור 2B, C). שתי אוכלוסיות משנה זוהו בשער FCS/SSC של מקרופאגים מקוטבים M1 לא נדבקו; אוכלוסייה אחת עם גודל קטן יותר (FCS) וצפיפות גבוהה יותר (SSC) והאוכלוסייה האחרת עם גודל גדול יותר וצפיפות נמוכה יותר (איור 2B),בעוד השער הראשי של תאי M2 שאינם מושפעים נראה הומוגני יותר (איור 2C). הן M1 והן M2 תאים נגזר מונוציט הציגו שינוי אנכי לצפיפות גבוהה יותר וגודל תא מופחת על זיהום Mtb, אשר עשוי לשקף מורכבות מוגברת בתוך התאים הנגרמת על ידי ספיגת חיידקי Mtb תאיים (איור 2B,C). יתר על כן, כתם הכדאיות חשף מוות תאי משופר (17-22%) בין תאי M1 ו- M2 הנגועים ב- Mtb ב- MOI של 5, בהשוואה לתאי M0 שאינם נגועים (99%) (איור 2A-C) או תאי M1 ו- M2 שאינם מושפעים (הנתונים אינם מוצגים). נתונים מייצגים הראו כי ביטוי Mtb-GFP (כלומר, זיהומיות Mtb) היה גבוה משמעותית ב- M2 (77% תאים חיוביים ל- GFP) בהשוואה לתאי M1 (19% תאים חיוביים ל- GFP) לאחר 4 שעות של זיהום (איור 2B,C). לאחר 24 שעות של זיהום, ביטוי Mtb-GFP היה 43% ו 85% בתאי M1 ו- M2 בהתאמה, מה שמרמז כי בתאי M1 הייתה עלייה גבוהה יחסית בביטוי GFP מ 4-24 שעות לאחר זיהום Mtb לעומת תאי M2, 126% לעומת 10.4% עלייה GFP-ביטוי בתאי M1 ו- M2 מ 4-24 שעות, בהתאמה.
כדי לאפיין את היעילות של קיטוב M1/M2 בתאים שאינם מושפעים מונוציטים נגזרים, התוויות נקודה שימשו לזיהוי תאי M1 שהיו חיוביים כפולים עבור CD64 ו- CD86 (CD64+CD86+) ותאי M2 שהיו חיוביים פעמיים עבור CD163 ו- CD200R (CD163+CD200R+; איור 3א',ב). הבחירה של סמני M1/M2 נעשתה בעיקר על סמך התוצאות מעבודתנו הקודמת25 אך גם ממחקרים אחרים26,27,28,29. הרבעים עבור התאים המוכתמים הוגדרו באמצעות שערים מתאימים לתאי M1/M2 לא מוכתמים (איור 3A). אף אחד מהסמנים הללו אינו מתבטא אך ורק בתאי M1 או M2, אך שיעור התאים החיוביים כמו גם עוצמת ביטוי פני השטח שונים. הדבר בא לידי ביטוי במיוחד בכתם M1 שבו כ-95% מתאי M1 ו-79% מתאי M2 היו CD64+CD86+, אך עוצמת הכתם הייתה גבוהה משמעותית בקבוצת המשנה M1 (איור 3A). בעוד ש-27% מתאי M1 היו חיוביים עבור CD200R של סמן M2, רק 1% היו חיוביים עבור CD163, וסיפקו 0.5% CD163+CD200R+ תאי M1 לעומת 63% CD163+CD200R+ תאי M2(איור 3A). לאחר 4 שעות של זיהום Mtb, עלייה בתדירות של CD200R+ תאים נצפתה בתאים מקוטבים M1 Mtb-GFP חיובי (16%), בעוד CD163-ביטוי הופחת בתאי M2 (איור 3B). מפת החום מדגימה עוצמה גבוהה של ביטוי GFP בתאי CD163+CD200R+ M2, אך גם בקבוצת המשנה CD64+CD86+ M2 בהשוואה לקבוצות המשנה המתאימות של תאי M1 (איור 3B). בסך הכל, השינוי בביטוי של סמני M1 ו- M2 המתאימים מוצג גם בהיסטוגרמות באיור 3C. יתר על כן, חיידקי Mtb-GFP הוצגו גם בתאי CD64+ M1 ובתאי CD163+ M2 על ידי מיקרוסקופיה קונפוקלית, שתמכה בספיגה תאית משופרת ו/או בצמיחה של Mtb בתוך M2 בהשוואה לתאי M1(איור 3D).
כדי לאמת את התוצאות של הגטינג הידני, יישמנו הפחתת ממדיות באמצעות קירוב והקרנה סעפת אחידים (UMAP). ניתוח UMAP הראה כי זיהום Mtb במשך 4 שעות לא היה מספיק כדי להשפיע על הקיטוב של מקרופאגים, לעומת 24 שעות של זיהום, אשר הביא אשכולות מופרדים בבירור של M1 ו M2 תאים נגועים(איור 4A). מקרופאגים M1 שאינם מושפעים הציגו ביטוי גבוה יותר של CD64, CD86, TLR2, HLA-DR ו- CCR7 בהשוואה למאקרופאגים M2, בעוד שתאי M2 שאינם מושפעים הציגו תקנה חזקה של סמני פנוטיפ M2 CD163, CD200R, CD206 ו- CD80 (איור 4B, C). בהסכמה ל gating ידני, זיהום Mtb לאחר 24 שעות גרם downregulation ברור של CD163, CD200R ו CD206 על תאים M2 ו upregulation של CD86 ו HLA-DR על תאים M1 (איור 4B,C),אשר מרמז כי Mtb יכול לווסת קיטוב מקרופאז. ניתוח פנוגרף עוקב (איור 4D-F) זיהה 24 אשכולות שונים בגדלים שונים שהופצו באופן ייחודי בין התאים M1 ו- M2 שאינם נגועים בתאים נגועים ב- Mtb כפי שמודגם בתרשימי UMAP (איור 4D), תרשימי עוגה (איור 4E) ומפות חום (איור 4F). בסך הכל, תוצאות אלה מראות יעילות מבטיחה של פרוטוקול זה כדי ליצור תאים מקוטבים M1 ו- M2 מגוונים מבחינה פנוטיפית ופונקציונלית במבחנה, כי הם מווסתים עוד יותר על ידי זיהום Mtb.
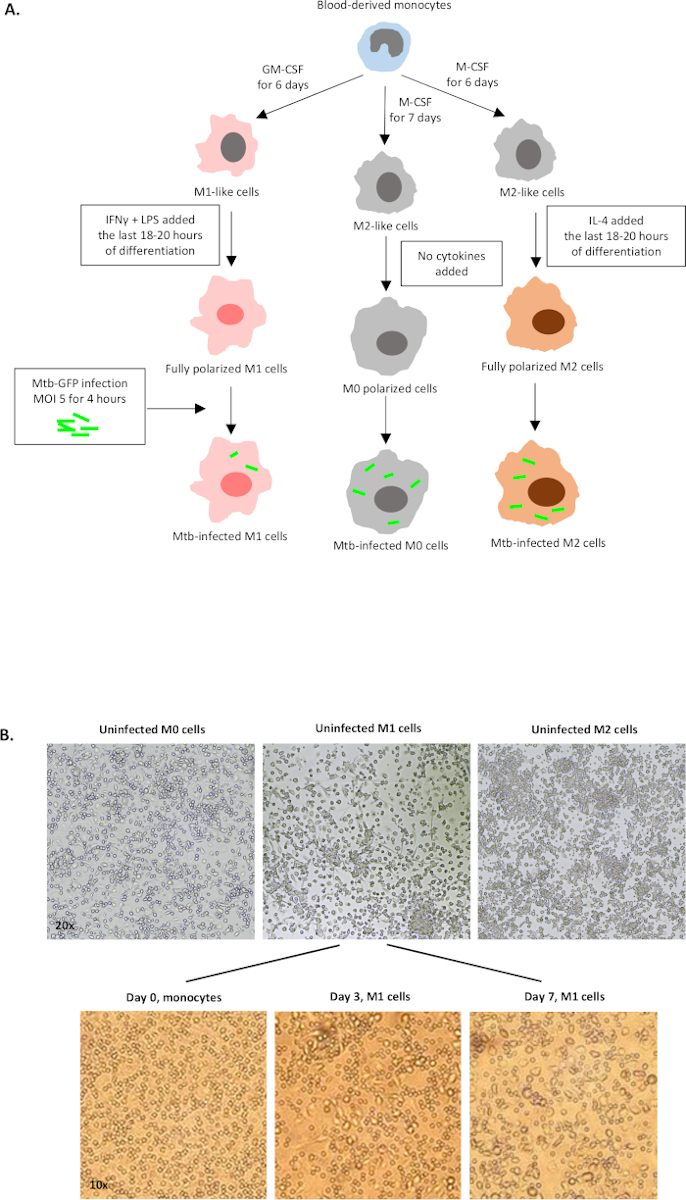
איור 1: איור סכמטי של התמיינות במבחנה וקיטוב של תאים אנושיים שמקורם במיאלואידים. (A)M0 (דמוי M2), M1 (מופעל קלאסית) ו M2 (מופעל לחילופין) תאים מתוארים. מונוציטים שהתקבלו מתורמי דם בריאים היו מקוטבים עם ציטוקינים שונים כמתואר בפרוטוקול ונדבקו בזן Mtb שכותרתו GFP, H37Rv, במשך 4 שעות לפני הניתוח עם ציטומטריית זרימה של 10 צבעים. תאים מקוטבים M1 מכילים בדרך כלל פחות חיידקים בהשוואה לתאים מקוטבים M2. (B)תמונות מיקרוסקופיות של תאים מקוטבים לחלוטין, לא מושפעים M0, M1 ו- M2 בלוחות 6-באר ביום 7, ותמונות מייצגות של הבחנה תא M1 ממונוציטים ביום 0, 3 ו -7. ההגדלה היא 20x (הלוח העליון) ו- 10x (הלוח התחתון). שים לב שתאי M1 מוארכים ומתוחים יותר בהשוואה לתאי M0 ו- M2 מעוגלו יותר (הלוח העליון). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
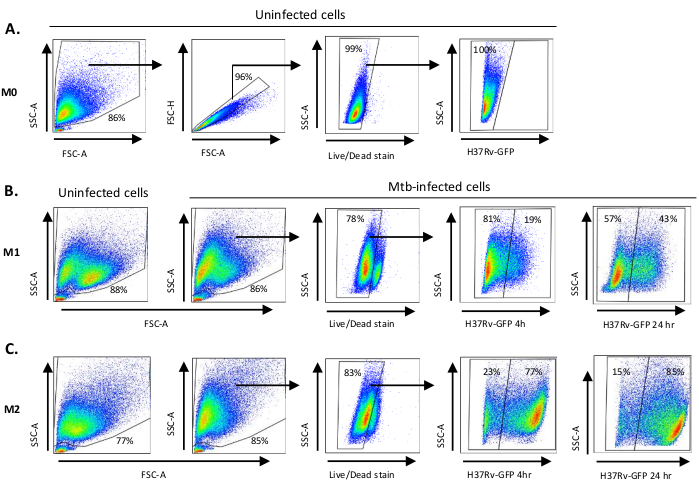
איור 2: אסטרטגיית גטינג של תאים מקוטבים מיאלואידיים מקוטבים באופן דיפרנציאלי. התוויות נקודה מייצגות המציגות (A) מאפייני פיזור קדימה (FSC) ופיזור צדדי (SSC) של מקרופאגים M0 שאינם מושפעים. ההתוויה FSC-A/FSC-H מציגה גיטינג ידני של תאים בודדים באופן פרופורציונלי עבור שטח וגובה. שער התא החי לא כלל תאים שהיו חיוביים עבור זומבי-UV (צבע הכדאיות). Mtb תאי זוהה על ידי ביטוי GFP בתאים חיים שנצפו בערוץ FITC. (B) Gating של M1 ו - (C) מקרופאגים M2 המציגים חלקות נקודה FCS / SSC של תאים נגועים והן בתאים נגועים Mtb 4 שעות ו 24 שעות לאחר ההדבקה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: היעילות של פרוטוקול הקיטוב במבחנה M1/M2. התוויות נקודה מייצגות וגירית רבעים המציגים תדרי קבוצת משנה של תאים מקוטבים מסוג M1 ו- M2 באמצעות CD64 ו- CD86 (M1) או CD163 ו- CD200R (M2) ב- (A) תאים לא מוכתמים ומוכתמים שאינם נגועים ו -( B) תאים מוכתמים Mtb 4 שעות לאחר ההדבקה. התוויית הנקודות ב- (B) ממחישה את עוצמת הפלואורסצנטיות של ביטוי GFP (מפת חום) במקרופאגים מקוטבים M1 ו- M2 המתקבלים משערי משנה שונים. (C)ממוצע גיאומטרי של עוצמת פלואורסצנטיות (MFI) מוצג בהיסטוגרמות מתורם מייצג אחד לאחר 4 שעות של זיהום Mtb. ערכי MFI בתאי M1 (תכלת) ו- M2 לא נגועים (סגול בהיר) מוצגים בלוח העליון ותאי M1 נגועים Mtb (כחול עמוק) ותאי M2 (סגול עמוק) מוצגים בלוח התחתון. (D)מוצגות תמונות קונפוקל מייצגות של תאים מקוטבים M1 ו- M2 נגועים ב- Mtb. תאי M1 ו- M2 הוכתמו עבור ביטוי CD64 ו- CD163, בהתאמה, באמצעות כשל חיסוני. כתמי משטח חיוביים מוצגים בחיידקים תאיים מבטאים אדום ו- GFP מוצג בירוק. גרעינים מוכתמים ב- DAPI מוצגים בצבע כחול. סולם – 10 מיקרומטר. הגדלת התמונות מימין היא 350x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
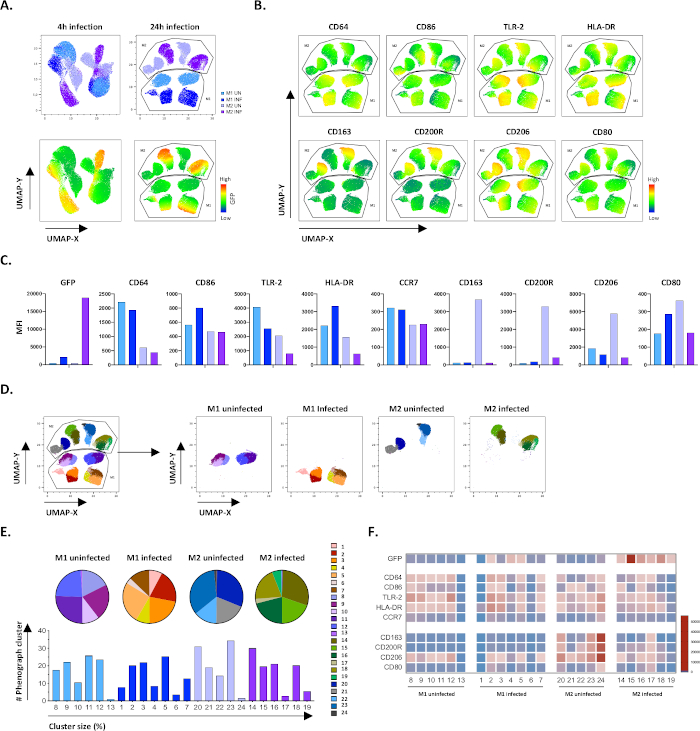
איור 4: הפחתת ממדיות עם קירוב והקרנה סעפת אחידים (UMAP) וניתוח פנוגרף של תאי M1 ו- M2 שאינם נגועים ב- Mtb. (A)UMAP, נוצר על ידי שרשור 11000 תאים חיים מתרביות תאים M1 ו- M2 נגועים Mtb משני תורמי דם מייצגים, 4 שעות (גרפים שמאליים) או 24 שעות (גרפים ימניים) לאחר ההדבקה. מפת החום עבור ביטוי GFP (הלוח התחתון) מציינת תאים נגועים ו- Mtb נגועים. (B-C) MFI של סמנים לידי ביטוי בתאי M1 ו- M2 נגועים Mtb 24 שעות לאחר ההדבקה, מוצג כמו (B) מפת חום או (C) חלקות בר. (D-F) ניתוח פנוגרף זיהה 24 אשכולות המופצים באופן דיפרנציאלי בין תרבויות M1 ו- M2 שאינן נגועות ב- Mtb. אשכולות 8-13 הם ייחודיים בתאי M1 נגועים, אשכולות 1-7 הם ייחודיים בתאי M1 נגועים Mtb, אשכולות 20-24 הם ייחודיים בתאי M2 נגועים אשכולות 14-19 הם ייחודיים בתאי M2 נגועים Mtb. ה- MFI של כל סמן בכל אשכול פנוגרף מוצג ב- (F). הנתונים מוצגים כתאי M1 (תכלת) ו-M2 לא נגועים (סגול בהיר) ותאי M1 נגועים ב-Mtb (כחול עמוק) ותאי M2 (סגול עמוק). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה 1: רשימת הנוגדנים המשמשים לציטומטריית זרימה.
| לייזר | מסנן | פלואורוכרום (פלואורוכרום) | פנוטיפ (פנטוטיפ) | פונקציה | שיבוט | מס' קטלוג | החברה |
| 639 | 670/30 | AF647 | TLR2 | קולטן זיהוי פתוגן | TL2.1 | 309714 | ביולגנד (שם ומלגן) |
| 639 | 780/60 | APC-Cy7 | CD206 | קולטן מנוז | 15-2 | 321120 | ביולגנד (שם ומלגן) |
| 405 | 610/20 | BV605 | CD163 | קולטן נבלות | GHI/61 | 333616 | ביולגנד (שם ומלגן) |
| 405 | 670/30 | BV650 | CD80 | מולקולה מגרה שותפה | 2D10 | 305227 | ביולגנד (שם ומלגן) |
| 405 | 710/50 | BV711 | CCR7 | קולטן כימוקין | G043H7 | 353228 | ביולגנד (שם ומלגן) |
| 405 | 780/60 | BV785 | CD86 | מולקולה מגרה שותפה | IT2.2 | 305442 | ביולגנד (שם ומלגן) |
| 488 | 530/30 | Gfp | הר(ר) | חיידקים תאיים | |||
| 561 | 586/15 | Pe | CD200R | קולטן מעכב | OX-108 | 329306 | ביולגנד (שם ומלגן) |
| 561 | 620/14 | PE/מסנוור 594 | CD64 | קולטן גמא Fc-I של IgG | 10.1 | 305032 | ביולגנד (שם ומלגן) |
| 561 | 661/20 | PE-Cy5 (PC5) | HLA-DR | מולקולה מסוג II של MHC | L243 | 307608 | ביולגנד (שם ומלגן) |
| 355 | 450/50 | BUV395 | צבע הכדאיות | סמן תא חי/מת | זומבי UV | 423108 | אינוויטרוגן |
Discussion
פרוטוקול ניסיוני זה מתאר קיטוב יעיל של תאים שמקורם במיאלואידים לתוך פנוטיפים M1 או M2 כולל הערכה עם פאנל cytometry זרימה 10 צבעים המאפשר הדמיה ואפיון עמוק של Mtb GFP שכותרתו בתת-קבוצות מקרופאגים מגוונות. למרות שחפת היא מחלה אנושית עתיקה, אין כיום מודל תקן הזהב ללמוד אינטראקציות Mtb-macrophage, ו cytometry זרימה מרובת צבעים של מקרופאגים יכול להיות מסובך בהשוואה לניתוחים של תגובות לימפוציטים. פרוטוקולים זמינים מעטים לבידול במבחנה של מונוציטים אנושיים למאקרופאגים מציגים ידע עמוק על סוג המקרופאגים הנוצרים. פרוטוקול בסיסי לקיטוב מקרופאז' והערכה ציטומטרית זרימה של הפעלת מקרופאג' באמצעות פאנל מוצק של סמנים עשוי להקל על אפיון כזה ולהציע הזדמנויות לחקור תכונות נוספות של תאים מקוטבים שטופלו בתנאים שונים. זה כולל ניתוחים של תאים בתרבית במבחנה, כמו גם ניתוחים של תאים vivo בדגימות קליניות, כלומר, הן PBMC והן מתלים חד-תאיים מנוזלי גוף (כלומר, שטיפת סימפונות) או רקמה הומוגנית. לפיכך, בידול ו/או מצב הפעלה של מונוציטים ומאקרופאגים המתקבלים מחולים עשויים להיות קשורים לתוצאות המחלה. הרחבה של CD16+CD163+ מונוציטים בדם היקפי דווחו בחולי שחפת ריאות30. תדירות מוגברת של CD163+ תאים זוהתה גם בעור מודלק של חולי אטופיק דרמטיטיס31. באופן דומה, CD206+ מקרופאגים דמויי M2 הוכחו לעכב התפשטות ובידול של תאים microenvironment של רקמת adipocyte32 ולהיות מועשר בדגימות מח עצם מחוות עצם מחולים עם לוקמיה מיאלואידית חריפה (AML)29. יחס גבוה של CD64 (M1) לתאי CD163 (M2) בדם שלם של חולים עם דלקת מפרקים ניוונית נמצאה קשורה לחומרת המחלה33. מחקר אחר השתמש CD86 (M1) ו CD163 (M2) כדי להדגים כי ביטוי M1 גבוה ברקמה בקורלציה לתוצאה גרועה יותר בקבוצה משנה של גידולים ממאירים במוח34.
ישנם מספר יתרונות משמעותיים של פרוטוקול ציטומטריית זרימה M1/M2 ניסיוני זה. מודל זה מספק את ההזדמנות ללמוד תגובות חיסוניות מולדות לזיהום Mtb ארסי וניתן לפתח אותו כך שיכיל מחקרים של תגובות חיסוניות אדפטיביות על ידי הוספת תאי T אוטולוגיים יחד עם מקרופאגים M1 או M2 בתגובות מעורבות לימפוציטים (MLRs). הפרוטוקול מתאים גם להקרנת תרופות ובדיקות של תרכובות אימונומודולטוריות ומיקרוביאליות שונות. כאן, חקרנו בעבר את ההשפעות של ויטמין D ואת מעכבי deacetylase histone פנילבוטיראט על תאים שמקורם מיאלואידית לאחר זיהום Mtb25,35. Cytometry זרימה M1/M2 יכול לשמש גם כדי להעריך הפעלת מקרופאג לאחר מיזוג עם supernatants תרבות התא או פלזמה המטופל. בעוד במחקרים vivo של זיהום משותף שחפת עם HIV או helminths או שחפת סוכרת שיתוף תחלואה יכול להיות מאתגר, מודל M1/M2 מורכב פחות עשוי להקל על מחקרים של תחלואה משותפת במבחנה. כמו כן, הפרוטוקול יכול להיות מנוצל למחקרי שידור כדי לבחון את זיהומיות Mtb של תאים או לחקור phagocytic, כמו גם קיבולת הצגת אנטיגן של תאים בודדים M1/M2. ציטומטריית זרימה M1/M2 היא גם אטרקטיבית לשימוש במחקרי סמנים ביולוגיים וחיסונים, לעקוב אחר פרוגנוזה של מחלות במהלך הטיפול ולבדוק טיפולים המכוונים לתאים שמקורם במיאלואידים. חשוב לציין, ניתן ליישם מספר שיטות שונות במקביל לזרימה ציטומטריה להערכה בו זמנית של פנוטיפים של קיטוב מקרופאז' ותגובות תפקודיות באמצעות מיקרוסקופיה קונפוקלית (איור 3D), PCR בזמן אמת, כתם מערבי, מבחני מולטיפלקס ו ELISA של גורמים מסיסים בתרבות supernatant, כמו גם הערכה של זיהומיות חיידקים תאיים וצמיחה באמצעות ביטוי GFP (cytometry זרימה מיקרוסקופיה confocal) ויחידות להרכיב מושבה (CFU). זיהום של תאי M1 או M2 עם חיידקי Mtb-GFP מאפשר גם מיון התאים שאינם נגועים ו- Mtb נגועים מאותה מדגם לניתוח רצף תא יחיד-RNA.
לפרוטוקול המתואר יש גם כמה מגבלות כולל חסרונות טכניים ומדעיים כאחד. החיסרון בשימוש במקרופאגים שמקורם במונוציט מתורמי דם אנושיים הוא שהשונות בין התורמים לעתים קרובות גבוהה והעובדה שהתאים אינם מקוטבים בסביבה הפיזיולוגית של רקמות אנושיות. שונות גדולה ביעילות הקיטוב M1/M2 או Mtb-infectivity בין תורמים עלולה לגרום לבעיות עם וריאציות תוך-מקצועיות ובין-מקצועיות, כוח סטטיסטי נמוך וצורך לכלול תורמים רבים כדי להשיג תוצאות אמינות. בנוסף, הדבקות בפלסטיק של מונוציטים ממחשבי PCBMCs גורמת למספר תלוי תורם של מונוציטים /well שעשויים בסופו של דבר לספק MOI שרירותי שעלול להשפיע על קיטוב המקרופאג' ועל הכדאיות של התאים לאחר זיהום Mtb. שלבים קריטיים בפרוטוקול כרוכים בכביסה נכונה כדי למנוע מסוגי תאים אחרים לזהם את תרביות התאים שעלולות להשפיע גם על קיטוב מקרופאגים. בעוד MOI נמוך מדי עשוי לחקות זיהום שחפת סמוי, MOI גבוה מדי יהרוג את התאים, הדגשת החשיבות של שימוש MOI מתאים. יתר על כן, זה יכול להיות קשה לאחזר תאים חסידים בתקיפות על ניתוק, אשר עלול לגרום ייצוג מוטה של קבוצות משנה מסוימות מקרופאגים המשמשים לניתוחי cytometry זרימה. שלב מכריע בניתוח cytometry זרימה כרוך בשימוש נכון של מטריצת פיצוי חרוזים ופקדים שליליים כגון תאים מוכתמים או FMO (פלואורסצנטיות מינוס אחד) פקדים כדי להבטיח גטינג ידני נכון.
מגבלה נוספת כרוכה בקיטוב של מונוציטים שמקורם בדם ולא מסביבת הרקמות המקומית. סימן ההיכר של שחפת אנושית הוא היווצרות של גרנולומות ברקמות נגועות Mtb ולכן, אימונופתולוגיה בשחפת צריך להיות למד באופן מועדף באתר הרקמה המקומית. עם זאת, מונוציטים מגויסים לריאה מדם היקפי על דלקת / זיהום, שבו תאים יכולים להבדיל למקרופאגים בנוכחות ציטוקינים דלקתיים כגון GM-CSF12. חשוב לציין, במילייה הפיזיולוגי של הרקמה ב vivo, סביר להניח שיש הטרוגניות גדולה של קיטוב מקרופאז כולל תערובת ויחסים שונים של אוכלוסיות מקרופאגים מגוונות דמויות M1 ו- M2 התורמות לגורל זיהום שחפת36. פיתחנו בעבר מודל רקמת ריאה organotypic אנושי המאפשר 3D-מחקרים של היווצרות גרנולומה בתיווך מקרופאג ב TB37. זה יכול להיות מעניין לנצל את פרוטוקול הקיטוב הנוכחי M1/M2 בשילוב עם מודל רקמת הריאה כדי להמשיך לחקור היווצרות גרנולומה שחפת, פונקציות אפקטים ויחס M1/M2 ברקמה ניסיונית.
פרוטוקול זה M1/M2 flowcytometry יכול בקלות להיות מותאם לכלול פאנל מורחב של סמנים מיאלואידים שימושי להערכת תכונות הקשורות מעכבות, כמו גם תגובות דלקתיות. יש עניין מחקרי רב במולקולות נקודת ביקורת חיסונית מעכבות כגון PD-1, SIRP-α, IDO וארגינאזות שיכולות לווסת תגובות מקרופאז'38. בהקשר זה, קיטוב של תאים מיאלואידיים יכול לכלול גם גירויים אחרים המקדמים מקרופאגים אימונורגולטוריים (Mreg) או תאים מדכאים שמקורם במיאלואידים (MDSC) שהוכחו כמעורבים במספר מחלות כולל שחפת38. לוחות ציטומטריה זרימה מתקדמים יותר של תת-קבוצות מקרופאג M1/M2/Mreg עשויים לכלול גם כתמים תאיים של ציטוקינים/כימוקינים IL-1β, TNF-α, IL-10 ו- MCP-1 או גורמים מסיסים אחרים או מולקולות אפקט כגון תחמוצת חנקן בלתי ניתנת להכנה (iNOS) ופפטידים אנטי-מיקרוביאליים. זה יכול לשפר את האפשרויות ללמוד תגובות מקרופגות רב תכליתיות, בדומה למה שתואר בהרחבה עבור תאי T39.
נכון לעכשיו, לוחות הכתמת ציטומטריה זרימה יכולים לכלול עד 30-40 צבעים, אשר מספק את היכולת immunophenotype תת-קבוצות תאים מרובים ומולקולות בו זמנית. ההגדרה הניסיונית הבסיסית של פרוטוקול cytometry זרימה M1/M2 זה יכולה לשמש כעמוד שדרה התואם לרוב סיטומטרים ישנים וחדשים של זרימה וניתן לבנות עליהם ולהתאים אותם בהתאם לצרכים האישיים, כולל האתגרים שמציבה העבודה עם Mtb הארסי בסביבת BSL-3. כיום, טכניקות להפחתת ממדיות כגון UMAP זמינות בגירסאות החדשות של תוכנת cytometry זרימה, המאפשר ניתוח של מספר רב של פרמטרים שנוצרו במחקרים חד-תאיים החיוניים להדמיה משופרת ופרשנות של נתונים מימדיים גבוהים40. השיפורים הטכנולוגיים המתמידים בציטומטריית זרימה צפויים להימשך בשנים הקרובות, כולל השילוב של פנוטיפים רב-פרמטריים יחד עם יכולות מיון תאים מודרניות, שם פרוטוקול זה עשוי להיות שימושי במספר מבחני זיהום Mtb מבוססי מקרופאג'.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לעמיתינו בסוכנות לבריאות הציבור של שבדיה, מטילדה סוונסון וסולומון גברמייקל על הסיוע במעבדת BSL-3.
עבודה זו נתמכה על ידי מענקים מקרן הלב והריאות השוודית (HLF) (2019-0299 ו-2019-0302 ל-SB), מועצת המחקר השוודית (VR) (2014-02592, 2019-01744 ו-2019-04720 עד SB), הקרן למניעת עמידות לאנטיביוטיקה (התנגדות), קרנות מכון קרולינסקה ו-KID ל-SB (מימון חלקי של חינוך לדוקטורט למרקו לורטי) ממכון קרולינסקה. ML נתמכה על ידי הקרן השוודית לסרטן ילדים (TJ2018-0128 ויחסי ציבור 2019-0100).
Materials
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
References
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved