Method Article
M1 和 M2 人类单细胞衍生细胞的极化和对 结核病 感染的流动细胞学分析
Erratum Notice
摘要
该协议提供了一种方法来研究人类M1或M2极化巨噬细胞中的 分枝杆菌 感染,该方法基于外周血单核细胞与感染GFP标记的病毒株H37Rv的巨噬细胞的分化,并使用10色面板(包括选定的M1/M2标记的表达)用流动细胞学进行分析。
摘要
人类巨噬细胞是细胞内结 核 (Mtb)感染的主要宿主细胞,因此在结核病(TB)的免疫控制中起着核心作用。我们建立了一个实验方案,通过使用10色流动细胞测量面板进行评估,将骨髓衍生细胞的免疫极化跟踪到M1(经典激活)或M2(另类激活)巨噬细胞中,从而允许在不同的巨噬细胞组中对绿色荧光蛋白(GFP)标记的Mtb进行可视化和深定型。从健康献血者那里获得的单核细胞被极化为M1或M2细胞,使用颗粒状巨噬细胞刺激因子(GM-CSF)或大噬细胞群刺激因子(M-CSF)的分化,然后分别与IFN-γ和脂聚糖(LPS)和IL-4两极分化。完全极化的M1和M2细胞在分离的Mtb感染巨噬细胞感染前4小时感染了Mtb-GFP,感染后4小时或24小时都沾染了流动细胞学。通过流细胞测量进行取样,使用流细胞分析软件对数据进行分析。通过均匀的歧管近似和投影 (UMAP) 和表象分析,进行了手动门控以及尺寸降低。该协议导致有效的M1/M2两极分化,CD64、CD86、TLR2、HLA-DR和CCR7在未受感染的M1细胞上水平升高,而未受感染的M2细胞对M2表型标记CD163、CD200R、CD206和CD80表现出很强的向上调节。与M2极化细胞相比,M1极化细胞通常含有更少的细菌。在Mtb感染后,几个M1/M2标记被调低管制,这表明Mtb可以调节巨噬细胞极化。此外,在感染后24小时内,发现24个不同大小的细胞群在M1和M2未受感染和Mtb感染的细胞中单独分布。这种M1/M2流细胞学协议可作为Mtb-宏噬菌体研究的骨干,并用于不同研究领域的特殊需要。
引言
巨噬细胞是免疫细胞,对组织平衡、炎症和疾病病理学的调节有重大贡献。细胞的单细胞-巨噬细胞系作为与生俱来的免疫力的重要组成部分,对改变的环境线索表示异质表型,这些表型反映了其可塑性和对不同解剖和免疫位置的适应。根据生长因子、细胞因子和其他微环境中的介质,巨噬细胞被分为两个主要可逆种群,每个群体在细菌控制和清除方面具有不同的作用:亲炎的、经典激活的M1极化巨噬细胞和最初被命名为模仿T帮手(Th)细胞命名的抗炎、替代激活的M2极化巨噬细胞。这种免疫极化巨噬细胞组通常被认为是简单化的,因为巨噬细胞的激活和分化不是线性的,而是更准确地说明为一个连续体,每个人群在疾病发展和进展4、5、6、7的结果中具有不同的特征和功能作用。然而,M1/M2宏噬菌体模型有许多实验优势,可用于几个不同的研究领域。
结核分枝杆菌(Mtb)是结核病的致病剂,估计每秒感染一人,被认为是世界上最致命的单一传染性病原体(2019年全球结核病报告)。由于呼吸道是Mtb感染的主要途径,肺大噬细胞是感染Mtb的首选宿主细胞,同时代表肺部Mtb的主要屏障和传染性储层。7年来,针对不同刺激的巨噬菌体偏振进行了广泛的研究,在大多数已发表的作品中, 体外单细胞培养物的M1极化是由粒细胞-巨噬细胞群细胞刺激因子(GM-CSF)与IFN-γ和LPS8、9共同诱导的,而M2极化则由巨噬细胞群刺激因子(M-CSF)和IL-410、11诱导。M1巨噬细胞是能调解细胞内病原体抗菌反应的强效效应细胞,在抗肿瘤免疫12中起着至关重要的作用。M2巨噬细胞,另一方面,具有抗炎功能,高噬菌体能力,主要参与伤口愈合和组织修复以及寄生虫感染12。因此,与M2巨噬细胞13相比,M1巨噬细胞内控制被认为更有效。然而,Mtb细菌也有潜力调节巨噬细胞极化,颠覆与生俱来的免疫力14,15,16,17。
虽然从外周血液18获得的单核细胞分化产生巨噬细胞是很常见的,但巨噬细胞也可以从诱导的多能干细胞(iPSC)19或从小鼠20、21的骨髓衍生巨噬细胞中产生。这些是研究从单核细胞/巨噬细胞祖先那里获得的初级巨噬细胞的可行技术,这些细胞将扩散并分化成成熟的巨噬细胞的同质种群。然而,这些协议很少提供关于获得的细胞的表型和功能的深入知识,也没有解释在体内获得的巨噬细胞中观察到的自然异质性。由于Mtb是一种严格的人类病原体,因此在人性化模型系统中研究Mtb也有优势。流细胞学是一种强大的技术,它提供了评估悬浮22中单细胞的多个表型和功能特征的可能性,对于粘附细胞,如巨噬细胞,也被称为自发光23,24,这可能是相当具有挑战性的。除了牢固粘附的巨噬细胞的化学分离外,Mtb 感染可能对细胞构成显著的压力因素,这为 Mtb 感染巨噬细胞的流动细胞学分析增加了另一个层次的复杂性。
在这个实验协议中,我们使用了先前建立的人类巨噬细胞感染模型,该模型基于原发性外周血-单细胞衍生细胞的免疫极化,这些细胞感染了毒性实验室Mtb菌株H37Rv,并使用10色面板(包括选定的M1和M2标记25的表达)用流动细胞学进行分析。该协议提供了一个高效和可重复的方法来研究M1或M2极化单核细胞衍生巨噬细胞对Mtb感染的反应。此外,在受Mtb感染的巨噬细胞上使用流动细胞学,使我们能够研究与常规M1和M2巨噬细胞相关的各种表面标记及其对Mtb感染的纵向反应。重要的是,该议定书可以很容易地用于研究感染其他病原体,在抗肿瘤研究或炎症条件研究,药物筛选等,也可以被利用来评估M1/M2巨噬细胞偏振在人类临床样本。
研究方案
从瑞典胡丁格卡罗林斯卡大学医院的血库获得健康匿名献血者的人体外周血液(道德批准 Dnr 2010/603-31/4)。所有涉及活毒性Mtb的实验步骤都是在瑞典索尔纳公共卫生局生物安全3级实验室进行的。
1. 准备媒体、缓冲器和细菌培养物
注:有关所有试剂和耗材的详细信息均在 材料表中提供。
- RPMI完整介质:补充RPMI 1640与1mM丙酸钠,2米L-谷氨酰胺,10米HEPES和10%热灭活胎儿牛血清(FBS)。在与 Mtb 感染合作时,避免在细胞培养介质中使用抗生素。
- 无血清RPMI介质:补充RPMI 1640与1mM丙酸钠,2米L-谷氨酰胺和10米血清。
- 洗涤缓冲区:准备含 0.05% (v/v) 补间-80 的磷酸盐缓冲盐水 (PBS)。
- FACS 缓冲区:准备包含 2.5% (v/v) FBS 和 0.5 mM EDTA 的 PBS。
- 固定缓冲:将含有 4% 甲醛的 PBS 制备到 PBS 中。确保在使用前新鲜准备,例如,从 37% 甲醛的库存溶液中混合。
- 渗透缓冲:加入0.1%的柠檬酸钠和0.1%的Triton X-100到除离子水。
- 洗涤缓冲(用于免疫荧光):准备含有0.1%BSA和0.1%补间-20的PBS。
- 阻塞缓冲区:准备含有 0.1% BSA 和 10% 普通山羊血清 (NGS) 到 PBS 的 PBS。
- 染色缓冲(用于免疫荧光):将含有 0.1% BSA 的 PBS 准备到 PBS。
- TB 完整介质: 补充中布鲁克 7H9 汤与 0.05% (v/v) Tween-80, 0.5% (v/v) 甘油, 卡那霉素 (20μg/mL), 10% (v/v) 米德尔布鲁克油酸, 白蛋白, 德克斯特罗斯和卡塔拉塞浓缩 (米德布鲁克 OADC 浓缩).
- 细菌培养:使用标准的毒性Mtb实验室菌株H37Rv,构成绿色荧光蛋白(GFP),用于单细胞衍生细胞的感染。这种Mtb菌株携带一个pFPV2质粒,其中含有编码GFP的基因,以及一个耐卡那霉素的基因。抗生素耐药性使含有卡纳霉素的培养物中能够持续选择质粒表达细菌。将细菌储存在结核病完全中等和 70% 甘油 (1:1 稀释) 在 -80 °C。
2. 外周血单核细胞与浅色外衣分离
注意:在 II 类生物安全柜内用人体血液(可能具有传染性)执行所有工作。在丢弃前,用消毒剂灭活残留血制品15分钟。在这种情况下,血液是从健康的志愿者那里获得的。此体外宏噬菌体分化协议旨在包括 10 x 106 个孤立的 PBMC/捐赠者/井。从每个捐赠者,一个 buffy 外套包含约 50 mL 的浓缩白细胞悬浮来自全血, 它通常提供 500×800 x 106 PBMC,其中约 10% 或 50×80 x10 6 单核细胞可以检索。
- 在 50 mL 管中制备的密度梯度介质 15 mL 之上装载 15 mL 的浅层涂层血。通过将移液器尖端倾斜到管壁上,慢慢地将血液覆盖在密度梯度层的顶部。
- 在室温 (RT) 下以 600 x g 旋转管子 25 分钟,加速 0 和减速。
注意:在离心前小心地关闭盖子,并始终检查管架在离心后是否可能溢出。 - 使用无菌巴斯德移液器取出顶部等离子层,然后使用无菌巴斯德移液器小心地将单核细胞层收集到新的 50 mL 管中。将无血清RPMI介质添加到PBMC颗粒中,以获得50mL的最终体积。在 RT 500 x g 离心前将管子倒置几次,小心混合 5 分钟。
- 小心丢弃超细剂,通过翻转手指内管底来补充细胞颗粒。
- 为了去除 PBMC 中的密度梯度中等污染,使用无血清 RPMI 清洗电池 2–3 次,以获得 50 mL 的最终体积。离心机在 500 x g 5 分钟在 Rt. 洗涤, 直到细胞超母体变得透明。
- 丢弃超母细胞,在20mL无血清RPMI介质中补充细胞。
- 通过尝试泛蓝色染色、手动使用血细胞仪或使用自动细胞计数器来计数细胞。通过将 96 井板(如 50 μL + 50 μL(用于血细胞计计数)或 10 μL = 10 μL(用于自动细胞计数)中的细胞-trypan 蓝色样本混合,稀释 1:2 或 1:10 中的锥形蓝色细胞悬浮,并计算细胞以获得活细胞/mL 的数量。
注意:三潘蓝是有毒的,必须丢弃在单独的化学废物中。
3. 单核细胞衍生细胞的分化和偏振
注:为了区分和偏振单细胞衍生细胞,我们以前为M0、M1样和M2样细胞以及完全M1和M2极化细胞建立的协议遵循了25。简单来说,这里只描述了完全两极分化的M1和M2巨噬细胞。
- 使用塑料粘性隔离单核细胞。简言之,种子新鲜分离的PBMC在6井培养板在适当的浓度,例如,10 x10 6 PBMC/井在2 mL血清无RPMI介质和孵育在37°C和5%CO2。
- 2–3 h 后,用移液器取出非粘附细胞,用 1 mL 无血清介质清洗井 3 次。附着的细胞是单核细胞,约占添加到井中的 PBMC 总数的 10%,即从每口井添加的 10 x10 6 个 PBMC 中检索到的 10 6 个单核细胞。
- 对于宏噬菌体分化,准备一个工作解决方案,分别包含 50 ng/mL GM-CSF 或 M-CSF 用于 M1 和 M2 巨噬细胞极化,每口井添加 2 mL 的 RPMI 完整介质。在37°C的5%CO2 孵化器中培养细胞3天。
- 在第3天,小心地从每口井的顶层取出1mL的细胞培养介质,用含有M-CSF或GM-CSF双浓度的1mL新鲜RPMI完整介质补充细胞培养物,以获得50 ng/mL的最终浓度。在 100 ng/mL/井的预制工作解决方案中添加生长因子。
- 在第6天,添加不同的刺激,为最后18-20小时的细胞分化,以获得完全极化和成熟的M1(干扰素-γ:IFN-γ,和脂质糖;LPS(大肠杆菌O55:B5)或M2(间皮4:IL-4)巨噬细胞。对于 M1 偏振,在 RPMI 完整介质中准备 IFN-γ 和 LPS,每口井添加 50 μL,以获得细胞培养物中 50 ng/mL IFN-γ和 10 ng/mL LPS 的最终浓度。对于 M2 极化,在 RPMI 完整介质中准备 IL-4,每口井添加 50 μL,以获得细胞培养物中 20 ng/mL 的最终浓度。
- 对于M0极化巨噬细胞的分化,仅用M-CSF刺激细胞,无需任何额外的细胞因子(提供M2样表型)25。
- 用光显微镜定期检查单核细胞衍生细胞培养的形态,以确保较小的单核细胞分化成较大的巨噬细胞。此外,监测M1和M2两极分化之间的潜在形态差异,即拉长和拉伸的M1细胞与M2细胞相比,形状更圆的25。
- 在第7天,将带有单细胞衍生细胞的板转移到BSL-3实验室,以感染毒性Mtb。
4. Mtb 文化的准备
注意:以下步骤必须在 BSL-3 设施中执行。对于所有与毒性Mtb的工作,使用防护服,呼吸保护,和乙醇耐药手套。
- 用 1 mL 的细菌别名解冻小瓶,并在 50 mL 过滤帽管中与 9 mL 的 TB 完整介质(1:10 稀释)混合。将悬浮在37°C和5%CO2的孵化器中培养。
- 24 小时后,在 2,300 x g 下旋转细菌悬架 10 分钟,并小心地从介质上倒出。在新的 50 mL 过滤帽培养管中,用 15~20 mL 的新鲜 TB 完整介质补充细菌颗粒,并在 37 °C 和 5% CO2中孵育。每 2–3 天混合管中的定居细菌,以维持所有细菌细胞的均质营养供应。
- 7–10 天后,通过上下管道正确混合细菌悬架,然后转移到 50 mL 螺丝帽管中。
- 将 35×40 mL 的无菌洗涤缓冲器添加到 50 mL 管中,并在 2,300 x g 下旋转细菌悬架 10 分钟。重复洗涤步骤一次。通过用微皮管将细菌颗粒重新喷入 1 mL 的无血清 RPMI 介质中。
- 再加入 9 mL 的无血清 RPMI 介质,在 37 °C 时将 II 类生物安全柜内的细菌悬浮物加入 5 分钟,以破坏细菌团。将管子反复浸入水浴声波器中(3–4 次),以确保细菌团的最大破坏。使用放置在生物安全柜内的光谱仪测量 600 nm 波长下 1 mL 细菌悬架的光学密度 (OD)。使用无血清RPMI介质设置参考。
- 使用公式计算菌落形成单位 (CFU) 的数量:(OD=0.155)/0.161 = Y, 和 Y x 107= Y x 106 CFU/mL, 例如, OD 值 0.32 提供细菌浓度 (0.32 + 0.155)/0.161 = 2.95, 2.95 x 107= 29.5 x 106 CFU/mL.
5. 单细胞衍生细胞的Mtb感染
注意:以下步骤必须在 BSL-3 设施中执行。
- 将无血清RPMI介质中的细菌颗粒重新注入新的无菌50mL管中,并将最终细菌浓度调整至约5 x 106 CFU/mL。
- 从包含单核细胞衍生的细胞的 6 个井板中取出细胞培养介质。向每口井添加 1 mL 无血清RPMI介质。每口井添加 1 mL 的细菌悬浮液,以获得多种感染 (MOI) 5:1,即 5 x 106 CFU 每 106 大噬细胞在 2 mL/井中孵育板 4 小时在 37 °C 和 5% CO2。
- 感染后,用1mL的无菌洗涤缓冲器清洗细胞3次,去除细胞外细菌。倾斜盘子,小心地从角落中取出整个洗涤缓冲区。在没有抗生素的RPMI完整介质的2mL中补充受Mtb感染的单核细胞衍生细胞,然后在流式细胞测量前将细胞染色或孵育24小时(或其他时间点)。
6. 受Mtb感染的单核细胞衍生细胞的流动细胞测量染色
注意:以下步骤必须在 BSL-3 设施中执行。流动细胞测量染色可以在96井板而不是管中进行。
- 通过孵育每口井1mLS的FACS缓冲器,在37°C和5%CO2时,将受Mtb感染的细胞(和未受感染的控制)从6井板中的井中分离出至少30分钟。
- 轻轻上下吹笛几次,以确保细胞分离。如果可能,用显微镜确认细胞分离。将细胞悬架从每口井转移到螺丝封顶的微中心管中,并在 200 x g 下旋转管 5 分钟。通过管道小心地丢弃超自然。
- 用FACS缓冲器在每个管中清洗两次细胞颗粒,在200 x g 下旋转细胞5分钟。
- 用大约 50 μL 鸡尾酒(包括TLR2 (AF647)、CD206 (APC-Cy7)、CD163 (BV605)、 CD80 来染色细胞(约 0.5 x 10 6 x10 6细胞/管) (BV650)、CCR7(BV711)、CD86(BV786)、CD200R(PE)、CD64(PE-炫目594)、HLA-DR(PE-Cy5)(表1)与活性染料僵尸紫外线在黑暗中4°C(冰箱)结合30分钟。
- 用 400 μL 的 FACS 缓冲器清洗染色细胞两次,以 200 x g 旋转细胞 5 分钟。
- 在黑暗中的RT用200μL的固定缓冲(新鲜准备)修复染色细胞30分钟,以确保分枝杆菌完全失活。
- 用 400 μL 的 FACS 缓冲器清洗两次细胞,在 200 x g 下旋转 5 分钟,以去除多余的固定缓冲区。
- 将固定细胞在 400 μL 的 FACS 缓冲器中恢复,并将样品转移到新的 1 mL 微中微富格管中,然后从 BSL-3 实验室取出 BSL-2 的流动细胞测量。将染色细胞储存在 +4 °C 中,直到采集样品。
注意:在将管子从BSL-3实验室取出之前,先用70%的乙醇喷洒管子。甲醛是有毒的(致癌的),必须在II类生物安全柜中处理。将甲醛废物丢弃在单独的化学废物中。
7. 对受Mtb感染的单核细胞衍生细胞进行流动细胞测量数据采集和分析
注意:步骤 7.1–7.2 应在上述流细胞测量染色之前执行。为避免细胞固定后细胞结块和串联染料分离问题,在原抗体染色后 4-10 小时内对 Mtb 感染细胞和未受感染的细胞进行采样。
- 在上面描述的流动细胞学染色之前,使用补偿珠(正负)补偿染色板(表1)中列出的每个荧光共生抗体的荧光信号。
- 滴定抗体稀释,以染色人类巨噬细胞,以获得每个氟色素的最佳信号。
- 使用未受污染的细胞来确定为负细胞群设置门所需的背景荧光水平,从而使染色细胞可视化(巨噬细胞是高度自动荧光)。
- 使用推荐的数据采集软件在流动细胞仪中获取至少 50,000 个单元/样本。
- 从流细胞计中导出流细胞仪中的采集文件,以流细胞测量标准 (FCS) 格式 3.1。
- 在流量细胞分析软件中分析 FCS 文件。
- 门巨噬细胞根据其前部和侧面散射(FSC和SSC)特性,使用僵尸-UV活性染料通过活细胞/死细胞门控排除死细胞。
- 在 FITC 通道中可视化 H37Rv-GFP 感染的巨噬细胞。
- 识别所有标记的正染色细胞的频率和几何平均荧光强度 (MFI)(表 1)。
8. 受Mtb感染的单细胞衍生细胞的免疫荧光染色
注:Mtb 感染必须在 BSL-3 设施中进行。
- 对于免疫染色,种子 2 x 105 PBMC/井在 500 μL 的无血清 RPMI 介质到 8 井室幻灯片获得 2 x 104 单核细胞/井。在单核细胞分化和M1/M2偏振后,继续进行上述Mtb感染。用固定缓冲区修复 Mtb 感染 24 小时后的幻灯片 30 分钟。固定幻灯片储存在-20°C的冰箱中,直到进一步分析。
- 用200μL的PBS清洗单细胞衍生细胞两次,每次10分钟。
- 在RT用200μL的渗透缓冲器渗透细胞5分钟。
- 用 200μL 的 PBS 清洗细胞 3 次,每次洗 5 分钟。
- 用 200μL 的洗涤缓冲器清洗两次,每次洗涤 5 分钟。
- 在RT上用200μL的阻塞缓冲区阻止非特定绑定30分钟。
- 在染色缓冲区中稀释主要抗体 1:100,用未受伤害的 CD64 抗体(克隆: 10.1)和 M2 细胞在 RT 使用未结合的 CD163 抗体(多克隆)孵育 M1 细胞 2 小时。
- 接下来,用200μL的洗涤缓冲器清洗细胞3次,每次洗10分钟。
- 在染色缓冲器中稀释标有二次抗体的荧光剂 1:1,000,并在 RT 上用防鼠器 IgG-Alexa 氟 594 和带防兔 IgG-Alexa 氟 594 的 M2 细胞孵育 M1 细胞 1 小时。
- 用 200 μL 洗涤缓冲器清洗细胞 3 次,每次洗涤 10 分钟。
- 拆下腔室网格,在每口井中加入约 20μL 的 DAPI 安装介质,并在每个滑梯上放置 1.5 毫米盖片。
- 用一层指甲油密封盖唇。
- 使用共焦显微镜获取图像,激光发射速度为 486 nm,用于激发 GFP(绿色通道)、402 nm 用于 DAPI(蓝色)和 560 nm 用于二次抗体(红色)。
结果
图1A中展示了用于单细胞衍生细胞极化的细胞因子刺激到M0(M2样细胞)、M1(完全极化M1细胞)和M2(完全极化M2细胞)的示意图图,而图1B中显示了M0、M1和M2细胞培养以及M1培养物的代表性图像。未受感染的 M0 细胞用于演示基本的门控策略 (图 2A)。最初,骨髓细胞 (+85%)根据其前向散射 (FSC) 和侧散射 (SSC) 特性(包括颗粒率较高的较大单元,以及排除在点图左下角发现的低 SSC 和 FSC 的小尺寸碎片)进行封门。在第二个图中,双倍(即细胞团)被定义为具有增加的面积,但与单个细胞相比高度相似,并被排除在进一步分析之外。因此,只有FSC-区域和FSC高度(单细胞)相称的细胞被包含在倾斜的形状门内。接下来,僵尸-UV生存能力染料,污渍死细胞内的细胞质蛋白,用于排除死细胞从随后的分析。不出所料,可行的未受感染的 M0 细胞对在 FITC 通道中可视化的 Mtb-GFP 表达是负面的。
接下来,我们在感染后4小时(图2B,C)对未受感染的M1和M2巨噬细胞应用了相同的门控策略。在未受感染的M1极化巨噬细胞的FCS/SSC门中检测到两个子种群:一个体积较小(FCS)和更高粒度(SSC)的种群,另一个体积较大、粒度较低的种群(图2B),而未受感染的M2细胞的大门则显得更加均匀(图2C)。M1 和 M2 单细胞衍生细胞在 Mtb 感染后都表现出垂直向更高粒度和减少细胞大小的转变,这可能反映了细胞内部因吸收细胞内 Mtb 细菌(图 2B,C)而引起的复杂性增加。此外,生存能力污渍显示细胞死亡增加(17-22%)在Mtb感染的M1和M2细胞中,MOI为5,而未受感染的M0细胞(99%)(图 2A-C) 或未受感染的 M1 和 M2 单元件(未显示数据)。代表性数据显示,Mtb-GFP表达(即Mtb感染)在M2(77%GFP阳性细胞)中比M1(19%GFP阳性细胞)细胞在感染4小时后(图2B,C)要高得多。在24小时感染后,Mtb-GFP在M1和M2细胞中的表达分别为43%和85%,这表明M1细胞的GFP表达比M2细胞在MTB感染后的4-24小时有相对较高的增长,M1和M2细胞的GFP表达从4-24小时分别增加126%和10.4%。
为了描述M1/M2偏振在未受感染的单细胞衍生细胞中的功效,使用点图来识别CD64和CD86(CD64+CD86+)的双阳性M1细胞和CD163和CD200R双阳性的M2细胞:图3A,B)。M1/M2标记的选择主要是根据我们以前工作的结果25,但也从其他研究26,27,28,29。染色细胞的象限是使用相应的门设置的未受污染的M1/M2细胞(图3A)。这些标记均不完全由 M1 或 M2 细胞表示,但正细胞的比例以及表面表达的强度不同。这一点从M1污渍中尤为明显,其中约95%的M1细胞和79%的M2细胞为CD64 +CD86+,但在M1子集(图3A)中,染色强度要高得多。27% 的 M1 细胞对 M2 标记 CD200R 呈阳性,而对 CD163 的阳性只有 1%,提供 0.5% CD163+CD200R+ M1 细胞,而 63% 的 CD163+CD200R+ M2 细胞(图 3A)。在Mtb感染4小时后,在Mtb-GFP阳性M1极化细胞(16%)中观察到CD200R+细胞的频率增加,而CD163表达在M2细胞(图3B)中减少。热图显示 CD163+CD200R+ M2 单元中的 GFP 表达强度很高,但与相应的 M1 单元组(图 3B)相比,在 CD64+CD86+ M2 子集中也显示了 GFP 表达的高强度。总体而言,在图 3C的直方图中也可视化了各自 M1 和 M2 标记的表达变化。此外,Mtb-GFP 细菌还通过共焦显微镜在 CD64+ M1 细胞和 CD163+ M2 细胞中可视化,这与 M1 细胞(图 3D)相比,支持 M2 内 Mtb 的增强细胞内吸收和/或生长。
为了验证手动门控的结果,我们使用均匀的歧管近似和投影 (UMAP) 应用了尺寸降低。UMAP分析表明,与24小时感染相比,4小时的Mtb感染不足以影响巨噬细胞的两极分化,导致M1和M2未受感染和受感染细胞群明显分离(图4A)。未受感染的M1巨噬细胞与M2巨噬细胞相比,表现出较高的CD64、CD86、TLR2、HLA-DR和CCR7的表达,而未受感染的M2细胞则表现出对M2表型标记CD163、CD200R、CD206和CD80(图4B,C)的有力向上调节。与手动门控一致,24小时后Mtb感染导致M2细胞上的CD163、CD200R和CD206明显下降,M1细胞上的CD86和HLA-DR(图4B,C)的向上调节,这表明Mtb可以调节巨噬细胞的极化。随后的表象分析(图4D-F)确定了24个不同大小的不同组,这些簇在M1和M2未受感染和Mtb感染的细胞中独特分布,如UMAP图(图4D)、饼图(图4E)和热图(图4F)所示。总之,这些结果表明,本协议在体外产生表型和功能多样化的M1和M2偏振细胞,进一步调节Mtb感染,效果良好。
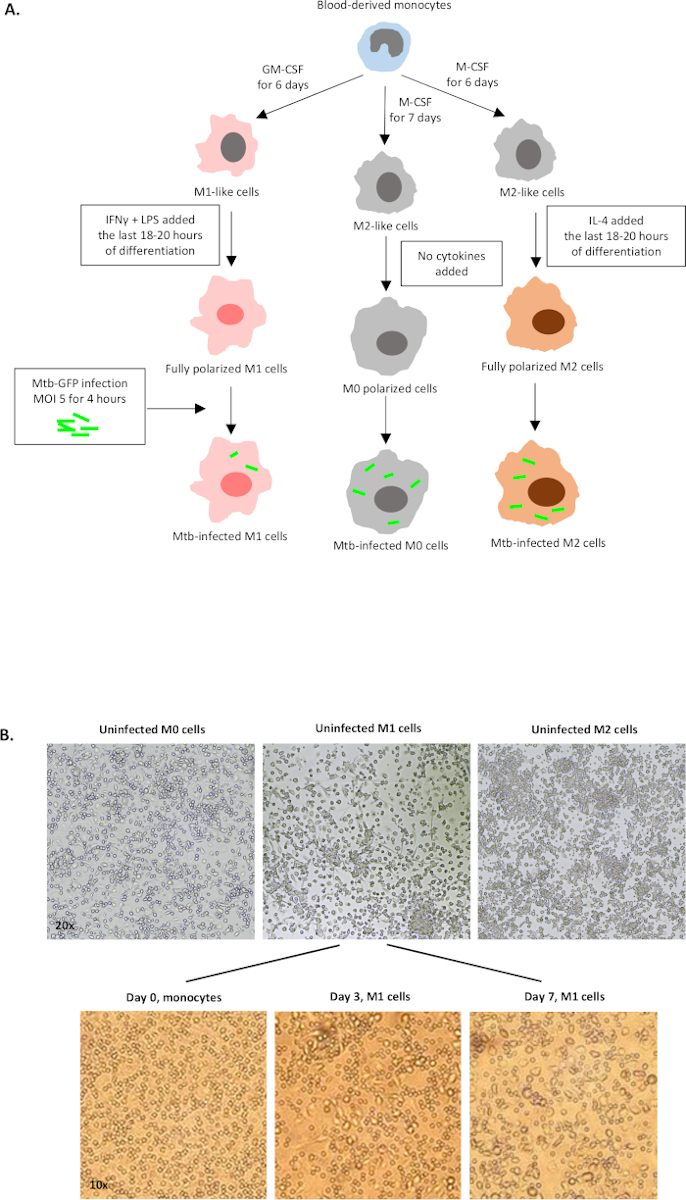
图1:人体骨髓衍生细胞体外分化和极化的示意图图。(A) 描述 M0 (M2 样)、M1(经典激活)和 M2(替代激活)单元格。从健康献血者那里获得的单核细胞与协议中描述的不同细胞因子两极分化,感染GFP标记的Mtb菌株H37Rv4小时,然后用10色流动细胞学进行分析。与M2极化细胞相比,M1极化细胞通常含有更少的细菌。(B) 第 7 天 6 井板中完全极化、未受感染的 M0、M1 和 M2 细胞的微观图像,以及 M1 细胞在第 0 天、第 3 天和第 7 天从单核细胞中分化的具有代表性的图像。放大为 20 倍(上面板)和 10 倍(下面板)。请注意,与更圆的 M0 和 M2 单元(上面板)相比,M1 单元格更拉长和拉伸。 请单击此处查看此图的更大版本。
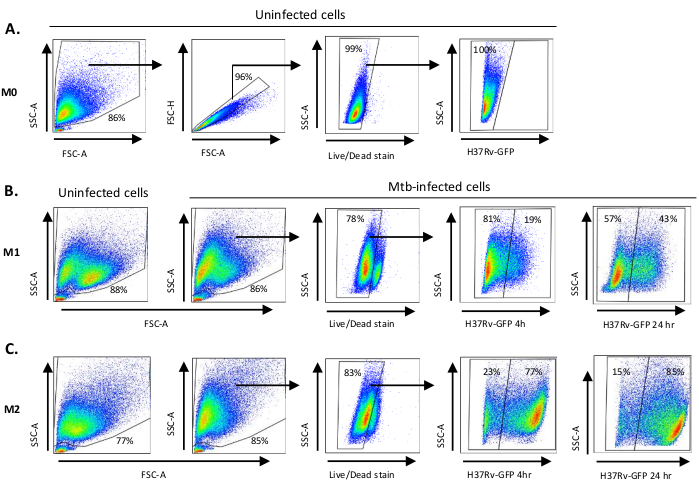
图2:微分极化骨髓衍生细胞的加丁策略。表示点图显示(A)未受感染的 M0 巨噬细胞的前向散射 (FSC) 和侧散射 (SSC) 属性。FSC-A/FSC-H 图显示了按面积和高度相称的单个单元的手动门控。活细胞门排除了对僵尸紫外线(活性染料)呈阳性的细胞。在 FITC 通道观察到的活细胞中,GFP 表达检测到了细胞内 Mtb。(B) M1 和 (C) M2 巨噬细胞的加丁显示未受感染细胞和 Mtb 感染细胞的 FCS/SSC 点图 4 h 和 24 h 感染后。 请单击此处查看此图的更大版本。

图3:体外M1/M2极化协议的有效性。代表点图和象限门控显示 M1 和 M2 极化细胞的子集频率,使用 CD64 和 CD86 (M1) 或 CD163 和 CD200R (M2) 在(A)未染色和染色未受感染的细胞和(B)感染 Mtb 的染色细胞 4 h 感染后。(B ) 中的点图图显示了从不同子门获得的 M1 和 M2 极化巨噬细胞中 GFP 表达(热图)的荧光强度。(C) 荧光强度的几何平均值 (MFI) 在 Mtb 感染 4 小时后,从一位代表性捐赠者的直方图中显示。未受感染的 M1(浅蓝色)和 M2 细胞(浅紫色)中的 MFI 值呈现在上面板中,受 M1 感染的 M1(深蓝色)和 M2 细胞(深紫色)呈现在下面板中。(D) 显示未受感染和 Mtb 感染的 M1 和 M2 极化细胞的代表共焦图像。M1 和 M2 细胞分别使用免疫荧光对 CD64 和 CD163 表达进行染色。正面染色以红色显示,GFP 表达细胞内细菌以绿色显示。DAPI 染色的核以蓝色显示。比例尺度-10微米。右侧图像的放大倍数为 350 倍。请单击此处查看此图的较大版本。
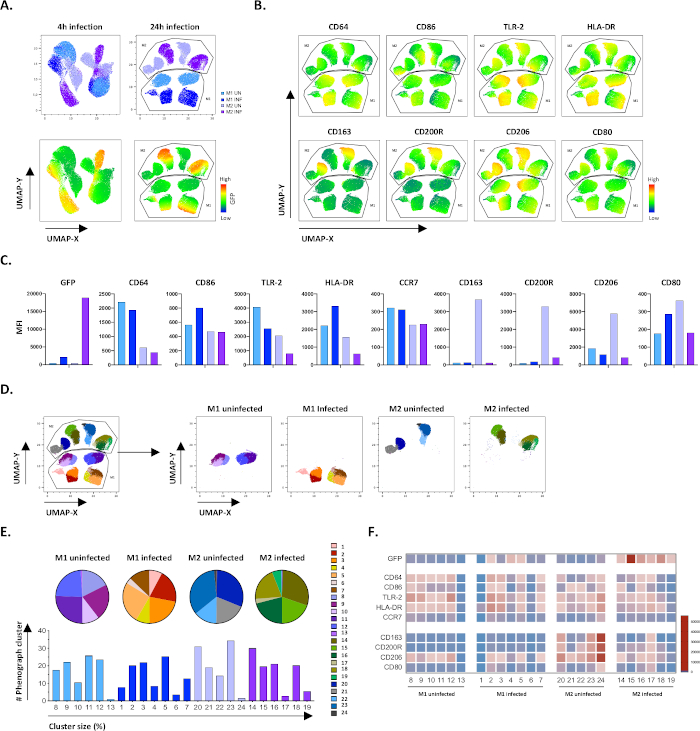
图4:通过均匀的歧义近似和投影(UMAP)减少尺寸,以及对未受感染和受M1和M2感染的M1和M2细胞进行表象分析。( A ) UMAP,由来自两个有代表性的献血者(4小时(左图)或24小时(右图)感染后未受感染和M1和M2细胞培养物的11000个活细胞连接而成。GFP表达(下面板)的热图表示未受感染和 Mtb 感染的细胞。(B-C)MFI的标记表示在未受感染和Mtb感染的M1和M2细胞24小时后感染,显示为(B)热图或(C)条图。(D-F)现象分析确定了24个在未受感染和受M1和M2感染的M1和M2文化中不同分布的星团。8–13 组在未受感染的 M1 细胞中独一无二,1–7 组在受 Mtb 感染的 M1 细胞中独一无二,20–24 在未受感染的 M2 细胞中独一无二,14–19 组在受 Mtb 感染的 M2 细胞中独一无二。每个现象集群中每个标记的 MFI 显示在(F)中。数据以未受感染的 M1(浅蓝色)和 M2 细胞(浅紫色)和 M1 感染 M1(深蓝色)和 M2 细胞(深紫色)的形式呈现。 请单击此处查看此图的更大版本。
表1:用于流动细胞测量的抗体列表。
| 激光 | 滤波器 | 氟色素 | 表现型 | 功能 | 克隆 | 目录号 | 公司 |
| 639 | 670/30 | AF647 | TLR2 | 病原体识别受体 | TL2.1 | 309714 | 比奥莱根德 |
| 639 | 780/60 | APC-Cy7 | CD206 | 曼诺斯受体 | 15-2 | 321120 | 比奥莱根德 |
| 405 | 610/20 | BV605 | CD163 | 寻宝受体 | GHI/61 | 333616 | 比奥莱根德 |
| 405 | 670/30 | BV650 | CD80 | 共刺激分子 | 2D10 | 305227 | 比奥莱根德 |
| 405 | 710/50 | BV711 | CCR7 | 切莫金受体 | G043H7 | 353228 | 比奥莱根德 |
| 405 | 780/60 | BV785 | CD86 | 共刺激分子 | IT2.2 | 305442 | 比奥莱根德 |
| 488 | 530/30 | 格夫普 | 山 | 细胞内细菌 | |||
| 561 | 586/15 | 体育 | CD200R | 抑制受体 | OX-108 | 329306 | 比奥莱根德 |
| 561 | 620/14 | PE/炫目 594 | CD64 | Igg 的 Fc 伽马受体 - I | 10.1 | 305032 | 比奥莱根德 |
| 561 | 661/20 | PE-Cy5 (PC5) | 赫拉博士 | MHC II类分子 | L243 | 307608 | 比奥莱根德 |
| 355 | 450/50 | 布夫395 | 活力染料 | 活细胞/死细胞标记 | 僵尸紫外线 | 423108 | 英维特罗根 |
讨论
此实验协议描述了骨髓衍生细胞的有效极化到 M1 或 M2 表型,包括使用 10 色流细胞测量面板进行评估,该面板允许在不同的巨噬细胞子集中可视化和深描述 GFP 标记的 Mtb。虽然结核病是一种古老的人类疾病,但目前还没有研究Mtb-巨噬细胞相互作用的黄金标准模型,与淋巴细胞反应分析相比,巨噬细胞的多色流动细胞测量可能比较复杂。很少有可用于人类单核细胞体外分化到巨噬细胞的协议,对产生的巨噬细胞类型有深刻的了解。使用坚实的标记面板对宏噬菌体活化进行宏噬菌体极化和流动细胞测量评估的基本方案可能促进这种特征的识别,并为探索在不同条件下处理的极化细胞的其他特征提供机会。这包括对体外培养的细胞的分析,以及临床样本中体内细胞的分析,即体液(即支气管气管厕所)或同质化组织的PBMC和单细胞悬浮。因此,从患者那里获得的单核细胞和巨噬细胞的分化和/或激活状态可能与疾病结果有关。在30名肺结核病患者中,已报告周围血液中CD16+CD163+单核细胞的扩张。 在31名特异性皮炎患者的发炎皮肤中也检测到CD163+细胞的频率增加。同样,CD206+ M2 状巨噬细胞已被证明可以抑制脂肪组织32微环境中细胞的增殖和分化,并在急性骨髓性白血病 (AML)29患者的骨髓样本中浓缩。发现骨关节炎患者全血CD64(M1)与CD163(M2)细胞的比例升高与疾病严重程度33有关。另一项研究使用CD86(M1)和CD163(M2)来证明组织中高M1表达与恶性脑肿瘤34亚群中更坏的结果相关。
此实验 M1/M2 流细胞测量协议有几个显著优势。该模型提供了研究对毒性Mtb感染的天生免疫反应的机会,并且可以通过在混合淋巴细胞反应(MMLR)中加入自体T细胞和M1或M2巨噬细胞来包含自适应免疫反应的研究。该协议还适用于药物筛选和测试不同的免疫调节剂和抗菌化合物。在这里,我们以前研究过维生素D和高石脱乙酰酶抑制剂苯基丁酸盐对Mtb感染25,35后骨髓衍生细胞的影响。M1/M2流细胞测量也可用于评估与细胞培养超纳特或患者血浆调理后的巨噬细胞活化。虽然在体内研究结核病共同感染艾滋病毒或蠕虫或结核病-糖尿病共发病可能是具有挑战性的,但较不复杂的M1/M2模型可能有助于体外共病的研究。同样,该协议可以用于传输研究,以检查细胞的Mtb感染率或研究单个M1/M2细胞的噬菌体以及抗原呈现能力。M1/M2流动细胞学也具有吸引力,可用于生物标志物和疫苗研究,在治疗期间跟踪疾病预后,并测试针对骨髓衍生细胞的疗法。重要的是,可以并行使用多种不同的方法与流动细胞学并行使用共聚焦显微镜(图3D),实时PCR,同时评估宏噬菌体极化表型和功能反应, 西斑、多路复用检测和ELISA对培养超自然体中的可溶性因素,以及使用GFP表达(流动细胞学和共聚焦显微镜)和结肠形成单元(CFU)对细胞内细菌感染和生长的评估。M1 或 M2 细胞与 Mtb-GFP 细菌的感染还能够从同一样本中对未受感染和 Mtb 感染的细胞进行排序,以便进行单细胞-RNA测序分析。
所述议定书也有一些局限性,包括技术和科学上的缺点。使用来自人类献血者的单细胞衍生巨噬细胞的缺点是,供体变异性往往很高,而且细胞在人体组织的生理环境中没有两极分化。M1/M2偏振有效性或捐赠者之间Mtb感染率的巨大变异性可能导致经验内部和经验间差异的问题,统计力低,需要包括许多捐助者才能获得可靠的结果。此外,PBMC 中单核细胞的塑料粘附性会导致依赖捐赠者的单核细胞数量/井,最终可能提供任意的 MOI,这可能会影响 Mtb 感染后的宏观噬菌体极化和细胞生存能力。协议中的关键步骤包括适当的洗涤,以防止其他细胞类型污染细胞培养物,也可能影响巨噬细胞极化。虽然过低的 MOI 可能会模仿潜在的结核病感染,但过高的 MOI 会杀死细胞,突出使用适当的 MOI 的重要性。此外,在分离时可能难以检索牢固的粘附细胞,这可能导致用于流动细胞分析的某些巨噬细胞子集的偏颇表示。流动细胞学分析的关键步骤包括正确使用珠子补偿矩阵和负控件,如未染色细胞或 FMO(荧光减去一)控制,以确保正确的手动门控。
另一个限制涉及从血液而不是从当地组织环境中提取的单核细胞的两极分化。人类结核病的特点是在受Mtb感染的组织中形成颗粒瘤,因此,结核病的免疫病理学应优先在当地组织部位进行研究。然而,单核细胞在炎症/感染时从外周血液中招募到肺部,细胞可以在有炎症细胞因子(如GM-CSF12)的情况下分化成巨噬细胞。重要的是,在体内组织生理环境中,可能存在大噬细胞极化的大量异质性,包括不同M1和M2状巨噬细胞群的混合物和不同比例,这些都促成了36型结核病感染的命运。我们以前已经开发出一种人体器官型肺组织模型,能够对TB37中大噬细胞介导的粒细胞瘤形成进行3D研究。利用目前的M1/M2极化协议与肺组织模型相结合,进一步研究实验组织中的结核病粒瘤形成、效应器功能和M1/M2比例,可能很有趣。
此 M1/M2 流细胞测量协议可以很容易地进行调整,以包括一个扩展的骨髓标记面板,可用于评估与抑制和炎症反应相关的功能。对抑制性免疫检查点分子(如PD-1、SIRP-α、IDO和能够调节大噬细胞反应38)的研究兴趣很大。在这种情况下,骨髓细胞的极化也可能涉及其他刺激,促进免疫调节巨噬细胞(Mreg)或骨髓衍生的抑制细胞(MDSC),已被证明涉及多种疾病,包括结核病38。M1/M2/Mreg巨噬细胞子集的更高级流动细胞学面板可能还包括细胞因子/化学因子IL-1、TNF-α、IL-10和MCP-1或其他可溶性因子或效应分子,如可诱导的一氧化氮(iNOS)和抗菌肽。这可以增强研究多功能巨噬细胞反应的可能性,类似于对T细胞39的广泛描述。
目前,流动细胞测量染色板可以包括多达30-40种颜色,这提供了同时免疫型多个细胞子集和分子的能力。此 M1/M2 流细胞学协议的基本实验设置可用作与大多数旧流和新流细胞仪兼容的骨干,并可根据个人需求(包括在 BSL-3 环境中与毒 Mtb 合作带来的挑战)进行构建和定制。目前,新版本的流细胞测量软件中已有UMAP等尺寸减少技术,能够分析单细胞研究中产生的大量参数,这对改进高维数据40的可视化和解释至关重要。流动细胞测量技术的不断改进可能会在未来几年内持续进行,包括多参数表型与现代细胞分拣功能的结合,在此协议可能证明在几个基于巨噬细胞的Mtb感染检测中很有用。
披露声明
作者没有什么可透露的。
致谢
我们感谢瑞典公共卫生局的同事玛蒂尔达·斯文松和所罗门·格布雷迈克尔在BSL-3实验室提供的援助。
这项工作得到了瑞典心肺基金会(HLF)(2019-0299年和2019-0302年对SB)、瑞典研究理事会(VR)(2014-02592) 的资助, 2019-01744和2019-04720至SB),预防抗生素耐药性基金会(抵抗),卡罗林斯卡研究所基金会和KID到SB(马可·洛雷蒂博士教育的部分资助)从卡罗林斯卡研究所。ML由瑞典儿童癌症基金会(TJ2018-0128和PR2019-0100)支持。
材料
| Name | Company | Catalog Number | Comments |
| 8-well chamber slides | Lab-Tek | 154534 | |
| BD Comp bead plus | BD | 560497 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | |
| DAPI Mounting media | Vector Laboratories | H-1200-10 | |
| EDTA (0.5 M) | Karolinska University hospital, Huddinge | N/A | |
| Falcon 6-well Flat Bottom plates | Corning Life Sciences | 353046 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| Formaldehyde | Sigma-Aldrich | F8775 | |
| Glycerol (70%) | Karolinska University hospital, Huddinge | N/A | |
| GM-CSF | Peprotech | 300-03 | |
| Goat anti-mouse IgG Alexa Fluor 594 secondary antibody | Invitrogen | R37121 | Secondary antibody for CD64 |
| Goat anti-Rabbit IgG Alexa Fluor 594 secondary antibody | Invitrogen | A-11037 | Secondary antibody for CD163 |
| HEPES | GE Healthcare Life Sciences | SH30237.01 | |
| IFN-γ | Peprotech | 300-02 | |
| IL-4 | Peprotech | 200-04 | |
| L-Glutamine | GE Healthcare Life Sciences | SH30034.01 | |
| LPS (Escherichia coli O55:B5) | Sigma-Aldrich | L6529 | |
| Lymphoprep | Alere Technologies AS | 11508545 | |
| M-CSF | Peprotech | 300-25 | |
| Middle Brook 7H10 agar plates | Karolinska University hospital, Huddinge | N/A | |
| Middle Brook 7H9 media | Karolinska University hospital, Huddinge | N/A | |
| Mouse anti-human CD64 primary antibody | Bio-Rad | MCA756G | Clone: 10.1 |
| Na-pyruvate | GE Healthcare Life Sciences | SH300239.01 | |
| Normal goat serum | Jackson ImmunoResearch | 005-000-121 | |
| Rabbit anti-human CD163 primary antibody | GeneTex | GTX81526 | Polyclonal |
| RPMI 1640 | Life Technologies Corporation | SH30096.01 | |
| Triton X-100 | Sigma-Aldrich | X-100 | |
| TubeSpin bioreactor tubes | TPP Techno Plastic Products AG | 87050 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Tween-80 | Sigma-Aldrich | P4780 |
参考文献
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Cassetta, L., Cassol, E., Poli, G. Macrophage polarization in health and disease. Scientific World Journal. 11, 2391-2402 (2011).
- Mills, C. D., Kincaid, K., Alt, J. M., Heilman, M. J., Hill, A. M. M-1/M-2 macrophages and the Th1/Th2 paradigm. Journal of Immunology. 164 (12), 6166-6173 (2000).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000 Prime Reports. 6, 13 (2014).
- Atri, C., Guerfali, F. Z., Laouini, D. Role of human macrophage polarization in inflammation during infectious diseases. International Journal of Molecular Sciences. 19 (6), (2018).
- Flynn, J. L., Gideon, H. P., Mattila, J. T., Lin, P. L. Immunology studies in non-human primate models of tuberculosis. Immunological Reviews. 264 (1), 60-73 (2015).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Fleetwood, A. J., Lawrence, T., Hamilton, J. A., Cook, A. D. Granulocyte-macrophage colony-stimulating factor (CSF) and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities: implications for CSF blockade in inflammation. Journal of Immunology. 178 (8), 5245-5252 (2007).
- Nathan, C. F., Murray, H. W., Wiebe, M. E., Rubin, B. Y. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. Journal of Experimental Medicine. 158 (3), 670-689 (1983).
- Leidi, M., et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro. Journal of Immunology. 182 (7), 4415-4422 (2009).
- Stein, M., Keshav, S., Harris, N., Gordon, S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. Journal of Experimental Medicine. 176 (1), 287-292 (1992).
- Italiani, P., Boraschi, D. From Monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Frontiers in Immunology. 5, 514 (2014).
- Verreck, F. A., et al. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proceedings of the National Academy of Sciences. 101 (13), 4560-4565 (2004).
- Redente, E. F., et al. Differential polarization of alveolar macrophages and bone marrow-derived monocytes following chemically and pathogen-induced chronic lung inflammation. Journal of Leukocyte Biology. 88 (1), 159-168 (2010).
- Refai, A., Gritli, S., Barbouche, M. R., Essafi, M. Mycobacterium tuberculosis virulent factor ESAT-6 drives macrophage differentiation toward the pro-inflammatory M1 phenotype and subsequently switches it to the anti-inflammatory M2 phenotype. Frontiers in Cellular and Infection Microbiology. 8, 327 (2018).
- Kahnert, A., et al. Alternative activation deprives macrophages of a coordinated defense program to Mycobacterium tuberculosis. European Journal of Immunology. 36 (3), 631-647 (2006).
- Marino, S., et al. Macrophage polarization drives granuloma outcome during Mycobacterium tuberculosis infection. Infection and Immunity. 83 (1), 324-338 (2015).
- Erbel, C., et al. An in vitro model to study heterogeneity of human macrophage differentiation and polarization. Journal of Visualized Experiments. (76), e50332 (2013).
- Lee, C. Z. W., Kozaki, T., Ginhoux, F. Publisher Correction: Studying tissue macrophages in vitro: are iPSC-derived cells the answer. Nature Reviews Immunology. 18 (11), 726 (2018).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- McKinnon, K. M. Flow Cytometry: An Overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Njoroge, J. M., et al. Characterization of viable autofluorescent macrophages among cultured peripheral blood mononuclear cells. Cytometry. 44 (1), 38-44 (2001).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. Journal of Immunological Methods. 386 (1-2), 101-107 (2012).
- Rao Muvva, J., Parasa, V. R., Lerm, M., Svensson, M., Brighenti, S. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection. Frontiers in Immunology. 10, 3157 (2019).
- Tarique, A. A., et al. functional, and plasticity features of classical and alternatively activated human macrophages. American Journal of Respiratory Cell and Molecular Biology. 53 (5), 676-688 (2015).
- Hristodorov, D., et al. Targeting CD64 mediates elimination of M1 but not M2 macrophages in vitro and in cutaneous inflammation in mice and patient biopsies. MAbs. 7 (5), 853-862 (2015).
- Jaguin, M., Houlbert, N., Fardel, O., Lecureur, V. Polarization profiles of human M-CSF-generated macrophages and comparison of M1-markers in classically activated macrophages from GM-CSF and M-CSF origin. Cellular Immunology. 281 (1), 51-61 (2013).
- Xu, Z. J., et al. The M2 macrophage marker CD206: a novel prognostic indicator for acute myeloid leukemia. Oncoimmunology. 9 (1), 1683347 (2020).
- Liu, Q., et al. Differential expression and predictive value of monocyte scavenger receptor CD163 in populations with different tuberculosis infection statuses. BMC Infectious Diseases. 19 (1), 1006 (2019).
- Sugaya, M., et al. Association of the numbers of CD163(+) cells in lesional skin and serum levels of soluble CD163 with disease progression of cutaneous T cell lymphoma. Journal of Dermatological Science. 68 (1), 45-51 (2012).
- Nawaz, A., et al. CD206(+) M2-like macrophages regulate systemic glucose metabolism by inhibiting proliferation of adipocyte progenitors. Nature Communications. 8 (1), 286 (2017).
- Liu, B., Zhang, M., Zhao, J., Zheng, M., Yang, H. Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis. Experimental and Therapeutic Medicine. 16 (6), 5009-5014 (2018).
- Lee, C., et al. M1 macrophage recruitment correlates with worse outcome in SHH Medulloblastomas. BMC Cancer. 18 (1), 535 (2018).
- Rekha, R. S., et al. Phenylbutyrate induces LL-37-dependent autophagy and intracellular killing of Mycobacterium tuberculosis in human macrophages. Autophagy. 11 (9), 1688-1699 (2015).
- Mattila, J. T., et al. Microenvironments in tuberculous granulomas are delineated by distinct populations of macrophage subsets and expression of nitric oxide synthase and arginase isoforms. Journal of Immunology. 191 (2), 773-784 (2013).
- Braian, C., Svensson, M., Brighenti, S., Lerm, M., Parasa, V. R. A 3D Human Lung Tissue Model for Functional Studies on Mycobacterium tuberculosis Infection. Journal of Visualized Experiments. (104), e53084 (2015).
- Brighenti, S., Joosten, S. A. Friends and foes of tuberculosis: modulation of protective immunity. Journal of Internal Medicine. , 12778 (2018).
- Chattopadhyay, P. K., Roederer, M. Good cell, bad cell: flow cytometry reveals T-cell subsets important in HIV disease. Cytometry Part A. 77 (7), 614-622 (2010).
- Becht, E., et al. Dimensionality reduction for visualizing single-cell data using UMAP. Nature Biotechnology. 37, 38-44 (2019).
Erratum
Formal Correction: Erratum: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection
Posted by JoVE Editors on 10/14/2020. Citeable Link.
An erratum was issued for: Polarization of M1 and M2 Human Monocyte-Derived Cells and Analysis with Flow Cytometry upon Mycobacterium tuberculosis Infection. Author and affiliation information was updated.
The author and affiliation information was updated from:
Akhirunnesa Mily1, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha2, Jagadeeswara Rao Muvva1, Magda Lourda1,3, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
3Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
to:
Akhirunnesa Mily1,2, Sadaf Kalsum1, Marco Giulio Loreti1, Rokeya Sultana Rekha3, Jagadeeswara Rao Muvva1, Magda Lourda1,4, Susanna Brighenti1
1Center for Infectious Medicine (CIM), Department of Medicine Huddinge, ANA Futura, Karolinska Institutet
2Infectious Diseases Division, International Centre for Diarrhoeal Disease Research, Bangladesh
3Clinical Microbiology, Department of Laboratory Medicine (Labmed), ANA Futura, Karolinska Institutet
4Childhood Cancer Research Unit, Department of Women's and Children's Health, Karolinska Institutet
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。