A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل الخلايا العضلية الأذينية والبطينية عالية الجودة للقياسات المتزامنة لتيار الكالسيوم2+ العابر وتيار الكالسيوم من النوع L
* These authors contributed equally
In This Article
Summary
تسمح نماذج الماوس بدراسة الآليات الرئيسية لعدم انتظام ضربات القلب. لهذا الغرض ، تعد خلايا عضلة القلب عالية الجودة ضرورية لإجراء قياسات المشبك الرقعة. هنا ، يتم وصف طريقة لعزل الخلايا العضلية الأذينية والبطينية عن طريق نضح لانجيندورف القائم على الإنزيم الرجعي ، والذي يسمح بالقياسات المتزامنة لعابرات الكالسيوم وتيار الكالسيوم من النوع L.
Abstract
تلعب نماذج الفئران دورا مهما في أبحاث عدم انتظام ضربات القلب وتسمح بدراسة الآليات الرئيسية لتكوين عدم انتظام ضربات القلب بما في ذلك وظيفة القناة الأيونية المتغيرة ومعالجة الكالسيوم. لهذا الغرض ، تعد خلايا عضلة القلب الأذينية أو البطينية ذات الجودة العالية ضرورية لإجراء قياسات المشبك التصحيحي أو لاستكشاف تشوهات التعامل مع الكالسيوم. ومع ذلك ، فإن العائد المحدود لخلايا عضلة القلب عالية الجودة التي تم الحصول عليها بواسطة بروتوكولات العزل الحالية لا يسمح بكلا القياسين في نفس الماوس. توضح هذه المقالة طريقة لعزل الخلايا العضلية الأذينية والبطينية عالية الجودة عن طريق نضح لانجيندورف القائم على الإنزيم الرجعي ، لإجراء قياسات متزامنة لاحقة لعابرات الكالسيوم وتيار الكالسيوم من النوع L من واحد. يتم الحصول على قلوب الفئران ، ويتم تقليب الشريان الأورطي بسرعة لإزالة الدم. ثم يتم ترشيح القلوب في البداية بمحلول خال من الكالسيوم (37 درجة مئوية) لفصل الأنسجة على مستوى الأقراص المقحمة وبعد ذلك بمحلول إنزيم يحتوي على القليل من الكالسيوم لتعطيل المصفوفة خارج الخلية (37 درجة مئوية). يتم تشريح القلب المهضوم لاحقا إلى الأذينين والبطينين. يتم تقطيع عينات الأنسجة إلى قطع صغيرة وتذويبها عن طريق سحب الماصة بعناية لأعلى ولأسفل. يتم إيقاف الهضم الأنزيمي ، ويتم إعادة إدخال الخلايا تدريجيا إلى تركيزات الكالسيوم الفسيولوجية. بعد التحميل باستخدام مؤشر Ca2+ الفلوري ، يتم تحضير خلايا عضلة القلب المعزولة للقياس المتزامن لتيارات الكالسيوم والعابرة. بالإضافة إلى ذلك ، تتم مناقشة مزالق العزل ويتم توفير بروتوكولات المشبك التصحيحي والآثار التمثيلية لتيارات الكالسيوم من النوع L مع قياسات عابرة متزامنة للكالسيوم في الخلايا العضلية الأذينية والبطينية المعزولة كما هو موضح أعلاه.
Introduction
عدم انتظام ضربات القلب شائع وأحد تحديات الرعاية الصحية الرئيسية الحالية لأنها تؤثر على ملايين الأشخاص في جميع أنحاء العالم. يرتبط عدم انتظام ضربات القلب بارتفاع معدلات المراضة والوفيات 1,2 ويمثل السبب الكامن وراء غالبية الوفيات القلبية المفاجئة3. أدت خيارات العلاج الحديثة إلى تحسين بقاء المريض على قيد الحياة ولكنها لا تزال علاجات الأعراض بشكل أساسي بدلا من استهداف الآليات الأساسية. وبالتالي ، فإن هذه العلاجات لها فعالية محدودة وقد تسبب في كثير من الأحيان آثارا جانبية شديدة4،5،6. يتطلب تحسين خيارات العلاج الحالية نظرة ثاقبة على الفيزيولوجيا المرضية الأساسية ، مما يخلق الحاجة إلى نماذج مناسبة للدراسة. تلعب النماذج الحيوانية الصغيرة - وتحديدا نماذج الفئران - دورا حاسما في أبحاث عدم انتظام ضربات القلب لأنها تسمح بدراسة الآليات الرئيسية لتكوين عدم انتظام ضربات القلب ، على سبيل المثال التأثير الجيني على الفيزيولوجيا الكهربية الخلوية أو وظيفة القناة الأيونية أو معالجة الكالسيوم 7,8.
لهذا الغرض ، هناك حاجة إلى خلايا عضلة القلب الأذينية والبطينية المعزولة بكمية كافية وقابلية للحياة. تم وصف مجموعة واسعة من مناهج العزل المختلفة للحصول على الخلايا العضلية الأذينية والبطينيةسابقا 9،10،11،12،13 وقدمت بعض المجموعات بيانات من القياسات المتزامنة للتيار من النوع L والكالسيوم الناجم عن الكالسيوم العابر من الأذين 14 أو البطين 15 خلايا عضلة القلب الفئران. ومع ذلك ، على حد علمنا ، لا توجد بيانات متاحة عن قياسات الأذين والبطين من واحد. يركز الباحثون على مجموعة واسعة من الموضوعات التي تتراوح من الفيزيولوجيا الكهربية إلى البروتينات ، والدراسات الوظيفية مثل انقباض الخلايا أو تفاعلات البروتين ، أو وظيفة الميتوكوندريا ، أو علم الوراثة - وكلها بحاجة إلى خلايا عضلية قلبية معزولة. وبالتالي ، لم يتم تطوير العديد من البروتوكولات المنشورة خصيصا لدراسات المشبك التصحيحي ، مما أدى إلى غلة محدودة وجودة خلية غير كافية لدراسات مشبك التصحيح. وبالتالي ، لا يمكن إجراء قياسات متزامنة لمشبك التصحيح والكالسيوم العابر للخلايا الأذينية والبطينية المعزولة من واحد باستخدام البروتوكولات المعمول بها.
لا يزال عزل الخلايا العضلية للفئران - وخاصة الأذينية - لتجارب المشبك الرقعة أمرا صعبا. توفر هذه المقالة طريقة بسيطة وسريعة لعزل الخلايا العضلية الأذينية والبطينية عالية الجودة عن طريق نضح لانجيندورف القائم على الإنزيم الرجعي ، والذي يسمح لاحقا بإجراء قياسات متزامنة لكل من تيار الغشاء الصافي وعابرات الكالسيوم المستحثة الحالية من واحد. توضح هذه المقالة بروتوكولا لعزل الخلايا العضلية الأذينية والبطينية المشتقة من الفئران البرية والفئران التي تحمل طفرات جينية. يمكن استخدام هذا البروتوكول للفئران الذكور والإناث على حد سواء. تم الحصول على عزل الخلايا العضلية والصور والنتائج التمثيلية الموضحة أدناه من الفئران البرية من النوع C57Bl / 6 في عمر 6 (± 1) أشهر. ومع ذلك ، فقد تم استخدام هذا البروتوكول بنجاح للفئران في مختلف الأعمار التي تتراوح من 2 إلى 24 شهرا مع أنماط وراثية مختلفة. يوضح الشكل 1 إعداد العزل ولقطة مقربة لقلب مقنن أثناء التروية الإنزيمية.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل مجلس مراجعة الحيوانات في ولاية سكسونيا السفلى (LAVES ، AZ-18/2900) وتم إجراؤها وفقا لجميع الإرشادات المؤسسية والوطنية والدولية لرعاية الحيوان.
1. الترتيبات المسبقة
- تحضير 1 لتر من 10x عازلة التروية (الجدول 1) ، 500 مل من 1x عازلة التروية (الجدول 2) ، 50 مل من مخزن الهضم (الجدول 3) ، 10 مل من المخزن المؤقت للتوقف (الجدول 4) ، 1 لتر من محلول Tyrode (الجدول 5) ، 10 مل من كل محلول خطوة الكالسيوم (محلول Tyrode مع الجلوكوز وكمية الكالسيوم ذات الصلة كما هو موضح) ، 1 لتر من محلول 4-AP (الجدول 5) ، 100 مل من محلول ماصة (الجدول 6) و 5 مل من حمض البلورونيك وفقا للوصفات المقدمة.
ملاحظة: يمكن تحضير محاليل الاستحمام (محلول Tyrode و 4-AP) (بدون جلوكوز) مسبقا وتخزينها عند +4 درجة مئوية ، ويضاف الجلوكوز في اليوم التجريبي. يمكن تخزين محلول الماصة عند -20 درجة مئوية ، ويضاف مؤشر الكالسيوم في اليوم التجريبي ثم يخزن المحلول على الثلج حتى استخدامه مرة أخرى. يمكن تخزين 10x عازلة للتروية في درجة حرارة الغرفة ، ويجب تحضير 1x عازل للتروية ومخزن مؤقت للهضم ومخزن مؤقت للتوقف طازجا في اليوم التجريبي. - قم بتشغيل حمام الماء ومضخة الأسطوانة.
- ملء جهاز Langendorff مع عازلة التروية ؛ تأكد من أنها خالية من الهواء.
- تحضير قنية الأبهر عن طريق تثبيته تحت المجهر تشريح ، والاتصال مع حقنة 1 مل مليئة عازلة التروية والهواء الصافي عن طريق شطف القنية.
ملاحظة: من الضروري تجنب أي هواء داخل نظام التروية ، لأن هذا سيؤثر بشكل مباشر على التروية التاجية وبالتالي فعالية الهضم. يمكن إضافة مصيدة الفقاعات إلى الإعداد إذا لزم الأمر ، لتجنب أي محاصرة للهواء بأمان. - قم بإعداد أطباق بتري مع ما يكفي من المخزن المؤقت للتروية لجمع الأعضاء والفحص المجهري (يجب أن يغطي المخزن المؤقت العضو بالكامل بشكل آمن ، ويجب أن تكون بضعة ملليلتر - اعتمادا على حجم طبق بتري المستخدم - كافية).
- قم بإعداد 3 أطباق بتري مع مخزن هضمي لتفكك الأنسجة والفحص المجهري ، ويجب أن يغطي المخزن المؤقت العضو للتشريح تحت المجهر داخل طبق بتري المعني ، ويعتمد المبلغ على حجم طبق بتري المستخدم. للتفكك استخدام 3 مل للأنسجة البطينية و 1.5 مل للأنسجة الأذينية.
2. حصاد الجهاز
- حقن الماوس مع 0.1 مل من الهيبارين (1000 وحدة / مل) i.p. باستخدام حقنة 1 مل مع قنية 27 غرام وانتظر لمدة 5-10 دقائق.
- ضع الماوس في غرفة الحث جنبا إلى جنب مع نسيج صغير غارقة في حوالي 500 ميكرولتر من الأيزوفلوران. لا ينبغي أن يكون الحيوان على اتصال مع الأنسجة. لتجنب ذلك ، يمكن للمرء استخدام شريط تضمين خزعة بلاستيكي لتغطية الأنسجة. بمجرد تخدير الحيوان بالكامل ، تحقق من منعكس قرصة إصبع القدم وبمجرد عدم وجوده بعد الآن ، قم بالقتل الرحيم للفأر بسرعة عن طريق خلع عنق الرحم.
- ضع الماوس على منصة على ظهره (على سبيل المثال ، على الستايروفوم المغطى بمنشفة ورقية) وقم بتثبيت الكفوف لأسفل باستخدام القنية لتثبيتها في مكانها.
- قم بإزالة الفراء والجلد الذي يغطي الصدر وجزء من البطن بقطع واضح من الغولوم باتجاه الارتفاق وافتح البطن مباشرة تحت الخنجري دون إصابة أي بنية عضو باستخدام المقص. ارفع القص بالملقط الجراحي واقطع الحجاب الحاجز بالمقص على طول حافة الأضلاع ، ثم اقطع الأضلاع في الخط الإبطي الإنسي وأزل القفص الصدري لكشف القلب.
- قم بإزالة التامور بعناية باستخدام ملقط حاد وإزالة القلب بسرعة عن طريق رفعه بالملقط الحاد من الأسفل وقطع الأوعية الكبيرة بقطع واحد باستخدام المقص.
- ضع القلب في مخزن التروية في درجة حرارة الغرفة وقم بقنية الشريان الأورطي بإبرة نهاية حادة تحت المجهر في أسرع وقت ممكن.
ملاحظة: قم بإزالة أي أنسجة رئوية وأنسجة دهنية متصلة بالعضو دون إضاعة الكثير من الوقت عليه. أثناء القنية ، تأكد من أن نهاية الإبرة لا تمتد عبر الصمام الأبهري ، لأن هذا سيضعف النتائج عن طريق منع المخازن المؤقتة من دخول الشرايين التاجية. - اربط القلب بقطعة من الحرير الخيطي بإحكام بالإبرة وافصلها عن المحقنة.
ملاحظة: يجب أن يستغرق الإجراء بأكمله من الحصول على القلب (اللحظة التي يتم فيها قطع الأوعية الكبيرة) حتى خياطة الشريان الأورطي إلى الإبرة أقل وقت ممكن. يوصى بعدم أخذ أكثر من 90-180 ثانية من إزالة القلب حتى بداية التروية.
3. الهضم الأنزيمي
- بعد القنية الأبهرية ، قم بتوصيل القلب المقن على الفور بجهاز Langendorff لتجنب دخول أي هواء إلى النظام.
ملاحظة: يمكن أن يساعد في الحصول على قطرة معلقة من محلول التروية في الجزء السفلي من جهاز Langendorff بالإضافة إلى قطرة من محلول التروية الموجود أعلى الإبرة لتجنب دخول أي هواء إلى النظام. - قم بتغذية القلب بمحلول التروية لمدة 1 دقيقة عند درجة حرارة 37 درجة مئوية بالضبط ومعدل تروية 4 مل / دقيقة بالضبط.
ملاحظة: من أجل الحصول على درجة حرارة 37 درجة مئوية عند طرف إبرة التروية ، يجب ضبط درجة حرارة حمام الماء أعلى قليلا عند حوالي 40 درجة مئوية. يجب اختبار ذلك بانتظام عن طريق قياس درجة الحرارة عند طرف التروية. - قم بتبديل التروية إلى مخزن الهضم والتعطير لمدة 9 دقائق بالضبط عند درجة حرارة 37 درجة مئوية بالضبط ومعدل تروية 4 مل / دقيقة بالضبط.
- انقل القلب المهضوم إلى طبق بتري مع ما يكفي من محلول الهضم لإبقائه مغطى بالكامل. ثم تشريح بعناية الأذينين والبطينين تحت المجهر.
- انقل الأذينين إلى طبق بتري يحتوي على 1.5 مل من محلول الهضم والبطينين إلى طبق بتري آخر به 3 مل من محلول الهضم.
- التسلخ الأذيني
- بعناية ، ولكن دون ضياع الوقت ، اسحب الأذينين إلى قطع صغيرة باستخدام ملقط حاد.
- قم بإذابة الأنسجة عن طريق السحب بعناية لأعلى ولأسفل باستخدام طرف ماصة سعة 1000 ميكرولتر ، والذي تم قطعه مسبقا لتوسيع فتحة الطرف.
- انقل المحلول إلى أنبوب طرد مركزي سعة 15 مل وأضف كمية مكافئة من المخزن المؤقت (1.5 مل) عن طريق السحب بعناية لأسفل على جانب الأنبوب لإنهاء التفاعل.
- مرر بعناية كل 3 مل من محاليل الخلايا / الأنسجة من خلال شبكة نايلون 200 ميكرومتر لإزالة قطع الأنسجة الكبيرة المتبقية التي لم يتم هضمها بالكامل.
ملاحظة: الهضم الناجح لن يترك أي قطع صلبة تقريبا.
- تشريح البطين
- قم بتقطيع أنسجة البطين بسرعة إلى قطع صغيرة باستخدام مقص التشريح والماصة لأعلى ولأسفل حتى تذوب. استخدم طرف ماصة آخر سعة 1000 ميكرولتر للسحب لأعلى ولأسفل ، وقد يتم تقصيره لتوسيع الفتحة.
- انقل محلول الخلية / الأنسجة إلى أنبوب طرد مركزي سعة 15 مل وأضف كمية مكافئة من المخزن المؤقت (3 مل) عن طريق السحب بعناية لأسفل على جانب الأنبوب لإنهاء التفاعل.
- مرر بعناية كل 6 مل من محلول الخلايا / الأنسجة من خلال شبكة نايلون 200 ميكرومتر لإزالة قطع الأنسجة الكبيرة التي لم يتم هضمها بالكامل.
ملاحظة: الهضم الناجح لن يترك أي قطع صلبة تقريبا.
- اترك كلا الأنبوبين (تعليق الخلايا الأذينية والبطينية) على المقعد في درجة حرارة الغرفة لمدة 6 دقائق حتى يستقر.
- أجهزة الطرد المركزي على حد سواء أنابيب 15 مل في 5 × ز لمدة 2 دقيقة.
4. إعادة إدخال الكالسيوم
ملاحظة: الخطوات التالية متطابقة لكل من الخلايا الأذينية والبطينية (ما لم يذكر خلاف ذلك) ويتم تنفيذها في درجة حرارة الغرفة.
- تخلص من المادة الطافية باستخدام ماصة باستور بلاستيكية وأعد تعليق الحبيبات بعناية في 10 مل من محلول تيرود الخالي من الكالسيوم.
- اترك الخلايا لمدة 8 دقائق للترسيب.
- أجهزة الطرد المركزي في 5 × غرام لمدة 1 دقيقة (الخلايا الأذينية فقط ، الترسيب يكفي للخلايا البطينية).
- تخلص من المادة الطافية وأعد تعليق الحبيبات بعناية في 10 مل من محلول Tyrode بتركيز 100 ميكرومتر من الكالسيوم.
- اترك الخلايا لمدة 8 دقائق للترسيب.
- أجهزة الطرد المركزي في 5 × غرام لمدة 1 دقيقة (الخلايا الأذينية فقط ، الترسيب يكفي للخلايا البطينية).
- تخلص من المادة الطافية وأعد تعليق الحبيبات بعناية في 10 مل من محلول Tyrode بتركيز 400 ميكرومتر من الكالسيوم.
- اترك الخلايا لمدة 8 دقائق للترسيب.
- أجهزة الطرد المركزي في 5 × غرام لمدة 1 دقيقة (الخلايا الأذينية فقط ، الترسيب يكفي للخلايا البطينية).
- تخلص من المادة الطافية وأعد تعليق الحبيبات بعناية في 1 مل (الأذيني) / 5 مل (البطين) من محلول تيرود بتركيز 1 مللي مول من الكالسيوم.
5. تحميل الخلايا العضلية مع مؤشر الكالسيوم الفلوري Fluo-3 AM
ملاحظة: نظرا لحساسية مؤشر الكالسيوم الفلوري للضوء ، يجب تنفيذ الخطوات التالية محمية من الضوء (على سبيل المثال ، عن طريق تغطية الأنابيب بورق الألمنيوم).
- قم بإعداد محلول مخزون Fluo-3 AM عن طريق إضافة 44 ميكرولتر من 20٪ pluronic F-127 في DMSO اللامائي إلى 50 ميكروغرام من Fluo-3AM (يمكن تخزينه في -20 درجة مئوية محمية من الضوء).
- أضف 10 ميكرولتر من محلول مخزون Fluo-3 AM إلى 1 مل من تعليق الخلية واحتضانها لمدة 10 دقائق في درجة حرارة الغرفة محمية من الضوء.
- أجهزة الطرد المركزي في 5 × ز لمدة 1 دقيقة.
- تخلص من المادة الطافية باستخدام ماصة باستور بلاستيكية وأعد تعليق الحبيبات في كمية معقولة من محلول الاستحمام للحصول على تركيز عمل جيد (1-5 مل من محلول الاستحمام حسب كثافة الخلية).
- اتركيه لمدة 30 دقيقة لإزالة الأسترة قبل البدء بالتجارب.
6. القياسات المتزامنة لمشبك التصحيح و epifluorescent Ca2+ - عابرة كما هو موضح سابقا16
ملاحظة: قياسات مشبك التصحيح ليست موضوع هذه المقالة ، يمكن إحالة القارئ المهتم إلى المنشورات الرئيسية التي تقدم أوصافا متعمقة لهذه الطريقة17،18،19،20،21،22. ومع ذلك ، من أجل فهم عام أفضل ، يتم تقديم ملخص عن بروتوكول لقياس تيارات الكالسيوم من النوع L جنبا إلى جنب مع عابرات الكالسيوم المستحثة الحالية.
- نقل الخلايا العضلية إلى غرفة الخلية ودمجها بمحلول الاستحمام عند 37 درجة مئوية.
- منع تيارات البوتاسيوم عن طريق إضافة 4-أمينوبيريدين وكلوريد الباريوم إلى محلول الاستحمام كما هو موضح في الجدول 5.
- تأكد من أن الأقطاب الكهربائية الدقيقة البورسليكات لديها مقاومة طرف من 2-5 MΩ مملوءة بمحلول ماصة (الجدول 6).
- إعداد القياسات للسماح بالتسجيل المتزامن لكل من الإشارات الكهربائية والتألق في نفس الوقت. يستخدم وضع مشبك الجهد لقياس تيار L-type Ca2+ مع بروتوكول يحمل الخلية عند -80 مللي فولت ونبضة منحدر 600 مللي ثانية إلى -40 مللي فولت لتعطيل تيار Na + السريع ، متبوعا بنبضة اختبار 100 مللي ثانية إلى +10 مللي فولت عند 0.5 هرتز (الشكل 2).
- استخدم الإثارة عند 488 نانومتر ، والضوء المنبعث عند <520 نانومتر للكشف والتحويل إلى [Ca2+] بافتراض
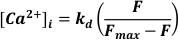
حيث kd = ثابت تفكك Fluo-3 (864 نانومتر) ، F = مضان Fluo-3 ؛ Fmax = Ca2+ - مضان مشبع تم الحصول عليه في نهاية كل تجربة19.
النتائج
يتم تحديد عائد العزل بعد إعادة إدخال الكالسيوم عن طريق سحب 10 ميكرولتر من تعليق الخلية على شريحة المجهر. أكثر من 100 خلية قابلة للحياة على شكل قضيب وغير منقبضة / 10 ميكرولتر لعزل الخلايا الأذينية وأكثر من 1000 خلية قابلة للحياة على شكل قضيب وغير متعاقدة / 10 ميكرولتر لعزل الخلايا البطينية تعتبر مح...
Discussion
توفر هذه المقالة طريقة سهلة وعملية للحصول على الخلايا العضلية الأذينية والبطينية عالية الجودة من نفس الماوس لدراسات المشبك التصحيحي مع تسجيلات الكالسيوم العابرة المتزامنة. تعتمد جودة البيانات التي تم الحصول عليها بشكل كبير على جودة عزل الخلية. كما ذكر أعلاه ، تم وصف العديد من الطرق لعزل ...
Disclosures
اي
Acknowledgements
تم دعم هذا العمل من قبل مؤسسة الأبحاث الألمانية (DFG; برنامج العالم السريري في طب الأوعية الدموية (PRIME) ، MA 2186 / 14-1 إلى P. Tomsits و D. Schüttler ؛ مشروع VO1568 / 3-1 و IRTG1816 و SFB1002 A13 إلى N. Voigt) ، مؤسسة الأبحاث الألمانية في إطار استراتيجية التميز الألمانية (EXC 2067/1- 390729940 إلى N. Voigt) ، المركز الألماني لأبحاث القلب والأوعية الدموية (DZHK ؛ 81X2600255 إلى S. Clauss و N. Voigt ؛ 81Z0600206 إلى S. Kääb) ، مؤسسة كورونا (S199 / 10079/2019 إلى S. Clauss) ، ERA-NET حول أمراض القلب والأوعية الدموية (ERA-CVD ؛ 01KL1910 إلى S. Clauss) ، مؤسسة هاينريش ولوت مولفينزل (إلى S. Clauss) ومؤسسة Else-Kröner-Fresenius (EKFS 2016_A20 إلى N. Voigt). لم يكن للممولين أي دور في إعداد المخطوطات.
Materials
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
References
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106 (2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588 (2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224 (2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688 (2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145 (2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227 (2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235 (2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved