JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Ca2+ 과도 현상 및 L형 칼슘 전류의 동시 측정을 위한 고품질 쥐 심방 및 심실 근세포의 분리
* 이 저자들은 동등하게 기여했습니다
요약
마우스 모델을 사용하면 부정맥 발생의 주요 메커니즘을 연구 할 수 있습니다. 이를 위해 패치 클램프 측정을 수행하기 위해 고품질 심근 세포가 필요합니다. 여기에서는 역행 효소 기반 Langendorff 관류를 통해 쥐 심방 및 심실 근세포를 분리하는 방법을 설명하며, 이를 통해 칼슘 과도 현상과 L형 칼슘 전류를 동시에 측정할 수 있습니다.
초록
마우스 모델은 부정맥 연구에서 중요한 역할을 하며 변경된 이온 채널 기능 및 칼슘 처리를 포함한 부정맥 생성의 주요 메커니즘을 연구할 수 있습니다. 이를 위해 고품질의 심방 또는 심실 심근 세포는 패치 클램프 측정을 수행하거나 칼슘 취급 이상을 탐색하는 데 필요합니다. 그러나 현재 격리 프로토콜에 의해 얻어진 고품질 심근 세포의 제한된 수율은 동일한 마우스에서 두 측정을 모두 허용하지 않습니다. 이 기사에서는 역행성 효소 기반 Langendorff 관류를 통해 고품질 쥐 심방 및 심실 근세포를 분리하여 한 동물에서 칼슘 과도 현상 및 L형 칼슘 전류를 동시에 측정하는 방법을 설명합니다. 마우스 심장을 채취하고, 대동맥을 빠르게 캐뉼라 화하여 혈액을 제거합니다. 그런 다음 심장은 처음에 칼슘이 없는 용액(37°C)으로 관류되어 삽입된 디스크 수준에서 조직을 해리한 다음 세포외 기질(37°C)을 파괴하기 위해 칼슘이 거의 포함되지 않은 효소 용액으로 관류합니다. 소화 된 심장은 이후 심방과 심실로 해부됩니다. 조직 샘플을 작은 조각으로 잘게 썰고 위아래로 조심스럽게 피펫팅하여 용해시킵니다. 효소 소화가 중단되고 세포가 생리적 칼슘 농도로 단계적으로 재도입됩니다. 형광 Ca2+ 지시약으로 로딩 한 후, 칼슘 전류와 과도 현상을 동시에 측정하기 위해 분리 된 심근 세포를 준비합니다. 또한, 분리 함정이 논의되고, 위에서 설명한 바와 같이 분리된 심방 및 심실 쥐 근세포에서 동시 칼슘 과도 측정과 함께 L형 칼슘 전류의 패치 클램프 프로토콜 및 대표적인 흔적이 제공됩니다.
서문
심장 부정맥은 흔하며 전 세계 수백만 명의 사람들에게 영향을 미치기 때문에 현재 주요 의료 문제 중 하나입니다. 부정맥은 높은 이환율 및 사망률과 관련이 있으며1,2 대부분의 심장 돌연사3의 근본 원인이다. 최신 치료 옵션은 환자 생존율을 향상시켰지만 여전히 기본 메커니즘을 표적으로 삼기보다는 주로 대증 치료입니다. 따라서, 이러한 치료법은 효능이 제한적이며 종종 심각한 부작용을 일으킬 수 있다 4,5,6. 현재 치료 옵션을 개선하려면 근본적인 병태생리학에 대한 통찰력이 필요하므로 연구에 적합한 모델이 필요합니다. 작은 동물 모델, 특히 마우스 모델은 부정맥 생성의 주요 메커니즘, 예를 들어 세포 전기 생리학, 이온 채널 기능 또는 칼슘 처리에 대한 유전 적 영향을 연구 할 수 있기 때문에 부정맥 연구에서 중요한 역할을합니다 7,8.
이를 위해서는 충분한 양과 생존력을 가진 고립 된 심방 및 심실 심근 세포가 필요합니다. 심방 및 심실 근세포를 얻기 위한 다양한 분리 접근법의 광범위한 스펙트럼이 이전에 설명되었으며9,10,11,12,13 일부 그룹은 심방 14 또는 심실 15에서 L형 전류 및 칼슘 전류 유도 칼슘 과도 현상의 동시 측정 데이터를 제시했습니다 쥐 심근 세포. 그러나 우리가 아는 한 동물의 심방 및 심실 측정에 대한 데이터는 없습니다. 연구자들은 전기생리학에서 단백질체학, 세포 수축성 또는 단백질 상호 작용과 같은 기능 연구, 미토콘드리아 기능 또는 유전학에 이르기까지 다양한 주제에 중점을 두고 있으며, 이 모든 것은 분리된 심근 세포를 필요로 합니다. 따라서 발표된 프로토콜 중 다수는 패치 클램프 연구를 위해 특별히 개발되지 않았기 때문에 패치 클램프 연구를 위한 수율이 제한되고 세포 품질이 불충분했습니다. 따라서 한 동물에서 분리된 심방 및 심실 세포의 동시 패치 클램프 및 칼슘 과도 측정은 확립된 프로토콜로 수행할 수 없습니다.
패치 클램프 실험을 위한 쥐, 특히 심방 근세포의 분리는 여전히 어려운 과제입니다. 이 기사는 역행 효소 기반 Langendorff 관류를 통해 고품질 쥐 심방 및 심실 근세포를 분리하는 간단하고 빠른 방법을 제공하며, 이를 통해 한 동물에서 순 막 전류와 전류 유도 칼슘 과도 현상을 동시에 측정할 수 있습니다. 이 기사는 야생형 마우스와 유전적 돌연변이를 가진 마우스에서 파생된 심방 및 심실 근세포의 분리를 위한 프로토콜을 자세히 설명합니다. 이 프로토콜은 수컷과 암컷 마우스 모두에 사용할 수 있습니다. 아래에 기술된 근세포 분리, 이미지 및 대표적인 결과는 6개월(± 1)개월의 야생형 C57Bl/6 마우스에서 얻었습니다. 그럼에도 불구하고, 이 프로토콜은 상이한 유전자형을 갖는 2개월에서 24개월에 이르는 다양한 연령의 마우스에 성공적으로 사용되었다. 그림 1 은 효소 관류 중 캐뉼러화된 심장의 분리 설정 및 확대 사진을 보여줍니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 동물 절차는 니더작센 동물 검토 위원회(LAVES, AZ-18/2900)의 승인을 받았으며 동물 복지에 대한 모든 제도적, 국가적 및 국제 지침에 따라 수행되었습니다.
1. 사전 준비
- 1L의 10x 관류 완충액(표 1), 500mL의 1x 관류 완충액(표 2), 50mL의 소화 완충액(표 3), 10mL의 정지 완충액(표 4), 1L의 Tyrode 용액(표 5), 10mL의 각 칼슘 단계 용액(포도당 및 표시된 각 양의 칼슘을 포함하는 Tyrode 용액)을 준비하고, 제공된 레시피에 따라 1L의 4-AP 용액(표 5), 100mL의 피펫 용액(표 6) 및 5mL의 플루론산.
참고: 목욕 용액(Tyrode 및 4-AP 용액)은 미리 준비하여(포도당 없이) +4°C에서 보관할 수 있으며 실험 당일에 포도당을 첨가합니다. 피펫 용액은 -20°C에서 보관할 수 있으며, 칼슘 지시약은 실험 당일에 첨가하고, 용액은 그 후 추가 사용 시까지 얼음 위에 보관한다. 10x 관류 완충액은 실온에서 보관할 수 있으며, 1x 관류 완충액, 소화 완충액 및 정지 완충액은 실험 당일에 새로 준비해야 합니다. - 수조와 롤러 펌프를 켭니다.
- Langendorff 장치를 관류 완충액으로 미리 채우십시오. 공기가 없는지 확인하십시오.
- 대동맥 캐뉼라를 해부 현미경으로 고정하여 준비하고 관류 완충액으로 채워진 1mL 주사기에 연결하고 캐뉼라를 헹구어 공기를 맑게 합니다.
알림: 관류 시스템 내부의 공기는 관상 동맥 관류에 직접적인 영향을 미치므로 소화 효과에 직접적인 영향을 미치므로 피하는 것이 중요합니다. 공기 트래핑을 안전하게 방지하기 위해 필요한 경우 설정에 버블 트랩을 추가할 수 있습니다. - 장기 수집 및 현미경 검사를 위한 충분한 관류 완충액으로 페트리 접시를 준비합니다(완충액은 전체 장기를 단단히 덮어야 하며 사용된 페트리 접시 크기에 따라 몇 밀리리터이면 충분해야 함).
- 조직 해리 및 현미경 검사를 위한 소화 완충액이 있는 3개의 페트리 접시를 준비하고, 완충액은 각 페트리 접시 내에서 현미경으로 해부할 장기를 덮어야 하며, 양은 사용된 페트리 접시 크기에 따라 다릅니다. 해리를 위해 심실 조직의 경우 3mL, 심방 조직의 경우 1.5mL를 사용합니다.
2. 장기 적출
- 27G 캐뉼라가 있는 1mL 주사기를 사용하여 0.1mL의 헤파린(1,000U/mL) i.p.를 마우스에 주입하고 5-10분 동안 기다립니다.
- 마우스를 약 500μL의 이소플루란에 담근 작은 조직과 함께 유도 챔버에 넣습니다. 동물은 조직과 접촉해서는 안됩니다. 이를 피하기 위해 플라스틱 생검 내장 카세트를 사용하여 조직을 덮을 수 있습니다. 동물이 완전히 마취되면 발가락 꼬집음 반사를 확인하고 더 이상 존재하지 않는 즉시 자궁 경부 탈구로 마우스를 신속하게 안락사시킵니다.
- 마우스를 뒤쪽의 플랫폼(예: 종이 타월로 덮인 스티로폼 위)에 놓고 캐뉼라로 발을 고정하여 제자리에 고정합니다.
- 가슴과 복부의 일부를 덮고있는 모피와 피부를 제거하고 jugulum에서 symphysis쪽으로 명확한 절개로 제거하고 가위를 사용하여 장기 구조를 손상시키지 않고 xiphoid 바로 아래에서 복부를 엽니 다. 수술용 집게로 흉골을 들어 올리고 갈비뼈 가장자리를 따라 가위로 횡격막을 자른 다음 내측 겨드랑이 라인에서 갈비뼈를 자르고 흉곽을 제거하여 심장을 노출시킵니다.
- 뭉툭한 집게를 사용하여 심낭을 조심스럽게 제거하고 아래에서 뭉툭한 집게로 들어 올리고 가위를 사용하여 한 번의 절단으로 큰 혈관을 절단하여 심장을 빠르게 제거합니다.
- 심장을 실온 관류 완충액에 넣고 현미경으로 뭉툭한 끝 바늘로 대동맥을 가능한 한 빨리 캐뉼러냅니다.
알림: 장기에 부착된 폐 조직과 지방 조직을 너무 많은 시간을 낭비하지 않고 제거하십시오. 캐뉼러를 삽입하는 동안 바늘 끝이 대동맥 판막을 통해 확장되지 않도록 하면 완충액이 관상 동맥으로 들어가는 것을 방지하여 결과를 손상시킬 수 있습니다. - 봉합 실크 조각으로 심장을 바늘에 단단히 묶고 주사기에서 분리하십시오.
참고: 심장을 채취하는 것(큰 혈관이 절단되는 순간)부터 대동맥을 바늘에 봉합할 때까지의 전체 절차는 가능한 한 적은 시간이 소요됩니다. 관류가 시작될 때까지 심장을 제거하는 데 90-180초 이상 걸리지 않는 것이 좋습니다.
3. 효소 소화
- 대동맥 캐뉼라 삽입 후, 캐뉼러 된 심장을 즉시 Langendorff 장치에 연결하여 공기가 시스템에 유입되지 않도록하십시오.
알림: Langendorff 장치 하단에 관류 완충액 한 방울을 매달고 바늘 상단에 관류 완충액 한 방울을 놓아 시스템에 공기가 유입되는 것을 방지하는 데 도움이 될 수 있습니다. - 정확히 37°C의 온도와 정확히 4mL/분의 관류 속도에서 1분 동안 관류 완충액으로 심장을 관류합니다.
참고: 관류 바늘 끝의 온도가 37°C가 되려면 수조 온도를 약 40°C보다 약간 높게 설정해야 합니다. 이것은 관류 팁의 온도를 측정하여 정기적으로 테스트해야 합니다. - 정확히 37°C의 온도와 정확히 4mL/분의 관류 속도에서 정확히 9분 동안 관류를 소화 완충액으로 전환합니다.
- 소화된 심장을 완전히 덮을 수 있도록 충분한 소화 완충액이 있는 페트리 접시에 옮깁니다. 그런 다음 현미경으로 심방과 심실을 조심스럽게 해부하십시오.
- 심방을 1.5mL의 소화 완충액이 있는 페트리 접시에 옮기고 심실을 3mL의 소화 완충액이 있는 다른 페트리 접시에 옮깁니다.
- 심방 박리
- 조심스럽게, 그러나 시간을 낭비하지 않고, 뭉툭한 집게를 사용하여 심방을 작은 조각으로 떼어 내십시오.
- 팁 입구를 넓히기 위해 이전에 절단한 1,000μL 피펫 팁을 사용하여 조심스럽게 위아래로 피펫팅하여 조직을 용해합니다.
- 용액을 15mL 원심분리기 튜브로 옮기고 튜브 측면에서 조심스럽게 피펫팅하여 동일한 양의 정지 완충액(1.5mL)을 추가하여 반응을 종료합니다.
- 3mL의 세포/조직 용액을 모두 200μm 나일론 메쉬에 조심스럽게 통과시켜 완전히 소화되지 않은 나머지 더 큰 조직 조각을 제거합니다.
알림: 소화가 성공하면 단단한 덩어리가 거의 남지 않습니다.
- 심실 박리
- 해부 가위와 피펫을 위아래로 사용하여 심실 조직을 작은 조각으로 빠르게 잘라 용해시킵니다. 위아래로 피펫팅을 위해 다른 1,000μL 피펫 팁을 사용하고, 개구부를 넓히기 위해 단축할 수 있습니다.
- 세포/조직 용액을 15mL 원심분리기 튜브로 옮기고 튜브 측면에서 조심스럽게 피펫팅하여 동일한 양의 정지 완충액(3mL)을 추가하여 반응을 종료합니다.
- 6mL의 모든 세포/조직 용액을 200μm 나일론 메쉬에 조심스럽게 통과시켜 완전히 소화되지 않은 더 큰 조직 조각을 제거합니다.
알림: 소화가 성공하면 단단한 덩어리가 거의 남지 않습니다.
- 두 튜브(심방 및 심실 세포 현탁액)를 실온에서 6분 동안 벤치에 두어 안정시킵니다.
- 두 15mL 튜브를 5 x g 에서 2분 동안 원심분리합니다.
4. 칼슘 재도입
참고: 다음 단계는 심방 및 심실 세포 모두에 대해 동일하며(달리 언급되지 않는 한) 실온에서 수행됩니다.
- 플라스틱 파스퇴르 피펫을 사용하여 상층액을 버리고 칼슘이 없는 티로드 용액 10mL에 펠릿을 조심스럽게 재현탁합니다.
- 침전을 위해 세포를 8분 동안 그대로 두십시오.
- 5 x g 에서 1 분 동안 원심 분리합니다 (심방 세포 만, 심실 세포에는 침전으로 충분합니다).
- 상층액을 버리고 100μM 칼슘 농도의 Tyrode 용액 10mL에 펠릿을 조심스럽게 재현탁합니다.
- 침전을 위해 세포를 8분 동안 그대로 두십시오.
- 5 x g 에서 1 분 동안 원심 분리합니다 (심방 세포 만, 심실 세포에는 침전으로 충분합니다).
- 상층액을 버리고 400μM 칼슘 농도의 티로드 용액 10mL에 펠릿을 조심스럽게 재현탁합니다.
- 침전을 위해 세포를 8분 동안 그대로 두십시오.
- 5 x g 에서 1 분 동안 원심 분리합니다 (심방 세포 만, 심실 세포에는 침전으로 충분합니다).
- 상층액을 버리고 펠릿을 1mM 칼슘 농도의 티로드 용액 5mL(심방)/1mL(심실)에 조심스럽게 재현탁합니다.
5. 형광 칼슘 지표 Fluo-3 AM으로 근세포 로딩
알림: 형광 칼슘 표시기의 감광성으로 인해 다음 단계는 빛으로부터 보호되어야 합니다(예: 튜브를 알루미늄 호일로 덮음).
- 무수 DMSO에 20% 플루로닉 F-127 44μL를 50μg의 Fluo-3AM에 첨가하여 Fluo-3 AM 원액을 준비합니다(빛으로부터 보호되는 -20°C에서 보관 가능).
- 10 μL의 Fluo-3 AM 원액을 1 mL의 세포 현탁액에 첨가하고 빛으로부터 보호되는 실온에서 10 분 동안 배양합니다.
- 5 x g 에서 1분 동안 원심분리합니다.
- 플라스틱 파스퇴르 피펫을 사용하여 상청액을 버리고 펠릿을 적절한 양의 목욕 용액에 재현탁하여 좋은 작업 농도(세포 밀도에 따라 1-5mL의 목욕 용액)를 얻습니다.
- 실험을 시작하기 전에 에스테르 제거를 위해 30분 동안 그대로 두십시오.
6. 앞서 설명한 바와 같이 동시 패치 클램프 및 epifluorescent Ca2+-과도 측정16
알림: 패치 clamp 측정은 이 기사의 주제가 아니며 관심 있는 독자는 이 방법 17,18,19,20,21,22에 대한 자세한 설명을 제공하는 주요 간행물을 참조할 수 있습니다. 그럼에도 불구하고, 더 나은 전반적인 이해를 위해, 현재 유도된 칼슘 과도 현상과 함께 L형 칼슘 전류를 측정하기 위한 프로토콜에 대한 요약이 제공된다.
- 근세포를 세포 챔버로 옮기고 37°C에서 수조 용액으로 슈퍼퓨즈합니다.
- 표 5에 표시된 대로 4-아미노피리딘과 염화바륨을 수조 용액에 첨가하여 칼륨 전류를 차단합니다.
- 붕규산 미세 전극의 팁 저항이 피펫 용액으로 채워진 2-5MΩ인지 확인합니다(표 6).
- 전기 신호와 에피형광을 동시에 기록할 수 있도록 측정을 설정합니다. 전압 클램프 모드는 전지를 -80mV로 유지하고 600ms의 램프 펄스를 -40mV로 유지하여 빠른 Na+ 전류를 비활성화한 다음 0.5Hz에서 +10mV까지 100ms 테스트 펄스를 유지하는 프로토콜로 L형 Ca2+ 전류를 측정하는 데 사용됩니다(그림 2).
- 488 nm에서 여기, <520 nm에서 방출된 빛을 사용하여 검출하고 [Ca2+]I 로 변환한다고 가정합니다.
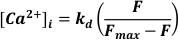
여기서 kd = Fluo-3 (864 nM)의 해리 상수, F = Fluo-3 형광; Fmax =Ca2+-포화 형광은 각 실험종료 시 얻어진다 19.
Access restricted. Please log in or start a trial to view this content.
결과
분리 수율은 칼슘 재도입 후 10 μL의 세포 현탁액을 현미경 슬라이드에 피펫팅하여 측정합니다. 심방 세포 분리를 위한 100개 이상의 생존 가능한 막대 모양의 비수축 세포/10μL 및 심실 세포 분리를 위한 1,000개 이상의 생존 가능한 막대 모양의 비수축 세포/10μL가 충분한 수율로 간주되며 일반적으로 이 프로토콜을 사용하여 얻습니다. 이 프로토콜로 얻은 심방 세포는 심장 전도 시스템의 세포, 특?...
Access restricted. Please log in or start a trial to view this content.
토론
이 기사는 동시 칼슘 과도 기록과 함께 패치 클램프 연구를 위해 동일한 마우스에서 고품질 심방 및 심실 근세포를 얻을 수 있는 쉽고 기능적인 방법을 제공합니다. 얻어진 데이터의 품질은 세포 분리의 품질에 크게 의존한다. 상기 언급한 바와 같이, 쥐 심근세포를 단리하는 많은 방법들이 이전에 기술되었다 9,10,11,12....
Access restricted. Please log in or start a trial to view this content.
공개
없음
감사의 말
이 연구는 독일 연구 재단 (DFG; 혈관 의학의 임상의 과학자 프로그램(PRIME), MA 2186/14-1 to P. Tomsits 및 D. Schüttler; VO1568/3-1, IRTG1816 및 SFB1002 프로젝트 A13 to N. Voigt), 독일 우수 전략(Excellence Strategy)에 따른 독일 연구 재단(EXC 2067/1- 390729940 to N. Voigt), 독일 심혈관 연구 센터(German Centre for Cardiovascular Research, DZHK; 81X2600255 to S. Clauss and N. Voigt; 81Z0600206 to S. Kääb), 코로나 재단(Corona Foundation) (S199/10079/2019 to S. Clauss), 심혈관 질환에 관한 ERA-NET (ERA-CVD; 01KL1910 to S. Clauss), Heinrich-and-Lotte-Mühlfenzl Stiftung (S. Clauss에게) 및 Else-Kröner-Fresenius 재단 (EKFS 2016_A20에서 N. Voigt까지). 자금 제공자는 원고 준비에 아무런 역할도 하지 않았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
참고문헌
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106(2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588(2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224(2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688(2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145(2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227(2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235(2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464(2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890(2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유