Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung von hochwertigen atrialen und ventrikulären Myozyten der Maus für die simultane Messung von Ca2+ Transienten und L-Typ Calciumstrom
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Mausmodelle ermöglichen es, Schlüsselmechanismen der Arrhythmogenese zu untersuchen. Zu diesem Zweck sind qualitativ hochwertige Kardiomyozyten notwendig, um Patch-Clamp-Messungen durchzuführen. In dieser Arbeit wird eine Methode zur Isolierung muriner atrialer und ventrikulärer Myozyten mittels retrograder enzymbasierter Langendorff-Perfusion beschrieben, die simultane Messungen von Calcium-Transienten und L-Typ-Calciumstrom ermöglicht.
Zusammenfassung
Mausmodelle spielen eine entscheidende Rolle in der Arrhythmieforschung und ermöglichen die Untersuchung von Schlüsselmechanismen der Arrhythmogenese, einschließlich der veränderten Ionenkanalfunktion und des Kalziumhandlings. Zu diesem Zweck sind atriale oder ventrikuläre Kardiomyozyten von hoher Qualität notwendig, um Patch-Clamp-Messungen durchzuführen oder Calcium-Handling-Anomalien zu untersuchen. Die begrenzte Ausbeute an qualitativ hochwertigen Kardiomyozyten, die mit den derzeitigen Isolationsprotokollen gewonnen wird, erlaubt jedoch nicht beide Messungen in derselben Maus. Dieser Artikel beschreibt eine Methode zur Isolierung hochwertiger muriner atrialer und ventrikulärer Myozyten mittels retrograder enzymbasierter Langendorff-Perfusion für die anschließende simultane Messung von Calciumtransienten und L-Typ-Calciumstrom von einem Tier. Mäuseherzen werden gewonnen, und die Aorta wird schnell kanüliert, um Blut zu entfernen. Die Herzen werden dann zunächst mit einer kalziumfreien Lösung (37 °C) perfundiert, um das Gewebe auf der Ebene der interkalierten Bandscheiben zu dissoziieren, und anschließend mit einer Enzymlösung, die wenig Kalzium enthält, um die extrazelluläre Matrix (37 °C) zu stören. Das verdaute Herz wird anschließend in Vorhöfe und Ventrikel zerlegt. Gewebeproben werden in kleine Stücke zerkleinert und durch vorsichtiges Auf- und Abpipettieren aufgelöst. Die enzymatische Verdauung wird gestoppt und die Zellen werden schrittweise wieder in physiologische Kalziumkonzentrationen gebracht. Nach Beladung mit einem fluoreszierenden Ca2+-Indikator werden isolierte Kardiomyozyten für die simultane Messung von Calciumströmen und -transienten präpariert. Darüber hinaus werden Isolationsfallstricke diskutiert und Patch-Clamp-Protokolle und repräsentative Spuren von L-Typ-Calciumströmen mit simultanen Calciumtransientenmessungen in atrialen und ventrikulären murinen Myozyten, die wie oben beschrieben isoliert wurden, bereitgestellt.
Einleitung
Herzrhythmusstörungen sind weit verbreitet und eine der größten Herausforderungen im Gesundheitswesen, da sie Millionen von Menschen weltweit betreffen. Herzrhythmusstörungen sind mit einer hohen Morbidität und Mortalität assoziiert 1,2 und stellen die zugrunde liegende Ursache für die Mehrzahl der plötzlichen Herztodedar 3. Heutige Behandlungsoptionen haben das Überleben der Patienten verbessert, sind aber immer noch hauptsächlich symptomatische Behandlungen, anstatt auf die zugrunde liegenden Mechanismen abzuzielen. Daher sind diese Behandlungen nur begrenzt wirksam und können häufig schwere Nebenwirkungen verursachen 4,5,6. Eine Verbesserung der derzeitigen Behandlungsmöglichkeiten erfordert Einblicke in die zugrunde liegende Pathophysiologie, was die Notwendigkeit geeigneter Modelle für die Untersuchung schafft. Kleintiermodelle - und insbesondere Mausmodelle - spielen eine entscheidende Rolle in der Arrhythmieforschung, da sie es ermöglichen, Schlüsselmechanismen der Arrhythmogenese zu untersuchen, z. B. den genetischen Einfluss auf die zelluläre Elektrophysiologie, die Funktion der Ionenkanäle oder den Umgang mit Kalzium 7,8.
Zu diesem Zweck werden isolierte atriale und ventrikuläre Kardiomyozyten in ausreichender Menge und Viabilität benötigt. Ein breites Spektrum unterschiedlicher Isolationsansätze zur Gewinnung von atrialen und ventrikulären Myozyten wurde bereits beschrieben 9,10,11,12,13, und einige Gruppen haben Daten aus gleichzeitigen Messungen von L-Typ-Strom und Kalziumstrom-induzierten Kalziumtransienten entweder aus dem Vorhof 14 oder dem Ventrikel 15 vorgelegt Kardiomyozyten der Maus. Unseres Wissens nach liegen jedoch keine Daten zu Vorhof- und Ventrikelmessungen eines Tieres vor. Die Forscher konzentrieren sich auf eine breite Palette von Themen, die von Elektrophysiologie über Proteomik, funktionelle Studien wie Zellkontraktilität oder Proteininteraktionen, mitochondriale Funktion bis hin zur Genetik reichen – alle benötigen isolierte Kardiomyozyten. Viele der veröffentlichten Protokolle wurden daher nicht speziell für Patch-Clamp-Studien entwickelt, was zu begrenzten Ausbeuten und unzureichender Zellqualität für Patch-Clamp-Studien führt. Daher können simultane Patch-Clamp- und Calcium-Transientenmessungen von Vorhof- und Ventrikelzellen, die aus einem Tier isoliert wurden, mit etablierten Protokollen nicht durchgeführt werden.
Die Isolierung von murinen – insbesondere atrialen – Myozyten für Patch-Clamp-Experimente ist nach wie vor eine Herausforderung. Dieser Artikel stellt eine einfache und schnelle Methode zur Isolierung hochwertiger muriner atrialer und ventrikulärer Myozyten mittels retrograder enzymbasierter Langendorff-Perfusion vor, die anschließend die gleichzeitige Messung von Nettomembranstrom und strominduzierten Kalziumtransienten von einem Tier ermöglicht. In diesem Artikel wird ein Protokoll zur Isolierung von atrialen und ventrikulären Myozyten aus Wildtyp-Mäusen und Mäusen mit genetischen Mutationen ausgearbeitet. Dieses Protokoll kann sowohl für männliche als auch für weibliche Mäuse verwendet werden. Die Myozytenisolierung, die Bilder und die repräsentativen Ergebnisse, die unten beschrieben werden, wurden von Wildtyp-C57Bl/6-Mäusen im Alter von 6 (± 1) Monaten erhalten. Nichtsdestotrotz wurde dieses Protokoll erfolgreich bei Mäusen im Alter von 2 bis 24 Monaten mit unterschiedlichen Genotypen eingesetzt. Abbildung 1 zeigt den Isolationsaufbau und eine Nahaufnahme eines kanülierten Herzens während der Enzymperfusion.
Protokoll
Alle Tierverfahren wurden vom Niedersächsischen Tierprüfungsamt (LAVES, AZ-18/2900) genehmigt und in Übereinstimmung mit allen institutionellen, nationalen und internationalen Richtlinien für den Tierschutz durchgeführt.
1. Vorbereitungen
- Bereiten Sie 1 l 10x Perfusionspuffer (Tabelle 1), 500 ml 1x Perfusionspuffer (Tabelle 2), 50 ml Aufschlusspuffer (Tabelle 3), 10 ml Stopppuffer (Tabelle 4), 1 l Tyrode-Lösung (Tabelle 5), 10 ml jeder Calcium-Stufenlösung (Tyrode-Lösung mit Glukose und entsprechender Menge an Calcium wie angegeben) vor. 1 l 4-AP-Lösung (Tabelle 5), 100 ml Pipettenlösung (Tabelle 6) und 5 ml Pluronsäure gemäß den bereitgestellten Rezepturen.
HINWEIS: Badlösungen (Tyrode und 4-AP-Lösung) können (ohne Glukose) im Voraus zubereitet und bei +4 °C gelagert werden, Glukose wird am Versuchstag hinzugefügt. Die Pipettenlösung kann bei -20 °C gelagert werden, der Calciumindikator wird am Versuchstag zugegeben und die Lösung dann bis zur weiteren Verwendung auf Eis gelagert. 10x Perfusionspuffer kann bei Raumtemperatur gelagert werden, 1x Perfusionspuffer, Verdauungspuffer und Stopppuffer sollten am Versuchstag frisch zubereitet werden. - Schalten Sie das Wasserbad und die Rollenpumpe ein.
- Langendorff-Apparatur mit Perfusionspuffer vorfüllen; Stellen Sie sicher, dass es luftfrei ist.
- Bereiten Sie die Aortenkanüle vor, indem Sie sie unter dem Präpariermikroskop fixieren, mit einer 1-ml-Spritze verbinden, die mit Perfusionspuffer gefüllt ist, und reinigen Sie die Kanüle, indem Sie die Kanüle ausspülen.
HINWEIS: Es ist wichtig, jegliche Luft im Perfusionssystem zu vermeiden, da dies die koronare Perfusion und damit die Verdauungseffektivität direkt beeinflusst. Bei Bedarf kann dem Setup eine Blasenfalle hinzugefügt werden, um Lufteinschlüsse sicher zu vermeiden. - Bereiten Sie Petrischalen mit ausreichend Perfusionspuffer für die Organentnahme und die Mikroskopie vor (Puffer sollte das gesamte Organ sicher bedecken, einige Milliliter – je nach verwendeter Petrischalegröße – sollten ausreichen).
- Bereiten Sie 3 Petrischalen mit Verdauungspuffer für die Gewebedissoziation und Mikroskopie vor, der Puffer sollte das Organ für die Präparation unter dem Mikroskop in der jeweiligen Petrischale bedecken, die Menge hängt von der verwendeten Petrischalegröße ab. Für die Dissoziation verwenden Sie 3 ml für ventrikuläres Gewebe und 1,5 ml für Vorhofgewebe.
2. Organentnahme
- Injizieren Sie der Maus 0,1 ml Heparin (1.000 U/ml) i.p. mit einer 1-ml-Spritze mit einer 27-g-Kanüle und warten Sie 5-10 Minuten.
- Legen Sie die Maus zusammen mit einem kleinen Gewebe, das mit ca. 500 μl Isofluran getränkt ist, in eine Induktionskammer. Das Tier sollte nicht mit dem Gewebe in Berührung kommen. Um dies zu vermeiden, kann man eine Biopsie-Einbettungskassette aus Kunststoff verwenden, um das Gewebe abzudecken. Sobald das Tier vollständig betäubt ist, überprüfen Sie den Zehenquetschreflex und sobald er nicht mehr vorhanden ist, schläfern Sie die Maus schnell durch Zervixluxation ein.
- Legen Sie die Maus auf eine Plattform auf dem Rücken (z. B. auf Styropor, das mit einem Papiertuch bedeckt ist) und fixieren Sie die Pfoten mit Kanülen, um sie an Ort und Stelle zu halten.
- Entfernen Sie das Fell und die Haut, die die Brust und einen Teil des Bauches bedecken, mit einem deutlichen Schnitt vom Jugulum in Richtung Symphyse und öffnen Sie den Bauch direkt unter dem Xipoid, ohne eine Organstruktur mit einer Schere zu verletzen. Heben Sie das Brustbein mit einer chirurgischen Zange an und schneiden Sie das Zwerchfell mit einer Schere entlang der Rippenkante durch, schneiden Sie dann die Rippen in der medialen Achsellinie ab und entfernen Sie den Brustkorb, um das Herz freizulegen.
- Entfernen Sie den Herzbeutel vorsichtig mit einer stumpfen Pinzette und entfernen Sie das Herz schnell, indem Sie es mit einer stumpfen Pinzette von unten anheben und die großen Gefäße mit einem einzigen Schnitt mit einer Schere durchtrennen.
- Geben Sie das Herz in einen Perfusionspuffer bei Raumtemperatur und kanülieren Sie die Aorta mit einer stumpfen Endnadel so schnell wie möglich unter dem Mikroskop.
Anmerkungen: Entfernen Sie jegliches Lungengewebe und Fettgewebe, das mit dem Organ verbunden ist, ohne zu viel Zeit damit zu verlieren. Achten Sie bei der Kanülierung darauf, dass das Ende der Nadel nicht durch die Aortenklappe ragt, da dies die Ergebnisse beeinträchtigt, da Puffer nicht in die Koronararterien gelangen. - Binden Sie das Herz mit einem Stück Nahtseide fest an die Nadel und trennen Sie es von der Spritze.
HINWEIS: Der gesamte Vorgang von der Gewinnung des Herzens (dem Moment, in dem die großen Gefäße durchtrennt werden) bis zum Nähen der Aorta an die Nadel sollte so wenig Zeit wie möglich in Anspruch nehmen. Es wird empfohlen, von der Entfernung des Herzens bis zum Beginn der Perfusion nicht länger als 90-180 s zu dauern.
3. Enzymatische Verdauung
- Nach der Aortenkanülierung wird das kanülierte Herz sofort an den Langendorff-Apparat angeschlossen, um das Eindringen von Luft in das System zu vermeiden.
Anmerkungen: Es kann hilfreich sein, einen hängenden Tropfen Perfusionspuffer an der Unterseite der Langendorff-Apparatur sowie einen Tropfen Perfusionspuffer auf der Oberseite der Nadel zu haben, um zu verhindern, dass Luft in das System eindringt. - Perfundieren Sie das Herz 1 min lang mit Perfusionspuffer bei einer Temperatur von exakt 37 °C und einer Perfusionsrate von exakt 4 mL/min.
HINWEIS: Um eine Temperatur von 37 °C an der Spitze der Perfusionsnadel zu erreichen, muss die Wasserbadtemperatur leicht über ca. 40 °C eingestellt werden. Dies sollte regelmäßig durch Messung der Temperatur an der Perfusionsspitze überprüft werden. - Perfusion auf Aufschlusspuffer umschalten und für exakt 9 min bei einer Temperatur von exakt 37 °C und einer Perfusionsrate von exakt 4 mL/min perfundieren.
- Übertragen Sie das verdaute Herz in eine Petrischale mit genügend Verdauungspuffer, um es vollständig bedeckt zu halten. Anschließend werden die Vorhöfe und Herzkammern unter dem Mikroskop sorgfältig präpariert.
- Übertragen Sie die Vorhöfe in eine Petrischale mit 1,5 ml Verdauungspuffer und die Ventrikel in eine andere Petrischale mit 3 ml Verdauungspuffer.
- Vorhofdissektion
- Ziehen Sie die Vorhöfe vorsichtig, aber ohne Zeitverlust mit einer stumpfen Pinzette in winzige Stücke auseinander.
- Lösen Sie das Gewebe auf, indem Sie mit einer 1.000-μl-Pipettenspitze, die zuvor geschnitten wurde, um die Spitzenöffnung zu erweitern, vorsichtig auf und ab pipettieren.
- Übertragen Sie die Lösung in ein 15-ml-Zentrifugenröhrchen und fügen Sie eine entsprechende Menge Stopppuffer (1,5 ml) hinzu, indem Sie vorsichtig an der Seite des Röhrchens nach unten pipettieren, um die Reaktion zu beenden.
- Führen Sie alle 3 ml Zell-/Gewebelösungen vorsichtig durch ein 200 μm Nylonnetz, um verbleibende größere Gewebestücke zu entfernen, die nicht vollständig verdaut wurden.
HINWEIS: Eine erfolgreiche Verdauung hinterlässt fast keine festen Brocken.
- Ventrikuläre Dissektion
- Hacken Sie das Ventrikelgewebe schnell mit einer Sezierschere in winzige Stücke und pipettieren Sie es auf und ab, um es aufzulösen. Verwenden Sie eine weitere 1.000-μl-Pipettenspitze zum Auf- und Abpipettieren, sie kann gekürzt werden, um die Öffnung zu erweitern.
- Übertragen Sie die Zell-/Gewebelösung in ein 15-ml-Zentrifugenröhrchen und fügen Sie eine entsprechende Menge Stopppuffer (3 ml) hinzu, indem Sie vorsichtig an der Seite des Röhrchens nach unten pipettieren, um die Reaktion zu beenden.
- Führen Sie alle 6 ml Zell-/Gewebelösung vorsichtig durch ein 200 μm Nylonnetz, um größere Gewebestücke zu entfernen, die noch nicht vollständig verdaut sind.
HINWEIS: Eine erfolgreiche Verdauung hinterlässt fast keine festen Brocken.
- Lassen Sie beide Röhrchen (Vorhof- und Ventrikelzellsuspension) 6 Minuten lang bei Raumtemperatur auf der Bank, damit sie sich absetzen können.
- Zentrifugieren Sie beide 15-ml-Röhrchen bei 5 x g für 2 min.
4. Wiedereinführung von Kalzium
HINWEIS: Die folgenden Schritte sind sowohl für Vorhof- als auch für Ventrikelzellen identisch (sofern nicht anders angegeben) und werden bei Raumtemperatur durchgeführt.
- Entsorgen Sie den Überstand mit einer Pasteurpipette aus Kunststoff und resuspendieren Sie das Pellet vorsichtig in 10 ml kalziumfreier Tyrode-Lösung.
- Lassen Sie die Zellen 8 Minuten zur Sedimentation stehen.
- Bei 5 x g für 1 min zentrifugieren (nur Vorhofzellen, Sedimentation reicht für Ventrikelzellen).
- Verwerfen Sie den Überstand und resuspendieren Sie das Pellet vorsichtig in 10 ml Tyrode-Lösung mit einer Calciumkonzentration von 100 μM.
- Lassen Sie die Zellen 8 Minuten zur Sedimentation stehen.
- Bei 5 x g für 1 min zentrifugieren (nur Vorhofzellen, Sedimentation reicht für Ventrikelzellen).
- Verwerfen Sie den Überstand und resuspendieren Sie das Pellet vorsichtig in 10 ml Tyrode-Lösung mit einer Calciumkonzentration von 400 μM.
- Lassen Sie die Zellen 8 Minuten zur Sedimentation stehen.
- Bei 5 x g für 1 min zentrifugieren (nur Vorhofzellen, Sedimentation reicht für Ventrikelzellen).
- Verwerfen Sie den Überstand und resuspendieren Sie das Pellet vorsichtig in 1 ml (atrial)/5 ml (ventrikulär) Tyrode-Lösung mit einer Calciumkonzentration von 1 mM.
5. Beladung von Myozyten mit fluoreszierendem Calcium-Indikator Fluo-3 AM
HINWEIS: Aufgrund der Lichtempfindlichkeit des fluoreszierenden Calciumindikators sollten die folgenden Schritte lichtgeschützt durchgeführt werden (z.B. durch Abdecken der Röhrchen mit Aluminiumfolie).
- Bereiten Sie die Fluo-3 AM-Stammlösung vor, indem Sie 44 μl 20 % pluronisches F-127 in wasserfreiem DMSO zu 50 μg Fluo-3AM hinzufügen (kann bei -20 °C lichtgeschützt gelagert werden).
- 10 μl Fluo-3 AM-Stammlösung zu 1 ml Zellsuspension geben und 10 min bei lichtgeschützter Raumtemperatur inkubieren.
- Bei 5 x g 1 min zentrifugieren.
- Entsorgen Sie den Überstand mit einer Pasteurpipette aus Kunststoff und resuspendieren Sie das Pellet in einer angemessenen Menge Badlösung, um eine gute Arbeitskonzentration zu erzielen (1-5 ml Badlösung, je nach Zelldichte).
- 30 Minuten zur Entesterung einwirken lassen, bevor Sie mit den Experimenten beginnen.
6. Simultane Patch-Clamp- und epifluoreszierendeCa2+-Transientenmessungen wie zuvor beschrieben16
HINWEIS: Patch-Clamp-Messungen sind nicht das Thema dieses Artikels, der interessierte Leser kann auf wichtige Publikationen verwiesen werden, die diese Methode ausführlich beschreiben 17,18,19,20,21,22. Nichtsdestotrotz wird zum besseren Gesamtverständnis eine Zusammenfassung eines Protokolls zur Messung von L-Typ-Kalziumströmen zusammen mit strominduzierten Kalziumtransienten bereitgestellt.
- Die Myozyten werden in eine Zellkammer überführt und mit einer Badelösung bei 37 °C überflossen.
- Blockieren Sie Kaliumströme, indem Sie der Badelösung 4-Aminopyridin und Bariumchlorid hinzufügen, wie in Tabelle 5 angegeben.
- Stellen Sie sicher, dass Borosilikat-Mikroelektroden einen Spitzenwiderstand von 2-5 MΩ aufweisen, die mit Pipettenlösung gefüllt sind (Tabelle 6).
- Setup-Messungen, um die gleichzeitige Aufzeichnung von elektrischen Signalen und Epifluoreszenz zu ermöglichen. Der Voltage-Clamp-Modus wird verwendet, um den L-Typ Ca2+-Strom mit einem Protokoll zu messen, das die Zelle bei -80 mV hält, und einem 600 ms Rampenimpuls auf -40 mV, um den schnellen Na+-Strom zu inaktivieren, gefolgt von einem 100 ms Testimpuls auf +10 mV bei 0,5 Hz (Abbildung 2).
- Verwenden Sie Anregung bei 488 nm, emittiertes Licht bei <520 nm, um es zu detektieren und in [Ca2+]I umzuwandeln, unter der Annahme, dass
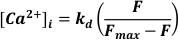
Dabei ist kd = Dissoziationskonstante von Fluo-3 (864 nM), F = Fluo-3-Fluoreszenz; Fmax = Ca2+-gesättigte Fluoreszenz, die am Ende jedes Experiments19 erhalten wurde.
Ergebnisse
Die Isolationsausbeute wird nach der Wiedereinführung von Calcium bestimmt, indem 10 μl Zellsuspension auf einen Objektträger pipettiert werden. Mehr als 100 lebensfähige, stäbchenförmige, nicht kontrahierende Zellen/10 μl für die Isolierung von Vorhofzellen und mehr als 1.000 lebensfähige, stäbchenförmige, nicht kontrahierende Zellen/10 μl für die Isolierung ventrikulärer Zellen gelten als ausreichende Ausbeute und werden üblicherweise mit diesem Protokoll gewonnen. Vorhofzellen, die mit diesem Protokoll ...
Diskussion
Dieser Artikel bietet eine einfache und funktionelle Möglichkeit, qualitativ hochwertige atriale und ventrikuläre Myozyten von derselben Maus für Patch-Clamp-Studien mit gleichzeitigen transienten Kalziumableitungen zu erhalten. Die Qualität der gewonnenen Daten hängt stark von der Qualität der Zellisolierung ab. Wie oben erwähnt, wurden bereits viele Verfahren zur Isolierung von murinen Kardiomyozyten beschrieben 9,10,11,12.
Offenlegungen
Nichts
Danksagungen
Diese Arbeit wurde gefördert von der Deutschen Forschungsgemeinschaft (DFG; Clinician Scientist Program In Vascular Medicine (PRIME), MA 2186/14-1 an P. Tomsits und D. Schüttler; VO1568/3-1, IGK 1816 und SFB1002 Projekt A13 bis N. Voigt), Deutsche Forschungsgemeinschaft im Rahmen der Exzellenzstrategie des Bundes und der Länder (EXC 2067/1- 390729940 an N. Voigt), Deutsches Zentrum für Herz-Kreislauf-Forschung (DZHK; 81X2600255 an S. Clauss und N. Voigt; 81Z0600206 an S. Kääb), die Corona-Stiftung (S199/10079/2019 an S. Clauss), das ERA-NET on Cardiovascular Diseases (ERA-CVD; 01KL1910 an S. Clauss), die Heinrich-und-Lotte-Mühlfenzl-Stiftung (an S. Clauss) und die Else-Kröner-Fresenius-Stiftung (EKFS 2016_A20 an N. Voigt). Die Geldgeber spielten bei der Vorbereitung des Manuskripts keine Rolle.
Materialien
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
Referenzen
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106 (2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588 (2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224 (2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688 (2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145 (2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227 (2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235 (2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten