需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
分离高质量鼠心房和心室肌细胞,同时测量 Ca2+ 瞬变和 L 型钙电流
* 这些作者具有相同的贡献
摘要
小鼠模型允许研究心律失常发生的关键机制。为此,需要高质量的心肌细胞来进行膜片钳测量。这里描述了一种通过逆行基于酶的Langendorff灌注分离鼠心房和心室肌细胞的方法,该方法允许同时测量钙瞬变和L型钙电流。
摘要
小鼠模型在心律失常研究中起着至关重要的作用,并允许研究心律失常发生的关键机制,包括离子通道功能的改变和钙处理。为此,需要高质量的心房或心室心肌细胞来进行膜片钳测量或探索钙处理异常。然而,通过当前分离方案获得的高质量心肌细胞的有限产量不允许在同一只小鼠中进行两次测量。本文描述了一种通过逆行基于酶的Langendorff灌注分离高质量鼠心房和心室肌细胞的方法,以便随后同时测量一只动物的钙瞬变和L型钙电流。获得小鼠心脏,并迅速插管主动脉以去除血液。然后首先用无钙溶液(37°C)灌注心脏以在插层盘水平上解离组织,然后用含有少量钙的酶溶液破坏细胞外基质(37°C)。消化的心脏随后被解剖成心房和心室。将组织样品切成小块,并通过小心地上下移液溶解。停止酶消化,并逐步将细胞重新引入生理钙浓度。用荧光Ca2+指示剂加载后,制备分离的心肌细胞,用于同时测量钙电流和瞬变。此外,还讨论了隔离陷阱,并提供了膜片钳方案和L型钙电流的代表性迹线,同时在如上所述分离的心房和心室鼠肌细胞中进行钙瞬时测量。
引言
心律失常很常见,也是当前主要的医疗保健挑战之一,因为它们影响着全球数百万人。心律失常与高发病率和死亡率有关1,2,是大多数心脏性猝死的根本原因3。最新的治疗方案提高了患者的生存率,但仍然主要是对症治疗,而不是针对潜在的机制。因此,这些治疗的疗效有限,并且可能经常引起严重的副作用4,5,6。当前治疗方案的改进需要深入了解潜在的病理生理学,从而需要合适的模型进行研究。小动物模型 - 特别是小鼠模型 - 在心律失常研究中起着至关重要的作用,因为它们可以研究心律失常发生的关键机制,例如对细胞电生理学,离子通道功能或钙处理的遗传影响7,8。
为此,需要足够数量和活力的孤立心房和心室心肌细胞。先前已经描述了获得心房和心室肌细胞的广谱不同分离方法9,10,11,12,13,并且一些小组提供了同时测量来自心房14或心室15的L型电流和钙电流诱导的钙瞬变的数据鼠心肌细胞。然而,据我们所知,没有一种动物的心房和心室测量数据。研究人员专注于各种各样的主题,从电生理学到蛋白质组学,细胞收缩力或蛋白质相互作用的功能研究,线粒体功能或遗传学 - 所有这些都需要分离的心肌细胞。因此,许多已发表的方案尚未专门针对膜片钳研究开发,导致膜片钳研究的产量有限且细胞质量不足。因此,不能使用既定的方案对从一只动物分离的心房和心室细胞同时进行膜片钳和钙瞬时测量。
分离鼠(尤其是心房)肌细胞进行膜片钳实验仍然具有挑战性。本文提供了一种简单快速的方法,通过基于逆行酶的Langendorff灌注分离高质量的鼠心房和心室肌细胞,随后可以同时测量一只动物的净膜电流和电流诱导的钙瞬变。本文详细阐述了分离来自野生型小鼠和携带基因突变的小鼠的心房和心室肌细胞的方案。该协议可用于雄性和雌性小鼠。下面描述的肌细胞分离,图像和代表性结果是从6(±1)个月大的野生型C57Bl / 6小鼠中获得的。然而,该方案已成功用于具有不同基因型的2至24个月不同年龄的小鼠。 图1 显示了酶灌注过程中分离设置和空心的特写。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有动物程序均由下萨克森州动物审查委员会(LAVES,AZ-18/2900)批准,并按照所有机构,国家和国际动物福利指南进行。
1. 预先安排
- 准备 1 L 10x 灌注缓冲液(表 1)、500 mL 1x 灌注缓冲液(表 2)、50 mL 消化缓冲液(表 3)、10 mL 终止缓冲液(表 4)、1 L Tyrode 溶液(表 5)、10 mL 每个钙阶梯溶液(含葡萄糖和相应钙量的 Tyrode 溶液,如所示), 根据提供的配方,1 L 4-AP 溶液(表 5)、100 mL 移液器溶液(表 6)和 5 mL 普鲁龙酸。
注意:可以提前制备浴溶液(Tyrode和4-AP溶液)(不含葡萄糖)并储存在+ 4°C,在实验日加入葡萄糖。移液器溶液可储存在-20°C,在实验当天加入钙指示剂,然后将溶液储存在冰上直至进一步使用。10x灌注缓冲液可在室温下储存,1x灌注缓冲液,消解缓冲液和停止缓冲液应在实验当天新鲜制备。 - 打开水浴和滚筒泵。
- 用灌注缓冲液预填充朗根多夫装置;确保它是无空气的。
- 通过将主动脉套管固定在解剖显微镜下来制备主动脉套管,用装有灌注缓冲液的 1 mL 注射器连接,并通过冲洗套管来清洁空气。
注意:避免灌注系统内有任何空气至关重要,因为这将直接影响冠状动脉灌注,从而影响消化效果。如有必要,可以在设置中添加气泡捕集器,以安全地避免任何空气滞留。 - 用足够的灌注缓冲液准备培养皿,用于器官收集和显微镜检查(缓冲液应牢固地覆盖整个器官,几毫升 - 取决于使用的培养皿大小 - 应该足够)。
- 用消化缓冲液准备3个培养皿,用于组织解离和显微镜检查,缓冲液应覆盖器官,以便在相应的培养皿内的显微镜下解剖,数量取决于使用的培养皿大小。对于解离,心室组织使用 3 mL,心房组织使用 1.5 mL。
2. 摘取器官
- 使用带有27G套管的1mL注射器将小鼠与0.1mL肝素(1,000U / mL)腹腔注射,并等待5-10分钟。
- 将小鼠与浸泡在约500μL异氟醚中的小组织一起放入诱导室中。动物不应与组织接触。为了避免这种情况,可以使用塑料活检包埋盒来覆盖组织。一旦动物完全麻醉,检查脚趾捏反射,一旦它不再存在,就通过颈椎脱位迅速对小鼠实施安乐死。
- 将鼠标放在其背部的平台上(例如,在用纸巾覆盖的聚苯乙烯泡沫塑料上),并用套管固定爪子以将其固定到位。
- 用剪刀从颈静脉向联合的清晰切口去除覆盖胸部和部分腹部的皮毛和皮肤,并在剑突下方打开腹部,而不会伤害任何器官结构。用手术钳抬起胸骨,用剪刀沿着肋骨边缘剪断横膈膜,然后在腋窝内侧线切割肋骨并取出肋骨以露出心脏。
- 使用钝钳小心地取出心包,并通过用钝钳从下方提起心脏并用剪刀一次切割大血管来快速取出心脏。
- 将心脏放入室温灌注缓冲液中,并在显微镜下尽快用钝端针插管主动脉。
注意:去除附着在器官上的任何肺组织和脂肪组织,而不会在其上浪费太多时间。插管时,请确保针头末端不会穿过主动脉瓣,因为这会阻止缓冲液进入冠状动脉,从而损害结果。 - 用一块缝合丝将心脏牢固地绑在针头上,然后断开注射器。
注意:从获得心脏(大血管被切断的那一刻)到将主动脉缝合到针头上的整个过程应花费尽可能少的时间。建议从取出心脏到开始灌注的时间不要超过90-180秒。
3. 酶消化
- 主动脉插管后,立即将空心连接到朗根道夫装置,避免任何空气进入系统。
注意:在Langendorff装置的底部悬挂一滴灌注缓冲液,并在针头顶部放置一滴灌注缓冲液,以避免任何空气进入系统,这很有帮助。 - 在正好37°C的温度和恰好4mL / min的灌注速率下用灌注缓冲液灌注心脏1分钟。
注意:为了使灌注针尖的温度为37°C,水浴温度必须设置为略高于约40°C。 应通过测量灌注尖端的温度来定期测试。 - 将灌注切换到消化缓冲液并在正好 37 °C 的温度和正好 4 mL/min 的灌注速率下灌注正好 9 分钟。
- 将消化的心脏转移到具有足够消化缓冲液的培养皿中,以使其完全覆盖。然后在显微镜下仔细解剖心房和心室。
- 将心房转移到装有 1.5 mL 消化缓冲液的培养皿中,将心室转移到另一个装有 3 mL 消化缓冲液的培养皿中。
- 心房夹层
- 小心地,但不浪费时间,使用钝钳将心房拉开成小块。
- 使用 1,000 μL 移液器吸头小心地上下移液来溶解组织,该吸头之前已被切割以扩大吸头开口。
- 将溶液转移到 15 mL 离心管中,并通过小心地从管侧面移液以结束反应,加入等量的终止缓冲液 (1.5 mL)。
- 小心地将所有 3 mL 细胞/组织溶液通过 200 μm 尼龙网,以去除尚未完全消化的剩余较大组织碎片。
注意:成功的消化几乎不会留下任何固体块。
- 心室夹层
- 使用解剖剪刀快速将心室组织切成小块,上下移液以溶解。使用另一个 1,000 μL 移液器吸头上下移液,可以缩短以扩大开口。
- 将细胞/组织溶液转移到 15 mL 离心管中,并通过小心地从管侧面移液以结束反应,加入等量的终止缓冲液 (3 mL)。
- 小心地将所有 6 mL 细胞/组织溶液通过 200 μm 尼龙网,以去除尚未完全消化的较大组织碎片。
注意:成功的消化几乎不会留下任何固体块。
- 将两个管(心房和心室细胞悬液)在室温下在工作台上放置6分钟以沉淀。
- 将两个 15 mL 管以 5 x g 离心 2 分钟。
4. 钙再引入
注意:以下步骤对于心房和心室细胞(除非另有说明)是相同的,并且在室温下进行。
- 使用塑料巴斯德移液管弃去上清液,并小心地将沉淀重悬于10mL无钙Tyrode溶液中。
- 让细胞沉降8分钟。
- 以5× g 离心1分钟(仅心房细胞,沉降足以用于心室细胞)。
- 弃去上清液,小心地将沉淀重悬于100μM钙浓度的10mL Tyrode溶液中。
- 让细胞沉降8分钟。
- 以5× g 离心1分钟(仅心房细胞,沉降足以用于心室细胞)。
- 弃去上清液,小心地将沉淀重悬于10mL钙浓度为400μM的Tyrode溶液中。
- 让细胞沉降8分钟。
- 以5× g 离心1分钟(仅心房细胞,沉降足以用于心室细胞)。
- 弃去上清液,小心地将沉淀重悬于1mL(心房)/ 5mL(心室)的Tyrode溶液中,钙浓度为1mM。
5.用荧光钙指示剂Fluo-3 AM加载肌细胞
注意:由于荧光钙指示剂的光敏性,应执行以下步骤,避光(例如,用铝箔覆盖管)。
- 通过将 44 μL 20% 多朗 F-127 无水 DMSO 添加到 50 μg Fluo-3AM 中(可在避光下储存在 -20 °C 中)来制备 Fluo-3 AM 储备溶液。
- 将 10 μL Fluo-3 AM 储备溶液加入 1 mL 细胞悬液中,并在室温避光下孵育 10 分钟。
- 以5× g 离心1分钟。
- 使用塑料巴斯德移液管弃去上清液,并将沉淀重悬于合理量的浴液中,以获得良好的工作浓度(1-5mL浴液,取决于细胞密度)。
- 在开始实验之前,静置30分钟进行脱酯。
6. 如前所述同时膜片钳和落射荧光 Ca2+ 瞬态测量16
注意:膜片钳测量不是本文的主题,感兴趣的读者可以参考主要出版物,其中提供了该方法的深入描述17,18,19,20,21,22。然而,为了更好地理解,提供了测量L型钙电流以及电流诱导的钙瞬变的协议摘要。
- 将肌细胞转移到细胞室中,并在37°C下用浴液过度融合。
- 如 表5所示,通过在浴液中加入4-氨基吡啶和氯化钡来阻断钾电流。
- 确保硼硅酸盐微电极的尖端电阻为2-5 MΩ,填充有移液器溶液(表6)。
- 设置测量以允许同时记录电信号和落射荧光。电压钳位模式用于测量 L 型Ca 2+ 电流,协议将电池保持在 -80 mV,600 ms 斜坡脉冲保持在 -40 mV 以停用快速 Na+ 电流,然后在 0.5 Hz 时将 100 ms 测试脉冲保持在 +10 mV(图 2)。
- 使用488 nm处的激发,在<520 nm处发射的光进行检测并转换为[Ca2+]I 假设
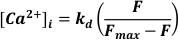
其中 kd = Fluo-3的解离常数(864 nM), F = Fluo-3荧光; Fmax = 在每个实验结束时获得的Ca 2+ 饱和荧光19.
Access restricted. Please log in or start a trial to view this content.
结果
通过将 10 μL 细胞悬液移液到显微镜载玻片上,在重新引入钙后确定分离产量。超过 100 个活的杆状非收缩细胞/10 μL 用于心房细胞分离和超过 1,000 个活的杆状、非收缩细胞/10 μL 用于心室细胞分离被认为是足够的产量,并且通常使用此协议获得。通过该方案获得的心房细胞显示出各种不同的细胞类型,其中包含心脏传导系统的细胞,特别是窦房结,以及来自左右心房以及心耳的不同肌细胞。由?...
Access restricted. Please log in or start a trial to view this content.
讨论
本文提供了一种简单实用的方法来从同一只小鼠获得高质量的心房和心室肌细胞,用于膜片钳研究,同时进行钙瞬时记录。所获得数据的质量在很大程度上取决于细胞分离的质量。如上所述,许多分离小鼠心肌细胞的方法已在前面描述9,10,11,12。分离的细胞用于各种分析,从膜片钳实验到收缩力研...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有
致谢
这项工作得到了德国研究基金会(DFG;血管医学临床科学家计划(PRIME),MA 2186/14-1至P. Tomsits和D. Schüttler;VO1568/3-1、IRTG1816 和 SFB1002 项目 A13 至 N. Voigt)、德国卓越战略下的德国研究基金会(EXC 2067/1- 390729940 至 N. Voigt)、德国心血管研究中心(DZHK;81X2600255 至 S. Clauss 和 N. Voigt;81Z0600206 至 S. Kääb)、科罗纳基金会(S199/10079/2019 至 S. Clauss)、ERA-NET 心血管疾病(ERA-CVD; 01KL1910 至 S. Clauss), Heinrich-and-Lotte-Mühlfenzl Stiftung(致S. Clauss)和Else-Kröner-Fresenius基金会(EKFS 2016_A20致N. Voigt)。资助者在手稿准备中没有任何作用。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
参考文献
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106(2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588(2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224(2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688(2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145(2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227(2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235(2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464(2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890(2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。