Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение высококачественных предсердных и желудочковых миоцитов мышей для одновременного измерения переходных процессов Ca2+ и кальциевого тока L-типа
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мышиные модели позволяют изучать ключевые механизмы аритмогенеза. Для этого необходимы высококачественные кардиомиоциты для проведения измерений патч-зажимом. Здесь описан метод выделения предсердных и желудочковых миоцитов мышей с помощью ретроградной ферментной перфузии Лангендорфа, который позволяет одновременно измерять кальциевые переходные процессы и кальциевый ток L-типа.
Аннотация
Мышиные модели играют решающую роль в исследованиях аритмии и позволяют изучать ключевые механизмы аритмогенеза, включая изменение функции ионных каналов и обращение с кальцием. Для этого необходимы высококачественные кардиомиоциты предсердий или желудочков для проведения измерений с помощью пластыря или для изучения аномалий обработки кальция. Однако ограниченный выход высококачественных кардиомиоцитов, полученных с помощью современных протоколов выделения, не позволяет проводить оба измерения на одной и той же мыши. В данной статье описывается метод выделения высококачественных предсердных и желудочковых миоцитов мышей с помощью ретроградной ферментной перфузии Лангендорфа для последующих одновременных измерений кальциевых переходных процессов и кальциевого тока L-типа у одного животного. Получаются мышиные сердца, а аорта быстро канюлируется для удаления крови. Затем сердца сначала перфузируют раствором, не содержащим кальция (37 ° C), чтобы диссоциировать ткань на уровне интеркалированных дисков, а затем раствором фермента, содержащим мало кальция, для разрушения внеклеточного матрикса (37 ° C). Переваренное сердце впоследствии рассекается на предсердия и желудочки. Образцы тканей измельчают на мелкие кусочки и растворяют путем осторожного пипетирования вверх и вниз. Ферментативное переваривание прекращается, и клетки постепенно возвращаются к физиологическим концентрациям кальция. После загрузки флуоресцентным Са2+-индикатором выделяют выделенные кардиомиоциты для одновременного измерения кальциевых токов и переходных процессов. Кроме того, обсуждаются подводные камни изоляции и предоставляются протоколы патч-зажима и репрезентативные следы кальциевых токов L-типа с одновременными переходными измерениями кальция в предсердных и желудочковых мышиных миоцитах, изолированных, как описано выше.
Введение
Сердечные аритмии являются распространенным явлением и одной из основных проблем здравоохранения в настоящее время, поскольку они затрагивают миллионы людей во всем мире. Аритмии связаны с высокой заболеваемостью и смертностью 1,2 и представляют собой основную причину большинства внезапных сердечных смертей3. Современные варианты лечения улучшили выживаемость пациентов, но по-прежнему в основном являются симптоматическими методами лечения, а не нацелены на основные механизмы. Таким образом, эти методы лечения имеют ограниченную эффективность и часто могут вызывать серьезные побочные эффекты 4,5,6. Улучшение существующих вариантов лечения требует понимания лежащей в основе патофизиологии, что создает потребность в подходящих моделях для изучения. Модели мелких животных - и особенно модели мышей - играют решающую роль в исследованиях аритмии, поскольку они позволяют изучать ключевые механизмы аритмогенеза, например, генетическое влияние на клеточную электрофизиологию, функцию ионных каналов или обработку кальция 7,8.
Для этого требуются изолированные предсердные и желудочковые кардиомиоциты достаточного количества и жизнеспособности. Ранее был описан широкий спектр различных подходов к выделению для получения предсердных и желудочковых миоцитов 9,10,11,12,13, а некоторые группы представили данные одновременных измерений кальциевых переходных процессов L-типа и кальциевых токов либо из предсердий 14, либо из желудочков 15 мышиные кардиомиоциты. Однако, насколько нам известно, нет данных об измерениях предсердий и желудочков у одного животного. Исследователи сосредотачиваются на широком спектре тем, начиная от электрофизиологии и заканчивая протеомикой, функциональными исследованиями, такими как сократимость клеток или белковые взаимодействия, функция митохондрий или генетика - все это нуждается в изолированных кардиомиоцитах. Таким образом, многие из опубликованных протоколов не были специально разработаны для исследований пластырного зажима, что приводит к ограниченному выходу и недостаточному качеству клеток для исследований пластырного зажима. Таким образом, одновременные пластырные зажимы и кальциевые переходные измерения клеток предсердий и желудочков, выделенных от одного животного, не могут быть выполнены с установленными протоколами.
Выделение мышиных, особенно предсердных, миоцитов для экспериментов с пластырем остается сложной задачей. В этой статье представлен простой и быстрый метод выделения высококачественных предсердных и желудочковых миоцитов мышей с помощью ретроградной ферментной перфузии Лангендорфа, который впоследствии позволяет одновременно измерять как чистый мембранный ток, так и ток-индуцированные кальциевые переходные процессы у одного животного. В данной статье разработан протокол выделения предсердных и желудочковых миоцитов, полученных от мышей дикого типа и мышей, несущих генетические мутации. Этот протокол можно использовать как для самцов, так и для самок мышей. Выделение миоцитов, изображения и репрезентативные результаты, описанные ниже, были получены от мышей дикого типа C57Bl/6 в возрасте 6 (± 1) месяцев. Тем не менее, этот протокол успешно используется для мышей в разном возрасте от 2 до 24 месяцев с разными генотипами. На рисунке 1 показана установка изоляции и крупный план канюлированного сердца во время ферментной перфузии.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры на животных были одобрены Советом по надзору за животными Нижней Саксонии (LAVES, AZ-18/2900) и проводились в соответствии со всеми институциональными, национальными и международными рекомендациями по благополучию животных.
1. Предварительные договоренности
- Приготовьте 1 л 10-кратного перфузионного буфера (Таблица 1), 500 мл 1-кратного перфузионного буфера (Таблица 2), 50 мл буфера для разложения (Таблица 3), 10 мл стоп-буфера (Таблица 4), 1 л раствора Тирода (Таблица 5), 10 мл каждого раствора на стадии кальция (раствор Тирода с глюкозой и соответствующим количеством кальция, как указано), 1 л раствора 4-АП (таблица 5), 100 мл раствора пипетки (таблица 6) и 5 мл плюроновой кислоты согласно предоставленным рецептам.
ПРИМЕЧАНИЕ: Растворы для ванн (Тирод и раствор 4-АП) можно приготовить заранее (без глюкозы) и хранить при температуре +4 °С, глюкозу добавляют в день эксперимента. Раствор пипетки можно хранить при -20 °C, в день эксперимента добавляют кальциевый индикатор, а затем хранят раствор на льду до дальнейшего использования. 10-кратный буфер для перфузии можно хранить при комнатной температуре, 1-кратный буфер для перфузии, буфер для разложения и буфер для остановки должны быть свежеприготовлены в экспериментальный день. - Включите водяную баню и роликовый насос.
- Аппарат Лангендорфа с перфузионным буфером; Убедитесь, что он свободен от воздуха.
- Подготовьте канюлю аорты, зафиксировав ее под диссекционным микроскопом, соедините со шприцем объемом 1 мл, наполненным буфером для перфузии, и очистите канюлю воздухом, промыв канюлю.
ПРИМЕЧАНИЕ: Крайне важно избегать попадания воздуха внутрь перфузионной системы, так как это напрямую повлияет на коронарную перфузию и, следовательно, на эффективность пищеварения. При необходимости к установке может быть добавлена пузырьковая ловушка, чтобы безопасно избежать захвата воздуха. - Подготовьте чашки Петри с достаточным количеством перфузионного буфера для забора органов и микроскопии (буфер должен надежно покрывать весь орган, нескольких миллилитров - в зависимости от размера используемой чашки Петри - должно быть достаточно).
- Подготовьте 3 чашки Петри с буфером для разложения для диссоциации тканей и микроскопии, буфер должен покрывать орган для вскрытия под микроскопом в пределах соответствующей чашки Петри, количество зависит от размера используемой чашки Петри. Для диссоциации используют 3 мл для ткани желудочка и 1,5 мл для ткани предсердий.
2. Извлечение органов
- Введите мышке 0,1 мл гепарина (1000 ЕД / мл) внутримышечно с помощью шприца объемом 1 мл с канюлей 27 г и подождите 5-10 минут.
- Поместите мышь в индукционную камеру вместе с небольшой тканью, пропитанной примерно 500 мкл изофлурана. Животное не должно соприкасаться с тканями. Чтобы избежать этого, можно использовать пластиковую кассету для биопсии, чтобы покрыть ткань. После того, как животное будет полностью обезболено, проверьте рефлекс защемления пальцев ног и, как только его больше нет, быстро усыпьте мышь вывихом шейки матки.
- Поместите мышь на платформу на спину (например, на пенополистирол, покрытый бумажным полотенцем) и зафиксируйте лапы канюлями, чтобы удерживать ее на месте.
- Удалите мех и кожу, покрывающие грудь и часть живота, с четким разрезом от jugulum к симфизу, и вскройте живот прямо под мечевидной костью, не повреждая структуру органа с помощью ножниц. Поднимите грудину хирургическими щипцами и разрежьте ножницами диафрагму по краю ребер, затем разрежьте ребра по медиальной подмышечной линии и удалите грудную клетку, чтобы обнажить сердце.
- Осторожно удалите перикард с помощью тупых щипцов и быстро удалите сердце, приподняв его тупыми щипцами снизу и разрезав крупные сосуды одним единственным разрезом с помощью ножниц.
- Поместите сердце в перфузионный буфер комнатной температуры и как можно быстрее канюлизируйте аорту иглой с тупым концом под микроскопом.
ПРИМЕЧАНИЕ: Удалите любую легочную ткань и жировую ткань, прикрепленную к органу, не теряя на это слишком много времени. Во время канюляции убедитесь, что конец иглы не проходит через аортальный клапан, так как это ухудшит результаты, предотвращая попадание буферов в коронарные артерии. - Плотно привяжите сердце кусочком шовного шелка к игле и отсоедините от шприца.
ПРИМЕЧАНИЕ: Вся процедура от извлечения сердца (момента, когда перерезаны крупные сосуды) до ушивания аорты иглой должна занимать как можно меньше времени. Рекомендуется не занимать более 90-180 секунд от удаления сердца до начала перфузии.
3. Ферментативное пищеварение
- После канюляции аорты немедленно подключите канюлированное сердце к аппарату Лангендорфа, избегая попадания воздуха в систему.
ПРИМЕЧАНИЕ: Может помочь наличие подвесной капли перфузионного буфера в нижней части аппарата Лангендорфа, а также капли перфузионного буфера, расположенного на верхней части иглы, чтобы избежать попадания воздуха в систему. - Перфузию сердца перфузионным буфером в течение 1 мин при температуре ровно 37 °C и скорости перфузии ровно 4 мл/мин.
ПРИМЕЧАНИЕ: Для того, чтобы температура на кончике перфузионной иглы составляла 37 °C, температура водяной бани должна быть установлена немного выше примерно 40 °C. Это следует регулярно проверять, измеряя температуру на перфузионном кончике. - Переключите перфузию на буфер для разложения и перфузию в течение ровно 9 минут при температуре ровно 37 °C и скорости перфузии ровно 4 мл/мин.
- Переложите переваренное сердце в чашку Петри с достаточным буфером для пищеварения, чтобы оно было полностью покрыто. Затем тщательно препарируют предсердия и желудочки под микроскопом.
- Перенесите предсердия в чашку Петри с 1,5 мл буфера для пищеварения, а желудочки - в другую чашку Петри с 3 мл буфера для пищеварения.
- Расслоение предсердий
- Аккуратно, но не теряя времени, раздвиньте предсердия на мельчайшие кусочки с помощью тупых щипцов.
- Растворите ткань, осторожно пипеткой вверх и вниз с помощью наконечника пипетки объемом 1,000 мкл, который предварительно был разрезан, чтобы расширить отверстие наконечника.
- Перенесите раствор в центрифужную пробирку объемом 15 мл и добавьте эквивалентное количество стоп-буфера (1,5 мл), осторожно пипеткой вниз сбоку от пробирки, чтобы закончить реакцию.
- Осторожно пропустите все 3 мл клеточных/тканевых растворов через нейлоновую сетку 200 мкм, чтобы удалить оставшиеся более крупные кусочки ткани, которые не были полностью переварены.
ПРИМЕЧАНИЕ: Успешное пищеварение почти не оставит твердых кусков.
- Диссекция желудочков
- Быстро измельчите желудочковую ткань на мелкие кусочки с помощью ножниц для рассечения и пипетки вверх и вниз, чтобы растворить. Используйте другой наконечник пипетки объемом 1,000 мкл для пипетки вверх и вниз, его можно укоротить, чтобы расширить отверстие.
- Перенесите клеточный/тканевый раствор в центрифужную пробирку объемом 15 мл и добавьте эквивалентное количество стоп-буфера (3 мл), осторожно пипетировав сбоку пробирки, чтобы закончить реакцию.
- Осторожно пропустите все 6 мл клеточного/тканевого раствора через нейлоновую сетку размером 200 мкм, чтобы удалить более крупные кусочки ткани, которые не были полностью переварены.
ПРИМЕЧАНИЕ: Успешное пищеварение почти не оставит твердых кусков.
- Оставьте обе трубки (суспензию предсердных и желудочковых клеток) на скамье при комнатной температуре на 6 минут для отстаивания.
- Центрифугируйте обе пробирки по 15 мл в дозе 5 x g в течение 2 мин.
4. Реинтродукция кальция
ПРИМЕЧАНИЕ: Следующие шаги идентичны как для предсердных, так и для желудочковых клеток (если не указано иное) и выполняются при комнатной температуре.
- Откажитесь от надосадочной жидкости с помощью пластиковой пипетки Пастера и осторожно ресуспендируйте гранулы в 10 мл раствора Tyrode, не содержащего кальция.
- Оставьте клетки на 8 мин для отстаивания.
- Центрифуга в дозе 5 х г в течение 1 мин (только предсердные клетки, для желудочковых клеток достаточно седиментации).
- Выбросьте надосадочную жидкость и осторожно ресуспендируйте гранулы в 10 мл раствора Tyrode с концентрацией кальция 100 мкМ.
- Оставьте клетки на 8 мин для отстаивания.
- Центрифуга в дозе 5 х г в течение 1 мин (только предсердные клетки, для желудочковых клеток достаточно седиментации).
- Выбросьте надосадочную жидкость и осторожно ресуспендируйте гранулы в 10 мл раствора Tyrode с концентрацией кальция 400 мкМ.
- Оставьте клетки на 8 мин для отстаивания.
- Центрифуга в дозе 5 х г в течение 1 мин (только предсердные клетки, для желудочковых клеток достаточно седиментации).
- Выбросьте надосадочную жидкость и осторожно ресуспендируйте гранулу в 1 мл (предсердие) / 5 мл (желудочковый) раствора Тирода с концентрацией кальция 1 мМ.
5. Загрузка миоцитов флуоресцентным кальциевым индикатором Флуо-3 АМ
ПРИМЕЧАНИЕ: Из-за светочувствительности флуоресцентного кальциевого индикатора следующие шаги следует выполнять в защищенном от света (например, накрыв трубки алюминиевой фольгой).
- Приготовьте исходный раствор Fluo-3 AM, добавив 44 мкл 20% плюронового F-127 в безводном ДМСО к 50 мкг Fluo-3AM (можно хранить при -20 °C в защищенном от света месте).
- Добавьте 10 мкл исходного раствора Флуо-3 АМ к 1 мл клеточной суспензии и инкубируйте в течение 10 мин при комнатной температуре в защищенном от света месте.
- Центрифуга в дозе 5 х г в течение 1 мин.
- Откажитесь от надосадочной жидкости с помощью пластиковой пипетки Пастера и ресуспендируйте гранулы в разумном количестве раствора для ванны, чтобы получить хорошую рабочую концентрацию (1-5 мл раствора для ванны в зависимости от плотности клеток).
- Оставьте на 30 минут для деэтерификации перед началом экспериментов.
6. Одновременные измерения патч-зажима и эпифлуоресцентного переходного процесса Ca2+, как описано ранее16
ПРИМЕЧАНИЕ: Измерения пластыря не являются темой данной статьи, заинтересованный читатель может обратиться к основным публикациям, содержащим подробное описание этого метода 17,18,19,20,21,22. Тем не менее, для лучшего общего понимания приводится краткое изложение протокола измерения кальциевых токов L-типа вместе с индуцированными током кальциевыми переходными процессами.
- Переносят миоциты в клеточную камеру и переплавляют раствором для ванны при 37 °C.
- Блокируйте токи калия, добавляя 4-аминопиридин и хлорид бария в раствор для ванны, как указано в таблице 5.
- Убедитесь, что боросиликатные микроэлектроды имеют сопротивление наконечника 2-5 МОм, заполненные раствором пипетки (таблица 6).
- Настройка измерений позволяет одновременно регистрировать как электрические сигналы, так и эпифлуоресценцию. Режим зажима напряжения используется для измерения тока Ca2+ L-типа с протоколом, удерживающим ячейку на -80 мВ и импульсом от 600 мс до -40 мВ для инактивации быстрого тока Na+, за которым следует испытательный импульс 100 мс до +10 мВ при 0,5 Гц (рис. 2).
- Используйте возбуждение при длине волны 488 нм, излучаемый свет при длине волны <520 нм для обнаружения и преобразования в [Ca2+]I, предполагая, что
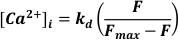
где kd = константа диссоциации флуоресценции-3 (864 нМ), F = флуоресценция флуоресценции-3; Fmax =Ca2+-насыщенная флуоресценция, полученная в конце каждого эксперимента19.
Access restricted. Please log in or start a trial to view this content.
Результаты
Выход выделения определяют после повторного введения кальция путем пипетки 10 мкл клеточной суспензии на предметное стекло микроскопа. Более 100 жизнеспособных, палочковидных, несокращающихся клеток / 10 мкл для выделения предсердных клеток и более 1000 жизнеспособных палочковидных, несо?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этой статье представлен простой и функциональный способ получения высококачественных миоцитов предсердий и желудочков от одной и той же мыши для исследований с помощью пластыря с одновременными записями переходных процессов кальция. Качество полученных данных сильно зависит от ка...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Никакой
Благодарности
Эта работа была поддержана Немецким научно-исследовательским обществом (DFG; Программа ученых-клиницистов в области сосудистой медицины (PRIME), MA 2186/14-1 для. Томсица и Д. Шюттлера; VO1568/3-1, IRTG1816 и SFB1002 проект A13 для Н. Фойгта), Немецкое научно-исследовательское общество в рамках Стратегии передового опыта Германии (EXC 2067/1-390729940 для Н. Фойгта), Немецкий центр сердечно-сосудистых исследований (DZHK; 81X2600255 для С. Клаусса и Н. Фойгта; 81Z0600206 для С. Кяэба), Фонд Corona (S199/10079/2019 для С. Клаусса), ERA-NET по сердечно-сосудистым заболеваниям (ERA-CVD; 01KL1910 для С. Клаусса), Фонд Генриха и Лотте-Мюльфенцль (С. Клаусс) и Фонд Эльзе-Крёнер-Фрезениус (EKFS 2016_A20 Н. Фойгту). Спонсоры не играли никакой роли в подготовке рукописи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
Ссылки
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106(2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588(2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224(2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688(2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145(2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227(2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235(2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464(2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890(2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены