É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de miócitos murinos atrial e ventricular de alta qualidade para medidas simultâneas de Ca2+ transitórios e corrente de cálcio tipo L
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Modelos murinos permitem estudar os principais mecanismos da arritmogênese. Para isso, cardiomiócitos de alta qualidade são necessários para a realização de medidas de patch-clamp. Aqui, é descrito um método para isolar miócitos murinos atriais e ventriculares via perfusão retrógrada de Langendorff baseada em enzimas, que permite medidas simultâneas de transientes de cálcio e corrente de cálcio tipo L.
Resumo
Modelos de camundongos desempenham um papel crucial na pesquisa de arritmias e permitem estudar mecanismos-chave da arritmogênese, incluindo função alterada do canal iônico e manipulação de cálcio. Para isso, cardiomiócitos atriais ou ventriculares de alta qualidade são necessários para realizar medidas de patch-clamp ou explorar anormalidades no manuseio do cálcio. No entanto, o rendimento limitado de cardiomiócitos de alta qualidade obtido pelos protocolos de isolamento atuais não permite ambas as medidas no mesmo camundongo. Este artigo descreve um método para isolar miócitos murinos atrial e ventricular de alta qualidade via perfusão retrógrada de Langendorff baseada em enzimas, para subsequentes medições simultâneas de transientes de cálcio e corrente de cálcio tipo L de um animal. Corações de camundongos são obtidos, e a aorta é rapidamente canulada para remover o sangue. Os corações são então inicialmente perfundidos com uma solução isenta de cálcio (37 °C) para dissociar o tecido ao nível dos discos intercalados e, posteriormente, com uma solução enzimática contendo pouco cálcio para romper a matriz extracelular (37 °C). O coração digerido é posteriormente dissecado em átrios e ventrículos. As amostras de tecido são picadas em pequenos pedaços e dissolvidas por pipetagem cuidadosa para cima e para baixo. A digestão enzimática é interrompida e as células são gradualmente reintroduzidas nas concentrações fisiológicas de cálcio. Após o carregamento com um indicador fluorescente de Ca2+, os cardiomiócitos isolados são preparados para a medição simultânea de correntes de cálcio e transientes. Além disso, armadilhas de isolamento são discutidas e protocolos de patch-clamp e traços representativos de correntes de cálcio do tipo L com medidas simultâneas de transientes de cálcio em miócitos murinos atriais e ventriculares isolados como descrito acima são fornecidos.
Introdução
As arritmias cardíacas são comuns e um dos grandes desafios atuais para a saúde, uma vez que afetam milhões de pessoas em todo o mundo. As arritmias estão associadas a alta morbidade e mortalidade 1,2 e representam a causa básica da maioria das mortes súbitas cardíacas3. As opções de tratamento atualizadas melhoraram a sobrevida do paciente, mas ainda são principalmente tratamentos sintomáticos em vez de visar os mecanismos subjacentes. Assim, esses tratamentos têm eficácia limitada e podem frequentemente causar efeitos colaterais graves 4,5,6. Uma melhoria das opções de tratamento atuais requer informações sobre a fisiopatologia subjacente, criando a necessidade de modelos adequados para estudo. Modelos de pequenos animais - e especificamente modelos de camundongos - desempenham um papel crucial na pesquisa de arritmias, pois permitem estudar mecanismos-chave da arritmogênese, por exemplo, o impacto genético na eletrofisiologia celular, na função dos canais iônicos ou no manuseio do cálcio 7,8.
Para isso, são necessários cardiomiócitos atriais e ventriculares isolados em quantidade e viabilidade suficientes. Um amplo espectro de diferentes abordagens de isolamento para obtenção de miócitos atriais e ventriculares foi previamente descrito9,10,11,12,13 e alguns grupos apresentaram dados de medidas simultâneas de transientes de cálcio induzidos pela corrente L e pela corrente de cálcio do átrio 14 ou ventricular15 cardiomiócitos murinos. No entanto, até onde sabemos, não há dados disponíveis de medidas atriais e ventriculares de um animal. Os pesquisadores se concentram em uma ampla variedade de tópicos que vão desde eletrofisiologia até proteômica, estudos funcionais como contratilidade celular ou interações proteicas, função mitocondrial ou genética – todos precisando de cardiomiócitos isolados. Muitos dos protocolos publicados, portanto, não foram desenvolvidos especificamente para estudos de patch clamp, levando a rendimentos limitados e qualidade celular insuficiente para estudos de patch clamp. Assim, medidas simultâneas de patch clamp e transiente de cálcio de células atriais e ventriculares isoladas de um animal não podem ser realizadas com protocolos estabelecidos.
O isolamento de miócitos murinos – especialmente atriais – para experimentos de patch clamp permanece desafiador. Este artigo fornece um método simples e rápido para o isolamento de miócitos murinos atrial e ventricular de alta qualidade via perfusão retrógrada de Langendorff baseada em enzimas, que subsequentemente permite medições simultâneas de transientes de cálcio induzidos pela corrente líquida e corrente de um animal. Este artigo elabora um protocolo para o isolamento de miócitos atriais e ventriculares derivados de camundongos selvagens e portadores de mutações genéticas. Este protocolo pode ser usado para camundongos machos e fêmeas. O isolamento de miócitos, as imagens e os resultados representativos descritos abaixo foram obtidos de camundongos selvagens C57Bl/6 com idade de 6 (± 1) meses. No entanto, este protocolo tem sido utilizado com sucesso em camundongos em várias idades variando de 2 a 24 meses com diferentes genótipos. A Figura 1 mostra o arranjo de isolamento e o close-up de um coração canulado durante a perfusão enzimática.
Protocolo
Todos os procedimentos com animais foram aprovados pelo Lower Saxony Animal Review Board (LAVES, AZ-18/2900) e conduzidos de acordo com todas as diretrizes institucionais, nacionais e internacionais de bem-estar animal.
1. Pré-arranjos
- Preparar 1 L de tampão de perfusão 10x (Tabela 1), 500 mL de tampão de perfusão 1x (Tabela 2), 50 mL de tampão de digestão (Tabela 3), 10 mL de tampão de parada (Tabela 4), 1 L de solução de Tyrode (Tabela 5), 10 mL de cada solução de etapa de cálcio (solução de Tyrode com glicose e respectiva quantidade de cálcio, conforme indicado), 1 L de solução de 4-AP (Tabela 5), 100 mL de solução de pipeta (Tabela 6) e 5 mL de ácido plurônico de acordo com as receitas fornecidas.
NOTA: As soluções de banho (Tyrode e solução 4-AP) podem ser preparadas (sem glicose) com antecedência e armazenadas a +4 °C, a glicose é adicionada no dia do experimento. A solução de pipeta pode ser armazenada a -20 °C, o indicador de cálcio é adicionado no dia experimental e a solução então armazenada em gelo até uso posterior. 10x tampão de perfusão pode ser armazenado à temperatura ambiente, 1x tampão de perfusão, tampão de digestão e tampão de parada devem ser preparados na hora no dia experimental. - Ligue o banho-maria e a bomba de roletes.
- Aparelho de Langendorff pré-preenchido com tampão de perfusão; Certifique-se de que está livre de ar.
- Preparar a cânula aórtica fixando-a sob o microscópio de dissecção, conectar com uma seringa de 1 mL preenchida com tampão de perfusão e ar puro enxaguando a cânula.
OBS: É fundamental evitar qualquer ar dentro do sistema de perfusão, pois isso afetará diretamente a perfusão coronariana e, consequentemente, a eficácia da digestão. Uma armadilha de bolhas pode ser adicionada à configuração, se necessário, para evitar com segurança qualquer aprisionamento de ar. - Prepare placas de Petri com tampão de perfusão suficiente para coleta de órgãos e microscopia (o tampão deve cobrir com segurança todo o órgão, alguns mililitros – dependendo do tamanho da placa de Petri usada – devem ser suficientes).
- Preparar 3 placas de Petri com tampão de digestão para dissociação tecidual e microscopia, tampão deve cobrir o órgão para dissecção sob o microscópio dentro da respectiva placa de Petri, quantidade depende do tamanho da placa de Petri utilizada. Para a dissociação utilizar 3 mL para tecido ventricular e 1,5 mL para tecido atrial.
2. Captação de órgãos
- Injetar 0,1 mL de heparina (1.000 U/mL) i.p. em camundongo usando uma seringa de 1 mL com cânula de 27 G e aguardar 5-10 min.
- Coloque o camundongo em uma câmara de indução junto com um pequeno tecido embebido em aproximadamente 500 μL de isoflurano. O animal não deve estar em contato com o tecido. Para evitar isso, pode-se usar um de plástico embutido em biópsia para cobrir o tecido. Uma vez que o animal esteja totalmente anestesiado, verifique se há reflexo de pinça do dedo do pé e, assim que ele não estiver mais presente, eutanasie rapidamente o camundongo por deslocamento cervical.
- Coloque o mouse em uma plataforma nas costas (por exemplo, em isopor coberto com um papel toalha) e fixe as patas com cânulas para mantê-lo no lugar.
- Remova o pelo e a pele que cobre o tórax e parte do abdômen com um corte claro da jugúgula em direção à sínfise e abra o abdome logo abaixo do xifoide sem ferir qualquer estrutura do órgão usando uma tesoura. Levante o esterno com pinça cirúrgica e corte o diafragma com tesoura ao longo da borda das costelas, depois corte as costelas na linha axilar medial e remova a caixa torácica para expor o coração.
- Remova cuidadosamente o pericárdio usando pinça romba e remova rapidamente o coração, levantando-o com pinça romba por baixo e cortando os grandes vasos com um único corte usando tesoura.
- Coloque o coração em tampão de perfusão à temperatura ambiente e canule a aorta com uma agulha romba sob o microscópio o mais rápido possível.
NOTA: Remova qualquer tecido pulmonar e tecido adiposo ligado ao órgão sem perder muito tempo nele. Ao canular, certifique-se de que a extremidade da agulha não se estenda através da válvula aórtica, pois isso prejudicará os resultados, impedindo que os tampões entrem nas artérias coronárias. - Amarre o coração com um pedaço de seda de sutura firmemente à agulha e desconecte da seringa.
NOTA: Todo o procedimento desde a obtenção do coração (momento em que os grandes vasos são cortados) até a sutura da aorta à agulha deve levar o menor tempo possível. Recomenda-se não demorar mais do que 90-180 s da remoção do coração até o início da perfusão.
3. Digestão enzimática
- Após a canulação da aorta, conectar imediatamente o coração canulado ao aparelho de Langendorff, evitando a entrada de ar no sistema.
NOTA: Pode ajudar a ter uma gota pendurada de tampão de perfusão na parte inferior do aparelho de Langendorff, bem como uma gota de tampão de perfusão na parte superior da agulha, a fim de evitar a entrada de ar no sistema. - Perfundir o coração com tampão de perfusão por 1 min a uma temperatura de exatamente 37 °C e uma taxa de perfusão de exatamente 4 mL/min.
NOTA: Para que a temperatura seja de 37 °C na ponta da agulha de perfusão, a temperatura em banho-maria deve ser ligeiramente superior a aproximadamente 40 °C. Isso deve ser testado regularmente, medindo a temperatura na ponta de perfusão. - Alternar a perfusão para o tampão de digestão e perfundir por exatamente 9 min a uma temperatura de exatamente 37 °C e uma taxa de perfusão de exatamente 4 mL/min.
- Transfira o coração digerido para uma placa de Petri com tampão de digestão suficiente para mantê-lo totalmente coberto. Em seguida, disseque cuidadosamente os átrios e ventrículos sob o microscópio.
- Transfira os átrios para uma placa de Petri com 1,5 mL de tampão de digestão e os ventrículos para outra placa de Petri com 3 mL de tampão de digestão.
- Dissecção atrial
- Com cuidado, mas sem perda de tempo, afaste os átrios em pequenos pedaços usando pinças rombas.
- Dissolva o tecido pipetando cuidadosamente para cima e para baixo usando uma ponta de pipeta de 1.000 μL, que foi previamente cortada para ampliar a abertura da ponta.
- Transfira a solução para um tubo de centrífuga de 15 ml e adicione uma quantidade equivalente de tampão de paragem (1,5 ml) pipetando cuidadosamente para baixo na lateral do tubo para terminar a reacção.
- Passe cuidadosamente todos os 3 mL de soluções celulares/teciduais através de uma malha de nylon de 200 μm para remover pedaços de tecido maiores remanescentes que não foram totalmente digeridos.
NOTA: Uma digestão bem-sucedida não deixará quase nenhum pedaço sólido.
- Dissecção ventricular
- Pique rapidamente o tecido ventricular em pequenos pedaços usando tesoura de dissecção e pipeta para cima e para baixo para dissolver. Use outra ponta de pipeta de 1.000 μL para pipetar para cima e para baixo, ela pode ser encurtada para ampliar a abertura.
- Transfira célula/solução de tecido para um tubo de centrífuga de 15 mL e adicione uma quantidade equivalente de tampão de parada (3 mL) pipetando cuidadosamente para baixo na lateral do tubo para encerrar a reação.
- Passe cuidadosamente todos os 6 mL de célula/solução de tecido através de uma malha de nylon de 200 μm para remover pedaços de tecido maiores que não foram totalmente digeridos.
NOTA: Uma digestão bem-sucedida não deixará quase nenhum pedaço sólido.
- Deixar ambos os tubos (suspensão de células atriais e ventriculares) no banco à temperatura ambiente por 6 min para assentar.
- Centrifugar ambos os tubos de 15 mL a 5 x g por 2 min.
4. Reintrodução do cálcio
NOTA: Os passos seguintes são idênticos para as células atriais e ventriculares (salvo indicação em contrário) e são realizados à temperatura ambiente.
- Eliminar o sobrenadante utilizando uma pipeta plástica de Pasteur e ressuspender cuidadosamente o pellet em 10 ml de solução de Tyrode sem cálcio.
- Deixar as células por 8 min para sedimentação.
- Centrifugar a 5 x g por 1 min (apenas células atriais, a sedimentação é suficiente para as células ventriculares).
- Eliminar o sobrenadante e ressuspender cuidadosamente o pellet em 10 ml de solução de Tyrode com concentração de cálcio de 100 μM.
- Deixar as células por 8 min para sedimentação.
- Centrifugar a 5 x g por 1 min (apenas células atriais, a sedimentação é suficiente para as células ventriculares).
- Eliminar o sobrenadante e ressuspender cuidadosamente o pellet em 10 ml de solução de Tyrode com concentração de cálcio de 400 μM.
- Deixar as células por 8 min para sedimentação.
- Centrifugar a 5 x g por 1 min (apenas células atriais, a sedimentação é suficiente para as células ventriculares).
- Eliminar o sobrenadante e ressuspender cuidadosamente o pellet em 1 ml (atrial)/ 5 ml (ventricular) de solução de Tyrode com concentração de cálcio a 1 mM.
5. Carga de miócitos com indicador de cálcio fluorescente Fluo-3 AM
NOTA: Devido à sensibilidade à luz do indicador de cálcio fluorescente, as seguintes etapas devem ser executadas protegidas da luz (por exemplo, cobrindo tubos com folha de alumínio).
- Preparar a solução-mãe de Fluo-3 AM adicionando 44 μL de F-127 plurónico a 20% em DMSO anidro a 50 μg de Fluo-3AM (pode ser armazenado a -20 °C protegido da luz).
- Adicionar 10 μL de solução-mãe de Fluo-3 AM a 1 ml de suspensão celular e incubar durante 10 minutos à temperatura ambiente protegida da luz.
- Centrifugar a 5 x g por 1 min.
- Descarte o sobrenadante usando uma pipeta plástica de Pasteur e ressuspenda o pellet em uma quantidade razoável de solução de banho para obter uma boa concentração de trabalho (1-5 mL de solução de banho, dependendo da densidade celular).
- Deixe por 30 min para desesterificação antes de iniciar os experimentos.
6. Medidas simultâneas de patch-clamp e Ca2+ transiente epifluorescente, conforme descrito anteriormente16
OBS: Medidas de patch clamp não são o tema deste artigo, o leitor interessado pode ser encaminhado para as principais publicações que fornecem descrições detalhadas deste método 17,18,19,20,21,22. No entanto, para uma melhor compreensão geral, um resumo sobre um protocolo para medir correntes de cálcio do tipo L juntamente com transientes de cálcio induzidos pela corrente é fornecido.
- Transferir miócitos para uma câmara celular e superfundir-se com solução de banho a 37 °C.
- Bloquear as correntes de potássio adicionando 4-aminopiridina e cloreto de bário à solução de banho, conforme indicado na Tabela 5.
- Certifique-se de que os microeletrodos de borossilicato tenham uma resistência de ponta de 2-5 MΩ preenchidos com solução de pipeta (Tabela 6).
- Configure medições para permitir a gravação simultânea de sinais elétricos e epifluorescência ao mesmo tempo. O modo de fixação de tensão é usado para medir a corrente Ca2+ tipo L com um protocolo que mantém a célula em -80 mV e um pulso de rampa de 600 ms a -40 mV para inativar a corrente rápida de Na+, seguido por um pulso de teste de 100 ms a +10 mV a 0,5 Hz (Figura 2).
- Use excitação a 488 nm, luz emitida a <520 nm para detectar e converter para [Ca2+]I supondo
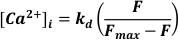
Onde kd = constante de dissociação de fluorescência de Fluo-3 (864 nM), F = fluorescência de Fluo-3; Fmax = fluorescência saturada de Ca2+ obtida ao final de cada experimento19.
Resultados
O rendimento do isolamento é determinado após a reintrodução de cálcio por pipetagem de 10 μL de suspensão celular em uma lâmina de microscópio. Mais de 100 células viáveis, em forma de bastonete, sem contração/10 μL para isolamento de células atriais, e mais de 1.000 células viáveis, em forma de bastonete, não contraídas/10 μL para isolamento de células ventriculares são consideradas como rendimento suficiente e são comumente obtidas usando este protocolo. As células atriais obtidas com este prot...
Discussão
Este artigo fornece uma maneira fácil e funcional de obter miócitos atriais e ventriculares de alta qualidade do mesmo camundongo para estudos de patch-clamp com registros simultâneos de transientes de cálcio. A qualidade dos dados obtidos depende muito da qualidade do isolamento celular. Como mencionado acima, vários métodos para isolar cardiomiócitos murinos foram descritos previamente9,10,11,12.
Divulgações
Nenhum
Agradecimentos
Este trabalho foi apoiado pela Fundação Alemã de Pesquisa (DFG; Cientista Clínico do Programa de Medicina Vascular (PRIME), MA 2186/14-1 para P. Tomsits e D. Schüttler; VO1568/3-1, IRTG1816 e SFB1002 projeto A13 a N. Voigt), Fundação Alemã de Pesquisa no âmbito da Estratégia de Excelência da Alemanha (EXC 2067/1- 390729940 a N. Voigt), Centro Alemão de Pesquisa Cardiovascular (DZHK; 81X2600255 a S. Clauss e N. Voigt; 81Z0600206 a S. Kääb), a Fundação Corona (S199/10079/2019 a S. Clauss), a ERA-NET sobre Doenças Cardiovasculares (ERA-CVD; 01KL1910 a S. Clauss), a Fundação Heinrich-and-Lotte-Mühlfenzl (a S. Clauss) e a Fundação Else-Kröner-Fresenius (EKFS 2016_A20 a N. Voigt). Os financiadores não tiveram nenhum papel na preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
Referências
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106 (2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588 (2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224 (2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688 (2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145 (2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227 (2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235 (2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados