A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד מיוציטים פרוזדוריים וחדריים באיכות גבוהה למדידות בו זמנית של Ca2+ Transients וזרם סידן מסוג L
* These authors contributed equally
In This Article
Summary
מודלים עכבריים מאפשרים ללמוד מנגנוני מפתח של arrhythmogenesis. לשם כך, קרדיומיוציטים באיכות גבוהה נחוצים לביצוע מדידות מהדק תיקון. כאן מתוארת שיטה לבידוד מיוציטים פרוזדוריים וחדרי מורין באמצעות זילוח לנגנדורף מבוסס אנזים מדרדר, המאפשר מדידות בו זמנית של סידן חולף וזרם סידן מסוג L.
Abstract
מודלים של עכברים ממלאים תפקיד מכריע בחקר הפרעות קצב ומאפשרים לחקור מנגנונים מרכזיים של הפרעות קצב, כולל שינוי בתפקוד תעלת היונים וטיפול בסידן. לשם כך, קרדיומיוציטים פרוזדוריים או חדריים באיכות גבוהה נחוצים לביצוע מדידות מהדק טלאי או לחקור הפרעות בטיפול בסידן. עם זאת, התשואה המוגבלת של קרדיומיוציטים באיכות גבוהה המתקבלים על ידי פרוטוקולי הבידוד הנוכחיים אינה מאפשרת את שתי המדידות באותו עכבר. מאמר זה מתאר שיטה לבידוד מיוציטים פרוזדוריים וחדרי מורין באיכות גבוהה באמצעות זילוח לנגנדורף מבוסס אנזים מדרדר, למדידות עוקבות בו זמנית של מעברי סידן וזרם סידן מסוג L מחיה אחת. לבבות עכבר מתקבלים, ואבי העורקים הוא cannulated במהירות כדי להסיר דם. לאחר מכן הלבבות מחוררים תחילה בתמיסה נטולת סידן (37°C) כדי לנתק את הרקמה ברמה של דיסקים משולבים ולאחר מכן בתמיסת אנזים המכילה מעט סידן כדי לשבש מטריצה חוץ-תאית (37°C). הלב המעוכל מנותח לאחר מכן לאטריה ולחדרים. דגימות רקמה נחתכות לחתיכות קטנות ומומסות על ידי פיפטציה בזהירות למעלה ולמטה. העיכול האנזימטי מופסק, והתאים מוכנסים מחדש בהדרגה לריכוזי הסידן הפיזיולוגיים. לאחר טעינה עם מחוון פלואורסצנטי Ca2+, קרדיומיוציטים מבודדים מוכנים למדידה בו זמנית של זרמי סידן וחולפים. בנוסף, נדונות מלכודות בידוד ופרוטוקולי מהדק טלאי ועקבות מייצגים של זרמי סידן מסוג L עם מדידות ארעיות סידן בו זמנית במיוציטים מורין פרוזדורים וחדריים שבודדו כמתואר לעיל.
Introduction
הפרעות קצב לב הן נפוצות ואחד האתגרים העיקריים כיום בתחום הבריאות, שכן הן משפיעות על מיליוני אנשים ברחבי העולם. הפרעות קצב קשורות לתחלואה גבוהה ולתמותה 1,2 ומייצגות את הסיבה הבסיסית לרוב מקרי המוות הלבבי הפתאומי3. אפשרויות הטיפול העדכניות שיפרו את הישרדות המטופלים, אך עדיין מדובר בעיקר בטיפולים סימפטומטיים ולא במנגנונים הבסיסיים. לכן, טיפולים אלה הם בעלי יעילות מוגבלת ועלולים לגרום לעתים קרובות לתופעות לוואי חמורות 4,5,6. שיפור אפשרויות הטיפול הנוכחיות דורש תובנה לגבי הפתופיזיולוגיה הבסיסית, מה שיוצר את הצורך במודלים מתאימים למחקר. מודלים של בעלי חיים קטנים - ובמיוחד מודלים של עכברים - ממלאים תפקיד מכריע במחקר הפרעות קצב, שכן הם מאפשרים לחקור מנגנוני מפתח של הפרעות קצב, למשל ההשפעה הגנטית על אלקטרופיזיולוגיה תאית, תפקוד תעלות יונים או טיפול בסידן 7,8.
לשם כך נדרשים קרדיומיוציטים פרוזדוריים וחדריים מבודדים בכמות מספקת וכדאיות. ספקטרום רחב של גישות בידוד שונות להשגת מיוציטים פרוזדוריים וחדריים תואר בעבר 9,10,11,12,13 וכמה קבוצות הציגו נתונים ממדידות סימולטניות של זרם מסוג L וזרם סידן המושרה על ידי מעבר סידן מפרוזדורים 14 או חדר 15 קרדיומיוציטים מורין. עם זאת, למיטב ידיעתנו אין נתונים זמינים על מדידות פרוזדורים כמו גם חדרים מחיה אחת. החוקרים מתמקדים במגוון רחב של נושאים, החל מאלקטרופיזיולוגיה ועד פרוטאומיקה, מחקרים פונקציונליים כמו התכווצות תאים או אינטראקציות חלבונים, תפקוד מיטוכונדריאלי או גנטיקה – כולם זקוקים לקרדיומיוציטים מבודדים. לפיכך, רבים מהפרוטוקולים שפורסמו לא פותחו במיוחד עבור מחקרי מהדק טלאי, מה שמוביל לתפוקות מוגבלות ואיכות תאים לא מספקת למחקרי מהדק טלאים. לפיכך, מדידות בו זמנית של מהדק טלאי וסידן ארעיות של תאים פרוזדוריים וחדרים שבודדו מבעל חיים אחד אינן יכולות להתבצע עם פרוטוקולים מבוססים.
בידוד של מיוציטים מורינים – במיוחד פרוזדורים – עבור ניסויים מהדק טלאי נותר מאתגר. מאמר זה מספק שיטה פשוטה ומהירה לבידוד של מיוציטים פרוזדוריים וחדרי מורין באיכות גבוהה באמצעות זילוח לנגנדורף מבוסס אנזים מדרדר, המאפשר לאחר מכן מדידות בו זמנית הן של זרם קרום נטו והן של מעבר סידן המושרה בזרם מחיה אחת. מאמר זה מפרט פרוטוקול לבידוד מיוציטים פרוזדוריים וחדריים שמקורם בעכברים מסוג בר ובעכברים הנושאים מוטציות גנטיות. פרוטוקול זה יכול לשמש עכברים זכרים ונקבות כאחד. בידוד המיוציטים, התמונות והתוצאות המייצגות המתוארות להלן התקבלו מעכברי בר מסוג C57Bl/6 בגיל 6 (± 1) חודשים. עם זאת, פרוטוקול זה שימש בהצלחה עבור עכברים בגילאים שונים החל מ 2 עד 24 חודשים עם גנוטיפים שונים. איור 1 מראה את מערך הבידוד ותקריב של לב משומר במהלך זילוח אנזימים.
Protocol
כל ההליכים בנושא בעלי חיים אושרו על ידי המועצה לביקורת בעלי חיים בסקסוניה התחתונה (LAVES, AZ-18/2900) ונערכו בהתאם לכל ההנחיות המוסדיות, הלאומיות והבינלאומיות לרווחת בעלי חיים.
1. סידורים מראש
- הכינו 1 ליטר של חיץ זילוח 10x (טבלה 1), 500 מ"ל של חיץ זילוח 1x (טבלה 2), 50 מ"ל של חיץ עיכול (טבלה 3), 10 מ"ל של חיץ עצירה (טבלה 4), 1 ליטר של תמיסת Tyrode (טבלה 5), 10 מ"ל של כל תמיסת שלב סידן (תמיסת Tyrode עם גלוקוז וכמות סידן מתאימה כפי שצוין), 1 ליטר של תמיסת 4-AP (טבלה 5), 100 מ"ל של תמיסת פיפטה (טבלה 6) ו-5 מ"ל של חומצה פלורונית לפי המתכונים שסופקו.
הערה: ניתן להכין מראש תמיסות אמבטיה (Tyrode ותמיסת 4-AP) (ללא גלוקוז) ולאחסן ב +4 ° C, גלוקוז מתווסף ביום הניסוי. ניתן לאחסן תמיסת פיפטה ב -20 מעלות צלזיוס, מחוון סידן מתווסף ביום הניסוי ותמיסה מאוחסנת על קרח עד לשימוש נוסף. ניתן לאחסן חיץ זילוח 10x בטמפרטורת החדר, יש להכין חיץ זילוח 1x, חיץ עיכול וחיץ עצירה טריים ביום הניסוי. - הפעל את אמבט המים ואת משאבת הרולר.
- מילוי מראש של מנגנון לנגנדורף בחיץ זילוח; ודא שהוא נטול אוויר.
- הכינו צינורית אבי העורקים על ידי קיבוע מתחת למיקרוסקופ דיסקציה, חברו מזרק 1 מ"ל מלא בחיץ זילוח ואוויר צלול על ידי שטיפת הצינורית.
הערה: חשוב להימנע מכל אוויר בתוך מערכת הזלוף, שכן זה ישפיע ישירות על זילוח כלילי ובכך על יעילות העיכול. במידת הצורך, ניתן להוסיף מלכודת בועות להתקנה, כדי למנוע בבטחה לכידת אוויר. - הכינו צלחות פטרי עם מספיק חיץ זילוח לאיסוף איברים ומיקרוסקופ (החיץ צריך לכסות היטב את כל האיבר, כמה מיליליטרים – תלוי בגודל צלחת הפטרי המשומשת – אמורים להספיק).
- הכינו 3 צלחות פטרי עם חיץ עיכול לדיסוציאציה של רקמות ומיקרוסקופ, החיץ צריך לכסות את האיבר לדיסקציה תחת המיקרוסקופ בתוך צלחת הפטרי המתאימה, הכמות תלויה בגודל צלחת הפטרי המשומשת. עבור דיסוציאציה להשתמש 3 מ"ל עבור רקמה חדרית ו 1.5 מ"ל עבור רקמת פרוזדורים.
2. קצירת איברים
- הזריקו לעכבר 0.1 מ"ל הפרין (1,000 U/mL) כלומר באמצעות מזרק 1 מ"ל עם צינורית 27 גרם והמתינו 5-10 דקות.
- הכניסו את העכבר לתא אינדוקציה יחד עם רקמה קטנה ספוגה בכ-500 מיקרוליטר איזופלורן. החיה לא צריכה להיות בקשר עם הרקמה. כדי להימנע מכך, ניתן להשתמש בקלטת הטבעה של ביופסיה פלסטית כדי לכסות את הרקמה. ברגע שהחיה מורדמת לחלוטין, בדוק אם יש רפלקס צביטת בוהן וברגע שהוא אינו קיים יותר, להרדים במהירות את העכבר על ידי נקע צוואר הרחם.
- הניחו את העכבר על פלטפורמה על גבו (למשל, על קלקר מכוסה במגבת נייר) וקיבעו את הכפות עם צינוריות כדי להחזיק אותו במקומו.
- הסר פרווה ועור המכסים את החזה וחלק מהבטן עם חתך ברור מ jugulum לכיוון סימפיזיס ולפתוח את הבטן ממש מתחת xiphoid מבלי לפגוע בכל מבנה איבר באמצעות מספריים. להרים את עצם החזה עם מלקחיים כירורגיים לחתוך את הסרעפת עם מספריים לאורך קצה הצלעות, ולאחר מכן לחתוך את הצלעות בקו השחי המדיאלי ולהסיר את כלוב הצלעות כדי לחשוף את הלב.
- בזהירות להסיר את קרום הלב באמצעות מלקחיים קהה במהירות להסיר את הלב על ידי הרמת אותו עם מלקחיים קהה מלמטה על ידי חיתוך כלי גדול עם חתך אחד בודד באמצעות מספריים.
- הכניסו את הלב לחיץ זילוח בטמפרטורת החדר וקשרו את אבי העורקים עם מחט קצה קהה מתחת למיקרוסקופ במהירות האפשרית.
הערה: הסר כל רקמת ריאה ורקמת שומן המחוברת לאיבר מבלי לאבד זמן רב מדי עליו. בזמן הקנולציה, יש לוודא כי קצה המחט אינו משתרע דרך שסתום אבי העורקים, שכן הדבר יפגע בתוצאות על ידי מניעת חוצצים מלהיכנס לעורקים הכליליים. - קשרו את הלב עם פיסת משי תפירה בחוזקה למחט והתנתקו מהמזרק.
הערה: כל ההליך מקבלת הלב (הרגע שבו כלי הדם הגדולים נחתכים) ועד תפירת אבי העורקים למחט צריך לקחת כמה שפחות זמן. מומלץ לא לקחת יותר מ 90-180 שניות מהסרת הלב עד תחילת הזלוף.
3. עיכול אנזימטי
- לאחר קנולציה של אבי העורקים, חברו מיד את הלב המשומר למנגנון לנגנדורף תוך הימנעות מכניסת אוויר למערכת.
הערה: זה יכול לעזור שיש טיפה תלויה של חיץ זילוח בתחתית מנגנון לנגנדורף, כמו גם טיפה של חיץ זילוח יושב על החלק העליון של המחט על מנת למנוע כל אוויר נכנס למערכת. - יש לערבב את הלב עם חיץ זילוח למשך דקה אחת בטמפרטורה של 37°C בדיוק וקצב זילוח של 4 מ"ל/דקה בדיוק.
הערה: על מנת לקבל טמפרטורה של 37 °C בקצה מחט הזלוף, טמפרטורת אמבט המים צריכה להיות מוגדרת מעט מעל כ 40 °C (70 °F). זה צריך להיבדק באופן קבוע על ידי מדידת הטמפרטורה בקצה זילוח. - מעבירים את הזילוח לחיץ העיכול ומחוררים למשך 9 דקות בדיוק בטמפרטורה של 37°C בדיוק ובקצב זילוח של 4 מ"ל/דקה בדיוק.
- העבירו את הלב המעוכל לצלוחית פטרי עם מספיק חיץ עיכול כדי לשמור עליו מכוסה במלואו. לאחר מכן לנתח בזהירות את אטריה וחדרים מתחת למיקרוסקופ.
- מעבירים את האטריה לצלחת פטרי עם 1.5 מ"ל של חיץ עיכול ואת החדרים לצלחת פטרי אחרת עם 3 מ"ל של חיץ עיכול.
- דיסקציה פרוזדורית
- בזהירות, אך ללא אובדן זמן, פרקו את האטריה לחתיכות זעירות באמצעות מלקחיים קהים.
- ממיסים את הרקמה על ידי זינוק זהיר למעלה ולמטה באמצעות קצה פיפטה 1,000 μL, אשר נחתך בעבר כדי להרחיב את פתח הקצה.
- העבר את התמיסה לצינור צנטריפוגה של 15 מ"ל והוסף כמות שווה ערך של חיץ עצירה (1.5 מ"ל) על ידי פיפטציה בזהירות בצד הצינור כדי לסיים את התגובה.
- העבירו בזהירות את כל 3 מ"ל תמיסות התא/רקמות דרך רשת ניילון של 200 מיקרומטר כדי להסיר את חתיכות הרקמה הגדולות שנותרו שלא עוכלו במלואן.
הערה: עיכול מוצלח לא ישאיר כמעט גושים מוצקים.
- דיסקציה חדרית
- חותכים במהירות את רקמת החדר לחתיכות זעירות באמצעות מספריים דיסקציה ופיפטה למעלה ולמטה כדי להתמוסס. השתמש עוד 1,000 μL פיפטה קצה עבור pipeting למעלה ולמטה, זה עשוי להיות מקוצר כדי להרחיב את הפתח.
- העבר תמיסת תא/רקמה לצינור צנטריפוגה של 15 מ"ל והוסף כמות שווה ערך של חיץ עצירה (3 מ"ל) על ידי פיטיפציה בזהירות בצד הצינור כדי לסיים את התגובה.
- העבירו בזהירות את כל 6 מ"ל תמיסת התא/רקמה דרך רשת ניילון של 200 מיקרומטר כדי להסיר חתיכות רקמה גדולות יותר שלא עוכלו במלואן.
הערה: עיכול מוצלח לא ישאיר כמעט גושים מוצקים.
- השאירו את שני הצינורות (מתלה תאי פרוזדורים וחדר חדרים) על הספסל בטמפרטורת החדר למשך 6 דקות כדי להתיישב.
- צנטריפוגה שני צינורות 15 מ"ל ב 5 x גרם במשך 2 דקות.
4. החזרת סידן
הערה: השלבים הבאים זהים הן עבור תאי פרוזדורים והן עבור תאים חדריים (אלא אם צוין אחרת) ומבוצעים בטמפרטורת החדר.
- יש להשליך את הסופרנאטנט באמצעות פיפטת פסטר מפלסטיק ולהשהות בזהירות את הגלולה ב-10 מ"ל של תמיסת טירוד נטולת סידן.
- השאירו תאים למשך 8 דקות לשיקוע.
- צנטריפוגה ב 5 x גרם במשך 1 דקות (רק תאים פרוזדורים, שקיעה מספיקה עבור תאים חדריים).
- יש להשליך את כדורי הסופרנאטנט בזהירות ב-10 מ"ל של תמיסת Tyrode עם ריכוז סידן של 100 מיקרומטר.
- השאירו תאים למשך 8 דקות לשיקוע.
- צנטריפוגה ב 5 x גרם במשך 1 דקות (רק תאים פרוזדורים, שקיעה מספיקה עבור תאים חדריים).
- יש להשליך את הסופרנאטנט ולהשהות בזהירות את הגלולה ב-10 מ"ל של תמיסת טירוד עם ריכוז סידן של 400 מיקרומטר.
- השאירו תאים למשך 8 דקות לשיקוע.
- צנטריפוגה ב 5 x גרם במשך 1 דקות (רק תאים פרוזדורים, שקיעה מספיקה עבור תאים חדריים).
- יש להשליך את הסופרנאטנט ולהשהות בזהירות את הגלולה ב-1 מ"ל (פרוזדור) / 5 מ"ל (חדרי) של תמיסת טירוד עם ריכוז סידן של 1 מ"מ.
5. העמסת מיוציטים עם מחוון סידן פלואורסצנטי Fluo-3 AM
הערה: בשל רגישות האור של מחוון הסידן הפלואורסצנטי, יש לבצע את השלבים הבאים מוגנים מפני אור (למשל, על ידי כיסוי צינורות ברדיד אלומיניום).
- הכן את תמיסת המלאי Fluo-3 AM על ידי הוספת 44 μL של 20% פלורוני F-127 ב- DMSO נטול מים ל- 50 מיקרוגרם של Fluo-3AM (ניתן לאחסן ב- -20 °C מוגן מפני אור).
- הוסף 10 μL של תמיסת מלאי Fluo-3 AM ל- 1 מ"ל של תרחיף תאים ודגור במשך 10 דקות בטמפרטורת החדר מוגן מפני אור.
- צנטריפוגה ב 5 x גרם במשך 1 דקה.
- יש להשליך את הסופרנאטנט באמצעות פיפטת פסטר מפלסטיק ולהשהות מחדש את הגלולה בכמות סבירה של תמיסת אמבטיה כדי לקבל ריכוז עבודה טוב (1-5 מ"ל של תמיסת אמבטיה בהתאם לצפיפות התא).
- השאירו למשך 30 דקות לדה-אסטריפיקציה לפני שתתחילו בניסויים.
6. מדידות ארעיות בו זמנית של מהדק טלאי ואפיפלואורסצנטי Ca2+ כמתואר לעיל16
הערה: מדידות מהדק טלאי אינן נושא מאמר זה, הקורא המעוניין עשוי להיות מופנה לפרסומים גדולים המספקים תיאורים מעמיקים של שיטה זו 17,18,19,20,21,22. עם זאת, להבנה כללית טובה יותר, ניתן סיכום על פרוטוקול למדידת זרמי סידן מסוג L יחד עם מעברי סידן המושרים בזרם.
- מעבירים מיוציטים לתוך תא התא וסופרפיוז עם תמיסת אמבטיה ב 37 ° C.
- חסום זרמי אשלגן על-ידי הוספת 4-אמינופירידין ובריום כלורי לתמיסת האמבטיה כמצוין בטבלה 5.
- ודא שלמיקרואלקטרודות בורוסיליקט יש עמידות חוד של 2-5 MΩ מלא בתמיסת פיפטה (טבלה 6).
- מדידות התקנה כדי לאפשר הקלטה בו זמנית של אותות חשמליים ואפיפלואורסנציה בו זמנית. מצב מהדק מתח משמש למדידת זרם Ca2+ מסוג L עם פרוטוקול המחזיק את התא ב -80 mV ודופק רמפה של 600 ms עד -40 mV כדי להשבית את זרם Na+ המהיר, ואחריו פעימת בדיקה של 100 ms ל +10 mV ב- 0.5 הרץ (איור 2).
- השתמש בעירור ב 488 ננומטר, נפלט אור ב <520 ננומטר כדי לזהות ולהמיר ל [Ca2+] אני מניח
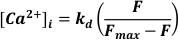
כאשר kd = קבוע דיסוציאציה של Fluo-3 (864 nM), F = פלואורסצנטיות פלואורסצנטית; Fmax = Ca2+ פלואורסצנטיות רוויה המתקבלת בסוף כל ניסוי19.
תוצאות
תפוקת הבידוד נקבעת לאחר החזרת הסידן על ידי הנחת 10 מיקרוליטר של תרחיף התא על שקופית מיקרוסקופ. יותר מ-100 תאים בני קיימא, בצורת מוט, שאינם מתכווצים/10 μL לבידוד תאים פרוזדוריים ויותר מ-1,000 תאים בני קיימא, בצורת מוט, שאינם מתכווצים/10 μL לבידוד תאים חדריים נחשבים לתנובה מספקת ומתקבלים בדרך כלל באמצ...
Discussion
מאמר זה מספק דרך קלה ופונקציונלית להשיג מיוציטים פרוזדוריים וחדריים באיכות גבוהה מאותו עכבר עבור מחקרי מהדק טלאי עם הקלטות סידן חולפות בו זמנית. איכות הנתונים המתקבלים תלויה מאוד באיכות בידוד התא. כפי שהוזכר לעיל, שיטות רבות לבודד קרדיומיוציטים murine תוארו בעבר 9,10,11,12.
Disclosures
ללא
Acknowledgements
עבודה זו נתמכה על ידי קרן המחקר הגרמנית (DFG; תוכנית מדען קליני ברפואת כלי דם (PRIME), MA 2186/14-1 לפ' טומסיץ וד' שוטלר; VO1568/3-1, IRTG1816 ופרויקט SFB1002 A13 עד N. Voigt), קרן המחקר הגרמנית תחת אסטרטגיית המצוינות של גרמניה (EXC 2067/1- 390729940 ל- N. Voigt), המרכז הגרמני למחקר קרדיווסקולרי (DZHK; 81X2600255 ל- S. Clauss ו- N. Voigt; 81Z0600206 ל- S. Kääb), קרן הקורונה (S199/10079/2019 ל- S. Clauss), ERA-NET למחלות לב וכלי דם (ERA-CVD; 01KL1910 ל- S. Clauss), קרן היינריך-ולוטה-מילפנצל (ל-S. Clauss) וקרן Else-Kröner-Fresenius (EKFS 2016_A20 ל-N. Voigt). למממנים לא היה כל תפקיד בהכנת כתבי היד.
Materials
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
References
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106 (2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588 (2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224 (2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688 (2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145 (2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227 (2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235 (2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved