Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement de myocytes auriculaires et ventriculaires murins de haute qualité pour des mesures simultanées des transitoires Ca2+ et du courant calcique de type L
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les modèles murins permettent d’étudier les mécanismes clés de l’arythmogenèse. À cette fin, des cardiomyocytes de haute qualité sont nécessaires pour effectuer des mesures patch-clamp. Ici, une méthode pour isoler les myocytes auriculaires et ventriculaires murins via une perfusion de Langendorff à base d’enzymes rétrogrades, qui permet des mesures simultanées des transitoires de calcium et du courant de calcium de type L, est décrite.
Résumé
Les modèles murins jouent un rôle crucial dans la recherche sur l’arythmie et permettent d’étudier les mécanismes clés de l’arythmagénèse, y compris la fonction altérée des canaux ioniques et la manipulation du calcium. À cette fin, des cardiomyocytes auriculaires ou ventriculaires de haute qualité sont nécessaires pour effectuer des mesures patch-clamp ou pour explorer les anomalies de manipulation du calcium. Cependant, le rendement limité des cardiomyocytes de haute qualité obtenus par les protocoles d’isolement actuels ne permet pas les deux mesures chez la même souris. Cet article décrit une méthode pour isoler des myocytes auriculaires et ventriculaires murins de haute qualité via une perfusion de Langendorff à base d’enzymes rétrogrades, pour des mesures simultanées ultérieures des transitoires de calcium et du courant de calcium de type L d’un animal. Des cœurs de souris sont obtenus et l’aorte est rapidement canulée pour éliminer le sang. Les cœurs sont ensuite perfusés dans un premier temps avec une solution sans calcium (37 °C) pour dissocier le tissu au niveau des disques intercalés, puis avec une solution enzymatique contenant peu de calcium pour perturber la matrice extracellulaire (37 °C). Le cœur digéré est ensuite disséqué en oreillettes et ventricules. Les échantillons de tissus sont coupés en petits morceaux et dissous en pipetant soigneusement de haut en bas. La digestion enzymatique est arrêtée et les cellules sont réintroduites progressivement aux concentrations physiologiques de calcium. Après chargement avec un indicateur Ca2+ fluorescent, des cardiomyocytes isolés sont préparés pour la mesure simultanée des courants de calcium et des transitoires. De plus, les pièges d’isolement sont discutés et des protocoles de patch-clamp et des traces représentatives de courants de calcium de type L avec des mesures transitoires de calcium simultanées dans les myocytes murins auriculaires et ventriculaires isolés comme décrit ci-dessus sont fournis.
Introduction
Les arythmies cardiaques sont courantes et constituent l’un des principaux défis actuels en matière de soins de santé, car elles touchent des millions de personnes dans le monde. Les arythmies sont associées à une morbidité et une mortalité élevées 1,2 et représentent la cause sous-jacente de la majorité des morts subites cardiaques3. Les options de traitement à jour ont amélioré la survie des patients, mais sont encore principalement des traitements symptomatiques plutôt que de cibler les mécanismes sous-jacents. Ainsi, ces traitements ont une efficacité limitée et peuvent fréquemment causer des effets secondaires graves 4,5,6. Une amélioration des options de traitement actuelles nécessite un aperçu de la physiopathologie sous-jacente, ce qui crée le besoin de modèles appropriés à étudier. Les modèles de petits animaux - et en particulier les modèles murins - jouent un rôle crucial dans la recherche sur l’arythmie car ils permettent d’étudier les mécanismes clés de l’arythmogenèse, par exemple l’impact génétique sur l’électrophysiologie cellulaire, la fonction des canaux ioniques ou la manipulation du calcium 7,8.
À cette fin, des cardiomyocytes auriculaires et ventriculaires isolés en quantité et viabilité suffisantes sont nécessaires. Un large éventail d’approches d’isolement différentes pour obtenir des myocytes auriculaires et ventriculaires a déjà été décrit 9,10,11,12,13 et certains groupes ont présenté des données provenant de mesures simultanées du courant de type L et des transitoires de calcium induits par le courant de calcium à partir d’un courant auriculaire 14 ou ventriculaire 15 cardiomyocytes murins. Cependant, à notre connaissance, il n’existe aucune donnée disponible sur les mesures auriculaires et ventriculaires d’un animal. Les chercheurs se concentrent sur une grande variété de sujets allant de l’électrophysiologie à la protéomique, en passant par les études fonctionnelles telles que la contractilité cellulaire ou les interactions protéiques, la fonction mitochondriale ou la génétique – toutes nécessitant des cardiomyocytes isolés. De nombreux protocoles publiés n’ont donc pas été spécifiquement développés pour les études de patch clamp, ce qui a conduit à des rendements limités et à une qualité cellulaire insuffisante pour les études de patch clamp. Ainsi, les mesures simultanées de patch clamp et de calcium transitoires de cellules auriculaires et ventriculaires isolées d’un animal ne peuvent pas être effectuées avec des protocoles établis.
L’isolement des myocytes murins – en particulier auriculaires – pour les expériences de patch clamp reste difficile. Cet article fournit une méthode simple et rapide pour l’isolement de myocytes auriculaires et ventriculaires murins de haute qualité via une perfusion de Langendorff à base d’enzymes rétrogrades, qui permet ensuite des mesures simultanées du courant membranaire net et des transitoires de calcium induits par le courant d’un animal. Cet article élabore un protocole pour l’isolement des myocytes auriculaires et ventriculaires dérivés de souris de type sauvage et de souris porteuses de mutations génétiques. Ce protocole peut être utilisé pour les souris mâles et femelles. L’isolement des myocytes et les images et les résultats représentatifs décrits ci-dessous ont été obtenus à partir de souris sauvages de type C57Bl/6 à l’âge de 6 (± 1) mois. Néanmoins, ce protocole a été utilisé avec succès pour des souris de différents âges allant de 2 à 24 mois avec différents génotypes. La figure 1 montre la configuration de l’isolement et un gros plan d’un cœur canulé pendant la perfusion enzymatique.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures relatives aux animaux ont été approuvées par le Conseil d’examen des animaux de Basse-Saxe (LAVES, AZ-18/2900) et ont été menées conformément à toutes les directives institutionnelles, nationales et internationales en matière de bien-être animal.
1. Préarrangements
- Préparer 1 L de tampon de perfusion 10x (tableau 1), 500 mL de tampon de perfusion 1x (tableau 2), 50 mL de tampon de digestion (tableau 3), 10 mL de tampon stop (tableau 4), 1 L de solution Tyrode (tableau 5), 10 mL de chaque solution calcique (solution Tyrode avec glucose et quantité respective de calcium comme indiqué), 1 L de solution 4-AP (tableau 5), 100 mL de solution pour pipette (tableau 6) et 5 mL d’acide pluronique selon les recettes fournies.
REMARQUE: Les solutions de bain (Tyrode et solution 4-AP) peuvent être préparées (sans glucose) à l’avance et stockées à +4 ° C, le glucose est ajouté le jour expérimental. La solution pour pipette peut être conservée à -20 °C, l’indicateur de calcium est ajouté le jour de l’expérimentation et la solution est ensuite stockée sur de la glace jusqu’à une utilisation ultérieure. Le tampon de perfusion 10x peut être stocké à température ambiante, le tampon de perfusion 1x, le tampon de digestion et le tampon d’arrêt doivent être fraîchement préparés le jour de l’expérience. - Allumez le bain-marie et la pompe à rouleaux.
- Préremplir l’appareil Langendorff avec un tampon de perfusion; Assurez-vous qu’il est sans air.
- Préparer la canule aortique en la fixant au microscope à dissection, la connecter avec une seringue de 1 mL remplie de tampon de perfusion et purifier l’air en rinçant la canule.
REMARQUE: Il est crucial d’éviter tout air à l’intérieur du système de perfusion, car cela affectera directement la perfusion coronaire et donc l’efficacité de la digestion. Un piège à bulles peut être ajouté à la configuration si nécessaire, pour éviter en toute sécurité tout piégeage d’air. - Préparez des boîtes de Petri avec suffisamment de tampon de perfusion pour la collecte d’organes et la microscopie (le tampon doit couvrir solidement tout l’organe, quelques millilitres – en fonction de la taille de la boîte de Petri utilisée – devraient suffire).
- Préparez 3 boîtes de Petri avec un tampon de digestion pour la dissociation des tissus et la microscopie, le tampon doit couvrir l’organe pour la dissection au microscope dans la boîte de Petri respective, la quantité dépend de la taille de la boîte de Petri utilisée. Pour la dissociation, utilisez 3 mL pour le tissu ventriculaire et 1,5 mL pour le tissu auriculaire.
2. Prélèvements d’organes
- Injectez à la souris 0,1 mL d’héparine (1 000 U/mL) à l’aide d’une seringue de 1 mL avec une canule de 27 G et attendez 5 à 10 minutes.
- Placez la souris dans une chambre d’induction avec un petit tissu imbibé d’environ 500 μL d’isoflurane. L’animal ne doit pas être en contact avec le tissu. Pour éviter cela, on peut utiliser une cassette d’incorporation de biopsie plastique pour couvrir le tissu. Une fois que l’animal est complètement anesthésié, vérifiez le réflexe de pincement des orteils et dès qu’il n’est plus présent, euthanasiez rapidement la souris par luxation cervicale.
- Placez la souris sur une plate-forme sur le dos (par exemple, sur de la mousse de polystyrène recouverte d’une serviette en papier) et fixez les pattes avec des canules pour la maintenir en place.
- Enlevez la fourrure et la peau recouvrant la poitrine et une partie de l’abdomen avec une coupe claire du jugulum vers la symphyse et ouvrez l’abdomen juste sous la xiphoïde sans blesser la structure de l’organe à l’aide de ciseaux. Soulevez le sternum avec une pince chirurgicale et coupez le diaphragme avec des ciseaux le long du bord des côtes, puis coupez les côtes en ligne axillaire médiale et retirez la cage thoracique pour exposer le cœur.
- Retirez soigneusement le péricarde à l’aide d’une pince émoussée et retirez rapidement le cœur en le soulevant avec une pince émoussée par le bas et en coupant les gros vaisseaux d’une seule coupe à l’aide de ciseaux.
- Placez le cœur dans un tampon de perfusion à température ambiante et canulez l’aorte avec une aiguille émoussée au microscope le plus rapidement possible.
REMARQUE: Enlevez tout tissu pulmonaire et tissu adipeux attaché à l’organe sans perdre trop de temps dessus. Pendant la canulation, assurez-vous que l’extrémité de l’aiguille ne s’étend pas à travers la valve aortique, car cela nuirait aux résultats en empêchant les tampons de pénétrer dans les artères coronaires. - Attachez fermement le cœur avec un morceau de soie suturante à l’aiguille et débranchez-le de la seringue.
REMARQUE: L’ensemble de la procédure depuis l’obtention du cœur (le moment où les gros vaisseaux sont coupés) jusqu’à la suture de l’aorte à l’aiguille devrait prendre le moins de temps possible. Il est recommandé de ne pas prendre plus de 90-180 s de retrait du cœur jusqu’au début de la perfusion.
3. Digestion enzymatique
- Après la canulation aortique, connectez immédiatement le cœur canulé à l’appareil de Langendorff en évitant que de l’air ne pénètre dans le système.
REMARQUE: Il peut être utile d’avoir une goutte suspendue de tampon de perfusion au bas de l’appareil Langendorff ainsi qu’une goutte de tampon de perfusion sur le dessus de l’aiguille afin d’éviter que de l’air ne pénètre dans le système. - Perfuser le cœur avec un tampon de perfusion pendant 1 min à une température d’exactement 37 °C et un taux de perfusion d’exactement 4 mL/min.
NOTE: Pour avoir une température de 37 °C à l’extrémité de l’aiguille de perfusion, la température du bain-marie doit être réglée légèrement au-dessus à environ 40 °C. Cela doit être testé régulièrement en mesurant la température à l’extrémité de perfusion. - Basculer la perfusion vers le tampon de digestion et la perfusible pendant exactement 9 minutes à une température d’exactement 37 °C et un taux de perfusion d’exactement 4 mL/min.
- Transférer le cœur digéré dans une boîte de Petri avec suffisamment de tampon de digestion pour le garder complètement couvert. Ensuite, disséquez soigneusement les oreillettes et les ventricules au microscope.
- Transférer les oreillettes dans une boîte de Petri avec 1,5 mL de tampon de digestion et les ventricules dans une autre boîte de Petri avec 3 ml de tampon de digestion.
- Dissection auriculaire
- Avec précaution, mais sans perte de temps, séparez les oreillettes en petits morceaux à l’aide de pinces émoussées.
- Dissoudre le tissu en pipetant soigneusement de haut en bas à l’aide d’une pointe de pipette de 1 000 μL, qui a déjà été coupée pour élargir l’ouverture de l’embout.
- Transférer la solution dans un tube à centrifuger de 15 mL et ajouter une quantité équivalente de tampon stop (1,5 mL) en pipetant soigneusement sur le côté du tube pour mettre fin à la réaction.
- Passez soigneusement les 3 mL de solutions cellulaires ou tissulaires à travers un filet de nylon de 200 μm pour enlever les gros morceaux de tissu restants qui n’ont pas été complètement digérés.
REMARQUE: Une digestion réussie ne laissera presque pas de morceaux solides.
- Dissection ventriculaire
- Hacher rapidement le tissu ventriculaire en petits morceaux à l’aide de ciseaux à dissection et pipette de haut en bas pour le dissoudre. Utilisez une autre pointe de pipette de 1 000 μL pour pipeter de haut en bas, elle peut être raccourcie pour élargir l’ouverture.
- Transférer la solution cellulaire/tissulaire dans un tube à centrifuger de 15 mL et ajouter une quantité équivalente de tampon stop (3 mL) en pipetant soigneusement sur le côté du tube pour mettre fin à la réaction.
- Passez soigneusement les 6 mL de solution cellulaire ou tissulaire à travers un filet de nylon de 200 μm pour enlever les gros morceaux de tissu qui n’ont pas été complètement digérés.
REMARQUE: Une digestion réussie ne laissera presque pas de morceaux solides.
- Laisser reposer les deux tubes (suspension de cellules auriculaires et ventriculaires) sur le banc à température ambiante pendant 6 min pour se déposer.
- Centrifuger les deux tubes de 15 mL à 5 x g pendant 2 min.
4. Réintroduction du calcium
REMARQUE: Les étapes suivantes sont identiques pour les cellules auriculaires et ventriculaires (sauf indication contraire) et sont effectuées à température ambiante.
- Jeter le surnageant à l’aide d’une pipette Pasteur en plastique et remettre soigneusement en suspension la pastille dans 10 mL de solution de Tyrode sans calcium.
- Laisser les cellules pendant 8 min pour la sédimentation.
- Centrifuger à 5 x g pendant 1 min (uniquement les cellules auriculaires, la sédimentation suffit pour les cellules ventriculaires).
- Jeter le surnageant et remettre soigneusement en suspension la pastille dans 10 mL de solution de Tyrode à concentration de calcium de 100 μM.
- Laisser les cellules pendant 8 min pour la sédimentation.
- Centrifuger à 5 x g pendant 1 min (uniquement les cellules auriculaires, la sédimentation suffit pour les cellules ventriculaires).
- Jeter le surnageant et remettre soigneusement en suspension la pastille dans 10 mL de solution Tyrode à une concentration de calcium de 400 μM.
- Laisser les cellules pendant 8 min pour la sédimentation.
- Centrifuger à 5 x g pendant 1 min (uniquement les cellules auriculaires, la sédimentation suffit pour les cellules ventriculaires).
- Jeter le surnageant et remettre délicatement la pastille en suspension dans 1 mL (auriculaire)/5 mL (ventrable) de solution Tyrode à concentration de calcium de 1 mM.
5. Charge des myocytes avec l’indicateur de calcium fluorescent Fluo-3 AM
REMARQUE : En raison de la sensibilité à la lumière de l’indicateur de calcium fluorescent, les étapes suivantes doivent être exécutées à l’abri de la lumière (p. ex., en recouvrant les tubes avec du papier d’aluminium).
- Préparer la solution mère de Fluo-3 AM en ajoutant 44 μL de F-127 pluronique à 20 % dans du DMSO anhydre à 50 μg de Fluo-3AM (peut être conservé à -20 °C à l’abri de la lumière).
- Ajouter 10 μL de solution mère de Fluo-3 AM à 1 mL de suspension cellulaire et incuber pendant 10 minutes à température ambiante à l’abri de la lumière.
- Centrifuger à 5 x g pendant 1 min.
- Jeter le surnageant à l’aide d’une pipette Pasteur en plastique et remettre en suspension la pastille dans une quantité raisonnable de solution de bain pour obtenir une bonne concentration de travail (1-5 mL de solution de bain selon la densité cellulaire).
- Laisser reposer 30 min pour la disestérification avant de commencer les expériences.
6. Mesures simultanées de patch-clamp et d’épifluorescent Ca2+-transitoires comme décrit précédemment16
NOTE: Les mesures de pince patch ne sont pas le sujet de cet article, le lecteur intéressé peut être renvoyé aux principales publications fournissant des descriptions détaillées de cette méthode 17,18,19,20,21,22. Néanmoins, pour une meilleure compréhension globale, un résumé d’un protocole pour mesurer les courants de calcium de type L ainsi que les transitoires de calcium induits par le courant est fourni.
- Transférer les myocytes dans une chambre cellulaire et superfuser avec une solution de bain à 37 °C.
- Bloquer les courants de potassium en ajoutant de la 4-aminopyridine et du chlorure de baryum à la solution du bain, comme indiqué dans le tableau 5.
- S’assurer que les microélectrodes borosilicatées ont une résistance à l’extrémité de 2 à 5 MΩ remplie de solution de pipette (tableau 6).
- Configurez les mesures pour permettre l’enregistrement simultané des signaux électriques et de l’épifluorescence en même temps. Le mode de serrage de tension est utilisé pour mesurer le courant Ca2+ de type L avec un protocole maintenant la cellule à -80 mV et une impulsion rampe de 600 ms à -40 mV pour inactiver le courant Na+ rapide, suivi d’une impulsion d’essai de 100 ms à +10 mV à 0,5 Hz (Figure 2).
- Utiliser l’excitation à 488 nm, la lumière émise à <520 nm pour détecter et convertir en [Ca2+]I en supposant
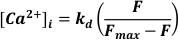
Où kd = constante de dissociation de Fluo-3 (864 nM), F = fluorescence Fluo-3; Fmax = Fluorescence saturée enCa2+ obtenue à la fin de chaque expérience19.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le rendement d’isolement est déterminé après la réintroduction du calcium en pipetant 10 μL de suspension cellulaire sur une lame de microscope. Plus de 100 cellules viables, en forme de bâtonnet, non contractantes/10 μL pour l’isolement de cellules auriculaires et plus de 1 000 cellules viables, en forme de bâtonnet, non contractantes/10 μL pour l’isolement des cellules ventriculaires sont considérées comme un rendement suffisant et sont couramment obtenues à l’aide de ce protocole. Les cellules auri...
Access restricted. Please log in or start a trial to view this content.
Discussion
Cet article fournit un moyen simple et fonctionnel d’obtenir des myocytes auriculaires et ventriculaires de haute qualité à partir de la même souris pour des études patch-clamp avec des enregistrements transitoires de calcium simultanés. La qualité des données obtenues dépend fortement de la qualité de l’isolement cellulaire. Comme mentionné ci-dessus, de nombreuses méthodes pour isoler les cardiomyocytes murins ont été décrites précédemment 9,10,11,12.
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun
Remerciements
Ce travail a été soutenu par la Fondation allemande pour la recherche (DFG; Clinician Scientist Program In Vascular Medicine (PRIME), MA 2186/14-1 à P. Tomsits et D. Schüttler; VO1568/3-1, IRTG1816 et SFB1002 projet A13 à N. Voigt), Fondation allemande pour la recherche dans le cadre de la stratégie d’excellence de l’Allemagne (EXC 2067/1- 390729940 à N. Voigt), Centre allemand de recherche cardiovasculaire (DZHK; 81X2600255 à S. Clauss et N. Voigt; 81Z0600206 à S. Kääb), la Fondation Corona (S199/10079/2019 à S. Clauss), l’ERA-NET sur les maladies cardiovasculaires (ERA-CVD; 01KL1910 à S. Clauss), la Heinrich-and-Lotte-Mühlfenzl Stiftung (à S. Clauss) et la Fondation Else-Kröner-Fresenius (EKFS 2016_A20 à N. Voigt). Les bailleurs de fonds n’ont joué aucun rôle dans la préparation des manuscrits.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
Références
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106(2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588(2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224(2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688(2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145(2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227(2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235(2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464(2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890(2020).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon