È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di miociti atriali e ventricolari murini di alta qualità per misurazioni simultanee di transitori Ca2+ e corrente di calcio di tipo L
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I modelli murini consentono di studiare i meccanismi chiave dell'aritmogenesi. A tale scopo, sono necessari cardiomiociti di alta qualità per eseguire misurazioni patch-clamp. Qui viene descritto un metodo per isolare i miociti atriali e ventricolari murini tramite perfusione Langendorff a base di enzimi retrogradi, che consente misurazioni simultanee di transitori di calcio e corrente di calcio di tipo L.
Abstract
I modelli murini svolgono un ruolo cruciale nella ricerca sull'aritmia e consentono di studiare i meccanismi chiave dell'aritmogenesi, tra cui l'alterata funzione dei canali ionici e la manipolazione del calcio. A tale scopo, sono necessari cardiomiociti atriali o ventricolari di alta qualità per eseguire misurazioni patch-clamp o per esplorare anomalie di manipolazione del calcio. Tuttavia, la resa limitata di cardiomiociti di alta qualità ottenuti dagli attuali protocolli di isolamento non consente entrambe le misurazioni nello stesso topo. Questo articolo descrive un metodo per isolare miociti atriali e ventricolari murini di alta qualità tramite perfusione di Langendorff basata su enzimi retrogradi, per successive misurazioni simultanee di transitori di calcio e corrente di calcio di tipo L da un animale. Si ottengono cuori di topo e l'aorta viene rapidamente incannulata per rimuovere il sangue. I cuori vengono quindi inizialmente perfusi con una soluzione priva di calcio (37 °C) per dissociare il tessuto a livello dei dischi intercalati e successivamente con una soluzione enzimatica contenente poco calcio per distruggere la matrice extracellulare (37 °C). Il cuore digerito viene successivamente sezionato in atri e ventricoli. I campioni di tessuto vengono tagliati in piccoli pezzi e sciolti mediante pipettaggio accurato su e giù. La digestione enzimatica viene interrotta e le cellule vengono gradualmente reintrodotte alle concentrazioni fisiologiche di calcio. Dopo il caricamento con un indicatore fluorescente Ca2+, i cardiomiociti isolati vengono preparati per la misurazione simultanea di correnti di calcio e transitori. Inoltre, vengono discusse le insidie dell'isolamento e vengono forniti protocolli patch-clamp e tracce rappresentative di correnti di calcio di tipo L con misurazioni simultanee dei transitori di calcio in miociti murini atriali e ventricolari isolati come descritto sopra.
Introduzione
Le aritmie cardiache sono comuni e rappresentano una delle principali sfide sanitarie attuali poiché colpiscono milioni di persone in tutto il mondo. Le aritmie sono associate ad elevata morbilità e mortalità 1,2 e rappresentano la causa sottostante della maggior parte delle morti cardiache improvvise3. Le opzioni di trattamento aggiornate hanno migliorato la sopravvivenza dei pazienti, ma sono ancora principalmente trattamenti sintomatici piuttosto che mirati ai meccanismi sottostanti. Pertanto, questi trattamenti hanno un'efficacia limitata e possono spesso causare gravi effetti collaterali 4,5,6. Un miglioramento delle attuali opzioni di trattamento richiede una comprensione della fisiopatologia sottostante, creando la necessità di modelli adatti da studiare. I piccoli modelli animali - e in particolare i modelli murini - svolgono un ruolo cruciale nella ricerca sull'aritmia in quanto consentono di studiare i meccanismi chiave dell'aritmogenesi, ad esempio l'impatto genetico sull'elettrofisiologia cellulare, la funzione dei canali ionici o la manipolazione del calcio 7,8.
A tale scopo sono necessari cardiomiociti atriali e ventricolari isolati di quantità e vitalità sufficienti. Un ampio spettro di diversi approcci di isolamento per ottenere miociti atriali e ventricolari è stato precedentemente descritto 9,10,11,12,13 e alcuni gruppi hanno presentato dati da misurazioni simultanee di transitori di calcio indotti da corrente di tipo L e transitori di calcio indotti da corrente atriale 14 o ventricolare 15 cardiomiociti murini. Tuttavia, per quanto ne sappiamo, non sono disponibili dati sulle misurazioni atriali e ventricolari di un animale. I ricercatori si concentrano su un'ampia varietà di argomenti che vanno dall'elettrofisiologia alla proteomica, studi funzionali come contrattilità cellulare o interazioni proteiche, funzione mitocondriale o genetica - tutti che necessitano di cardiomiociti isolati. Molti dei protocolli pubblicati non sono stati quindi sviluppati specificamente per gli studi sui patch morb, portando a rese limitate e qualità delle celle insufficiente per gli studi sui patch morb. Pertanto, le misurazioni simultanee di patch clamp e transitori di calcio di cellule atriali e ventricolari isolate da un animale non possono essere eseguite con protocolli stabiliti.
L'isolamento dei miociti murini, specialmente atriali, per gli esperimenti di patch clamp rimane impegnativo. Questo articolo fornisce un metodo semplice e veloce per l'isolamento di miociti atriali e ventricolari murini di alta qualità tramite perfusione di Langendorff basata su enzimi retrogradi, che consente successivamente misurazioni simultanee sia della corrente netta di membrana che dei transitori di calcio indotti dalla corrente da un animale. Questo articolo elabora un protocollo per l'isolamento di miociti atriali e ventricolari derivati da topi wild type e topi portatori di mutazioni genetiche. Questo protocollo può essere utilizzato sia per i topi maschi che per le femmine. L'isolamento dei miociti, le immagini e i risultati rappresentativi descritti di seguito sono stati ottenuti da topi selvatici tipo C57Bl/6 all'età di 6 (± 1) mesi. Tuttavia, questo protocollo è stato utilizzato con successo per topi di varie età che vanno da 2 a 24 mesi con genotipi diversi. La Figura 1 mostra la configurazione dell'isolamento e un primo piano di un cuore cannulato durante la perfusione enzimatica.
Protocollo
Tutte le procedure sugli animali sono state approvate dal Lower Saxony Animal Review Board (LAVES, AZ-18/2900) e sono state condotte in conformità con tutte le linee guida istituzionali, nazionali e internazionali per il benessere degli animali.
1. Predisposizioni
- Preparare 1 L di tampone di perfusione 10x (Tabella 1), 500 mL di tampone di perfusione 1x (Tabella 2), 50 mL di tampone di digestione (Tabella 3), 10 mL di tampone di arresto (Tabella 4), 1 L di soluzione di Tyrode (Tabella 5), 10 mL di ciascuna soluzione di fase di calcio (Soluzione di Tyrode con glucosio e la rispettiva quantità di calcio come indicato), 1 L di soluzione 4-AP (Tabella 5), 100 mL di soluzione per pipetta (Tabella 6) e 5 ml di acido pluronico secondo le ricette fornite.
NOTA: Le soluzioni da bagno (Tyrode e soluzione 4-AP) possono essere preparate (senza glucosio) in anticipo e conservate a +4 °C, il glucosio viene aggiunto il giorno sperimentale. La soluzione di pipetta può essere conservata a -20 °C, l'indicatore di calcio viene aggiunto il giorno sperimentale e la soluzione viene quindi conservata su ghiaccio fino a un ulteriore utilizzo. Il tampone di perfusione 10x può essere conservato a temperatura ambiente, il tampone di perfusione 1x, il tampone di digestione e il tampone di arresto devono essere preparati al momento il giorno sperimentale. - Accendere il bagno d'acqua e la pompa a rulli.
- Apparecchio Langendorff di preriempimento con tampone di perfusione; Assicurati che sia privo di aria.
- Preparare la cannula aortica fissandola sotto il microscopio a dissezione, collegare con una siringa da 1 mL riempita con tampone di perfusione e aria pulita risciacquando la cannula.
NOTA: È fondamentale evitare qualsiasi aria all'interno del sistema di perfusione, poiché ciò influenzerà direttamente la perfusione coronarica e quindi l'efficacia della digestione. Una trappola a bolle potrebbe essere aggiunta alla configurazione, se necessario, per evitare in modo sicuro qualsiasi intrappolamento d'aria. - Preparare le piastre di Petri con sufficiente tampone di perfusione per la raccolta degli organi e la microscopia (il tampone dovrebbe coprire saldamente l'intero organo, pochi millilitri – a seconda delle dimensioni della capsula di Petri utilizzata – dovrebbero essere sufficienti).
- Preparare 3 piastre di Petri con tampone di digestione per la dissociazione tissutale e la microscopia, il tampone deve coprire l'organo per la dissezione al microscopio all'interno della rispettiva capsula di Petri, la quantità dipende dalla dimensione della capsula di Petri utilizzata. Per la dissociazione utilizzare 3 ml per il tessuto ventricolare e 1,5 ml per il tessuto atriale.
2. Prelievo di organi
- Iniettare nel mouse 0,1 mL di eparina (1.000 U/mL) i.p. utilizzando una siringa da 1 mL con una cannula da 27 G e attendere 5-10 minuti.
- Posizionare il topo in una camera di induzione insieme a un piccolo tessuto imbevuto di circa 500 μL di isoflurano. L'animale non deve essere in contatto con il tessuto. Per evitare ciò, è possibile utilizzare una cassetta di plastica per incorporare biopsia per coprire il tessuto. Una volta che l'animale è completamente anestetizzato, controllare il riflesso del pizzico del dito del piede e non appena non è più presente, eutanasia rapidamente il topo per lussazione cervicale.
- Posizionare il mouse su una piattaforma sul dorso (ad esempio, su polistirolo coperto con un tovagliolo di carta) e fissare le zampe verso il basso con cannule per tenerlo in posizione.
- Rimuovere la pelliccia e la pelle che copre il torace e parte dell'addome con un taglio netto dal giugulo verso la sinfisi e aprire l'addome proprio sotto lo xifoide senza ferire alcuna struttura d'organo usando le forbici. Sollevare lo sterno con una pinza chirurgica e tagliare il diaframma con le forbici lungo il bordo delle costole, quindi tagliare le costole nella linea ascellare mediale e rimuovere la gabbia toracica per esporre il cuore.
- Rimuovere con attenzione il pericardio con una pinza smussata e rimuovere rapidamente il cuore sollevandolo con una pinza smussata dal basso e tagliando i grandi vasi con un singolo taglio usando le forbici.
- Mettere il cuore in tampone di perfusione a temperatura ambiente e cannulare l'aorta con un ago smussato al microscopio il più rapidamente possibile.
NOTA: Rimuovere qualsiasi tessuto polmonare e tessuto adiposo attaccato all'organo senza perdere troppo tempo su di esso. Durante l'incannulamento, assicurarsi che l'estremità dell'ago non si estenda attraverso la valvola aortica, poiché ciò comprometterà i risultati impedendo ai tamponi di entrare nelle arterie coronarie. - Legare saldamente il cuore con un pezzo di seta suturatrice all'ago e scollegare dalla siringa.
NOTA: L'intera procedura dall'ottenimento del cuore (il momento in cui i grandi vasi vengono tagliati) fino alla sutura dell'aorta all'ago dovrebbe richiedere il minor tempo possibile. Si raccomanda di non impiegare più di 90-180 s dalla rimozione del cuore fino all'inizio della perfusione.
3. Digestione enzimatica
- Dopo l'incannulamento aortico, collegare immediatamente il cuore cannulato all'apparato Langendorff evitando che l'aria entri nel sistema.
NOTA: Può essere utile avere una goccia sospesa di tampone di perfusione nella parte inferiore dell'apparecchio Langendorff e una goccia di tampone di perfusione posizionata sulla parte superiore dell'ago per evitare che l'aria entri nel sistema. - Perfondere il cuore con tampone di perfusione per 1 minuto ad una temperatura di esattamente 37 °C e una velocità di perfusione di esattamente 4 mL/min.
NOTA: Per avere una temperatura di 37 °C sulla punta dell'ago di perfusione, la temperatura del bagno d'acqua deve essere impostata leggermente al di sopra di circa 40 °C. Questo dovrebbe essere testato regolarmente misurando la temperatura sulla punta di perfusione. - Commutare la perfusione in tampone di digestione e perfondere per esattamente 9 minuti ad una temperatura di esattamente 37 °C e una velocità di perfusione di esattamente 4 mL/min.
- Trasferire il cuore digerito in una capsula di Petri con abbastanza tampone di digestione per mantenerlo completamente coperto. Quindi sezionare attentamente gli atri e i ventricoli al microscopio.
- Trasferire gli atri in una capsula di Petri con 1,5 ml di tampone di digestione e i ventricoli in un'altra capsula di Petri con 3 ml di tampone di digestione.
- Dissezione atriale
- Con attenzione, ma senza perdita di tempo, separare gli atri in piccoli pezzi usando una pinza smussata.
- Sciogliere il tessuto con attenzione su e giù utilizzando una punta da 1.000 μL, che è stata precedentemente tagliata per allargare l'apertura della punta.
- Trasferire la soluzione in una provetta da centrifuga da 15 mL e aggiungere una quantità equivalente di tampone di arresto (1,5 mL) mediante pipettaggio accurato sul lato del tubo per terminare la reazione.
- Passare con cautela tutti i 3 ml di soluzioni cellulari/tissutali attraverso una rete di nylon da 200 μm per rimuovere i restanti pezzi di tessuto più grandi che non sono stati completamente digeriti.
NOTA: Una digestione di successo non lascerà quasi nessun pezzo solido.
- Dissezione ventricolare
- Tritare rapidamente il tessuto ventricolare in piccoli pezzi usando forbici da dissezione e pipetta su e giù per dissolvere. Utilizzare un'altra punta per pipetta da 1.000 μL per il pipettaggio su e giù, può essere accorciata per allargare l'apertura.
- Trasferire la cellula/soluzione tissutale in una provetta da centrifuga da 15 mL e aggiungere una quantità equivalente di tampone di arresto (3 ml) mediante pipettaggio accurato sul lato del tubo per terminare la reazione.
- Passare con cautela tutti i 6 ml di soluzione cellulare/tissutale attraverso una rete di nylon da 200 μm per rimuovere i pezzi di tessuto più grandi che non sono stati completamente digeriti.
NOTA: Una digestione di successo non lascerà quasi nessun pezzo solido.
- Lasciare entrambi i tubi (sospensione di cellule atriali e ventricolari) sul banco a temperatura ambiente per 6 minuti per sedimentare.
- Centrifugare entrambi i tubi da 15 ml a 5 x g per 2 minuti.
4. Reintroduzione del calcio
NOTA: I seguenti passaggi sono identici sia per le cellule atriali che per quelle ventricolari (se non diversamente specificato) e vengono eseguiti a temperatura ambiente.
- Eliminare il surnatante con una pipetta Pasteur di plastica e risospendere accuratamente il pellet in 10 mL di soluzione di Tyrode senza calcio.
- Lasciare le cellule per 8 minuti per la sedimentazione.
- Centrifugare a 5 x g per 1 minuto (solo cellule atriali, la sedimentazione è sufficiente per le cellule ventricolari).
- Eliminare il surnatante e risospendere accuratamente il pellet in 10 mL di soluzione di Tyrode con concentrazione di calcio di 100 μM.
- Lasciare le cellule per 8 minuti per la sedimentazione.
- Centrifugare a 5 x g per 1 minuto (solo cellule atriali, la sedimentazione è sufficiente per le cellule ventricolari).
- Eliminare il surnatante e risospendere accuratamente il pellet in 10 mL di soluzione di Tyrode con concentrazione di calcio di 400 μM.
- Lasciare le cellule per 8 minuti per la sedimentazione.
- Centrifugare a 5 x g per 1 minuto (solo cellule atriali, la sedimentazione è sufficiente per le cellule ventricolari).
- Scartare il surnatante e risospendere con cautela il pellet in 1 mL (atriale)/ 5 mL (ventricolare) di soluzione di Tyrode con concentrazione di calcio di 1 mM.
5. Carico di miociti con indicatore di calcio fluorescente Fluo-3 AM
NOTA: A causa della sensibilità alla luce dell'indicatore fluorescente di calcio, i seguenti passaggi devono essere eseguiti protetti dalla luce (ad esempio, coprendo i tubi con un foglio di alluminio).
- Preparare la soluzione madre di Fluo-3 AM aggiungendo 44 μL di F-127 pluronico al 20% in DMSO anidro a 50 μg di Fluo-3AM (può essere conservato a -20 °C al riparo dalla luce).
- Aggiungere 10 μL di soluzione madre Fluo-3 AM a 1 mL di sospensione cellulare e incubare per 10 minuti a temperatura ambiente al riparo dalla luce.
- Centrifugare a 5 x g per 1 min.
- Scartare il surnatante con una pipetta Pasteur di plastica e risospendere il pellet in una quantità ragionevole di soluzione di bagno per ottenere una buona concentrazione di lavoro (1-5 ml di soluzione di bagno a seconda della densità cellulare).
- Lasciare agire per 30 minuti per la deesterificazione prima di iniziare con gli esperimenti.
6. Misurazioni simultanee di patch-clamp e transitori di Ca2+ epifluorescenti come descritto in precedenza16
NOTA: Le misurazioni dei morsetti patch non sono l'argomento di questo articolo, il lettore interessato può essere rimandato alle principali pubblicazioni che forniscono descrizioni approfondite di questo metodo 17,18,19,20,21,22. Tuttavia, per una migliore comprensione generale, viene fornito un riassunto su un protocollo per misurare le correnti di calcio di tipo L insieme ai transitori di calcio indotti dalla corrente.
- Trasferire i miociti in una camera cellulare e superfondere con soluzione di bagno a 37 °C.
- Bloccare le correnti di potassio aggiungendo 4-amminopiridina e cloruro di bario alla soluzione del bagno come indicato nella Tabella 5.
- Assicurarsi che i microelettrodi borosilicati abbiano una resistenza della punta di 2-5 MΩ riempiti con soluzione di pipetta (Tabella 6).
- Impostare le misure per consentire la registrazione simultanea di segnali elettrici ed epifluorescenza allo stesso tempo. La modalità di morsetto di tensione viene utilizzata per misurare la corrente Ca2+ di tipo L con un protocollo che mantiene la cella a -80 mV e un impulso di rampa di 600 ms a -40 mV per inattivare la corrente veloce Na+, seguita da un impulso di prova di 100 ms a +10 mV a 0,5 Hz (Figura 2).
- Utilizzare l'eccitazione a 488 nm, la luce emessa a <520 nm per rilevare e convertire in [Ca2+]I assumendo
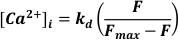
Dove kd = costante di dissociazione di Fluo-3 (864 nM), F = fluorescenza Fluo-3; Fmax = fluorescenza satura di Ca2+ ottenuta alla fine di ogni esperimento19.
Risultati
La resa di isolamento viene determinata dopo la reintroduzione del calcio pipettando 10 μL di sospensione cellulare su un vetrino da microscopio. Più di 100 cellule vitali, a forma di bastoncello, non contraenti/10 μL per l'isolamento delle cellule atriali e più di 1.000 cellule vitali, a forma di bastoncello, non contraenti/10 μL per l'isolamento delle cellule ventricolari sono considerate come resa sufficiente e sono comunemente ottenute utilizzando questo protocollo. Le cellule atriali ottenute con questo protoco...
Discussione
Questo articolo fornisce un modo semplice e funzionale per ottenere miociti atriali e ventricolari di alta qualità dallo stesso topo per studi patch-clamp con registrazioni simultanee di transitori di calcio. La qualità dei dati ottenuti dipende fortemente dalla qualità dell'isolamento cellulare. Come accennato in precedenza, molti metodi per isolare cardiomiociti murini sono stati descritti in precedenza 9,10,11,12.
Divulgazioni
Nessuno
Riconoscimenti
Questo lavoro è stato sostenuto dalla German Research Foundation (DFG; Clinician Scientist Program In Vascular Medicine (PRIME), MA 2186/14-1 a P. Tomsits e D. Schüttler; VO1568/3-1, progetto IRTG1816 e SFB1002 A13 a N. Voigt), Fondazione tedesca per la ricerca nell'ambito della strategia di eccellenza tedesca (EXC 2067/1- 390729940 a N. Voigt), Centro tedesco per la ricerca cardiovascolare (DZHK; 81X2600255 a S. Clauss e N. Voigt; 81Z0600206 a S. Kääb), la Fondazione Corona (S199/10079/2019 a S. Clauss), l'ERA-NET sulle malattie cardiovascolari (ERA-CVD; 01KL1910 a S. Clauss), la Heinrich-and-Lotte-Mühlfenzl Stiftung (a S. Clauss) e la Fondazione Else-Kröner-Fresenius (EKFS 2016_A20 a N. Voigt). I finanziatori non hanno avuto alcun ruolo nella preparazione dei manoscritti.
Materiali
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
Riferimenti
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106 (2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588 (2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224 (2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688 (2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145 (2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227 (2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235 (2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon