Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de miocitos aurículas y ventriculares murinas de alta calidad para mediciones simultáneas de transitorios de Ca2+ y corriente de calcio tipo L
* Estos autores han contribuido por igual
En este artículo
Resumen
Los modelos de ratón permiten estudiar los mecanismos clave de la arritmogénesis. Para este propósito, los cardiomiocitos de alta calidad son necesarios para realizar mediciones de parche y pinza. Aquí, se describe un método para aislar miocitos aurinos y ventriculares a través de la perfusión de Langendorff retrógrada basada en enzimas, que permite mediciones simultáneas de transitorios de calcio y corriente de calcio de tipo L.
Resumen
Los modelos de ratón desempeñan un papel crucial en la investigación de la arritmia y permiten estudiar los mecanismos clave de la arritmogénesis, incluida la función alterada del canal iónico y el manejo del calcio. Para este propósito, los cardiomiocitos auriculares o ventriculares de alta calidad son necesarios para realizar mediciones de patch-clamp o para explorar anomalías en el manejo del calcio. Sin embargo, el rendimiento limitado de cardiomiocitos de alta calidad obtenidos por los protocolos de aislamiento actuales no permite ambas mediciones en el mismo ratón. Este artículo describe un método para aislar miocitos aurinos y ventriculares murinos de alta calidad mediante perfusión de Langendorff retrógrada basada en enzimas, para mediciones simultáneas posteriores de transitorios de calcio y corriente de calcio tipo L de un animal. Se obtienen corazones de ratón y la aorta se canula rápidamente para eliminar la sangre. Los corazones se perfunden inicialmente con una solución libre de calcio (37 °C) para disociar el tejido a nivel de discos intercalados y luego con una solución enzimática que contiene poco calcio para alterar la matriz extracelular (37 °C). El corazón digerido se disecciona posteriormente en aurículas y ventrículos. Las muestras de tejido se cortan en trozos pequeños y se disuelven pipeteando cuidadosamente hacia arriba y hacia abajo. La digestión enzimática se detiene, y las células se reintroducen gradualmente a las concentraciones fisiológicas de calcio. Después de cargar con un indicador fluorescente de Ca2+, los cardiomiocitos aislados se preparan para la medición simultánea de corrientes y transitorios de calcio. Además, se discuten las trampas de aislamiento y se proporcionan protocolos de patch-clamp y trazas representativas de corrientes de calcio tipo L con mediciones transitorias simultáneas de calcio en miocitos murinos auriculares y ventriculares aislados como se describió anteriormente.
Introducción
Las arritmias cardíacas son comunes y uno de los principales desafíos actuales de atención médica, ya que afectan a millones de personas en todo el mundo. Las arritmias se asocian con alta morbilidad y mortalidad 1,2 y representan la causa subyacente de la mayoría de las muertes súbitas cardíacas3. Las opciones de tratamiento actualizadas han mejorado la supervivencia del paciente, pero siguen siendo principalmente tratamientos sintomáticos en lugar de dirigirse a los mecanismos subyacentes. Por lo tanto, estos tratamientos tienen una eficacia limitada y con frecuencia pueden causar efectos secundarios graves 4,5,6. Una mejora de las opciones de tratamiento actuales requiere una visión de la fisiopatología subyacente, creando la necesidad de modelos adecuados para estudiar. Los modelos de animales pequeños, y específicamente los modelos de ratón, desempeñan un papel crucial en la investigación de arritmias, ya que permiten estudiar mecanismos clave de la arritmogénesis, por ejemplo, el impacto genético en la electrofisiología celular, la función del canal iónico o el manejo del calcio 7,8.
Para ello, se requieren cardiomiocitos auriculares y ventriculares aislados de cantidad y viabilidad suficientes. Se ha descrito previamente un amplio espectro de diferentes enfoques de aislamiento para obtener miocitos auriculares y ventriculares 9,10,11,12,13 y algunos grupos han presentado datos de mediciones simultáneas de corrientes de tipo L y transitorios de calcio inducidos por corriente de calcio de atrial 14 o ventricular 15 Cardiomiocitos murinos. Sin embargo, hasta donde sabemos, no hay datos disponibles de mediciones auriculares y ventriculares de un animal. Los investigadores se centran en una amplia variedad de temas que van desde la electrofisiología hasta la proteómica, estudios funcionales como la contractilidad celular o las interacciones de proteínas, la función mitocondrial o la genética, todos con necesidad de cardiomiocitos aislados. Por lo tanto, muchos de los protocolos publicados no se han desarrollado específicamente para estudios de pinza de parche, lo que lleva a rendimientos limitados y calidad celular insuficiente para estudios de pinza de parche. Por lo tanto, las mediciones simultáneas de pinza de parche y transitorios de calcio de células auriculares y ventriculares aisladas de un animal no se pueden realizar con los protocolos establecidos.
El aislamiento de miocitos murinos, especialmente auriculares, para experimentos de pinza de parche sigue siendo un desafío. Este artículo proporciona un método simple y rápido para el aislamiento de miocitos aurinos y ventriculares murinos de alta calidad a través de la perfusión de Langendorff basada en enzimas retrógradas, que posteriormente permite mediciones simultáneas de la corriente neta de la membrana y los transitorios de calcio inducidos por la corriente de un animal. Este artículo elabora un protocolo para el aislamiento de miocitos auriculares y ventriculares derivados de ratones de tipo salvaje y ratones portadores de mutaciones genéticas. Este protocolo se puede utilizar para ratones machos y hembras por igual. El aislamiento de miocitos, las imágenes y los resultados representativos que se describen a continuación se obtuvieron de ratones salvajes tipo C57Bl / 6 a la edad de 6 (± 1) meses. Sin embargo, este protocolo se ha utilizado con éxito en ratones de varias edades que van de 2 a 24 meses con diferentes genotipos. La figura 1 muestra la configuración de aislamiento y un primer plano de un corazón canulado durante la perfusión enzimática.
Protocolo
Todos los procedimientos con animales fueron aprobados por la Junta de Revisión de Animales de Baja Sajonia (LAVES, AZ-18/2900) y se llevaron a cabo de acuerdo con todas las directrices institucionales, nacionales e internacionales para el bienestar animal.
1. Preacuerdos
- Preparar 1 L de tampón de perfusión 10x (Tabla 1), 500 ml de 1x tampón de perfusión (Tabla 2), 50 ml de tampón de digestión (Tabla 3), 10 ml de tampón de parada (Tabla 4), 1 L de solución de Tyrode (Tabla 5), 10 ml de cada solución escalonada de calcio (solución de Tyrode con glucosa y la cantidad respectiva de calcio según se indique), 1 L de solución de 4-AP (Tabla 5), 100 ml de solución de pipeta (Tabla 6) y 5 ml de ácido plurónico según las recetas proporcionadas.
NOTA: Las soluciones de baño (Tyrode y solución 4-AP) se pueden preparar (sin glucosa) por adelantado y almacenar a +4 °C, la glucosa se agrega el día experimental. La solución de pipeta se puede almacenar a -20 °C, el indicador de calcio se añade el día experimental y la solución se almacena en hielo hasta su uso posterior. El tampón de perfusión 10x se puede almacenar a temperatura ambiente, el tampón de perfusión 1x, el tampón de digestión y el tampón de parada deben prepararse recién en el día experimental. - Encienda el baño de agua y la bomba de rodillos.
- Prellenar el aparato de Langendorff con tampón de perfusión; Asegúrese de que esté libre de aire.
- Prepare la cánula aórtica fijándola bajo el microscopio de disección, conéctela con una jeringa de 1 ml llena de tampón de perfusión y limpie el aire enjuagando la cánula.
NOTA: Es crucial evitar cualquier aire dentro del sistema de perfusión, ya que esto afectará directamente la perfusión coronaria y, por lo tanto, la efectividad de la digestión. Se puede agregar una trampa de burbujas a la configuración si es necesario, para evitar de manera segura cualquier atrapamiento de aire. - Prepare placas de Petri con suficiente tampón de perfusión para la recolección de órganos y microscopía (el tampón debe cubrir de forma segura todo el órgano, unos pocos mililitros, dependiendo del tamaño de la placa de Petri utilizado, deberían ser suficientes).
- Prepare 3 placas de Petri con tampón de digestión para disociación de tejidos y microscopía, el tampón debe cubrir el órgano para la disección bajo el microscopio dentro de la placa de Petri respectiva, la cantidad depende del tamaño de la placa de Petri utilizada. Para la disociación use 3 mL para el tejido ventricular y 1.5 mL para el tejido auricular.
2. Sustracción de órganos
- Inyecte al ratón con 0,1 ml de heparina (1.000 U/ml) i.p. usando una jeringa de 1 ml con una cánula de 27 G y espere de 5 a 10 min.
- Coloque el ratón en una cámara de inducción junto con un pequeño tejido empapado en aproximadamente 500 μL de isoflurano. El animal no debe estar en contacto con el tejido. Para evitar eso, uno puede usar un casete de incrustación de biopsia plástica para cubrir el tejido. Una vez que el animal esté completamente anestesiado, verifique el reflejo de pellizco del dedo del pie y tan pronto como ya no esté presente, eutanasia rápidamente al ratón por dislocación cervical.
- Coloque el ratón en una plataforma sobre su espalda (por ejemplo, sobre espuma de poliestireno cubierta con una toalla de papel) y fije las patas hacia abajo con cánulas para mantenerlo en su lugar.
- Retire el pelaje y la piel que cubren el pecho y parte del abdomen con un corte claro desde el yugulo hacia la sínfisis y abra el abdomen justo debajo del xifoide sin dañar ninguna estructura de órgano con tijeras. Levante el esternón con fórceps quirúrgicos y corte el diafragma con tijeras a lo largo del borde de las costillas, luego corte las costillas en línea axilar medial y retire la caja torácica para exponer el corazón.
- Retire con cuidado el pericardio con pinzas romas y retire rápidamente el corazón levantándolo con pinzas romas desde abajo y cortando los vasos grandes con un solo corte con tijeras.
- Coloque el corazón en tampón de perfusión a temperatura ambiente y canule la aorta con una aguja roma bajo el microscopio lo más rápido posible.
NOTA: Retire cualquier tejido pulmonar y tejido graso adherido al órgano sin perder demasiado tiempo en él. Mientras canula, asegúrese de que el extremo de la aguja no se extienda a través de la válvula aórtica, ya que esto perjudicará los resultados al evitar que los amortiguadores entren en las arterias coronarias. - Ate el corazón con un trozo de seda de sutura firmemente a la aguja y desconéctelo de la jeringa.
NOTA: Todo el procedimiento desde la obtención del corazón (el momento en que se cortan los vasos grandes) hasta la sutura de la aorta a la aguja debe tomar el menor tiempo posible. Se recomienda no tomar más de 90-180 s desde la extracción del corazón hasta el inicio de la perfusión.
3. Digestión enzimática
- Después de la canulación aórtica, conecte inmediatamente el corazón canulado al aparato de Langendorff evitando que entre aire en el sistema.
NOTA: Puede ser útil tener una gota colgante de tampón de perfusión en la parte inferior del aparato de Langendorff, así como una gota de tampón de perfusión en la parte superior de la aguja para evitar que entre aire en el sistema. - Perfundir el corazón con tampón de perfusión durante 1 min a una temperatura de exactamente 37 °C y una velocidad de perfusión de exactamente 4 mL/min.
NOTA: Para tener una temperatura de 37 °C en la punta de la aguja de perfusión, la temperatura del baño de agua debe ajustarse ligeramente por encima de aproximadamente 40 °C. Esto debe probarse regularmente midiendo la temperatura en la punta de perfusión. - Cambie la perfusión a tampón de digestión y perfunda durante exactamente 9 minutos a una temperatura de exactamente 37 °C y una velocidad de perfusión de exactamente 4 ml / min.
- Transfiera el corazón digerido a una placa de Petri con suficiente tampón de digestión para mantenerlo completamente cubierto. Luego disecciona cuidadosamente las aurículas y los ventrículos bajo el microscopio.
- Transfiera las aurículas a una placa de Petri con 1,5 ml de tampón de digestión y los ventrículos a otra placa de Petri con 3 ml de tampón de digestión.
- Disección auricular
- Con cuidado, pero sin pérdida de tiempo, separe las aurículas en pedazos pequeños con pinzas romas.
- Disuelva el tejido pipeteando cuidadosamente hacia arriba y hacia abajo con una punta de pipeta de 1.000 μL, que se ha cortado previamente para ensanchar la abertura de la punta.
- Transfiera la solución a un tubo de centrífuga de 15 ml y agregue una cantidad equivalente de tampón de parada (1,5 ml) pipeteando cuidadosamente hacia abajo en el lado del tubo para finalizar la reacción.
- Pase cuidadosamente los 3 ml de soluciones celulares/tisulares a través de una malla de nylon de 200 μm para eliminar los trozos de tejido más grandes restantes que no se hayan digerido completamente.
NOTA: Una digestión exitosa no dejará casi trozos sólidos.
- Disección ventricular
- Pique rápidamente el tejido ventricular en trozos pequeños con tijeras de disección y pipeta hacia arriba y hacia abajo para disolver. Utilice otra punta de pipeta de 1.000 μL para pipetear hacia arriba y hacia abajo, puede acortarse para ensanchar la abertura.
- Transfiera la solución celular/tisular a un tubo de centrífuga de 15 ml y agregue una cantidad equivalente de tampón de parada (3 ml) pipeteando cuidadosamente hacia abajo en el lado del tubo para finalizar la reacción.
- Pase cuidadosamente los 6 ml de solución celular/tisular a través de una malla de nylon de 200 μm para eliminar los trozos de tejido más grandes que no se hayan digerido completamente.
NOTA: Una digestión exitosa no dejará casi trozos sólidos.
- Deje ambos tubos (suspensión de células auriculares y ventriculares) en el banco a temperatura ambiente durante 6 minutos para que se asienten.
- Centrifugar ambos tubos de 15 ml a 5 x g durante 2 min.
4. Reintroducción del calcio
NOTA: Los siguientes pasos son idénticos para las células auriculares y ventriculares (a menos que se indique lo contrario) y se realizan a temperatura ambiente.
- Deseche el sobrenadante con una pipeta plástica Pasteur y resuspenda cuidadosamente el pellet en 10 ml de solución Tyrode sin calcio.
- Deje las celdas durante 8 minutos para la sedimentación.
- Centrifugar a 5 x g durante 1 min (solo células auriculares, la sedimentación es suficiente para las células ventriculares).
- Deseche el sobrenadante y vuelva a suspender cuidadosamente el pellet en 10 ml de solución de Tyrode con una concentración de calcio de 100 μM.
- Deje las celdas durante 8 minutos para la sedimentación.
- Centrifugar a 5 x g durante 1 min (solo células auriculares, la sedimentación es suficiente para las células ventriculares).
- Deseche el sobrenadante y vuelva a suspender cuidadosamente el pellet en 10 ml de solución de Tyrode con una concentración de calcio de 400 μM.
- Deje las celdas durante 8 minutos para la sedimentación.
- Centrifugar a 5 x g durante 1 min (solo células auriculares, la sedimentación es suficiente para las células ventriculares).
- Deseche el sobrenadante y resuspenda cuidadosamente el pellet en 1 ml (auricular) / 5 ml (ventricular) de solución Tyrode con una concentración de calcio de 1 mM.
5. Carga de miocitos con indicador de calcio fluorescente Fluo-3 AM
NOTA: Debido a la sensibilidad a la luz del indicador de calcio fluorescente, los siguientes pasos deben ejecutarse protegidos de la luz (por ejemplo, cubriendo los tubos con papel de aluminio).
- Preparar la solución madre de Fluo-3 AM añadiendo 44 μL de plurónico F-127 al 20% en DMSO anhidro a 50 μg de Fluo-3AM (puede conservarse a -20 °C protegido de la luz).
- Añadir 10 μL de solución madre de Fluo-3 AM a 1 ml de suspensión celular e incubar durante 10 min a temperatura ambiente protegido de la luz.
- Centrifugar a 5 x g durante 1 min.
- Deseche el sobrenadante con una pipeta plástica Pasteur y vuelva a suspender el pellet en una cantidad razonable de solución de baño para obtener una buena concentración de trabajo (1-5 ml de solución de baño dependiendo de la densidad celular).
- Dejar actuar durante 30 minutos para la desesterificación antes de comenzar con los experimentos.
6. Mediciones simultáneas de patch-clamp y Ca2+-transitorio epifluorescente como se describió anteriormente16
NOTA: Las mediciones de pinzas de parche no son el tema de este artículo, el lector interesado puede ser referido a las principales publicaciones que proporcionan descripciones detalladas de este método 17,18,19,20,21,22. Sin embargo, para una mejor comprensión general, se proporciona un resumen de un protocolo para medir las corrientes de calcio de tipo L junto con los transitorios de calcio inducidos por corriente.
- Transfiera los miocitos a una cámara celular y superfunda con una solución de baño a 37 °C.
- Bloquear las corrientes de potasio añadiendo 4-aminopiridina y cloruro de bario a la solución de baño como se indica en la Tabla 5.
- Asegúrese de que los microelectrodos de borosilicato tengan una resistencia de punta de 2-5 MΩ llena con solución de pipeta (Tabla 6).
- Configure las mediciones para permitir el registro simultáneo de señales eléctricas y epifluorescencia al mismo tiempo. El modo de abrazadera de voltaje se utiliza para medir la corriente Ca2+ de tipo L con un protocolo que mantiene la celda a -80 mV y un pulso de rampa de 600 ms a -40 mV para inactivar la corriente rápida de Na+, seguido de un pulso de prueba de 100 ms a +10 mV a 0.5 Hz (Figura 2).
- Utilice la excitación a 488 nm, emita luz a <520 nm para detectar y convertir a [Ca2+]I suponiendo
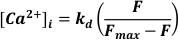
Donde kd = constante de disociación de Fluo-3 (864 nM), F = fluorescencia de Fluo-3; Fmax = Ca2+-fluorescencia saturada obtenida al final de cada experimento19.
Resultados
El rendimiento de aislamiento se determina después de la reintroducción de calcio mediante el pipeteo de 10 μL de suspensión celular en un portaobjetos de microscopio. Más de 100 células viables, en forma de bastón, no contraídas/10 μL para el aislamiento de células auriculares y más de 1.000 células viables, en forma de bastón, no contraídas/10 μL para el aislamiento de células ventriculares se consideran rendimiento suficiente y se obtienen comúnmente utilizando este protocolo. Las células auriculares...
Discusión
Este artículo proporciona una manera fácil y funcional de obtener miocitos auriculares y ventriculares de alta calidad del mismo ratón para estudios de parche y pinza con registros transitorios de calcio simultáneos. La calidad de los datos obtenidos depende en gran medida de la calidad del aislamiento celular. Como se mencionó anteriormente, muchos métodos para aislar cardiomiocitos murinos han sido descritos previamente 9,10,11,12.
Divulgaciones
Ninguno
Agradecimientos
Este trabajo fue apoyado por la Fundación Alemana de Investigación (DFG; Clinician Scientist Program In Vascular Medicine (PRIME), MA 2186/14-1 a P. Tomsits y D. Schüttler; VO1568/3-1, IRTG1816 y SFB1002 proyecto A13 a N. Voigt), Fundación Alemana de Investigación bajo la Estrategia de Excelencia de Alemania (EXC 2067/1- 390729940 a N. Voigt), Centro Alemán de Investigación Cardiovascular (DZHK; 81X2600255 a S. Clauss y N. Voigt; 81Z0600206 a S. Kääb), la Fundación Corona (S199/10079/2019 a S. Clauss), la ERA-NET sobre Enfermedades Cardiovasculares (ERA-CVD; 01KL1910 a S. Clauss), la Heinrich-and-Lotte-Mühlfenzl Stiftung (a S. Clauss) y la Fundación Else-Kröner-Fresenius (EKFS 2016_A20 a N. Voigt). Los financiadores no tuvieron ningún papel en la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Sigma-Aldrich | 31550 | |
| 27G cannula | Servoprax | L10220 | |
| 4-Aminopyridine | Sigma-Aldrich | A78403 | |
| Anhydrous DMSO | Sigma-Aldrich | D12345 | |
| Aortic cannula | Radnoti | 130163-20 | |
| BaCl2 | Sigma-Aldrich | 342920 | |
| blunt surgical forceps | Kent Scientific | INS650915-4 | |
| Bovine Calf Serum | Sigma-Aldrich | 12133C | |
| CaCl2 | Sigma-Aldrich | C5080 | |
| Circulating heated water bath | Julabo | ME | |
| Collagenase Type II | Worthington | LS994177 | |
| disscetion scissors | Kent Scientific | INS600124 | |
| DL-aspartat K+-salt | Sigma-Aldrich | A2025 | |
| EGTA | Sigma-Aldrich | E4378 | |
| Fluo-3 | Invitrogen | F3715 | |
| Fluo-3 AM | Invitrogen | F1242 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Guanosine 5′-triphosphate tris salt | Sigma-Aldrich | G9002 | |
| Heating coil | Radnoti | 158821 | |
| Heparin | Ratiopharm | 25.000 IE/5ml | |
| HEPES | Sigma-Aldrich | H9136 | |
| induction chamber | CWE incorporated | 13-40020 | |
| Isoflurane | Cp-pharma | 1214 | |
| Jacketed heart chamber | Radnoti | 130160 | |
| KCl | Merck | 1049360250 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| MgCl x 6H2O | Sigma-Aldrich | M0250 | |
| MgSO4 x 7H2O | Sigma-Aldrich | M9397 | |
| Na2ATP | Sigma-Aldrich | A2383 | |
| Na2HPO4 x 2H2O | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Nylon mesh (200 µm) | VWR-Germany | 510-9527 | |
| pasteur pipette | Sigma Aldrich | Z331759 | |
| petri-dishes | Thermo Fisher | 150318 | |
| Pluronic Acid F-127 | Sigma-Aldrich | P2443 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| Roller Pump | Ismatec | ISM597D | |
| surgical forceps | Kent Scientific | INS650908-4 | |
| surgical scissors | Kent Scientific | INS700540 | |
| suturing silk | Fine Science Tools | NC9416241 | |
| syringe | Merck | Z683531-100EA | |
| Taurin | Sigma-Aldrich | 86330 |
Referencias
- Camm, A. J., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace. 12 (10), 1360-1420 (2010).
- Chugh, S. S., et al. Worldwide epidemiology of atrial fibrillation: a global burden of disease 2010 study. Circulation. 129 (8), 837-847 (2014).
- Tonchev, I., Luria, D., Orenstein, D., Lotan, C., Biton, Y. For whom the bell tolls : Refining risk assessment for sudden cardiac death. Current Cardiology Reports. 21 (9), 106 (2019).
- Kirchhof, P., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal. 37 (38), 2893-2962 (2016).
- Dobrev, D., Nattel, S. New antiarrhythmic drugs for treatment of atrial fibrillation. Lancet. 375 (9721), 1212-1223 (2010).
- Heijman, J., Voigt, N., Carlsson, L. G., Dobrev, D. Cardiac safety assays. Current opinion in pharmacology. 15, 16-21 (2014).
- Schüttler, D., et al. Animal models of atrial fibrillation. Circulation Research. 127 (1), 91-110 (2020).
- Clauss, S., et al. Animal models of arrhythmia: classic electrophysiology to genetically modified large animals. Nature Reviews. Cardiology. 16 (8), 457-475 (2019).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Jansen, H. J., Rose, R. A. Isolation of atrial myocytes from adult mice. Journal of Visualized Experiments. (149), e59588 (2019).
- Blackwood, E. A., Bilal, A. S., Azizi, K., Sarakki, A., Glembotski, C. C. Simultaneous isolation and culture of atrial myocytes, ventricular myocytes, and non-myocytes from an adult mouse heart. Journal of Visualized Experiments. (160), e61224 (2020).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Report. 6 (9), 13688 (2018).
- Köhncke, C., et al. Isolation and Kv channel recordings in murine atrial and ventricular cardiomyocytes. Journal of Visualized Experiments. (73), e50145 (2013).
- Brandenburg, S., et al. Axial tubule junctions activate atrial Ca(2+) release across species. Frontiers in Physiology. 9, 1227 (2018).
- Hofhuis, J., et al. Dysferlin links excitation-contraction coupling to structure and maintenance of the cardiac transverse-axial tubule system. Europace. 22 (7), 1119-1131 (2020).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiment. (77), e50235 (2013).
- Voigt, N., Makary, S., Nattel, S., Dobrev, D. Voltage-clamp-based methods for the detection of constitutively active acetylcholine-gated I(K,ACh) channels in the diseased heart. Methods in Enzymology. 484, 653-675 (2010).
- Voigt, N., Nattel, S., Dobrev, D. Proarrhythmic atrial calcium cycling in the diseased heart. Advances in Experimental Medicine and Biology. 740, 1175-1191 (2012).
- Trafford, A. W., Díaz, M. E., Eisner, D. A. A novel, rapid and reversible method to measure Ca buffering and time-course of total sarcoplasmic reticulum Ca content in cardiac ventricular myocytes. Pflugers Archiv: European Journal of Physiology. 437 (3), 501-503 (1999).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. European Journal of Physiology. 391 (2), 85-100 (1981).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , (2020).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15 (5), 415-422 (2010).
- Plačkić, J., Kockskämper, J. Isolation of atrial and ventricular cardiomyocytes for in vitro studies. Methods in Molecular Biology. 1816, 39-54 (2018).
- Díaz, M. E., Trafford, A. W., Eisner, D. A. The effects of exogenous calcium buffers on the systolic calcium transient in rat ventricular myocytes. Biophysical Journal. 80 (4), 1915-1925 (2001).
- Zimmerman, A. N., Hülsmann, W. C. Paradoxical influence of calcium ions on the permeability of the cell membranes of the isolated rat heart. Nature. 211 (5049), 646-647 (1966).
- Chen, X., O'Connell, T. D., Xiang, Y. K. With or without Langendorff: A new method for adult myocyte isolation to be tested with time. Circulation Research. 119 (8), 888-890 (2016).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Brack, K. E., Narang, R., Winter, J., Ng, G. A. The mechanical uncoupler blebbistatin is associated with significant electrophysiological effects in the isolated rabbit heart. Experiment in Physiology. 98 (5), 1009-1027 (2013).
- Seibertz, F., Reynolds, M., Voigt, N. Single-cell optical action potential measurement in human induced pluripotent stem cell-derived cardiomyocytes. Journal of Visual Experiment. , e61890 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados