A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وضع العلامات التساهمية مع ديثيلبيروبونات لدراسة بنية البروتين الأعلى ترتيبا حسب قياس الطيف الكتلي
In This Article
Summary
يتم وصف الإجراءات التجريبية لأداء الوسم التساهمي القائم على النظام الغذائي مع الكشف الطيفي الشامل. يتم خلط Diethylpyrocarbonate ببساطة مع مجمع البروتين أو البروتين من الفائدة، مما يؤدي إلى تعديل بقايا الأحماض الأمينية المذيبات التي يمكن الوصول إليها. ويمكن تحديد المخلفات المعدلة بعد الهضم البروتيولي وتحليل الكروماتوغرافيا السائلة/قياس الطيف الكتلي.
Abstract
إن توصيف بنية البروتين ذات الترتيب الأعلى أمر ضروري لفهم وظيفته. وقد برز قياس الطيف الكتلي كأداة قوية لهذا الغرض، وخاصة بالنسبة لأنظمة البروتين التي يصعب دراستها بالطرق التقليدية. لدراسة بنية البروتين عن طريق التصلب المتعدد ، يتم إجراء تفاعلات كيميائية محددة في محلول يشفر المعلومات الهيكلية للبروتين في كتلته. أحد النهج الفعالة بشكل خاص هو استخدام الكواشف التي تعدل بشكل مشترك المذيبات سلاسل جانبية من الأحماض الأمينية يمكن الوصول إليها. تؤدي ردود الفعل هذه إلى زيادات كتلية يمكن توطينها بدقة على مستوى المخلفات عند دمجها مع الهضم البروتيوليكي وقياس الطيف الكتلي المترادف. هنا، نحن نصف البروتوكولات المرتبطة باستخدام ديثيليبيروكربونات (DEPC) ككواشف وضع العلامات التساهمية جنبا إلى جنب مع الكشف عن مرض التصلب العصبي المتعدد. DEPC هو جزيء كهربائي للغاية قادر على وضع علامات تصل إلى 30٪ من المخلفات في البروتين المتوسط ، وبالتالي توفير دقة هيكلية ممتازة. وقد استخدمت DEPC بنجاح جنبا إلى جنب مع مرض التصلب العصبي المتعدد للحصول على معلومات هيكلية للبروتينات الصغيرة ذات المجال الواحد، مثل β2-microglobulin، إلى البروتينات الكبيرة متعددة المجالات، مثل الأجسام المضادة أحادية النسيلة.
Introduction
البروتينات هي الجزيئات الحيوية الأساسية في كل عملية فسيولوجية تقريبا. إن تنوع الوظائف التي تؤديها البروتينات ممكن بسبب الهياكل التي تعتمدها والتفاعلات التي لديها مع الجزيئات الحيوية الأخرى. لفهم وظيفة البروتين على مستوى أعمق، هناك حاجة إلى أدوات بيوكيميائية وبيولوجية فيزيائية لتوضيح هذه السمات والتفاعلات الهيكلية الهامة. تقليديا، قدمت الأشعة السينية البلورية، المجهر الإلكتروني المبرد، والرنين المغناطيسي النووي (NMR) الطيفية التفاصيل المطلوبة على المستوى الذري للكشف عن بنية البروتين. ومع ذلك، لا يمكن استجواب العديد من أنظمة البروتين من خلال هذه التقنيات بسبب سوء سلوك التبلور، وتوافر البروتين المحدود، والتباين المفرط في العينة، أو قيود الوزن الجزيئي. ونتيجة لذلك، ظهرت أساليب تحليل أحدث تتغلب على هذه القيود. ومن بين التقنيات الناشئة التي يمكن أن توفر المعلومات الهيكلية البروتين هو قياس الطيف الكتلي.
يقيس قياس الطيف الكتلي (MS) نسبة الكتلة إلى الشحنة للجزيء (m/z)، لذلك يجب الحصول على المعلومات الهيكلية عالية الترتيب للبروتين عن طريق ترميز المعلومات الهيكلية المطلوبة في كتلة البروتين. وقد تم تطوير عدة طرق لترميز هذه المعلومات، بما في ذلك تبادل الهيدروجين والديوتريوم (HDX)1،2،3،4، الربط المتبادل الكيميائي (XL)5،6، ووضع العلامات التساهمية (CL)7،8،9،10. في HDX، يتم تبادل العمود الفقري وسط الهيدروجين من قبل الديوتريوم أكثر قليلا ضخمة بمعدلات تعتمد على إمكانية الوصول المذيبات ومدى الترابط H. يمكن ترجمة مدى HDX عن طريق هضم البروتين بسرعة إلى شظايا الببتيد قبل فصل وقياس هذه الشظايا عن طريق مطياف الكتلة أو عن طريق فصل البروتين في تجربة من أعلى إلى أسفل. تحديد سعر الصرف يوفر المزيد من التبصر في ديناميات البروتين. وقد ثبت HDX لتكون أداة قيمة لتميز بنية البروتين على الرغم من التحديات المرتبطة تبادل الظهر والحاجة إلى معدات متخصصة لتحقيق أقصى قدر من الاستنساخ. في XL-MS، يتم تفاعل البروتينات مع الكواشف ثنائية الوظائف التي تربط بشكل مشترك بين السلاسل الجانبية للبقايا المجاورة داخل بروتين معين أو بين بروتينين. عند القيام بذلك، يمكن أن توفر XL-MS قيود المسافة التي يمكن استخدامها لتوصيف بنية البروتين. يمكن تحديد مناطق البروتين المرتبطة عبر عن طريق الهضم البروتيولي يليها تحليل الكروماتوغرافيا السائلة (LC)-MS. في حين أن XL-MS هو أداة متعددة الاستخدامات تم استخدامها لدراسة مجموعة متنوعة من مجمعات البروتين ، بما في ذلك داخل الخلايا ، فإن تحديد منتجات XL أمر صعب ويتطلب برامج متخصصة.
وقد برز CL-MS مؤخرا كأداة تكميلية وأحيانا بديلة تعتمد على التصلب المتعدد لدراسة بنية البروتين والتفاعلات. في CL-MS، يتم تعديل مجمع البروتين أو البروتين بشكل مكافئ مع كاشف أحادي الوظائف يمكن أن يتفاعل مع سلاسل جانبية معرضة للمذيبات(الشكل 1). من خلال مقارنة مدى تعديل مجمع البروتين أو البروتين في ظل ظروف مختلفة ، يمكن الكشف عن تغييرات تشكيل ، ومواقع ملزمة ، وواجهات البروتين والبروتين. بعد تفاعل CL ، يمكن الحصول على معلومات خاصة بالموقع ، غالبا على مستوى الأحماض الأمينية الواحدة ، باستخدام سير عمل البروتيوميات النموذجي من أسفل إلى أعلى حيث يتم هضم البروتينات بشكل بروتيوكليتيكي ، ويتم فصل شظايا الببتيد بواسطة LC ، ويتم تحديد المواقع المعدلة باستخدام MS جنبا إلى جنب (MS / MS). وقد أتاح التاريخ الغني لكيمياء التكيف البيولوجي العديد من الكواشف لتجارب CL-MS. وتندرج الكواشف الخاصة ب CL في فئتين عامتين: '1' محددة و'2' غير محددة. الكواشف محددة تتفاعل مع مجموعة وظيفية واحدة (على سبيل المثال، الأمينات الحرة)8،10 وسهلة التنفيذ ، لكنها تميل إلى توفير معلومات هيكلية محدودة. وتتفاعل الكواشف غير المحددة مع مجموعة واسعة من السلاسل الجانبية، ولكنها غالبا ما تتطلب معدات متخصصة مثل الليزر أو مصادر السنكروترون لإنتاج هذه الأنواع شديدة التفاعل. هيدروكسيل الجذور هي الكاشف غير محددة الأكثر استخداما، بعد أن تم تطبيقها في البصمة الراديكالية الهيدروكسيل (HRF)7،11،12،13 التجارب لدراسة مجموعة واسعة من البروتينات والمجمعات البروتينية في ظل مجموعة متنوعة من الشروط.
وقد استخدمت مجموعتنا البحثية بنجاح كاشفا آخر غير محدد نسبيا يسمى ديثيليبيروكربونات (DEPC) لدراسة بنية البروتين والتفاعلات في سياق تجارب CL-MS14و15و16و17و18و19و20و21و22و 23و 24و25. DEPC يقدم بساطة الكواشف وضع العلامات محددة (أي، لا توجد معدات متخصصة ضرورية لأداء ردود الفعل)، في حين تتفاعل مع ما يصل إلى 30٪ من الأحماض الأمينية في البروتين المتوسط. كمكشف كهربائي للغاية ، DEPC قادر على التفاعل مع N-terminus والسلاسل الجانبية النووية من السيستين والهستيدين والليسين والتيروزين وسيرين ومخلفات الثريونين. عادة، يتم إنشاء منتج واحد من هذه التفاعلات، مما أدى إلى زيادة كتلة من 72.02 دا. هذا النوع واحد من المنتجات يتناقض مع ما يصل إلى 55 المنتجات المختلفة التي يمكن أن تنتج عندما تتفاعل البروتينات مع الجذور الهيدروكسيل7. هذه الكيمياء البسيطة تسهل تحديد المواقع المسماة.
هنا، نحن نقدم بروتوكولات لاستخدام CL-MS المستندة إلى DEPC لدراسة بنية البروتين والتفاعلات. يتم وصف التفاصيل المرتبطة بإعداد الكاشف ، وتفاعلات البروتين DEPC ، وظروف هضم البروتين ، ومعلمات LC-MS و MS / MS ، وتحليل البيانات. كما أننا نثبت فائدة وضع العلامات على DEPC من خلال تقديم نتائج نموذجية من التفاعلات بين البروتين والمعدن والبروتين والبروتين بالإضافة إلى البروتينات التي تخضع لتغييرات هيكلية عند التدفئة.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد البروتين والكواشف
ملاحظة: يتضمن هذا البروتوكول على سبيل المثال سير العمل لتسمية بروتين مع DEPC. قد تختلف بعض الحالات وتركيزات الكاشف المذكورة استنادا إلى البروتين المفضل.
- إعداد جميع حلول الكاشف في أنابيب الطرد المركزي الدقيق 1.5 مل.
- إعداد محلول البروتين من التركيز المطلوب، وعادة في حدود عشرات ميكرومتر، في 10 M 3-(N-morpholino) حمض البروبانسولفونيك (MOPS) العازلة في درجة الحموضة 7.4. بدلا من ذلك، قم بإعداد محلول البروتين الموجود في 10 mM pH 7.4 MOPS إذا كانت العينة تحتوي على مخزن مؤقت للنيوكليوفيليا يكون رد الفعل مع DEPC. ويمكن أيضا استخدام مخازن عازلة أخرى (مثل الملحية العازلة للفوسفات)، طالما أنها لا تحتوي على مجموعات وظيفية نيوكليوفيليا.
- إعداد محلول DEPC 100 mM في أسيتونيتريل الجاف (ACN) عن طريق الأنابيب 1.45 ميكرولتر من الأسهم 6.9 M DEPC حل في 98.55 ميكرولتر من ACN.
ملاحظة: لا توجد مجموعة واحدة من التركيزات التي ستعمل مع كل بروتين، على الرغم من أن تركيزات الأمثل يمكن تقديرها على أساس عدد من له ومخلفات ليس23. على سبيل المثال، مع 50 ميكرولتر من محلول 50 ميكرومتر β2-microglobulin، تفاعل مع البروتين مع 0.2 ميكرولتر من 100 mM DEPC لتركيز DEPC النهائي من 200 ميكرومتر (يساوي 4x تركيز البروتين) لضمان نسبة الضرس المطلوب باستخدام هذا المثال العام(الجدول 1). DEPC وضع العلامات هو رد فعل 2 من أجلnd، لذلك تغيير إما تركيز البروتين أو DEPC في خليط رد الفعل سوف تغير معدل وضع العلامات. - إعداد 1 M imidazole الحل عن طريق وزنها من أصل 10 ملغ من إيميدازول وحل في 146.9 ميكرولتر من المياه HPLC الصف.
2. وضع العلامات التكافؤية للبروتين سليمة
- حدد درجة حرارة حمام الماء إلى 37 درجة مئوية وانتظر حتى يصل الحمام إلى درجة حرارة مستقرة.
ملاحظة: يمكن العثور على تركيزات الكاشف ووحدات التخزين لبروتوكول وضع العلامات على سبيل المثال في الجدول 1. - في أنبوب جديد للطرد المركزي الدقيق، امزج عازل MOPS ومحلول البروتين في الأحجام المدرجة في الجدول 1.
- إلى البروتين والتخزين المؤقت إضافة 0.2 ميكرولتر من محلول DEPC، والتأكد من خلط بشكل صحيح الحل الناتج، ومن ثم وضع أنبوب يحتوي على خليط التفاعل في حمام الماء 37 درجة مئوية لمدة 1 دقيقة.
ملاحظة: يجب ألا يتجاوز حجم ACN المضاف 1٪ من إجمالي حجم التفاعل لتجنب اضطراب بنية البروتين أثناء رد فعل وضع العلامات. رد فعل الوقت متروك للمستخدم، على الرغم من رد فعل 1 دقيقة تحت شروط المثال يقلل من الإفراط في وضع البنود والتحلل المائي المحتملة من DEPC14. - بعد 1 دقيقة، قم بإزالة الأنبوب الذي يحتوي على خليط التفاعل من حمام الماء وإرواء التفاعل مع 1 ميكرولتر من محلول إيميدازول M 1 لمسح DEPC المتبقي غير المتفاعل.
ملاحظة: يجب أن يساوي التركيز النهائي للimidazole في خليط التفاعل 50x تركيز DEPC في خليط التفاعل. سيضمن هذا أن يتم مسح DEPC غير المتفاعلة المتبقية.
3. إعداد هضم البروتين لLC-MS من أسفل إلى أعلى
ملاحظة: اختر شروط الهضم التي تكون قابلة للبروتين من الفائدة. وتشمل الخطوات الشائعة تتكشف البروتين والحد من و alkylating أي روابط ثنائي الكبريتيد.
- تتكشف البروتين عن طريق إضافة كاشف تتكشف المناسبة لخليط رد الفعل.
ملاحظة: تشمل العوامل الشائعة التي تتكشف ACN واليوريا والهيدروكلوريد جوانيدين (GuHCl). - إعداد حلول Tris (2-carboxyethyl)phosphine (TCEP) و iodoacetamide (IAM) عن طريق وزن 5 ملغ من كل منها وحلها في أنابيب ميكروسينتريفوجي جديدة في 174.4 و 270.3 ميكرولتر من 10 مللي متر في درجة الحموضة 7.4 MOPS العازلة، على التوالي، للحد من وخطوات الألكيل.
- تقليل الروابط ثنائية الكبريتيد بإضافة 2 ميكرولتر من 100 mM TCEP (التركيز النهائي من 2 mM في خليط التفاعل) حل لخليط التفاعل والتفاعل لمدة 3 دقائق في درجة حرارة الغرفة.
ملاحظة: يجب أن يساوي التركيز النهائي ل TCEP 40x تركيز البروتين لكل سند ثنائي الكبريتيد الموجود في المحلول. - خفضت الألكيلات السيستينات مع 4 ميكرولتر من محلول IAM 100 mM (التركيز النهائي من 4 mM في خليط التفاعل) لمدة 30 دقيقة في الظلام. IAM حساس للضوء وسوف تتحلل تحت الضوء المباشر.
ملاحظة: يجب أن يكون التركيز النهائي لل IAM في المحلول ضعف التركيز المستخدم في TCEP ، أو 80x تركيز البروتين لكل رابطة ثنائي الكبريتيد. - هضم البروتين مع انزيم مناسب مثل تريبسين أو تشيموتريبسين. نسبة البروتين:الانزيم 10:1 لعملية الهضم لمدة 3 ساعات عند 37 درجة مئوية مع إنزيم معطل بمعدل اهتزاز يبلغ 300 سكتة دماغية / دقيقة كافية عادة للبروتينات المسماة DEPC. راجع المناقشة.
- بعد الهضم، افصل الإنزيم المشلوم عن الببتيدات المهضومة عن طريق الطرد المركزي عند 12000 دورة في الدقيقة لمدة 5 دقائق.
- تحليل العينة فورا بواسطة LC-MS/MS أو فلاش تجميد العينة مع النيتروجين السائل لتقليل تدهور العينة وفقدان التسمية. تخزين عينات فلاش المجمدة في < -20 درجة مئوية حتى جاهزة لتحليل LC-MS / MS.
4. LC-MS/ MS التحليل
ملاحظة: يمكن استخدام معلمات LC-MS/MS القياسية لعلم البروتيوميات من أسفل إلى أعلى لتحديد المواقع المسماة على شظايا الببتيد البروتيوليكية. ويرد أدناه مثال عام على ذلك.
- فصل الببتيدات التي تحمل علامة DEPC باستخدام مرحلة ثابتة C18 معكوسة. استخدم مرحلة LC المحمولة النموذجية من مذيبين: (A) الماء + 0.1٪ حمض الفورميك و (B) ACN + 0.1٪ حمض الفورميك باستخدام تدرج (على سبيل المثال، الشكل 2)لتحقيق أفضل فصل للببتيدات.
ملاحظة: يمكن تحسين وقت الفصل استنادا إلى تعقيد العينة، ويعتمد معدل تدفق المرحلة المتنقلة على ما إذا كان يتم استخدام الشعيرات الدموية أو نانو LC. - استخدام مطياف الكتلة قادرة على القيام على الانترنت LC-MS و MS / MS لتحديد مواقع تعديل DEPC على الببتيد. في تجاربنا، استخدمنا بنجاح عدة أنواع من مطياف الكتلة. يجب أن يكون أي مطياف كتلي قادر على إجراء MS/MS تلقائيا للعديد من الببتيدات أثناء تحليل LC-MS مناسبا. تتضمن معلمات MS ذات الصلة: الجهد المصدر ESI = -4000 V لESI العادية؛ -2000 V للرذاذ النانوي. دقة المركبة المدارية = 000 60؛ مدة الاستبعاد الديناميكي = 30 s; MS/MS نوع التنشيط: CID ETD أو كليهما; نطاق المسح الشامل = 200-2000؛ التحكم التلقائي في الكسب = 4.0E5 (MS1 في Orbitrap) و 5.0E4 (MS2 في فخ أيون رباعي الخطي).
- قم بتحميل عينة البروتين المهضومة والمحملة بحقنها في نظام LC وابدأ عملية الاستحواذ LC-MS/MS. إذا تم تجميد العينة فلاش، إذابة قبل التحليل. تحويل السائل السائل LC إلى النفايات لأول 5 دقائق لتجنب الأملاح المفرطة من الدخول إلى مصدر ESI.
ملاحظة: تستخدم حلقة حقن 5 ميكرولتر بشكل عام، مما يسمح بحقن ما يقرب من 2.5 ميكروغرام من البروتين إلى LC-MS/MS. هذا يعتمد على شروط التحميل من LC لعدم تسد حاقن العينة.
5. تحليل البيانات
- تحديد مواقع تسمية DEPC وتحديد مناطق ذروة الببتيد باستخدام البرامج المناسبة لمطياف الكتلة المستخدمة.
- وتشمل DEPC إضافة (72.02 دا) وcarbamidomethylation (57.02 دا) كتعديلات متغيرة. معلمات بحث إضافية لتحليل MS/MS كما يلي: الحد الأقصى للانقسامات الفائتة = 3; أنواع أيونات الأجزاء = b و y; السلائف m/z التسامح = 10 ppm (يجب أن تكون هذه القيمة أعلى إذا تم استخدام مطياف كتلة فخ رباعي الأيونات); تفاوت جزء m/z = 0.5 Da (يجب أن تكون هذه القيمة أقل إذا تم استخدام مطياف كتلة عالي الدقة لمسح أيون المنتج)؛ شحنة السلائف = 1-4.
ملاحظة: خوارزميات البحث قاعدة بيانات مختلفة لديها أنظمة تسجيل مختلفة، والعديد يمكن أن يكون صعوبة في تحديد الببتيدات DEPC المعدلة لأن مستويات التعديل يمكن أن تكون منخفضة. قد يكون تعديل قطع النتيجة ضروريا لتحديد الببتيدات الأكثر تسمية. إذا كان الأمر كذلك، ثم الاستجواب اليدوي للبيانات MS / MS ينبغي أن تستخدم للتحقق من الببتيدات منخفضة التهديف. لم يتم تضمين منتج التحلل المائي لعلامة DEPC في البحث عن البيانات لأن DEPC المتحللة لم تعد تفاعلية تجاه السلاسل الجانبية النووية. - تحديد نسب تعديل مستوى المخلفات باستخدام مناطق الذروة الكروماتوغرافية للإصدارات المعدلة وغير المعدلة من الببتيدات.
ملاحظة: يجب النظر في أي ببتيد يحتوي على بقايا معدلة من الفائدة ويجب أن تكون جميع الدول المسؤولة التي يتم تضمينها موجودة في جميع العينات المقاسة. الببتيدات لها كفاءات تأين مختلفة و eluting في أوقات مختلفة يسبب هذه القيمة لتكون مقياس نسبي بدلا من المطلق لتعديل موقع معين.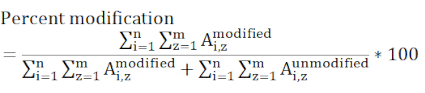
حيث يمثلA،z منطقة الذروة من أي الببتيد معين (1) الذي يحتوي على بقايا الفائدة ويعتبر جميع الدول تهمة الكشف (ض). - تحديد ما إذا كان تغيير وضع العلامات بين عنصر التحكم والعينة التجريبية مهما باستخدام التقييم الإحصائي. ثلاثة قياسات تكرار لكل عينة نموذجية، وتستخدم أكثر t-الاختبارات الأكثر شيوعا مع فترات الثقة 95 أو 99٪.
Access restricted. Please log in or start a trial to view this content.
النتائج
تحديد مواقع تعديل DEPC ونسب التعديل
ويمكن قياس الإضافة الشاملة بسبب وضع العلامات التساهمية في (أ) البروتين سليمة و (ب) مستويات الببتيد8،9. على مستوى سليم، يمكن الحصول على توزيع أنواع البروتين مع أعداد مختلفة من التسميات من التحليل المباشر أو LC-MS من عينات ...
Access restricted. Please log in or start a trial to view this content.
Discussion
الخطوات الهامة
وينبغي النظر في عدة نقاط تتعلق بالتصميم التجريبي لضمان نتائج موثوقة لوضع العلامات. أولا، لتحقيق أقصى قدر من وضع العلامات البروتين، فمن الضروري تجنب المخازن المؤقتة مع مجموعات نوى بقوة (على سبيل المثال، تريس) لأنها يمكن أن تتفاعل مع DEPC وانخفاض مدى وضع العلامات. ومن ال?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
يعترف المؤلفون بدعم المعاهد الوطنية للصحة (NIH) بموجب منحة R01 GM075092. تم الحصول على مطياف الكتلة الحرارية Orbitrap فيوجن المستخدمة للحصول على بعض البيانات الموصوفة هنا بأموال من المنحة الوطنية للمعاهد الصحية S10OD010645.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 3448 | |
| 3-(N-morpholino)propanesulfonic acid | Millipore Sigma | M1254 | |
| 3-(N-morpholino)propanesulfonic acid sodium salt | Millipore Sigma | M9381 | |
| Acclaim PepMap RSLC C18 Column | Thermo Scientific | 164537 | 300 μm x 15 cm, C18, 2 μm, 100 A |
| Acetonitrile | Fisher Scientific | A998-1 | |
| Diethylpyrocarbonate | Millipore Sigma | D5758 | |
| HPLC-grade water | Fisher Scientific | W5-1 | |
| Imidazole | Millipore Sigma | I5513 | |
| Immobilized chymotrypsin | ProteoChem | g4105 | |
| Immobilized trypsin, TPCK Treated | Thermo Fisher Scientific | 20230 | |
| Iodoacetamide | Millipore Sigma | I1149 | |
| Tris(2-carboxyethyl)phosphine | Millipore Sigma | C4706 |
References
- Katta, V., Chait, B. T., Carr, S. Conformational Changes in Proteins Probed by Hydrogen-exchange Electrospray-ionization. Rapid Communications in Mass Spectrometry. 5, 214-217 (1991).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25, 158-170 (2006).
- Pirrone, G. F., Iacob, R. E., Engen, J. R. Applications of hydrogen/deuterium exchange MS from 2012 to 2014. Analytical Chemistry. 87, 99-118 (2015).
- Oganesyan, I., Lento, C., Wilson, D. J. Contemporary hydrogen deuterium exchange mass spectrometry. Methods. 144, 27-42 (2018).
- Sinz, A. Chemical cross-linking and mass spectrometry to map three-dimensional protein structures and protein-protein interactions. Mass Spectrometry Reviews. 25, 663-682 (2006).
- Holding, A. N. XL-MS: Protein cross-linking coupled with mass spectrometry. Methods. 89, 54-63 (2015).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107, 3514-3543 (2007).
- Mendoza, V. L., Vachet, R. W. Probing Protein Structure by Amino Acid-Specific Covalent Labeling and Mass Spectrometry. Mass Spectrometry Reviews. 28, 785-815 (2009).
- Limpikirati, P., Liu, T., Vachet, R. W. Covalent labeling-mass spectrometry with non-specific reagents for studying protein structure and interactions. Methods. 144, 79-93 (2018).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemistry Reviews. 120, 4335(2020).
- Maleknia, S. D., Brenowitz, M., Chance, M. R. Millisecond radiolytic modification of peptides by synchrotron X-rays identified by mass spectrometry. Analytical Chemistry. 71, 3965-3973 (1999).
- Aye, T. T., Low, T. Y., Sze, S. K. Nanosecond laser-induced photochemical oxidation method for protein surface mapping with mass spectrometry. Analytical Chemistry. 77, 5814-5822 (2005).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society of Mass Spectrometry. 16, 2057-2063 (2005).
- Mendoza, V. L., Vachet, R. W. Protein surface mapping using diethylpyrocarbonate with mass spectrometric detection. Analytical Chemistry. 80, 2895-2904 (2008).
- Mendoza, V. L., Antwi, K., Barón-rodríguez, M. A., Blanco, C., Vachet, R. W. Structure of the Pre-amyloid Dimer of β-2-microglobulin from Covalent Labeling and Mass Spectrometry. Biochemistry. 49, 1522-1532 (2010).
- Mendoza, V. L., Barón-Rodríguez, M. A., Blanco, C., Vachet, R. W. Structural insights into the pre-amyloid tetramer of β-2-microglobulin from covalent labeling and mass spectrometry. Biochemistry. 50, 6711-6722 (2011).
- Zhou, Y., Vachet, R. W. Increased protein structural resolution from diethylpyrocarbonate-based covalent labeling and mass spectrometric detection. Journal of the American Society of Mass Spectrometry. 23, 708-717 (2012).
- Borotto, N. B., et al. Investigating Therapeutic Protein Structure with Diethylpyrocarbonate Labeling and Mass Spectrometry. Analytical Chemistry. 87, 10627-10634 (2015).
- Liu, T., Marcinko, T. M., Kiefer, P. A., Vachet, R. W. Using Covalent Labeling and Mass Spectrometry To Study Protein Binding Sites of Amyloid Inhibiting Molecules. Analytical Chemistry. 89, 11583-11591 (2017).
- Limpikirati, P., et al. Covalent labeling and mass spectrometry reveal subtle higher order structural changes for antibody therapeutics. MAbs. 11, 463-476 (2019).
- Limpikirati, P., Pan, X., Vachet, R. W. Covalent Labeling with Diethylpyrocarbonate: Sensitive to the Residue Microenvironment, Providing Improved Analysis of Protein Higher Order Structure by Mass Spectrometry. Analytical Chemistry. 91, 8516-8523 (2019).
- Liu, T., Limpikirati, P., Vachet, R. W. Synergistic Structural Information from Covalent Labeling and Hydrogen-Deuterium Exchange Mass Spectrometry for Protein-Ligand Interactions. Analytical Chemistry. 91, 15248-15254 (2019).
- Pan, X., Limpikirati, P., Chen, H., Liu, T., Vachet, R. W. Higher-Order Structure Influences the Kinetics of Diethylpyrocarbonate Covalent Labeling of Proteins. Journal of the American Society of Mass Spectrometry. 31, 658-665 (2020).
- Limpikirati, P. K., Zhao, B., Pan, X., Eyles, S. J., Vachet, R. W. Covalent Labeling/Mass Spectrometry of Monoclonal Antibodies with Diethylpyrocarbonate: Reaction Kinetics for Ensuring Protein Structural Integrity. Journal of the American Society of Mass Spectrometry. 31, 1223-1232 (2020).
- Liu, T., Marcinko, T. M., Vachet, R. W. Protein-Ligand Affinity Determinations Using Covalent Labeling-Mass Spectrometry. Journal of the American Society of Mass Spectrometry. 31, 1544-1553 (2020).
- Srikanth, R., Mendoza, V. L., Bridgewater, J. D., Zhang, G., Vachet, R. W. Copper Binding to β-2-Microglobulin and its Pre-Amyloid Oligomers. Biochemistry. 48, 9871-9881 (2009).
- Lim, J., Vachet, R. W. Using mass spectrometry to study copper-protein binding under native and non-native conditions: β-2-microglobulin. Analytical Chemistry. 76, 3498-3504 (2004).
- Lindsley, C. W. Predictions and Statistics for the Best-Selling Drugs Globally and in the United States in 2018 and a Look Forward to 2024 Projections. ACS Chemical Neuroscience. 10, 1115(2019).
- Floege, J., Ketteler, M. β2-Microglobulin-derived amyloidosis: An update. Kidney International. 59, 164(2001).
- Antwi, K., et al. Cu (II) organizes β-2-microglobulin oligomers but is released upon amyloid formation. Protein Science. 17, 748-759 (2008).
- Dong, J., et al. Unique Effect of Cu(II) in the Metal-Induced Amyloid Formation of β-2-Microglobulin. Biochemistry. 53, 1263-1274 (2014).
- Marcinko, T. M., Drews, T., Liu, T., Vachet, R. W. Epigallocatechin-3-gallate Inhibits Cu(II)-Induced β-2-Microglobulin Amyloid Formation by Binding to the Edge of Its β-Sheets. Biochemistry. 59, 1093-1103 (2020).
- Zhou, Y., Vachet, R. W. Diethylpyrocarbonate Labeling for the Structural Analysis of Proteins: Label Scrambling in Solution and How to Avoid it. Journal of the American Society of Mass Spectrometry. 23, 899-907 (2012).
- Borotto, N. B., Degraan-Weber, N., Zhou, Y., Vachet, R. W. Label scrambling during CID of covalently labeled peptide ions. Journal of the American Society of Mass Spectrometry. 25, 1739-1746 (2014).
- Aprahamian, M. L., Chea, E. E., Jones, L. M., Lindert, S. Rosetta Protein Structure Prediction from Hydroxyl Radical Protein Footprinting Mass Spectrometry Data. Analytical Chemistry. 90, 7721-7729 (2018).
- Schmidt, C., et al. Surface Accessibility and Dynamics of Macromolecular Assemblies Probed by Covalent Labeling Mass Spectrometry and Integrative Modeling. Analytical Chemistry. 89, 1459-1468 (2017).
- Zheng, X., Wintrode, P. L., Chance, M. R. Complementary Structural Mass Spectrometry Techniques Reveal Local Dynamics in Functionally Important Regions of a Metastable Serpin. Structure. 16, 38-51 (2008).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by H/D exchange and covalent labeling: The glycerol facilitator. Journal of Molecular Biology. 416, 400-413 (2012).
- Li, J., et al. Mapping the Energetic Epitope of an Antibody/Interleukin-23 Interaction with Hydrogen/Deuterium Exchange, Fast Photochemical Oxidation of Proteins Mass Spectrometry, and Alanine Shave Mutagenesis. Analytical Chemistry. 89, 2250-2258 (2017).
- Borotto, N. B., Zhang, Z., Dong, J., Burant, B., Vachet, R. W. Increased β-Sheet Dynamics and D-E Loop Repositioning Are Necessary for Cu(II)-Induced Amyloid Formation by β-2-Microglobulin. Biochemistry. 56, 1095-1104 (2017).
- Shi, L., Liu, T., Gross, M. L., Huang, Y. Recognition of Human IgG1 by Fcγ Receptors: Structural Insights from Hydrogen-Deuterium Exchange and Fast Photochemical Oxidation of Proteins Coupled with Mass Spectrometry. Biochemistry. 58, 1074-1080 (2019).
- Gerega, S. K., Downard, K. M. PROXIMO - A new docking algorithm to model protein complexes using data from radical probe mass spectrometry (RP-MS). Bioinformatics. 22, 1702-1709 (2006).
- Kamal, J. K. A., Chance, M. R. Modeling of protein binary complexes using structural mass spectrometry data. Protein Science. 17, 79-94 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved