Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ковалентная маркировка диэтилпирокарбонатом для изучения структуры белка высшего порядка с помощью масс-спектрометрии
В этой статье
Резюме
Описаны экспериментальные процедуры выполнения ковалентной маркировки на основе диэтилпирокарбоната с масс-спектрометрическим детектированием. Диэтилпирокарбонат просто смешивают с интересуемым белком или белковым комплексом, что приводит к модификации доступных растворителю аминокислотных остатков. Модифицированные остатки могут быть идентифицированы после протеолитического сбраживания и анализа жидкостной хроматографии/масс-спектрометрии.
Аннотация
Характеристика структуры белка более высокого порядка имеет важное значение для понимания его функции. Масс-спектрометрия (МС) стала мощным инструментом для этой цели, особенно для белковых систем, которые трудно изучать традиционными методами. Чтобы изучить структуру белка с помощью MS, в растворе проводят специфические химические реакции, которые кодируют структурную информацию белка в его массу. Одним из особенно эффективных подходов является использование реагентов, которые ковалентно модифицируют доступные растворителям боковые цепи аминокислот. Эти реакции приводят к увеличению массы, которое может быть локализовано с разрешением на уровне остатка в сочетании с протеолитическим сбраживанием и тандемной масс-спектрометрией. Здесь мы описываем протоколы, связанные с использованием диэтилпирокарбоната (DEPC) в качестве ковалентного реагента маркировки вместе с обнаружением РС. DEPC представляет собой высокоэлектрофильной молекулу, способную маркировать до 30% остатков в среднем белке, тем самым обеспечивая отличное структурное разрешение. DEPC успешно используется вместе с MS для получения структурной информации для небольших однодоменные белки, такие как β2-микроглобулин, к крупным многодоменные белки, такие как моноклональные антитела.
Введение
Белки являются важными биомолекулами практически в каждом физиологическом процессе. Разнообразие функций, которые выполняют белки, возможно из-за структур, которые они принимают, и взаимодействий, которые они имеют с другими биомолекулами. Чтобы понять функцию белка на более глубоком уровне, необходимы биохимические и биофизические инструменты для выяснения этих важных структурных особенностей и взаимодействий. Традиционно рентгеновская кристаллография, криогенная электронная микроскопия и спектроскопия ядерного магнитного резонанса (ЯМР) обеспечивали желаемую детализацию на атомном уровне для выявления структуры белка. Однако многочисленные белковые системы не могут быть опрошены этими методами из-за плохого поведения кристаллизации, ограниченной доступности белка, чрезмерной гетерогенности образца или ограничений молекулярной массы. Следовательно, появились новые методы анализа, которые преодолевают эти ограничения. Среди новых методов, которые могут предоставить структурную информацию белка, является масс-спектрометрия.
Масс-спектрометрия (MS) измеряет отношение массы к заряду молекулы (m/z), поэтому структурная информация белка более высокого порядка должна быть получена путем кодирования желаемой структурной информации в массу белка. Было разработано несколько подходов к кодированию этой информации, включая водородно-дейтериевый обмен (HDX)1,2,3,4,химическое сшивание (XL)5,6и ковалентную маркировку (CL)7,8,9,10. В HDX магистральные амидные водороды обмениваются немного более массивными дейтериями со скоростью, которая зависит от доступности растворителей и степени H-связи. Степень HDX может быть локализована путем быстрого переваривания белка в пептидные фрагменты перед разделением и измерением этих фрагментов масс-спектрометром или путем диссоциации белка в эксперименте сверху вниз. Определение обменного курса дает дальнейшее понимание динамики белка. HDX оказался ценным инструментом для характеристики структуры белка, несмотря на проблемы, связанные с обратным обменом и необходимостью специализированного оборудования для максимизации воспроизводимости. В XL-MS белки реагируют с бифункциональными реагентами, которые ковалентно связывают соседние боковые цепи остатка внутри данного белка или между двумя белками. При этом XL-MS может обеспечить ограничения расстояния, которые могут быть использованы для характеристики структуры белка. Области белка, которые являются сшитыми, могут быть идентифицированы с помощью протеолитического пищеварения с последующим анализом жидкостной хроматографии (LC)-MS. В то время как XL-MS является универсальным инструментом, который использовался для изучения различных белковых комплексов, в том числе внутри клеток, идентификация продуктов XL является сложной задачей и требует специализированного программного обеспечения.
CL-MS появился в последнее время как дополнительный, а иногда и альтернативный инструмент на основе MS для изучения структуры и взаимодействий белка. В CL-MS белок или белковый комплекс ковалентно модифицируют монофункциональным реагентом, который может реагировать с боковыми цепями, подвергающимися воздействию растворителя(рисунок 1). Сравнивая степени модификации белка или белкового комплекса в различных условиях, можно выявить конформационные изменения, сайты связывания и белково-белковые интерфейсы. После реакции CL сайт-специфическая информация, часто на уровне одной аминокислоты, может быть получена с использованием типичных рабочих процессов протеомики снизу вверх, в которых белки протеолитически перевариваются, пептидные фрагменты разделяются LC, а модифицированные участки идентифицируются с использованием тандема MS (MS / MS). Богатая история химии биоконъюгатов сделала многочисленные реагенты доступными для экспериментов CL-MS. Реагенты CL делятся на две общие категории: (i) специфические и (ii) неспецифические. Специфические реагенты реагируют с одной функциональной группой (например, свободными аминами)8,10 и легко реализуются, но они, как правило, предоставляют ограниченную структурную информацию. Неспецифические реагенты реагируют с широким спектром боковых цепей, но часто требуют специализированного оборудования, такого как лазеры или синхротронные источники для получения этих высокореактивных видов. Гидроксильные радикалы являются наиболее часто используемым неспецифическим реагентом, поскольку были применены в гидроксильных радикалах (HRF)7,11,12,13 экспериментов для изучения широкого спектра белков и белковых комплексов в различных условиях.
Наша исследовательская группа успешно использовала другой относительно неспецифический реагент под названием диэтилпирокарбонат (DEPC) для изучения структуры и взаимодействий белка в контексте экспериментов CL-MS14,15,16,17,18,19,20,21,22,23,24,25. DEPC предлагает простоту специфических реагентов маркировки (т.е. для выполнения реакций не требуется специализированное оборудование), реагируя при этом с 30% аминокислот в среднем белке. Как высокоэлектрофильный реагент, DEPC способен реагировать с N-концем и нуклеофильными боковыми цепями цистеина, гистидина, лизина, тирозина, серина и остатков треонина. Как правило, образуется один продукт этих реакций, в результате чего увеличивается масса на 72,02 Да. Этот единственный тип продукта контрастирует с 55 различными продуктами, которые могут быть получены, когда белки реагируют с гидроксильными радикалами7. Такая простая химия облегчает идентификацию маркированных участков.
Здесь мы предоставляем протоколы для использования CL-MS на основе DEPC для изучения структуры и взаимодействий белка. Описаны детали, связанные с препаратом реагента, реакциями DEPC-белка, условиями переваривания белка, параметрами LC-MS и MS/MS, а также анализом данных. Мы также демонстрируем полезность маркировки DEPC, приводя примеры результатов взаимодействия белка-металла, белка-лиганда и белка-белка, а также белков, претерпевающих структурные изменения при нагревании.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Препарат белка и реагента
ПРИМЕЧАНИЕ: Этот протокол включает в себя пример рабочего процесса для маркировки белка с помощью DEPC. Некоторые условия и концентрации реагентов могут варьироваться в зависимости от выбранного белка.
- Приготовьте все растворы реагентов в микроцентрифужных пробирках по 1,5 мл.
- Готовят белковый раствор нужной концентрации, обычно в диапазоне десятков мкМ, в буфере 10 мМ 3-(N-морфолино)пропансульфоновой кислоты (МОПС) при рН 7,4. Альтернативно, готовят буферно-обменный существующий белковый раствор в 10 мМ рН 7,4 MOPS, если образец содержит нуклеофильный буфер, который будет реакционноспособным с DEPC. Другие буферы (например, фосфатно-буферный физиологический раствор) также могут быть использованы, если они не имеют нуклеофильных функциональных групп.
- Готовят раствор DEPC 100 мМ в сухом ацетонитриле (ACN) путем пипетирования 1,45 мкл запасного 6,9 М РАСТВОРА DEPC в 98,55 мкл ACN.
ПРИМЕЧАНИЕ: Не существует единого набора концентраций, которые будут работать с каждым белком, хотя оптимальные концентрации могут быть оценены на основе количества остатков His и Lys23. Например, с 50 мкл раствора β2-микроглобулина 50 мкМ реагируют на белок с 0,2 мкл из 100 мМ DEPC для конечной концентрации DEPC 200 мкМ (равной 4x концентрации белка) для обеспечения желаемого молярного соотношения с использованием этого общего примера(таблица 1). Маркировка DEPC представляет собой реакцию2-го порядка, поэтому изменение концентрации белка или DEPC в реакционной смеси изменит скорость маркировки. - Готовят 1 М раствора имидазола, взвешивая 10 мг имидазола и растворяя в 146,9 мкл воды класса ВЭЖХ.
2. Ковалентная маркировка интактного белка
- Установите температуру водяной бани на 37 °C и дождитесь, пока ванна достигнет стабильной температуры.
ПРИМЕЧАНИЕ: Концентрации и объемы реагентов для примера протокола маркировки можно найти в таблице 1. - В новой микроцентрифужной трубке смешайте буфер MOPS и белковый раствор в объемах, перечисленных в таблице 1.
- К белку и буферу добавляют 0,2 мкл раствора DEPC, убедившись, что полученный раствор правильно перемешивают, а затем помещают трубку, содержащую реакционную смесь, на водяную баню при 37 °C на 1 минуту.
ПРИМЕЧАНИЕ: Объем добавленного ACN не должен превышать 1% от общего объема реакции, чтобы избежать возмущения структуры белка во время реакции маркировки. Время реакции остается за пользователем, хотя 1-минутная реакция в условиях примера минимизирует чрезмерную маркировку и потенциальный гидролиз DEPC14. - Через 1 минуту вынимают трубку, содержащую реакционную смесь, с водяной бани и гасят реакцию 1 мкл раствора имидазола 1 М для удаления оставшегося нереактированного DEPC.
ПРИМЕЧАНИЕ: Конечная концентрация имидазола в реакционной смеси должна быть в 50 раз больше концентрации DEPC в реакционной смеси. Это обеспечит сохранение нереактированного DEPC.
3. Подготовка белкового переваривания к восходящему LC-MS
ПРИМЕЧАНИЕ: Выбирайте условия пищеварения, которые поддаются интересуя белку. Общие шаги включают в себя развертывание белка и уменьшение и алкилирование любых дисульфидных связей.
- Расверните белок, добавив в реакционную смесь соответствующий разворачивающийся реагент.
ПРИМЕЧАНИЕ: Общие разворачивающие агенты включают ACN, мочевину и гуанидин гидрохлорид (GuHCl). - Готовят растворы трис(2-карбоксиэтил)фосфина (TCEP) и йодоацетамида (IAM), взвешивая по 5 мг каждого и растворяя их в новых микроцентрифужных пробирках в 174,4 и 270,3 мкл буфера pH 7,4 MOPS 10 мМ соответственно для этапов восстановления и алкилирования.
- Уменьшают дисульфидные связи путем добавления 2 мкл раствора TCEP 100 мМ (конечная концентрация 2 мМ в реакционной смеси) в реакционную смесь и взаимодействия в течение 3 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Конечная концентрация TCEP должна быть в 40 раз больше концентрации белка на дисульфидную связь, присутствующая в растворе. - Алкилат восстановленных цистеинов с 4 мкл раствора 100 мМ ИАМ (конечная концентрация 4 мМ в реакционной смеси) в течение 30 минут в темноте. IAM светочувствительна и разлагается при прямом освещении.
ПРИМЕЧАНИЕ: Конечная концентрация IAM в растворе должна быть в два раза выше концентрации, используемой для TCEP, или в 80 раз выше концентрации белка на дисульфидную связь. - Переваривайте белок с помощью соответствующего фермента, такого как трипсин или химотрипсин. Соотношение белка:фермент 10:1 для 3-часового пищеварения при 37 °C с иммобилизованным ферментом со скоростью встряхивания 300 ударов в минуту обычно достаточно для белков, меченых DEPC. См. раздел Обсуждение.
- После пищеварения отделяют иммобилизованный фермент от переваренные пептиды центрифугированием при 12 000 об/мин в течение 5 минут.
- Немедленно проанализируйте образец с помощью LC-MS/MS или заморозьте образец жидким азотом, чтобы свести к минимуму деградацию образца и потерю этикетки. Храните замороженные образцы при температуре < -20 °C до готовности к анализу LC-MS/MS.
4. Анализ LC-MS/MS
ПРИМЕЧАНИЕ: Стандартные параметры LC-MS/MS для протеомики снизу вверх могут быть использованы для идентификации меченых участков на фрагментах протеолитических пептидов. Ниже приведен общий пример.
- Отделите меченые DEPC пептиды, используя стационарную фазу C18 с обратной фазой. Используйте типичную подвижную фазу LC из двух растворителей: (A) воды + 0,1% муравьиной кислоты и (B) ACN + 0,1% муравьиной кислоты с использованием градиента (например, Фиг.2)для достижения наилучшего разделения пептидов.
ПРИМЕЧАНИЕ: Время разделения может быть оптимизировано в зависимости от сложности образца, а скорость потока подвижной фазы зависит от того, используется ли капиллярный или нано LC. - Используйте масс-спектрометр, способный выполнять онлайн-LC-MS и MS/MS для идентификации участков модификации DEPC на пептиде. В наших экспериментах мы успешно использовали несколько типов масс-спектрометров. Любой масс-спектрометр, способный автоматически выполнять MS/MS многих пептидов в ходе анализа LC-MS, должен быть подходящим. Соответствующие параметры MS включают: напряжение источника ESI = -4000 В для обычного ESI; -2000 В для нанораспросыка; Разрешение орбитрапа = 60 000; Продолжительность динамического исключения = 30 с; Тип активации MS/MS: CID, ETD или и то, и другое; Диапазон массового сканирования = 200-2 000; Автоматическая регулировка усиления = 4,0E5 (MS1 в Orbitrap) и 5,0E4 (MS2 в линейной квадрупольной ионной ловушке).
- Загрузите и введйте переваренный, меченый образец белка в систему LC и начните сбор LC-MS / MS. Если образец был заморожен во вспышке, разморозить перед анализом. Отводите сточные воды LC в отходы в течение первых 5 минут, чтобы избежать попадания избыточных солей в источник ESI.
ПРИМЕЧАНИЕ: Обычно используется инъекционная петля объемом 5 мкл, позволяющая впрыскивать приблизительно 2,5 мкг белка в LC-MS/MS. Это зависит от условий нагрузки ЛК, чтобы не засорять инжектор образца.
5. Анализ данных
- Идентификация участков маркировки DEPC и количественная оценка пиковых областей пептидов с помощью соответствующего программного обеспечения для используемого масс-спектрометра.
- Включают добавление DEPC (72,02 Da) и карбамидометилирование (57,02 Da) в качестве переменных модификаций. Дополнительные параметры поиска для анализа MS/MS следующие: Максимальное количество пропущенных расщеплений = 3; Типы ионов фрагментов = b и y; Допуск предшественника m/z = 10 ppm (это значение должно быть выше, если используется масс-спектрометр квадрупольной ионной ловушки); Допуск фрагмента m/z = 0,5 Da (это значение должно быть ниже, если для сканирования ионов продукта используется масс-спектрометр высокого разрешения); Заряд предшественника = 1-4.
ПРИМЕЧАНИЕ: Различные алгоритмы поиска в базах данных имеют разные системы оценки, и многие из них могут испытывать трудности с идентификацией пептидов, модифицированных DEPC, поскольку уровни модификации могут быть низкими. Корректировка отсечения оценки может потребоваться для выявления более меченых пептидов. Если это так, то ручной опрос данных MS / MS следует использовать для проверки низкоскоростных пептидов. Продукт гидролиза метки DEPC не включается в поиск данных, поскольку гидролизованный DEPC больше не реагирует по отношению к нуклеофильным боковым цепям. - Определить процент модификации уровня остатка, используя хроматографические пиковые области модифицированных и немодифицированных версий пептидов.
ПРИМЕЧАНИЕ: Любой пептид, содержащий модифицированный остаток, представляющий интерес, должен быть рассмотрен, и все включенные состояния заряда должны присутствовать во всех измеренных образцах. Пептиды, имеющие различную эффективность ионизации и элюирование в разное время, заставляют это значение быть относительной, а не абсолютной мерой модификации конкретного сайта.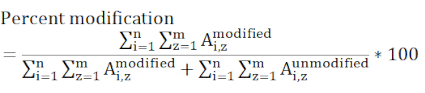
где Ai,z представляет пиковую область любого данного пептида (i), который содержит интересующая остаток и учитывает все обнаруженные состояния заряда (z). - Определите, является ли изменение маркировки между контрольной и экспериментальной выборкой значительным, используя статистическую оценку. Три реплицированных измерения для каждого образца являются типичными, и t-тесты чаще всего используются с 95 или 99% доверительными интервалами.
Access restricted. Please log in or start a trial to view this content.
Результаты
Определение участков модификации DEPC и процентов модификаций
Массовое добавление за счет ковалентной маркировки может быть измерено на (а) интактном белке и (б) пептидных уровнях8,9. На интактном уровне распределение белковых видов с различным коли?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Критические шаги
Для обеспечения надежных результатов маркировки следует учитывать несколько моментов, касающихся экспериментального проектирования. Во-первых, чтобы максимизировать маркировку белка, необходимо избегать буферов с сильно нуклеофильными группами (например, Tris...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы признают поддержку со стороны Национальных институтов здравоохранения (NIH) в рамках гранта R01 GM075092. Масс-спектрометр Thermo Orbitrap Fusion, используемый для получения некоторых данных, описанных здесь, был приобретен на средства Гранта Национального института здравоохранения S10OD010645.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 3448 | |
| 3-(N-morpholino)propanesulfonic acid | Millipore Sigma | M1254 | |
| 3-(N-morpholino)propanesulfonic acid sodium salt | Millipore Sigma | M9381 | |
| Acclaim PepMap RSLC C18 Column | Thermo Scientific | 164537 | 300 μm x 15 cm, C18, 2 μm, 100 A |
| Acetonitrile | Fisher Scientific | A998-1 | |
| Diethylpyrocarbonate | Millipore Sigma | D5758 | |
| HPLC-grade water | Fisher Scientific | W5-1 | |
| Imidazole | Millipore Sigma | I5513 | |
| Immobilized chymotrypsin | ProteoChem | g4105 | |
| Immobilized trypsin, TPCK Treated | Thermo Fisher Scientific | 20230 | |
| Iodoacetamide | Millipore Sigma | I1149 | |
| Tris(2-carboxyethyl)phosphine | Millipore Sigma | C4706 |
Ссылки
- Katta, V., Chait, B. T., Carr, S. Conformational Changes in Proteins Probed by Hydrogen-exchange Electrospray-ionization. Rapid Communications in Mass Spectrometry. 5, 214-217 (1991).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25, 158-170 (2006).
- Pirrone, G. F., Iacob, R. E., Engen, J. R. Applications of hydrogen/deuterium exchange MS from 2012 to 2014. Analytical Chemistry. 87, 99-118 (2015).
- Oganesyan, I., Lento, C., Wilson, D. J. Contemporary hydrogen deuterium exchange mass spectrometry. Methods. 144, 27-42 (2018).
- Sinz, A. Chemical cross-linking and mass spectrometry to map three-dimensional protein structures and protein-protein interactions. Mass Spectrometry Reviews. 25, 663-682 (2006).
- Holding, A. N. XL-MS: Protein cross-linking coupled with mass spectrometry. Methods. 89, 54-63 (2015).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107, 3514-3543 (2007).
- Mendoza, V. L., Vachet, R. W. Probing Protein Structure by Amino Acid-Specific Covalent Labeling and Mass Spectrometry. Mass Spectrometry Reviews. 28, 785-815 (2009).
- Limpikirati, P., Liu, T., Vachet, R. W. Covalent labeling-mass spectrometry with non-specific reagents for studying protein structure and interactions. Methods. 144, 79-93 (2018).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemistry Reviews. 120, 4335(2020).
- Maleknia, S. D., Brenowitz, M., Chance, M. R. Millisecond radiolytic modification of peptides by synchrotron X-rays identified by mass spectrometry. Analytical Chemistry. 71, 3965-3973 (1999).
- Aye, T. T., Low, T. Y., Sze, S. K. Nanosecond laser-induced photochemical oxidation method for protein surface mapping with mass spectrometry. Analytical Chemistry. 77, 5814-5822 (2005).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society of Mass Spectrometry. 16, 2057-2063 (2005).
- Mendoza, V. L., Vachet, R. W. Protein surface mapping using diethylpyrocarbonate with mass spectrometric detection. Analytical Chemistry. 80, 2895-2904 (2008).
- Mendoza, V. L., Antwi, K., Barón-rodríguez, M. A., Blanco, C., Vachet, R. W. Structure of the Pre-amyloid Dimer of β-2-microglobulin from Covalent Labeling and Mass Spectrometry. Biochemistry. 49, 1522-1532 (2010).
- Mendoza, V. L., Barón-Rodríguez, M. A., Blanco, C., Vachet, R. W. Structural insights into the pre-amyloid tetramer of β-2-microglobulin from covalent labeling and mass spectrometry. Biochemistry. 50, 6711-6722 (2011).
- Zhou, Y., Vachet, R. W. Increased protein structural resolution from diethylpyrocarbonate-based covalent labeling and mass spectrometric detection. Journal of the American Society of Mass Spectrometry. 23, 708-717 (2012).
- Borotto, N. B., et al. Investigating Therapeutic Protein Structure with Diethylpyrocarbonate Labeling and Mass Spectrometry. Analytical Chemistry. 87, 10627-10634 (2015).
- Liu, T., Marcinko, T. M., Kiefer, P. A., Vachet, R. W. Using Covalent Labeling and Mass Spectrometry To Study Protein Binding Sites of Amyloid Inhibiting Molecules. Analytical Chemistry. 89, 11583-11591 (2017).
- Limpikirati, P., et al. Covalent labeling and mass spectrometry reveal subtle higher order structural changes for antibody therapeutics. MAbs. 11, 463-476 (2019).
- Limpikirati, P., Pan, X., Vachet, R. W. Covalent Labeling with Diethylpyrocarbonate: Sensitive to the Residue Microenvironment, Providing Improved Analysis of Protein Higher Order Structure by Mass Spectrometry. Analytical Chemistry. 91, 8516-8523 (2019).
- Liu, T., Limpikirati, P., Vachet, R. W. Synergistic Structural Information from Covalent Labeling and Hydrogen-Deuterium Exchange Mass Spectrometry for Protein-Ligand Interactions. Analytical Chemistry. 91, 15248-15254 (2019).
- Pan, X., Limpikirati, P., Chen, H., Liu, T., Vachet, R. W. Higher-Order Structure Influences the Kinetics of Diethylpyrocarbonate Covalent Labeling of Proteins. Journal of the American Society of Mass Spectrometry. 31, 658-665 (2020).
- Limpikirati, P. K., Zhao, B., Pan, X., Eyles, S. J., Vachet, R. W. Covalent Labeling/Mass Spectrometry of Monoclonal Antibodies with Diethylpyrocarbonate: Reaction Kinetics for Ensuring Protein Structural Integrity. Journal of the American Society of Mass Spectrometry. 31, 1223-1232 (2020).
- Liu, T., Marcinko, T. M., Vachet, R. W. Protein-Ligand Affinity Determinations Using Covalent Labeling-Mass Spectrometry. Journal of the American Society of Mass Spectrometry. 31, 1544-1553 (2020).
- Srikanth, R., Mendoza, V. L., Bridgewater, J. D., Zhang, G., Vachet, R. W. Copper Binding to β-2-Microglobulin and its Pre-Amyloid Oligomers. Biochemistry. 48, 9871-9881 (2009).
- Lim, J., Vachet, R. W. Using mass spectrometry to study copper-protein binding under native and non-native conditions: β-2-microglobulin. Analytical Chemistry. 76, 3498-3504 (2004).
- Lindsley, C. W. Predictions and Statistics for the Best-Selling Drugs Globally and in the United States in 2018 and a Look Forward to 2024 Projections. ACS Chemical Neuroscience. 10, 1115(2019).
- Floege, J., Ketteler, M. β2-Microglobulin-derived amyloidosis: An update. Kidney International. 59, 164(2001).
- Antwi, K., et al. Cu (II) organizes β-2-microglobulin oligomers but is released upon amyloid formation. Protein Science. 17, 748-759 (2008).
- Dong, J., et al. Unique Effect of Cu(II) in the Metal-Induced Amyloid Formation of β-2-Microglobulin. Biochemistry. 53, 1263-1274 (2014).
- Marcinko, T. M., Drews, T., Liu, T., Vachet, R. W. Epigallocatechin-3-gallate Inhibits Cu(II)-Induced β-2-Microglobulin Amyloid Formation by Binding to the Edge of Its β-Sheets. Biochemistry. 59, 1093-1103 (2020).
- Zhou, Y., Vachet, R. W. Diethylpyrocarbonate Labeling for the Structural Analysis of Proteins: Label Scrambling in Solution and How to Avoid it. Journal of the American Society of Mass Spectrometry. 23, 899-907 (2012).
- Borotto, N. B., Degraan-Weber, N., Zhou, Y., Vachet, R. W. Label scrambling during CID of covalently labeled peptide ions. Journal of the American Society of Mass Spectrometry. 25, 1739-1746 (2014).
- Aprahamian, M. L., Chea, E. E., Jones, L. M., Lindert, S. Rosetta Protein Structure Prediction from Hydroxyl Radical Protein Footprinting Mass Spectrometry Data. Analytical Chemistry. 90, 7721-7729 (2018).
- Schmidt, C., et al. Surface Accessibility and Dynamics of Macromolecular Assemblies Probed by Covalent Labeling Mass Spectrometry and Integrative Modeling. Analytical Chemistry. 89, 1459-1468 (2017).
- Zheng, X., Wintrode, P. L., Chance, M. R. Complementary Structural Mass Spectrometry Techniques Reveal Local Dynamics in Functionally Important Regions of a Metastable Serpin. Structure. 16, 38-51 (2008).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by H/D exchange and covalent labeling: The glycerol facilitator. Journal of Molecular Biology. 416, 400-413 (2012).
- Li, J., et al. Mapping the Energetic Epitope of an Antibody/Interleukin-23 Interaction with Hydrogen/Deuterium Exchange, Fast Photochemical Oxidation of Proteins Mass Spectrometry, and Alanine Shave Mutagenesis. Analytical Chemistry. 89, 2250-2258 (2017).
- Borotto, N. B., Zhang, Z., Dong, J., Burant, B., Vachet, R. W. Increased β-Sheet Dynamics and D-E Loop Repositioning Are Necessary for Cu(II)-Induced Amyloid Formation by β-2-Microglobulin. Biochemistry. 56, 1095-1104 (2017).
- Shi, L., Liu, T., Gross, M. L., Huang, Y. Recognition of Human IgG1 by Fcγ Receptors: Structural Insights from Hydrogen-Deuterium Exchange and Fast Photochemical Oxidation of Proteins Coupled with Mass Spectrometry. Biochemistry. 58, 1074-1080 (2019).
- Gerega, S. K., Downard, K. M. PROXIMO - A new docking algorithm to model protein complexes using data from radical probe mass spectrometry (RP-MS). Bioinformatics. 22, 1702-1709 (2006).
- Kamal, J. K. A., Chance, M. R. Modeling of protein binary complexes using structural mass spectrometry data. Protein Science. 17, 79-94 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены