Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Etiquetado Covalente Con Dietilpirocarbonato Para El Estudio De La Estructura De Orden Superior De Proteínas Por Espectrometría De Masas
En este artículo
Resumen
Se describen los procedimientos experimentales para realizar el etiquetado covalente a base de dietilpirocarbonato con detección espectrométrica de masas. El dietilpirocarbonato simplemente se mezcla con la proteína o complejo proteico de interés, lo que lleva a la modificación de residuos de aminoácidos accesibles al disolvente. Los residuos modificados se pueden identificar después de la digestión proteolítica y la cromatografía líquida / análisis de espectrometría de masas.
Resumen
Caracterizar la estructura de orden superior de una proteína es esencial para comprender su función. La espectrometría de masas (EM) ha surgido como una poderosa herramienta para este propósito, especialmente para los sistemas de proteínas que son difíciles de estudiar por métodos tradicionales. Para estudiar la estructura de una proteína por EM, se realizan reacciones químicas específicas en solución que codifican la información estructural de una proteína en su masa. Un enfoque particularmente efectivo es utilizar reactivos que modifican covalentemente las cadenas laterales de aminoácidos accesibles con disolventes. Estas reacciones conducen a aumentos de masa que se pueden localizar con la resolución del nivel de residuos cuando se combinan con la digestión proteolítica y la espectrometría de masas en tándem. Aquí, se describen los protocolos asociados con el uso de dietilpirocarbonato (DEPC) como un reactivo de etiquetado covalente junto con la detección de MS. DEPC es una molécula altamente electrofílica capaz de etiquetar hasta el 30% de los residuos en la proteína media, proporcionando así una excelente resolución estructural. DEPC se ha utilizado con éxito junto con la EM para obtener información estructural de pequeñas proteínas de un solo dominio, como la β2-microglobulina, a grandes proteínas multidominio, como los anticuerpos monoclonales.
Introducción
Las proteínas son biomoléculas esenciales en prácticamente todos los procesos fisiológicos. La variedad de funciones que realizan las proteínas son posibles debido a las estructuras que adoptan y las interacciones que tienen con otras biomoléculas. Para entender la función de la proteína en un nivel más profundo, se necesitan herramientas bioquímicas y biofísicas para dilucidar estas importantes características e interacciones estructurales. Tradicionalmente, la cristalografía de rayos X, la microscopía electrónica criogénica y la espectroscopia de resonancia magnética nuclear (RMN) han proporcionado el detalle a nivel atómico deseado para revelar la estructura de la proteína. Sin embargo, numerosos sistemas de proteínas no pueden ser interrogados por estas técnicas debido a un comportamiento de cristalización deficiente, disponibilidad limitada de proteínas, heterogeneidad excesiva de la muestra o limitaciones de peso molecular. En consecuencia, han surgido nuevos métodos de análisis que superan estas limitaciones. Entre las técnicas emergentes que pueden proporcionar información estructural de proteínas se encuentra la espectrometría de masas.
La espectrometría de masas (MS) mide la relación masa-carga (m/z) de una molécula, por lo que la información estructural de orden superior de la proteína debe obtenerse mediante la codificación de la información estructural deseada en la masa de la proteína. Se han desarrollado varios enfoques para codificar esta información, incluyendo el intercambio hidrógeno-deuterio (HDX)1,2,3,4,reticulado químico (XL)5,6,y etiquetado covalente (CL)7,8,9,10. En HDX, los hidrógenos de amida de columna vertebral se intercambian por deuterios ligeramente más masivos a tasas que dependen de la accesibilidad del disolvente y la extensión del enlace H. La extensión de HDX se puede localizar digiriendo rápidamente la proteína en fragmentos del péptido antes de separar y de medir estos fragmentos por el espectrómetro de masa o disociando la proteína en un experimento de arriba hacia abajo. La determinación del tipo de cambio proporciona más información sobre la dinámica de las proteínas. HDX ha demostrado ser una herramienta valiosa para caracterizar la estructura de las proteínas a pesar de los desafíos asociados con el intercambio posterior y la necesidad de equipos especializados para maximizar la reproducibilidad. En XL-MS, las proteínas se reaccionan con reactivos bifuncionales que unen covalentemente las cadenas laterales de residuos adyacentes dentro de una proteína dada o entre dos proteínas. Al hacerlo, XL-MS puede proporcionar restricciones de distancia que se pueden utilizar para caracterizar la estructura de la proteína. Las regiones de la proteína que están reticenladas pueden ser identificadas por digestión proteolítica seguida de cromatografía líquida (LC)-análisis de MS. Si bien XL-MS es una herramienta versátil que se ha utilizado para estudiar una variedad de complejos de proteínas, incluidas las células internas, la identificación de los productos XL es un desafío y requiere un software especializado.
Cl-MS ha surgido recientemente como una herramienta complementaria y a veces alternativa basada en MS para estudiar la estructura de las proteínas y las interacciones. En CL-MS, una proteína o complejo proteico se modifica covalentemente con un reactivo mono-funcional que puede reaccionar con cadenas laterales expuestas al solvente (Figura 1). Al comparar las extensiones de modificación de una proteína o complejo de proteínas bajo diferentes condiciones, se pueden revelar cambios de conformación, sitios de unión e interfaces proteína-proteína. Después de la reacción del CL, la información sitio-específica, a menudo en el solo nivel del aminoácido, se puede obtener usando los flujos de trabajo típicos de la proteómica de abajo hacia arriba en los cuales las proteínas se digieren proteolytically, los fragmentos del péptido son separados por el LC, y los sitios modificados se identifican usando el ms en tándem (MS/MS). La rica historia de la química bioconjugada ha hecho que numerosos reactivos estén disponibles para experimentos cl-ms. Los reactivos cl se dividen en dos categorías generales: (i) específicos y (ii) no específicos. Los reactivos específicos reaccionan con un solo grupo funcional (por ejemplo, aminas libres)8,10 y son fáciles de implementar, pero tienden a proporcionar información estructural limitada. Los reactivos no específicos reaccionan con una amplia gama de cadenas laterales, pero a menudo requieren equipos especializados como láseres o fuentes de sincrotrón para producir estas especies altamente reactivas. Los radicales hidroxilo son el reactivo inespecífico más comúnmente utilizado, habiéndose aplicado en la huella de radicales hidroxilo (HRF)7,11,12,13 experimentos para estudiar una amplia gama de proteínas y complejos proteicos bajo una variedad de condiciones.
Nuestro grupo de investigación ha utilizado con éxito otro reactivo relativamente inespecífero llamado dietilpirocarbonato (DEPC) para estudiar la estructura de las proteínas y las interacciones en el contexto de los experimentos CL-MS14,15, 16,17,18,19,20,21,22,23,24,25. DEPC ofrece la simplicidad de reactivos de etiquetado específicos (es decir, no se necesita ningún equipo especializado para realizar las reacciones), mientras que reacciona con hasta un 30% de aminoácidos en la proteína promedio. Como reactivo altamente electrofílico, DEPC es capaz de reaccionar con el N-terminal y las cadenas laterales nucleofílicas de cisteína, histidina, lisina, tirosina, serina y residuos de treonina. Típicamente, se genera un solo producto de estas reacciones, resultando en un aumento de masa de 72.02 Da. Este único tipo de producto contrasta con los hasta 55 productos diferentes que se pueden producir cuando las proteínas reaccionan con los radicales hidroxilo7. Esta química simple facilita la identificación de sitios etiquetados.
Aquí, proporcionamos protocolos para el uso de CL-MS basado en DEPC para estudiar la estructura de las proteínas y las interacciones. Los detalles asociados a la preparación del reactivo, a las reacciones de la DEPC-proteína, a las condiciones de la digestión de la proteína, a los parámetros de LC-MS y de MS/MS, y al análisis de datos se describen. También demostramos la utilidad del etiquetado DEPC proporcionando resultados de ejemplo de proteína-metal, proteína-ligando, y las interacciones proteína-proteína, así como las proteínas que sufren cambios estructurales en el calentamiento.
Protocolo
1. Preparación de proteínas y reactivos
Nota : este protocolo incluye un flujo de trabajo de ejemplo para etiquetar una proteína con DEPC. Algunas condiciones y concentraciones de reactivos enumeradas pueden variar según la proteína de elección.
- Prepare todas las soluciones de reactivos en tubos microcentrífugos de 1,5 mL.
- Preparar una solución proteica de la concentración deseada, generalmente en el rango de decenas de μM, en un tampón de ácido 3-(N-morfolino)propanesulfónico (MOPS) de 10 mM a pH 7.4. Alternativamente, prepare una solución de proteína de intercambio tampón existente en 10 mM pH 7.4 MOPS si la muestra contiene un tampón nucleofílico que sería reactivo con DEPC. También se pueden utilizar otros tampones (por ejemplo, solución salina tamponada con fosfato), siempre y cuando no tengan grupos funcionales nucleófilos.
- Prepare una solución DEPC de 100 mM en acetonitrilo seco (ACN) pipeteando 1,45 μL de la solución de DEPC de 6,9 M en 98,55 μL del ACN.
NOTA: No hay un solo conjunto de concentraciones que funcionen con cada proteína, aunque las concentraciones óptimas se pueden estimar en función del número de residuos de His y Lys23. Por ejemplo, con 50 μL de una solución de 50 μM de β2-microglobulina, reaccione la proteína con 0,2 μL de los 100 mM de DEPC para una concentración final de DEPC de 200 μM (igual a 4x la concentración de proteínas) para asegurar la relación molar deseada utilizando este ejemplo general (Tabla 1). El etiquetado DEPC es una reacción de2º orden, por lo que cambiar la concentración de proteína o DEPC en la mezcla de reacción cambiará la velocidad de etiquetado. - Prepare la solución de imidazol de 1 M pesando 10 mg de imidazol y disolviendo en 146,9 μL de agua de grado HPLC.
2. Etiquetado covalente de proteína intacta
- Ajuste la temperatura del baño de agua a 37 °C y espere a que el baño alcance una temperatura estable.
NOTA: Las concentraciones y volúmenes de reactivos para un ejemplo de protocolo de etiquetado se pueden encontrar en la Tabla 1. - En un nuevo tubo de microcentrífuga, mezcle el tampón MOPS y la solución proteica en los volúmenes enumerados en el Cuadro 1.
- A la proteína y al tampón añadir 0,2 μL de la solución DEPC, asegurándose de mezclar correctamente la solución resultante, y luego colocar el tubo que contiene la mezcla de reacción en el baño de agua de 37 °C durante 1 minuto.
NOTA: El volumen de ACN añadido no debe exceder el 1% del volumen total de la reacción para evitar la perturbación de la estructura de la proteína durante la reacción de etiquetado. El tiempo de reacción depende del usuario, aunque una reacción de 1 minuto en las condiciones de ejemplo minimiza el sobreetiquetado y la hidrólisis potencial de DEPC14. - Después de 1 minuto, retire el tubo que contiene la mezcla de reacción del baño de agua y saciar la reacción con 1 μL de la solución de imidazol de 1 M para limpiar el DEPC restante sin reaccionar.
NOTA: La concentración final de imidazol en la mezcla de reacción debe ser igual a 50 veces la concentración de DEPC en la mezcla de reacción. Esto asegurará que el DEPC restante sin reaccionar sea borrado.
3. Preparación del resumen de la proteína para la LC-MS de abajo hacia arriba
NOTA: Elija las condiciones de digestión que son susceptibles a la proteína de interés. Los pasos comunes implican desplegar la proteína y reducir y alquilear cualquier enlaces disulfuro.
- Despliegue la proteína añadiendo un reactivo de despliegue apropiado a la mezcla de reacción.
NOTA: Los agentes de despliegue comunes incluyen ACN, urea y clorhidrato de guanidina (GuHCl). - Preparar soluciones de Tris(2-carboxiletil)fosfina (TCEP) e iodoacetamida (IAM) pesando 5 mg de cada una y disolviéndolos en nuevos tubos de microcentrífuga en 174,4 y 270,3 μL de tampón de 10 mM pH 7,4 MOPS, respectivamente, para las etapas de reducción y alquilación.
- Reducir los enlaces disulfuro añadiendo 2 μL de la solución TCEP (concentración final de 2 mM en mezcla de reacción) a la solución de 100 mM en mezcla de reacción y reaccionando durante 3 minutos a temperatura ambiente.
NOTA: La concentración final de TCEP debe ser igual a 40 veces la concentración de proteína por enlace disulfuro presente en la solución. - El alquilato redujo las cisteinas con 4 μL de la solución iam de 100 mM (concentración final de 4 mM en la mezcla de reacción) durante 30 minutos en la oscuridad. Iam es sensible a la luz y se descompone bajo luz directa.
NOTA: La concentración final de IAM en solución debe ser el doble de la concentración utilizada para TCEP, o 80 veces la concentración de proteína por enlace disulfuro. - Digiera la proteína con una enzima apropiada como la tripsina o la quimotripsina. Una relación proteína:enzima de 10:1 para una digestión de 3 horas a 37 °C con enzima inmovilizada a una tasa de agitación de 300 golpes/min es típicamente suficiente para las proteínas etiquetadas con DEPC. Ver Discusión.
- Después de la digestión, separe la enzima inmovilizada de los péptidos digeridos por centrifugación a 12.000 rpm durante 5 minutos.
- Analice la muestra inmediatamente por LC-MS/MS o flash-congele la muestra con nitrógeno líquido para minimizar la degradación de la muestra y la pérdida de la etiqueta. Almacene las muestras congeladas a < -20 °C hasta que estén listas para el análisis LC-MS/MS.
4. Análisis LC-MS/MS
NOTA: Los parámetros estándar de LC-MS/MS para la proteómica de abajo hacia arriba se pueden utilizar para identificar sitios etiquetados en los fragmentos de péptido proteolítico. A continuación se describe un ejemplo general.
- Separe los péptidos marcados con DEPC utilizando una fase estacionaria C18 de fase invertida. Utilice una fase móvil LC típica de dos disolventes: (A) agua + 0,1% de ácido fórmico y (B) ACN + 0,1% de ácido fórmico utilizando un gradiente (por ejemplo, figura 2)para lograr la mejor separación de péptidos.
NOTA: El tiempo de separación se puede optimizar en función de la complejidad de la muestra, y el caudal de fase móvil depende de si se utiliza LC capilar o nano. - Utilice un espectrómetro de masas capaz de hacer LC-MS y MS/MS en línea para identificar los sitios de modificación de DEPC en el péptido. En nuestros experimentos, hemos utilizado con éxito varios tipos de espectrómetros de masas. Cualquier espectrómetro de masas capaz de realizar automáticamente MS/MS de muchos péptidos durante el curso de un análisis LC-MS debe ser adecuado. Los parámetros relevantes de la EM incluyen: voltaje de la fuente ESI = -4000 V para ESI regular; -2000 V para nanospray; Resolución de Orbitrap = 60.000; Duración de exclusión dinámica = 30 s; Tipo de activación de MS/MS: CID, ETD o ambos; Rango de exploración masiva = 200-2,000; Control automático de ganancia = 4.0E5 (MS1 en Orbitrap) y 5.0E4 (MS2 en trampa de iones cuadrupolo lineal).
- Cargue e inyecte la muestra de proteína digerida y etiquetada en el sistema LC y comience la adquisición de LC-MS/MS. Si la muestra ha sido congelada por flash, descongele antes del análisis. Desvíe el efluente LC a residuos durante los primeros 5 minutos para evitar que las sales excesivas entren en la fuente de ESI.
NOTA: Generalmente se utiliza un bucle de inyección de 5 μL, lo que permite la inyección de aproximadamente 2,5 μg de proteína a la LC-MS/MS. Esto depende de las condiciones de carga de la LC para no obstruir el inyector de la muestra.
5. Análisis de datos
- Identifique los sitios de la etiqueta DEPC y cuantifique las áreas pico del péptido usando el software apropiado para el espectrómetro de masas que se utiliza.
- Incluya la adición de DEPC (72.02 Da) y la carbamidometilación (57.02 Da) como modificaciones variables. Los parámetros de búsqueda adicionales para el análisis de MS/MS son los siguientes: Escisión máxima omitida = 3; Tipos de iones de fragmentos = b e y; Tolerancia del precursor m/z = 10 ppm (este valor debería ser mayor si se utiliza un espectrómetro de masas de trampa de iones cuadrupolo); Tolerancia m/z del fragmento = 0,5 Da (este valor debe ser menor si se utiliza un espectrómetro de masas de alta resolución para un escaneo iónico del producto); Carga precursora = 1-4.
NOTA: Diferentes algoritmos de búsqueda de base de datos tienen diferentes sistemas de puntuación, y muchos pueden tener dificultades para identificar péptidos modificados por DEPC porque los niveles de modificación pueden ser bajos. Ajustar el punto de corte de puntuación puede ser necesario para identificar más péptidos etiquetados. Si es así, entonces la interrogación manual de los datos de MS/MS se debe utilizar para verificar los péptidos de baja puntuación. El producto de la hidrólisis de la etiqueta DEPC no se incluye en la búsqueda de datos porque el DEPC hidrolizado ya no es reactivo hacia las cadenas laterales nucleofílicas. - Determinar los porcentajes de modificación del nivel de residuos utilizando las áreas de pico cromatográfico de las versiones modificadas y no modificadas de los péptidos.
NOTA: Cualquier péptido que contenga el residuo modificado de interés debe ser considerado y todos los estados de carga que se incluyen deben estar presentes en todas las muestras medidas. Los péptidos que tienen diferentes eficiencias de ionización y eluting en diferentes momentos hace que este valor sea una medida relativa en lugar de absoluta de la modificación de un sitio específico.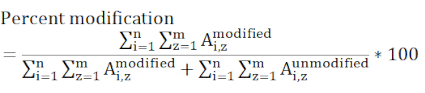
donde Ai,z representa el área máxima de cualquier péptido dado (i) que contiene el residuo de interés y considera todos los estados de carga detectados (z). - Determine si un cambio de etiquetado entre una muestra de control y experimental es significativo mediante una evaluación estadística. Tres mediciones de réplica para cada muestra es típica, y las pruebas t se utilizan con mayor frecuencia con intervalos de confianza de 95 o 99%.
Resultados
Identificación de sitios de modificación de DEPC y porcentajes de modificación
La adición de masa debida al etiquetado covalente puede medirse en los niveles (a) de proteínas intactas y (b)péptidos 8,9. A nivel intacto, se puede obtener una distribución de especies de proteínas con diferentes números de etiquetas a partir del análisis directo o LC-MS de muestras de proteínas etiquetadas. Para obtener información estructural de mayor resolu...
Discusión
Pasos críticos
Se deben considerar varios puntos relacionados con el diseño experimental para garantizar resultados de etiquetado confiables. En primer lugar, para maximizar el etiquetado de proteínas, es necesario evitar los tampones con grupos fuertemente nucleófilos (por ejemplo, Tris) porque pueden reaccionar con DEPC y reducir el alcance del etiquetado. También es concebible que tales tampones puedan reaccionar con residuos etiquetados, causando la eliminación de la etiqueta y, por lo tanto, la pé...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen el apoyo de los Institutos Nacionales de la Salud (NIH) bajo la Subvención R01 GM075092. El espectrómetro de masas Thermo Orbitrap Fusion utilizado para adquirir algunos de los datos descritos aquí fue adquirido con fondos de la subvención S10OD010645 de los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | Thermo Fisher Scientific | 3448 | |
| 3-(N-morpholino)propanesulfonic acid | Millipore Sigma | M1254 | |
| 3-(N-morpholino)propanesulfonic acid sodium salt | Millipore Sigma | M9381 | |
| Acclaim PepMap RSLC C18 Column | Thermo Scientific | 164537 | 300 μm x 15 cm, C18, 2 μm, 100 A |
| Acetonitrile | Fisher Scientific | A998-1 | |
| Diethylpyrocarbonate | Millipore Sigma | D5758 | |
| HPLC-grade water | Fisher Scientific | W5-1 | |
| Imidazole | Millipore Sigma | I5513 | |
| Immobilized chymotrypsin | ProteoChem | g4105 | |
| Immobilized trypsin, TPCK Treated | Thermo Fisher Scientific | 20230 | |
| Iodoacetamide | Millipore Sigma | I1149 | |
| Tris(2-carboxyethyl)phosphine | Millipore Sigma | C4706 |
Referencias
- Katta, V., Chait, B. T., Carr, S. Conformational Changes in Proteins Probed by Hydrogen-exchange Electrospray-ionization. Rapid Communications in Mass Spectrometry. 5, 214-217 (1991).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25, 158-170 (2006).
- Pirrone, G. F., Iacob, R. E., Engen, J. R. Applications of hydrogen/deuterium exchange MS from 2012 to 2014. Analytical Chemistry. 87, 99-118 (2015).
- Oganesyan, I., Lento, C., Wilson, D. J. Contemporary hydrogen deuterium exchange mass spectrometry. Methods. 144, 27-42 (2018).
- Sinz, A. Chemical cross-linking and mass spectrometry to map three-dimensional protein structures and protein-protein interactions. Mass Spectrometry Reviews. 25, 663-682 (2006).
- Holding, A. N. XL-MS: Protein cross-linking coupled with mass spectrometry. Methods. 89, 54-63 (2015).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107, 3514-3543 (2007).
- Mendoza, V. L., Vachet, R. W. Probing Protein Structure by Amino Acid-Specific Covalent Labeling and Mass Spectrometry. Mass Spectrometry Reviews. 28, 785-815 (2009).
- Limpikirati, P., Liu, T., Vachet, R. W. Covalent labeling-mass spectrometry with non-specific reagents for studying protein structure and interactions. Methods. 144, 79-93 (2018).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemistry Reviews. 120, 4335 (2020).
- Maleknia, S. D., Brenowitz, M., Chance, M. R. Millisecond radiolytic modification of peptides by synchrotron X-rays identified by mass spectrometry. Analytical Chemistry. 71, 3965-3973 (1999).
- Aye, T. T., Low, T. Y., Sze, S. K. Nanosecond laser-induced photochemical oxidation method for protein surface mapping with mass spectrometry. Analytical Chemistry. 77, 5814-5822 (2005).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society of Mass Spectrometry. 16, 2057-2063 (2005).
- Mendoza, V. L., Vachet, R. W. Protein surface mapping using diethylpyrocarbonate with mass spectrometric detection. Analytical Chemistry. 80, 2895-2904 (2008).
- Mendoza, V. L., Antwi, K., Barón-rodríguez, M. A., Blanco, C., Vachet, R. W. Structure of the Pre-amyloid Dimer of β-2-microglobulin from Covalent Labeling and Mass Spectrometry. Biochemistry. 49, 1522-1532 (2010).
- Mendoza, V. L., Barón-Rodríguez, M. A., Blanco, C., Vachet, R. W. Structural insights into the pre-amyloid tetramer of β-2-microglobulin from covalent labeling and mass spectrometry. Biochemistry. 50, 6711-6722 (2011).
- Zhou, Y., Vachet, R. W. Increased protein structural resolution from diethylpyrocarbonate-based covalent labeling and mass spectrometric detection. Journal of the American Society of Mass Spectrometry. 23, 708-717 (2012).
- Borotto, N. B., et al. Investigating Therapeutic Protein Structure with Diethylpyrocarbonate Labeling and Mass Spectrometry. Analytical Chemistry. 87, 10627-10634 (2015).
- Liu, T., Marcinko, T. M., Kiefer, P. A., Vachet, R. W. Using Covalent Labeling and Mass Spectrometry To Study Protein Binding Sites of Amyloid Inhibiting Molecules. Analytical Chemistry. 89, 11583-11591 (2017).
- Limpikirati, P., et al. Covalent labeling and mass spectrometry reveal subtle higher order structural changes for antibody therapeutics. MAbs. 11, 463-476 (2019).
- Limpikirati, P., Pan, X., Vachet, R. W. Covalent Labeling with Diethylpyrocarbonate: Sensitive to the Residue Microenvironment, Providing Improved Analysis of Protein Higher Order Structure by Mass Spectrometry. Analytical Chemistry. 91, 8516-8523 (2019).
- Liu, T., Limpikirati, P., Vachet, R. W. Synergistic Structural Information from Covalent Labeling and Hydrogen-Deuterium Exchange Mass Spectrometry for Protein-Ligand Interactions. Analytical Chemistry. 91, 15248-15254 (2019).
- Pan, X., Limpikirati, P., Chen, H., Liu, T., Vachet, R. W. Higher-Order Structure Influences the Kinetics of Diethylpyrocarbonate Covalent Labeling of Proteins. Journal of the American Society of Mass Spectrometry. 31, 658-665 (2020).
- Limpikirati, P. K., Zhao, B., Pan, X., Eyles, S. J., Vachet, R. W. Covalent Labeling/Mass Spectrometry of Monoclonal Antibodies with Diethylpyrocarbonate: Reaction Kinetics for Ensuring Protein Structural Integrity. Journal of the American Society of Mass Spectrometry. 31, 1223-1232 (2020).
- Liu, T., Marcinko, T. M., Vachet, R. W. Protein-Ligand Affinity Determinations Using Covalent Labeling-Mass Spectrometry. Journal of the American Society of Mass Spectrometry. 31, 1544-1553 (2020).
- Srikanth, R., Mendoza, V. L., Bridgewater, J. D., Zhang, G., Vachet, R. W. Copper Binding to β-2-Microglobulin and its Pre-Amyloid Oligomers. Biochemistry. 48, 9871-9881 (2009).
- Lim, J., Vachet, R. W. Using mass spectrometry to study copper-protein binding under native and non-native conditions: β-2-microglobulin. Analytical Chemistry. 76, 3498-3504 (2004).
- Lindsley, C. W. Predictions and Statistics for the Best-Selling Drugs Globally and in the United States in 2018 and a Look Forward to 2024 Projections. ACS Chemical Neuroscience. 10, 1115 (2019).
- Floege, J., Ketteler, M. β2-Microglobulin-derived amyloidosis: An update. Kidney International. 59, 164 (2001).
- Antwi, K., et al. Cu (II) organizes β-2-microglobulin oligomers but is released upon amyloid formation. Protein Science. 17, 748-759 (2008).
- Dong, J., et al. Unique Effect of Cu(II) in the Metal-Induced Amyloid Formation of β-2-Microglobulin. Biochemistry. 53, 1263-1274 (2014).
- Marcinko, T. M., Drews, T., Liu, T., Vachet, R. W. Epigallocatechin-3-gallate Inhibits Cu(II)-Induced β-2-Microglobulin Amyloid Formation by Binding to the Edge of Its β-Sheets. Biochemistry. 59, 1093-1103 (2020).
- Zhou, Y., Vachet, R. W. Diethylpyrocarbonate Labeling for the Structural Analysis of Proteins: Label Scrambling in Solution and How to Avoid it. Journal of the American Society of Mass Spectrometry. 23, 899-907 (2012).
- Borotto, N. B., Degraan-Weber, N., Zhou, Y., Vachet, R. W. Label scrambling during CID of covalently labeled peptide ions. Journal of the American Society of Mass Spectrometry. 25, 1739-1746 (2014).
- Aprahamian, M. L., Chea, E. E., Jones, L. M., Lindert, S. Rosetta Protein Structure Prediction from Hydroxyl Radical Protein Footprinting Mass Spectrometry Data. Analytical Chemistry. 90, 7721-7729 (2018).
- Schmidt, C., et al. Surface Accessibility and Dynamics of Macromolecular Assemblies Probed by Covalent Labeling Mass Spectrometry and Integrative Modeling. Analytical Chemistry. 89, 1459-1468 (2017).
- Zheng, X., Wintrode, P. L., Chance, M. R. Complementary Structural Mass Spectrometry Techniques Reveal Local Dynamics in Functionally Important Regions of a Metastable Serpin. Structure. 16, 38-51 (2008).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by H/D exchange and covalent labeling: The glycerol facilitator. Journal of Molecular Biology. 416, 400-413 (2012).
- Li, J., et al. Mapping the Energetic Epitope of an Antibody/Interleukin-23 Interaction with Hydrogen/Deuterium Exchange, Fast Photochemical Oxidation of Proteins Mass Spectrometry, and Alanine Shave Mutagenesis. Analytical Chemistry. 89, 2250-2258 (2017).
- Borotto, N. B., Zhang, Z., Dong, J., Burant, B., Vachet, R. W. Increased β-Sheet Dynamics and D-E Loop Repositioning Are Necessary for Cu(II)-Induced Amyloid Formation by β-2-Microglobulin. Biochemistry. 56, 1095-1104 (2017).
- Shi, L., Liu, T., Gross, M. L., Huang, Y. Recognition of Human IgG1 by Fcγ Receptors: Structural Insights from Hydrogen-Deuterium Exchange and Fast Photochemical Oxidation of Proteins Coupled with Mass Spectrometry. Biochemistry. 58, 1074-1080 (2019).
- Gerega, S. K., Downard, K. M. PROXIMO - A new docking algorithm to model protein complexes using data from radical probe mass spectrometry (RP-MS). Bioinformatics. 22, 1702-1709 (2006).
- Kamal, J. K. A., Chance, M. R. Modeling of protein binary complexes using structural mass spectrometry data. Protein Science. 17, 79-94 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados