Method Article
تطبيق الماوس البارثينوجينيك Haploid الخلايا الجذعية الجنينية كبديل للحيوانات المنوية
In This Article
Summary
تهدف هذه المقالة إلى إظهار استخدام الخلايا الجذعية الجنينية الهيمونوجينية كبديل للحيوانات المنوية لبناء أجنة شبه مستنسخة.
Abstract
في الكائنات الحية مع التكاثر الجنسي، والخلايا الجرثومية هي مصدر الخلايا totipotent التي تتطور إلى أفراد جدد. في الفئران ، وتخصيب البويضات من قبل spermatozoon يخلق zygote totipotent. في الآونة الأخيرة، ذكرت العديد من المنشورات أن الخلايا الجذعية الجنينية haploid (haESCs) يمكن أن تكون بديلا عن الجينوم الجامدي وتسهم في الأجنة، التي تتطور إلى فئران. هنا، نقدم بروتوكولا لتطبيق haESCs البارثينوجينية كبديل للحيوانات المنوية لبناء الأجنة عن طريق الحقن داخل السيتوبلازمي في البويضات. يتكون هذا البروتوكول من خطوات لإعداد haESCs كبديل للحيوانات المنوية ، وحقن كروموسومات haESC في البويضات ، وزراعة الأجنة شبه المستنسخة. يمكن للأجنة أن تنتج فئرانا شبه مستنسخة خصبة بعد نقل الأجنة. استخدام haESCs كبديل للحيوانات المنوية يسهل تحرير الجينوم في الجرثومة ، ودراسات التطور الجنيني ، والتحقيق في البصمة الجينومية.
Introduction
في الثدييات، الأمشاج هي الخلايا الوحيدة التي تنقل المعلومات الوراثية إلى الجيل القادم. الانصهار من البويضات والحيوانات المنوية يشكل الزيغوت diploid التي تتطور إلى بالغ. الطفرات في الجينوم gametic وبالتالي ورثت من قبل النسل ودفع الاختلاف الجيني في الأنواع1. وقد تم تطبيق إدخال الطفرات في الجرثومة لإنتاج الحيوانات المعدلة وراثيا لدراسات بيولوجية متنوعة بما في ذلك توصيف وظيفة الجينات ونمذجة الأمراض. كل من البويضات والحيوانات المنوية هي خلايا متمايزة بشكل ميؤوس منه ومتخصصة للغاية توقفت عن الانتشار. ولذلك ، فإن التعديل المباشر ل gametes صعب من الناحية الفنية ، وتم تطوير نهج متخصصة. ويمكن إدخال تعديلات جينية في الجرثومة الماوس عن طريق حقن ESCs المعدلة وراثيا في الكيسات الأريمية، حيث أنها تندمج في الجنين النامية واستعمار الجرثومة. بالإضافة إلى ذلك ، أصبح التعديل الوراثي للzygotes باستخدام نهج تحرير الجينوم ، بما في ذلك نظام CRISPR / Cas9 ، معتمدا على نطاق واسع2.
في الآونة الأخيرة ، تم الإبلاغ عن نهج متميز ، والذي يطبق haESCs كبديل لجينوم gametic3،4،5،6،7،8. HaESCs هي خطوط الخلايا الجذعية المستمدة من كتلة الخلية الداخلية من الكيسات الأريمية الهابلويدية البارثينوجينية أو الاندروجينية وتمتلك مجموعة واحدة من الكروموسومات4و7و9و10. وقد ثبت أن كلا من haESCs البارثينوجينية والدروجينية يمكن أن تسهم في جينوم الفئران شبه المستنسخة بعد الحقن داخل السيتوبلازمي في البويضات. وعلى النقيض من النهج الأخرى، يمكن تعديل جينوم الهايسك مباشرة في الثقافة بسبب قدرتها على التجديد الذاتي. إدخال التعديلات الوراثية في الجرثومة عن طريق استبدال الحيوانات المنوية مع haESCs هو وسيلة هامة للدراسات البيولوجية. وهو ينص على إمكانية زراعة الجينوم الأمومي أو الأبوي والتعامل معه بشكل منفصل، وهو مستمد من ال haESCs البارثينوجينية أو الاندروجينية، على التوالي. ويمكن بعد ذلك استخدام HaESCs كبديل الجينوم gametic ، وهو أمر مفيد بشكل خاص لدراسات الطباعة الجينومية ، والتعبير عن أليل محددة ، والعمليات الخاصة الأبوية.
في الفئران ، مطلوب كل من المعلومات الجينومية الأمومية والأبية لنمو الجنين الطبيعي11. لذلك ، لم يكن من الممكن الحصول على الجراء كاملة الأجل عندما تم حقن ال haESCs البارثينوجينية البرية (phaESCs) لتحل محل جينوم الحيوانات المنوية5،8. للتغلب على كتلة النمو، يجب تصحيح البصمة الجينومية لجينوم الأم من ال haESCs البارثينوجينية إلى تكوين أبوي. ويمكن تحقيق ذلك عن طريق التلاعب بالمناطق المثيلية المتمايزة. حتى الآن ، تم دراسة عمليات الحذف المستهدفة من H19- DMR ، Gtl2 - Dlk1 IG- DMR ، وRasgrf1- DMR لقمع الجينات المعبر عنها الأمهات في phaESCs3،5،8،12. أثبتت هذه الدراسات أن حذف كل من H19-DMR و IG-DMR كافية لتحويل الأم إلى تكوين بصمة أبوية يمكن أن تحل محل كروموسومات الحيوانات المنوية. الحقن داخل السيتوبلازمي من الكتائب التي تحمل حذف DMR اثنين في البويضات أسفرت عن الجراء شبه المستنسخة مع تردد بين 5.1٪ و 15.5٪ من الأجنة المنقولة من 2 خلية.
ويستند هذا البروتوكول على تطبيق phaESCs مع حذف كل من H19-DMR و IG-DMR، والتي نقوم بعبارة phaESCs بالضربة القاضية المزدوجة (DKO-phaESCs). نحن نقدم تعليمات مفصلة لتعديل البصمة الجينومية في الكتائب لإنشاء خطوط DKO-phaESC ، لحقن DKO-phaESCs في البويضات كبديل لجينوم الحيوانات المنوية ، لثقافة الأجنة شبه المستنسخة إلى الكيسات الأريمية ، والحصول على الفئران شبه المستنسخة. هذا البروتوكول هو مرجع للباحثين الذين يحتاجون إلى تلاعب دقيق ومباشر في الجينوم الأبوي وتوليد الأجنة والفئران شبه المستنسخة.
Protocol
وقد أجريت جميع التجارب على الحيوانات بموجب الترخيص ZH152/17 وفقا لمعايير ولوائح لجنة أخلاقيات الكانتونات زيوريخ ومرفق الحيوانات EPIC في معهد علوم الصحة الجزيئية، ETH زيوريخ.
ملاحظة: يبدأ هذا البروتوكول مع حذف H19- و IG-DMRs في phaESCs. للحصول على تفاصيل حول كيفية إنشاء خطوط phaESC، يرجى الرجوع إلى التقارير المنشورة10،13. يتم توفير نظرة عامة وإطار زمني لهذا البروتوكول (الخطوات 1-14) في الشكل 1A; يتم سرد الوسائط والحلول والمخازن المؤقتة في الجدول 1. يظهر إجراء إنشاء خطوط DKO-phaESC (الخطوات 1-6) في الشكل 1B، ويتم تصوير استراتيجية بناء الأجنة شبه المستنسخة (الخطوات 7-14) في الشكل 1C.
1. العدوى من البلازميدات لحذف H19-DMR و IG-DMR في phaESCs
- إعداد CRISPR/Cas9 plasmids للتعبير المشترك عن نواة Cas9 وتوجيه RNAs لاستهداف حذف H19-DMR و IG-DMR. Ligate أربعة أزواج من دليل RNA oligos (H19-DMR-gRNA1-F, R; H19-DMR-gRNA2-F, R; IG-DMR-gRNA1-F, R; IG-DMR-gRNA2-F، R المدرجة في الجدول 2) إلى pX330 البلازميدات.
ملاحظة: الرجوع إلى البروتوكول المنشور على الإجراء التفصيلي لإعداد هذه 4 CRISPR/Cas9 plasmids14. بدلا من ذلك ، يمكن الوصول إلى البلازميدات المتاحة لسلالات الماوس العامة أيضا من خلال مستودع(جدول المواد). - معطف سطح بئر واحد من لوحة 6-جيدا مع 1 مل من محلول الجيلاتين 0.2٪ عن طريق الحضانة في 37 درجة مئوية لمدة 10 دقيقة.
- لوحة 2 × 105 البرية نوع phaESCs على البئر المغلفة الجيلاتين في المتوسط haESC دون المضادات الحيوية، واحتضان لوحة في 37 درجة مئوية في جوCO 2 5٪ لمدة يوم واحد.
ملاحظة: يتم حذف المضادات الحيوية من الوسط لزيادة كفاءة شفط الدهون اللاحق. استخدمنا الكتائب البرية في الممر 10. نوصي باستخدام phaESCs المرور المبكر، ولكن تم استخدام مجموعة متنوعة من عدد المرور بنجاح8. ولا يعرف حاليا الارتباط بين رقم المرور وكفاءة الحصول على أجنة والفئران شبه المستنسخة. - ترانسفيكت phaESCs في بئر لوحة 6-جيدا (من الخطوة 1.3) مع 6 البلازميدات في وقت واحد باستخدام كاشف شفط الدهون: 50 نانوغرام piggyBac plasmid تحمل متحول CAG-EGFP، 50 نانوغرام piggyBac نقل البلازميد ، و 600 نانوغرام من كل من 4 CRISPR / Cas9 plasmids (من الخطوة 1.1). الرجوع إلى بروتوكول الشركة المصنعة على إجراء مفصل من transfection.
ملاحظة: يتم استخدام اثنين من البلازميدات piggyBac لدمج جهاز الإرسال والاستقبال للتعبير في كل مكان من البروتين الفلوري الأخضر المحسن (EGFP) في جينوم phaESCs. إذا لم تكن هناك حاجة لوضع علامات GFP على الخلايا ، يمكن استبدال هاتين البلازميدات ببلازميد CRISPR /Cas9 للتعبير العابر عن البروتينات الفلورية (على سبيل المثال ، pX458 plasmid) بدلا من واحدة من pX330 plasmids. يمكن بعد ذلك استخدام تعبير EGFP عابر لفرز الخلايا المصابة. - بعد يومين من العدوى، يستنشق الوسط، وإضافة 800 ميكرولتر من التريبسين.
- احتضان لوحة في 37 درجة مئوية في 5٪ CO2 الغلاف الجوي لمدة 5 دقائق. ثم، إضافة 2 مل من المخزن المؤقت غسل لإرواء التريبسين، وماصة عدة مرات للحصول على تعليق خلية واحدة.
- نقل تعليق الخلية إلى أنبوب 15 مل.
- الطرد المركزي الأنبوب في 160 × ز لمدة 5 دقائق، وإزالة supernatant.
- Resuspend بيليه الخلية في 400 ميكرولتر من العازلة صيانة haESC تكملها مع 15 ميكروغرام / مل Hoechst 33342.
ملاحظة: للحد من السمية المحتملة من Hoechst 33342، 1 ميكروغرام / مل Hoechst 33342 و 50 ميكرومتر فيراباميل قد استخدمت بدلا من 15 ميكروغرام / مل Hoechst 3334215. - احتضان تعليق الخلية عند درجة حرارة 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪ لمدة 15 دقيقة. بعد الحضانة، نقل تعليق الخلية إلى أنبوب 5 مل من خلال غطاء مصفاة الخلية، والحفاظ على أنبوب في 4 درجة مئوية حتى تصبح جاهزة للاستخدام في الخطوة التالية (القسم 2).
2. طلاء خلية واحدة من phaESCs المصابة باستخدام مقياس التدفق الخلوي
- قبل يوم واحد من فرز الكتائب المصابة، الخلايا الليفية الجنينية الماوس المشعع لوحة (MEFs) على لوحات الجيلاتين المغلفة 96 بئرا في كثافة 4 × 104 خلايا / سم2 في المتوسطة MEF. عادة، يتم إعداد 6 لوحات لإنشاء خط phaESC مع عمليات الحذف المستهدفة. احتضان لوحات في 37 درجة مئوية في 5٪ CO2 الغلاف الجوي.
ملاحظة: تتوفر ملفات MEFs المشععة تجاريا. نحن نستخدم MEFs المستمدة من أجنة E12.5 من فئران DR4. على الرغم من أن haESCs يمكن أن تنمو على لوحات مغلفة الجيلاتين دون MEFs، نوصي MEFs لزيادة جدوى haESCs واحد فرزها. - في يوم الفرز، يستنشق متوسط MEF من لوحات 96 بئرا، وإضافة 120 ميكرولتر من متوسط haESC الطازج لكل بئر. حافظ على اللوحات عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪.
- قم بإعداد فرز الخلايا باستخدام فوهة 100 ميكرومتر وفقا لتعليمات الشركة المصنعة. يتم استخدام ليزر الأشعة فوق البنفسجية 355 نانومتر والليزر الأزرق 488 نانومتر لإثارة Hoechst 33342 و EGFP مضان، على التوالي.
ملاحظة: بدلا من ذلك، Hoechst 33342 يمكن الكشف عن طريق الإثارة مع 405 نانومتر. - فرز الكتائب المصابة في أنبوب 5 مل (من الخطوة 1.10) باستخدام بوابة لجمع خلايا هابلويد في المرحلة G1/S التي تظهر التعبير EGFP. إيداع خلية واحدة في كل بئر من لوحات 96 جيدا من الخطوة 2.2.
ملاحظة: الكشف عن تلطيخ Hoechst 33342 يميز بشكل عام 3 قمم للخلايا ذات محتوى الحمض النووي 1n و 2n و 4n ، والتي تتوافق مع خلايا haploid في مرحلة G1 ، وهي مزيج من خلايا haploid في مرحلة G2 / M وخلايا ثنائية اللويد في مرحلة G1 ، وخلايا ثنائية في مرحلة G2 / M ، على التوالي. يتم تحديد خلايا هابلويد في مرحلة G1/S على أنها الذروة ذات الكثافة المنخفضة للفلورة Hoechst 33342. تظهر نتيجة تمثيلية وبوابة فرز في الشكل 2A. - بعد الطلاء، واحتضان لوحات 96 بئرا في 37 درجة مئوية في جو CO2 5٪.
3- الاستنساخ الفرعي لمركبات الكتائب المتحولة
- بعد ثلاثة أيام من طلاء الخلية الواحدة ، يمكن ملاحظة المستعمرات في عدة آبار من لوحات 96 بئرا تحت المجهر. وضع علامة على الآبار التي تنمو فيها مستعمرات واحدة فقط.
ملاحظة: في تجربتنا، لوحظت مستعمرات واحدة في 20٪-40٪ من آبار الآبار من لوحات 96 بئرا. - في اليوم 4 بعد طلاء خلية واحدة، استبدال نصف المتوسطة مع متوسط haESC جديدة في الآبار مع مستعمرات واحدة.
- قبل يوم واحد من التمرير (في اليوم 4 أو 5 بعد طلاء خلية واحدة) ، لوحة MEFs المشععة على لوحات الجيلاتين المغلفة 96 جيدا في كثافة 4 × 104 خلايا / سم2 في المتوسطة MEF. حافظ على اللوحات عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪.
- بعد 5 أو 6 أيام من الطلاء أحادي الخلية، حدد الآبار من 96 بئرا تحتوي على مستعمرات مفردة يبلغ قطرها أكثر من 150 ميكرومتر.
ملاحظة: يفضل اختيار 100 بئر تقريبا لإنشاء خط phaESC مع عمليات حذف DMR المستهدفة. - يستنشق الوسط في الآبار المحددة وإضافة 30 ميكرولتر من التريبسين. احتضان لوحات 96 بئرا في 37 درجة مئوية في جو CO2 5٪ لمدة 5 دقائق. ثم، إضافة 30 ميكرولتر من المخزن المؤقت غسل إلى كل بئر لإرواء التريبسين.
- إضافة 140 ميكرولتر من haESC المتوسطة في كل بئر، وماصة عدة مرات للحصول على خلايا واحدة.
- يستنشق المتوسطة MEF من آبار لوحات 96 جيدا أعدت في الخطوة 3.3.
- نقل phaESCs من كل بئر من الخطوة 3.6 إلى بئر جديدة من لوحة جديدة 96 جيدا من الخطوة 3.7.
- احتضان الصفائح ذات ال96 بئرا التي تحتوي على فرش فرعية من الكتائب عند درجة حرارة 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة 5٪.
- في اليوم التالي، يستنشق كل وسيلة من كل بئر، وإضافة 120 ميكرولتر من المتوسط haESC جديدة. احتضان لوحات في 37 درجة مئوية في 5٪ CO2 الغلاف الجوي.
- قبل يوم واحد من الخلايا تصبح التقاء لتمرير، لوحة MEFs المشععة على لوحات الجيلاتين المغلفة 24 بئرا في كثافة 4 × 104 خلايا / سم2 في المتوسطة MEF. حافظ على اللوحات عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪.
- عندما تصبح phaESCs التقاء لتمرير، يستنشق المتوسط وإضافة 30 ميكرولتر من تريبسين. احتضان لوحات 96 بئرا في 37 درجة مئوية لمدة 5 دقائق.
- إضافة 90 ميكرولتر من المخزن المؤقت غسل في كل بئر لإرواء تريبسين. ماصة عدة مرات للحصول على خلايا واحدة.
- يستنشق المتوسطة MEF من آبار لوحات 24 جيدا من الخطوة 3.11، وإضافة 600 ميكرولتر من المتوسط haESC الطازجة.
- نقل 60 ميكرولتر من تعليق subclones phaESC من كل بئر في الخطوة 3.13 إلى بئر جديدة من لوحات 24 جيدا من الخطوة 3.14. الحفاظ على التعليق المتبقية من كل subclone phaESC لاستخراج الحمض النووي و genotyping في الخطوة 4.
- احتضان لوحات 24 بئرا مع subclones phaESC في 37 درجة مئوية في جو CO2 5٪.
- قبل يوم واحد من ثقافات الخلية تصل إلى كثافة لتمرير، لوحة MEFs المشععة على لوحات الجيلاتين المغلفة 6-جيدا في كثافة 4 × 104 خلايا / سم2 في المتوسطة MEF. حافظ على اللوحات عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪.
- عندما تصبح phaESCs التقاء بما فيه الكفاية لتمرير، يستنشق المتوسط وإضافة 250 ميكرولتر من تريبسين. احتضان لوحات 24 بئرا في 37 درجة مئوية لمدة 5 دقائق.
ملاحظة: بعد كتابة في الخطوة 4.9، فقط خطوط phaESC مع حذف كل من H19-DMRو IG-DMR تحتاج إلى أن يتم تمريرها. - إضافة 750 ميكرولتر من المخزن المؤقت غسل في كل بئر لإرواء تريبسين. ماصة عدة مرات للحصول على تعليق خلية واحدة. نقل تعليق الخلية إلى أنبوب 15 مل.
- الطرد المركزي الأنبوب في 160 × ز لمدة 5 دقائق، وإزالة supernatant، وإعادة إنفاق بيليه الخلية في 2 مل من المتوسط haESC.
- يستنشق المتوسطة MEF من آبار لوحات 6 آبار من الخطوة 3.17. نقل تعليق phaESC من كل أنبوب من الخطوة 3.20 إلى بئر جديدة. حافظ على اللوحات عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪.
- قم بتوسيع استنساخ الخلية بتكرار الخطوات من 3.17 إلى 3.21 وزيادة حجم اللوحة وأحجام التريبسين وحاجز الغسيل و haESC المتوسط. قم بإعداد قارورة T25 لكل خط phaESC مستنسخ فرعي من MEFs للخطوة 5.
ملاحظة: نوصي بتجميد a aliquot من كل خط phaESC المستنسخة الفرعية في 300 ميكرولتر من تجميد المتوسطة والحفاظ على cryostock في تخزين النيتروجين السائل قبل الشروع في الخطوة 5.
4. أول جنوة من خطوط الكتائب المستنسخة الفرعية مع MEFs
- لاستخراج الحمض النووي الجينومي من تعليق الخلية المتبقية من الخطوة 3.15، إضافة 200 ميكرولتر من العازلة تحلل إلى كل بئر من لوحات 96 بئر. نقل تعليق الخلية إلى أنبوب 1.5 مل. شطف كل بئر مع إضافية 200 ميكرولتر من العازلة تحلل لاسترداد جميع الخلايا المتبقية وجمع في نفس أنبوب 1.5 مل.
- احتضان أنبوب 1.5 مل في 55 درجة مئوية لمدة 3 ساعة مع الاختلاط.
- بعد الحضانة، أضف 460 ميكرولتر من الأيزوبروبانول إلى كل أنبوب 1.5 مل، واخلط بلطف حتى يصبح ترسب الحمض النووي مرئيا.
- طرد مركزي أنابيب في ≥ 10،000 × ز لمدة 5 دقائق وإزالة supernatant. غسل الكريات الحمض النووي مع 200 ميكرولتر من الإيثانول 70٪.
- طرد مركزي أنابيب في ≥ 10،000 × ز لمدة 5 دقائق وإزالة supernatant.
- جفف الأنابيب في الهواء لمدة 10 دقائق ثم أعيد إنفاق الحمض النووي في 20 ميكرولتر من الماء.
- تنفيذ تفاعل البوليميراز المتسلسل (PCR) باستخدام بوليمرات الحمض النووي الحرارية باتباع بروتوكول الشركة المصنعة.
ملاحظة: يتم سرد أزواج التمهيدي ل PCR في الجدول 2 وتستخدم كما يلي: H19-DMR-P1 و P3 (407 bp ل H19-DMR المحذوفة)؛ H19-DMR-P2 و P3 (623 نقطة أساس للنمط البري H19-DMR)؛ IG-DMR-P1 وP3 (319 نقطة أساس لحذف IG-DMR)؛ IG-DMR-P2 و P3 (492 نقطة أساس للنوع البري IG-DMR). ملف درجة الحرارة من PCR لجميع أزواج التمهيدي هو على النحو التالي: 30 ق 98 درجة مئوية، 35 × (10 ق 98 درجة مئوية، 20 ق 56 درجة مئوية، 30 ق 72 درجة مئوية)، 5 دقائق 72 درجة مئوية. يظهر طول شظايا الحمض النووي المضخمة لحذفات H19-DMRو IG-DMRبعض الاختلاف بسبب الانضمام إلى النهاية غير المتجانسة المرتبطة بالتحرير بوساطة CRISPR/Cas9. تم استزراع PhaESCs مع MEFs ، والتي تحتوي على النوع البري H19- DMR و IG- DMR DNA. لذلك ، فإن أزواج التمهيدي من H19- DMR - P2 / P3 و IG- DMR - P2 / P3 ، والتي تضخيم شظايا الحمض النووي البرية ، ليست مفيدة. ومع ذلك، يتم تضمين هذه أزواج التمهيدي كعناصر تحكم وينبغي أن تعطي الفرقة في جميع ردود الفعل. - تحليل شظايا PCR بواسطة أجاروز هلام الكهربائي. الرجوع إلى البروتوكول المنشور على الإجراء التفصيلي للكهتروفورسيس16.
- تحديد خطوط الخلايا مع حذف كل من H19-DMRو IG-DMR. تظهر صورة تمثيلية للكهتروفورسيس في الشكل 2B.
ملاحظة: في حالتنا، تم تحديد ثمانية أسطر خلية مع حذف كل من H19-DMRو IG-DMRبين 135 خط phaESC مستنسخة فرعية.
5. تنقية الخلايا Haploid من خطوط phaESC المستنسخة الفرعية
- عندما تصبح ثقافات phaESC المستنسخة الفرعية في قوارير T25 من الخطوة 3.22 كثيفة بما يكفي للتمرير ، تبهر الوسط وتضيف 1.5 مل من التريبسين. احتضان قارورة في 37 درجة مئوية لمدة 5 دقائق. ثم، إضافة 4.5 مل من المخزن المؤقت غسل وماصة عدة مرات للحصول على تعليق خلية واحدة.
- نقل كل تعليق الخلية في أنبوب 15 مل والطرد المركزي أنبوب في 160 × ز لمدة 5 دقائق. إزالة supernatant و resuspend الكريات الخلية في 400 ميكرولتر من العازلة صيانة haESC تكملها مع 15 ميكروغرام / مل Hoechst 33342.
- احتضان تعليق الخلية عند 37 درجة مئوية لمدة 15 دقيقة. بعد الحضانة، نقل تعليق الخلية إلى أنبوب 5 مل من خلال غطاء مصفاة الخلية. شطف غطاء مصفاة الخلية مع إضافية 400 ميكرولتر من العازلة صيانة haESC، وجمع الخلايا المتبقية في نفس أنبوب 5 مل. حافظ على الأنبوب عند درجة حرارة 4 درجات مئوية حتى يصبح جاهزا للفرز.
- إعداد مقياس التدفق الخلوي مع فوهة 100 ميكرومتر وفقا لتعليمات الشركة المصنعة.
ملاحظة: Hoechst 33342 يمكن الكشف عن طريق الإثارة في 405 نانومتر. هنا، يتم استخدام ليزر الأشعة فوق البنفسجية 355 نانومتر للكشف عن Hoechst 33342. - إعداد تعليق الخلية (من الخطوة 5.3) وأنبوب جديد 15 مل يحتوي على 2 مل من العازلة صيانة haESC لجمع الخلايا المفرزة في مقياس التدفق الخلوي.
- بدء التحليل وإعداد بوابة الفرز لجمع خلايا haploid في المرحلة G1/S. ارجع إلى الرسم البياني في الشكل 2A لتحديد مجموعة مراحل G1/S phaESC.
ملاحظة: قد لا تحتوي بعض خطوط phaESC المستنسخة الفرعية على أي خلايا هابلويد بسبب التدبيس الكامل أو الطلاء الخاطئ للخلايا ثنائية الدبلويد في الخطوة 2. إذا لم يتم ملاحظة خلايا haploid في مرحلة G1/S، انتقل إلى عينة أخرى دون الفرز. في حالتنا، 5 خطوط الخلية تحتوي على خلايا هابلويد و 3 خطوط الخلية تحتوي فقط على خلايا ثنائية المستوى من أصل 8 خطوط الكتائب المستنسخة الفرعية. - بعد فرز الخلية، أضف 5 مل من مخزن الغسيل المؤقت على طول جدار أنبوب التجميع 15 مل. الطرد المركزي الأنبوب في 160 × ز لمدة 5 دقائق. أزل الناتنات الفائق.
- حدد لوحة بحجم مناسب للاستزراع حسب عدد الخلايا المفرزة. استخدم بئرا واحدا من لوحة من 96 بئرا ولوحة من 24 بئرا ولوحة من 12 بئرا لمساعدة 1000-40000 خلية و40000-200000 خلية و200000-400000 خلية على التوالي. Resuspend بيليه الخلية في 120 ميكرولتر، 600 ميكرولتر، و 1.2 مل من المتوسط haESC، على التوالي.
ملاحظة: لوحة الخلايا في كثافة عالية لأن انخفاض التقاء يمكن أن يسبب موت الخلايا من الخلايا بعد الفرز. من هذه النقطة فصاعدا، يتم استزراع الكتائب على الآبار المغلفة بالجيلاتين دون MEFs لتسهيل الكتابة الجينية في الخطوة 6 والتطبيق اللاحق للحقن داخل السيتوبلازمي من الخطوة 9. - بعد نقل تعليق الخلية إلى بئر مغلفة بالجيلاتين من الحجم المناسب ، احتضن اللوحة عند 37 درجة مئوية في جو CO2 بنسبة 5٪.
- مواصلة توسيع الثقافات phaESC عن طريق تكرار الخطوات 3.18 إلى 3.21 مع زيادة أحجام لوحة وزيادة كميات من التريبسين، وغسل العازلة، والمتوسطة haESC. يتم استزراع الخلايا على الآبار المغلفة بالجيلاتين دون MEFs.
- لكل خط الكتائب المستنسخة الفرعية، وإعداد ثقافة في بئر واحد من لوحة 24 جيدا وبئن واحد من لوحة 6-جيدا للخطوات 6 و 9، على التوالي.
ملاحظة: يجب تجميد بعض خلايا كل خط phaESC المستنسخ في 300 ميكرولتر من متوسط التجميد كمخزون التبريد في خزان النيتروجين السائل قبل الشروع في الخطوة 9.
6. الجينوتيبينج الثاني من خطوط phaESC المستنسخة دون MEFs
ملاحظة: يتم تنفيذ جولة ثانية من الكتابة الجينية للتأكد من أن خطوط phaESC المستنسخة الفرعية تمتلك حذف كل من H19- و IG-DMRs ، وأن أليلات النمط البري غائبة بعد إزالة MEFs.
- تأكد تحت المجهر من أن الثقافات الموجودة في آبار صفائح 24 بئرا من الخطوة 5.11 خالية من MEFs.
ملاحظة: في حالة ملاحظة MEFs، من الضروري الاستمرار في تمرير الثقافات حتى تختفي ملفات تعريف الارتباط الحيوي لتجنب تلويث PCR بالحمض النووي البري من MEFs. - يستنشق المتوسط من الثقافات التقاء وإضافة 400 ميكرولتر من العازلة تحلل لكل بئر من لوحة 24 جيدا. بعد الأنابيب عدة مرات، نقل تعليق الخلية إلى أنبوب 1.5 مل.
- احتضان أنبوب 1.5 مل في 55 درجة مئوية لمدة 3 ساعة مع الاختلاط.
- بعد الحضانة، أضف 400 ميكرولتر من الأيزوبروبانول إلى أنبوب 1.5 مل، واخلط بلطف حتى يصبح ترسب الحمض النووي مرئيا.
- الطرد المركزي الأنبوب في ≥ 10،000 × ز لمدة 5 دقائق وإزالة supernatant. غسل بيليه الحمض النووي مع 200 ميكرولتر من الإيثانول 70٪.
- الطرد المركزي الأنبوب في ≥ 10،000 × ز لمدة 5 دقائق وإزالة supernatant.
- جفف الأنبوب في الهواء لمدة 10 دقائق ثم أعيد إنفاق الحمض النووي في 50 ميكرولتر من الماء.
- إجراء PCR genotyping بعد الخطوة 4.7 وكهروفوريسيس هلام في الخطوة 4.8 لتحديد خطوط الخلية، والتي تمتلك حذف كل من H19- وIG-DMRs وخالية من أليليس البرية.
ملاحظة: يتم عرض صورة لتحليل genotyping ثاني نموذجي في الشكل 2B للرجوع إليها. في حالتنا ، كانت جميع خطوط الخلايا ال 5 المختارة بعد تنقية الخلية haploid (الخطوة 5) خالية من أليلات النمط البري وتمتلك فقط أليلات الحذف من H19- و IG- DMRs. - استخدم خطوط phaESC المستنسخة الفرعية المحددة بعد هذا الكتابة الجينية الثانية كخطوط DKO-phaESC.
7. الإباضة الفائقة للفئران
- لإنتاج البويضات MII، بدء الإباضة الفائقة عن طريق الحقن داخل الصفاق من 5 وحدة IU من مصل الفرس الحوامل gonadotropin (PMSG) حل في كل فأرة أنثى B6D2F1 (4-5 أسابيع من العمر) 63-65 ساعة قبل جمع البويضات.
ملاحظة: يوصى بسلالة الماوس B6D2F1 لهذا البروتوكول لأن البويضات B6D2F1 تتسامح مع الحقن داخل السيتوبلازم بشكل جيد وتظهر إمكانات تنموية عالية بعد الإجراء17. - بعد 48 ساعة من حقن PMSG ، حقن intraperitoneally 5 وحدة من محلول gonadotropin chorionic الإنسان في كل فأر.
8. جمع Oocyte
- إعداد لوحة 4-جيدا تحتوي على 700 ميكرولتر من المتوسط الهيالورونيديز في بئر واحد و 700 ميكرولتر من M2 المتوسطة في الآبار المتبقية 3. بالإضافة إلى ذلك، إعداد طبق 6 سم مع 7 مل من M2 المتوسطة وطبق مركز جيدا مع 900 ميكرولتر من المتوسط M16. قم بتدفئة الطبق والأطباق مسبقا عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة 5٪.
- في يوم الحقن داخل السيتوبلازمي ، قتل الإناث فائقة الإباضة (من الخطوة 7.2) إما عن طريق خلع عنق الرحم أواستنشاق ثاني أكسيد الكربون في حوالي الساعة 8 صباحا في الصباح. تشريح oviducts باستخدام ملاقط ومقص. ضع القنوات في الطبق الذي يبلغ قطره 6 سم مع M2 medium.
- الإفراج عن المجمعات الركامية البويضات (COCs) عن طريق تمزيق أمبولا من oviducts مع إبرة 30 G. نقل COCs إلى متوسط الهيالورونيديز قبل الحارة والحفاظ على 37 درجة مئوية في جو CO2 5٪.
- بعد 2-3 دقائق، وجمع البويضات الخالية من الركاز مع ماصة الفم وغسل البويضات 3 مرات عن طريق نقلها إلى المتوسط M2 الطازجة في الآبار الأخرى 3 من لوحة 4-جيدا.
- جمع البويضات ميتافايز الثاني (MII) ، التي تمتلك الهيئات القطبية الأولى ، في طبق وسط جيدا مع M16 المتوسطة والحفاظ على لوحة في 37 درجة مئوية في جوCO 2 5 ٪ حتى استخدامها للحقن داخل السيتوبلازم في الخطوة 12.
9. معالجة وجمع DKO-phaESCs
- إعداد ثقافة DKO-phaESC في بئر من لوحة من 6 آبار بدون MEFs عند التقاء 60-80٪ قبل يوم واحد من الحقن داخل السيتوبلازم (من الخطوة 5.11).
- للحث على اعتقال دورة الخلية في المرحلة M، يستنشق المتوسط تماما وإضافة 2 مل من haESC المتوسطة التي تحتوي على 0.05 ملغم / مل demecolcine.
- بعد 8 ساعة من العلاج demecolcine، يستنشق المتوسط وإضافة 800 ميكرولتر من تريبسين.
- احتضان لوحة في 37 درجة مئوية في جو CO2 5٪ لمدة 5 دقائق، ثم إضافة 2 مل من العازلة غسل لإرواء التريبسين، وماصة عدة مرات للحصول على تعليق خلية واحدة.
- نقل تعليق الخلية إلى أنبوب 15 مل. الطرد المركزي الأنبوب في 160 × ز لمدة 5 دقائق وإزالة supernatant.
- Resuspend بيليه الخلية في 400 ميكرولتر من العازلة صيانة haESC تحتوي على 15 ميكروغرام / مل Hoechst 33342.
- احتضان تعليق الخلية عند درجة حرارة 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪ لمدة 15 دقيقة. بعد الحضانة، نقل تعليق الخلية إلى أنبوب 5 مل من خلال غطاء مصفاة الخلية، والحفاظ على أنبوب في 4 درجة مئوية حتى فرز الخلية في الخطوة 10.
10- تنقية مركبات DKO-phaESCs الموقوفة في المرحلة M
- إعداد مقياس التدفق الخلوي مع فوهة 100 ميكرومتر وفقا لتعليمات الشركة المصنعة.
ملاحظة: Hoechst 33342 يمكن الكشف عن طريق الإثارة في 405 نانومتر. هنا، يتم استخدام ليزر الأشعة فوق البنفسجية 355 نانومتر للكشف عن Hoechst 33342. - إعداد DKO-phaESCs التي تم القبض عليها في مرحلة M من الخطوة 9.7 وبدء التحليل. حدد بوابة فرز مناسبة لجمع خلايا المرحلة M haploid (2n) من العينة المعالجة بديمكولسين.
ملاحظة: بعد العلاج demecolcine, ومن المتوقع 2 مجموعات الخلية, المقابلة لهابلويد وديبلويد M-المرحلة اعتقل الخلايا كما هو مبين في الشكل 3B. اعتقال دورة الخلية بعد اكتمال العلاج demecolcine، وبالتالي، لا يلاحظ ذروة الحمض النووي haploid 1n. وهذا أمر مهم لأن خلايا المرحلة M haploid وخلايا ديبلويد G1 تمتلك نفس محتوى الحمض النووي (2n) وتنتج قمم متداخلة. - إعداد أنبوب 15 مل تحتوي على 2 مل من العازلة صيانة haESC لجمع الخلايا المفرزة في تدفق cytometer. بدء فرز الخلايا.
- بعد فرز الخلية، أضف 5 مل من المخزن المؤقت للغسيل على طول جدار أنبوب التجميع. الطرد المركزي الأنبوب في 160 × ز لمدة 5 دقائق وإزالة supernatant.
- Resuspend الخلايا في حجم مناسب من العازلة صيانة haESC للحصول على تركيز النهائي من 5 × 105 خلايا / مل.
- نقل تعليق الخلية إلى أنبوب 1.5 مل. الحفاظ على أنبوب على الجليد حتى جاهزة للحقن داخل السيتوبلازم في الخطوة 12.
11. إعداد عقد وmicroinjection ماصة
ملاحظة: لتنفيذ الحقن داخل السيتوبلازم (الخطوة 12)، هناك حاجة إلى عدة عقد وماصة microinjection(الشكل 4A). يمكن شراء هذه المواسير على الطلب حسب الطلب من مورد تجاري أو مصنوعة من الشعيرات الدموية الزجاجية المناسبة باستخدام سحب micropipette وmicroforge.
- سحب الشعيرات الدموية الزجاجية borosilicate على سحب micropipette. لسحب الشعيرات الدموية الزجاجية borosilicate دون خيوط (0.78 × 1.00 × 80 ملم) يتم إعطاء المعلمات التالية لسحب الأفقي المشتعلة(جدول المواد)كمرجع، ولكن سوف تختلف عن غيرها من الصكوك وأنواع الشعيرات الدموية الزجاج: الحرارة 510 (اختبار المنحدر 480)، سحب 0، السرعة 150، الوقت 175 والضغط 200 لعقد الأنابيب؛ الحرارة 510 (اختبار المنحدر 480) ، سحب 90 ، السرعة 140 ، الوقت 125 والضغط 200 لمواسير الأنابيب microinjection.
ملاحظة: يجب تحديد المعلمات المثلى بشكل فردي لأن العديد من العوامل بما في ذلك الرطوبة ، ونموذج سحب micropipette والكثير من الشعيرات الدموية الزجاجية يمكن أن تؤثر على شكل ماصة الحقن. وينبغي أن تهدف إلى شكل ممدود مع تفتق التدريجي في. - إعداد عقد ماصة
- تعيين واحد سحب الشعرية أعدت في الخطوة 11.1 إلى microforge. وضع الشعرية على حبة الزجاج على خيوط وخفض الشعرية لإجراء اتصال مع حبة الزجاج في حين تسخين خيوط.
- كسر الشعرية عن طريق إيقاف التدفئة وفصل من حبة الزجاج بحيث قطرها الخارجي هو 60-100 ميكرومتر.
- ضع طرف الشعرية أفقيا لمواجهة حبة الزجاج على خيوط.
- سخني الخيط للسماح القطر الداخلي للطرف الشعري أن يذوب إلى قطر 10-20 ميكرومتر.
- تحريك الشعرية بحيث يضع حبة الزجاج عند نقطة ~ 1 ملم من طرف الشعرية دون اتصال. سخني الخيط للسماح للشعيرات الدموية بالانحناء بزاوية 20 درجة. إنزال الشعرية، و يطلق عليها ماصة عقد، من microforge.
ملاحظة: لقياس حجم الشعرية، يفضل تثبيت الشبكية العدسة في الميكروفورج.
- إعداد ماصة الأنابيب الدقيقة
- تعيين واحد سحب الشعرية أعدت في الخطوة 11.1 إلى microforge. وضع الشعرية على حبة الزجاج على خيوط وخفض الشعرية لإجراء اتصال مع حبة الزجاج في حين تسخين خيوط.
- كسر الشعرية عن طريق إيقاف التدفئة وفصل من حبة الزجاج في موقف أن قطرها الخارجي هو 6 ميكرومتر.
- تحريك الشعرية بحيث يضع حبة الزجاج عند نقطة ~ 1 ملم من طرف الشعرية دون اتصال. سخني الخيط للسماح للشعيرات الدموية بالانحناء لأعلى بزاوية 20 درجة. قم بإنزال ماصة الأنابيب الدقيقة من الميكروفورج وتخزينها في صندوق آمن لاستخدامها لاحقا.
ملاحظة: يتم إعداد ماصة microinjection مع المواصفات التالية: القطر الخارجي, 6 ميكرومتر; القطر الداخلي, 4.5-5 ميكرومتر; زاوية الانحناء، 20 درجة. تحديد التصميم الأمثل لماصة microinjection مهم لنجاح الحقن داخل السيتوبلازمي. يمكن أن يمنع القطر الداخلي الكبير جدا تمزق غشاء البلازما في DKO-phESCs المانحة (انظر قسم المناقشة). إذا كان القطر الداخلي ضيقا جدا ، فقد يعوق الأنابيب السلسة للجهات المانحة DKO-phESCs. زاوية الانحناء < 30 درجة هو الأفضل كما زاوية منعطف عالية يعوق تأثير البقول بيزو.
12. الحقن داخل السيتوبلازمية من DKO-phaESCs
- قبل الحقن داخل السيتوبلازمي (من الخطوة 12.2) ، قم بإعداد محلول البولي فينيلبيرولدون (PVP) عن طريق إضافة 5 مل من M2 المتوسطة إلى أنبوب 50 مل يحتوي على 0.6 غرام من PVP وتهيج الأنبوب على الروك عند 4 درجة مئوية لمدة يومين. بعد أن يذوب PVP تماما ، يتم تصفية المحلول وتخزينه عند درجة حرارة 4 درجات مئوية.
- في يوم الحقن داخل السيتوبلازم، قم بإعداد طبق من وسط البئر مع 900 ميكرولتر من متوسط KSOM ودفئ الطبق مسبقا عند 37 درجة مئوية في جو CO2 بنسبة 5٪.
- إعداد طبق micromanipulation عن طريق محاذاة قطرات من 5 ميكرولتر من محلول PVP و 20 ميكرولتر من المتوسط M2 على غطاء طبق 10 سم التي يتم وضعها رأسا على عقب. تغطية قطرات مع الزيت المعدني، ووضع الطبق على خشبة المسرح من المجهر الحقن.
ملاحظة: الترتيب الموصى به من طبق micromanipulation يظهر في الشكل 4B. - تثبيت ماصة عقد على micromanipulator. ملء ماصة microinjection مع زيت الفلوروكربون باستخدام طرف microloader، وجبل على المحرك بيزو.
- تزج ماصة microinjection في قطرة مع حل PVP وماصة صعودا وهبوطا عدة مرات لمعطف الزجاج مع PVP وجعلها أقل لزجة. تحميل حجم صغير من حل PVP في ماصة microinjection، ونقل ماصة إلى قطرة مع المتوسط M2.
- تزج ماصة عقد في المتوسط M2، والتركيز على ماصة في الجزء السفلي من قطرة.
- نقل ما يقرب من 2 ميكرولتر من تعليق DKO-phaESC من الخطوة 10.6 إلى انخفاض متوسط M2.
- نقل 10 البويضات MII من الخطوة 8.5 إلى نفس M2 انخفاض المتوسطة باستخدام ماصة الفم.
- للحقن، تدوير البويضات في قطرة متوسطة M2 بحيث يواجه الفضاء perivitelline ماصة microinjection، ولوحة MII لا يقع في مسار ماصة microinjection (الشكل 4A). عقد البويضات عن طريق تطبيق الضغط السلبي من خلال ماصة عقد.
ملاحظة: يتم التعرف على لوحة MII بصريا على أنها نتوء من ooplasm التي يشار إليها باسم "سنام" وغالبا ما تقع بجوار الجسم القطبي الأول. تحتوي لوحة MII على المغزل الميوتيكي مع الكروموسومات المرفقة. يجب تجنب لمس ماصة microinjection ولوحة MII حيث يمكن أن يؤدي الضرر الميكانيكي للمغزل والكروموسومات إلى تعطيل نمو الجنين. - تحميل واحد DKO-phaESC في غيض من ماصة microinjection عن طريق تطبيق الضغط السلبي لطيف. تمزق غشاء البلازما من DKO-phaESC عن طريق الأنابيب لتجنب حقن سليمة DKO-phaESC (الشكل 3C; انظر المناقشة).
ملاحظة: في حالة عدم تمزق غشاء البلازما في DKO-phaESC عن طريق الأنابيب، تجاهل DKO-phaESC وتحميل DKO-phaESC آخر. - وضع ماصة microinjection في اتصال مع pellucida زونا من البويضات، وتطبيق كمية صغيرة من الضغط السلبي داخل ماصة microinjection.
- تطبيق نبضات بيزو (كثافة, 20; تردد, 4) لاختراق زونا في حين دفع غيض من ماصة microinjection نحو الفضاء perivitelline. تأكد من أن لوحة MII ، التي تحتوي على مغزل وكروموسومات ، لا توجد في مسار ماصة الميكروينيكشن.
ملاحظة: تجريبيا ضبط الإعداد إلى نبضات بيزو أدنى للحفر من خلال زونا لتقليل إمكانية حدوث ضرر لoolemma. - تجاهل جزء من بيلوسيدا زونا من ماصة microinjection، ووضع DKO-phaESC على حافة ماصة.
- اختراق البويضات مع ماصة microinjection بحيث يصل إلى oolemma الجانب الآخر.
ملاحظة: لا تلمس لوحة MII لمنع تلف المغزل والكروموسومات. - تطبيق نبض بيزو (كثافة، 6؛ التردد، 1) لاختراق oolemma. تأكد من أن oolemma يرتاح على طول رمح ماصة microinjection.
ملاحظة: تجريبيا تحديد الإعداد الأدنى من نبض بيزو لكسر oolemma لتقليل الضرر الذي لحق البويضات. - حقن DKO-phaESC مع الحد الأدنى من حجم المتوسطة في ooplasm، وسحب ماصة microinjection بسلاسة من البويضات.
- الإفراج عن البويضات حقن من ماصة عقد، ووضعها على جانب من microdrop لجمع في وقت لاحق.
- كرر إجراء الحقن من الخطوات 12.9 إلى 12.17 للبويضات MII الأخرى في قطرة M2 المتوسطة.
ملاحظة: تجنب إبقاء البويضات خارج الحاضنة لأكثر من 20 دقيقة. في تجربتنا ، يمكن التلاعب دفعة من 10 البويضات بشكل مريح في غضون 15 دقيقة بعد التدريب المناسب. - نقل دفعة من البويضات المحقونة من قطرة M2 المتوسطة إلى طبق مركز جيدا مسبقا مع KSOM المتوسطة.
- احتفظ بالطبق لمدة ساعة واحدة عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة 5٪.
- كرر التلاعب البويضات من الخطوتين 12.5 و 12.20 مع مجموعات إضافية من البويضات MII للحصول على ما يكفي من البويضات حقن.
13. تفعيل الأجنة شبه المستنسخة التي شيدت
- إعداد اثنين من الأطباق مركز جيدا مع 900 μL كل من KSOM المتوسطة والتنشيط المتوسطة. إعداد لوحة 4-جيدا مع 700 ميكرولتر من المتوسط KSOM في كل بئر. قم بتدفئة الأطباق والطبق مسبقا عند درجة حرارة 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪.
- بعد 1 ساعة في KSOM المتوسطة، نقل البويضات حقن من الخطوة 12.21 في طبق مركز جيدا قبل الحارة مع وسيطة التنشيط.
- احتفظ بالطبق لمدة 6 ساعة عند 37 درجة مئوية في جو ثاني أكسيد الكربون بنسبة5٪ لتنشيطه.
- بعد التنشيط ، لاحظ أن بعض الأجنة شبه المستنسخة تشكل ثلاثة أجسام قطبية ، وهي الأجسام القطبية الأولى والثانية للبويضة ، والجسم القطبي الزائف من DKO-phaESC (الشكل 3E).
- غسل الأجنة 3 مرات عن طريق نقلها إلى آبار جديدة مع KSOM المتوسطة في لوحة 4-جيدا.
- نقل الأجنة إلى طبق مركز جيدا مع KSOM المتوسطة، والحفاظ على الطبق في 37 درجة مئوية في جو CO2 5٪ لمزيد من التطوير.
14. تطوير الأجنة شبه المستنسخة التي شيدت
- بعد يوم واحد من الثقافة في KSOM المتوسطة من الخطوة 13.6، العديد من الأجنة شبه المستنسخة تصل إلى مرحلة 2 خلية(الشكل 5A).
- لمزيد من التطوير لأجنة ما قبل الزرع في المختبر ، استمر في زراعة الأجنة شبه المستنسخة في وسط KSOM عند 37 درجة مئوية في جو CO2 بنسبة 5٪. نقل الأجنة شبه المستنسخة إلى المتوسط KSOM الطازجة في اليوم 2. في اليوم الرابع، ستصل عدة أجنة إلى مرحلة الكيسة الأريمية(الشكل 5A).
- للحصول على اشتقاق الفئران شبه المستنسخة، نقل الأجنة من 2 خلية من الخطوة 14.1 إلى oviducts من الإناث المتلقي الحوامل الزائفة. التعرف على الإناث الحوامل الزائفات عن طريق التزاوج مع الذكور الذين تم قطع القناة الدافقة قبل يوم واحد من نقل الجنين واختيارهم على أساس وجود قابس مرئي بوضوح في صباح اليوم لنقل الجنين (0.5 يوما بعد الكوتوم (dpc)). حوالي 19.5 ديسيبل ، يتم تسليم الجراء على المدى الكامل بشكل طبيعي من الإناث المتلقي(الشكل 5B).
النتائج
الغرض من هذا البروتوكول هو تطبيق haESCs كبديل للحيوانات المنوية للحصول على الأجنة والفئران شبه المستنسخة. لهذا الغرض، تم إنشاء خط DKO-phaESC يحمل المتحول CAG-EGFP واستخدامها لحقن داخل السيتوبلازم في البويضات MII. للحصول على خط phaESC مناسب مع تكوين بصمة الأب، قمنا بالهندسة الوراثية باستخدام نواة Cas9. خط ESC haploid يحتوي على خلايا هابلويد وديبلويد التي تنشأ بسبب ميل متأصل من ESCs haploid لdiploidization10. مجموعة كروموسوم haploid هو شرط أساسي لاستبدال ناجح لجينوم الحيوانات المنوية. تحليل محتوى الحمض النووي حسب قياس التدفق الخلوي يظهر توزيع خلايا هابلويد وديبلويد في G0/G1-, S-, و G2/M-مراحل (الشكل 2A).
لإنشاء خطوط DKO-phaESC ، تم تحويل خطوط phaESC البرية مع بنيات الإرسال والاستقبال piggyBac للتعبير عن EGFP المعدلة وراثيا المستقرة ومع كريسبر / Cas9 plasmids للحصول على حذف H19- وIG-DMRs. لاستبعاد ESCs diploid وعزل فقط haploid ESCs التعبير عن EGFP، تم تعريف بوابة فرز محددة(الشكل 2A). ثم تم طلاء خلايا واحدة إيجابية من نوع EGFP في آبار فردية من 96 لوحة بئر للحصول على استنساخ فرعي. استخدمت مغذيات MEF لزيادة كفاءة الطلاء وبقاء الكتائب المصابة. وبعد التوسع في الثقافات، قامت PCR بجولة أولية من الكتابة الجينية لتحديد الحيوانات المستنسخة الفرعية التي تحمل حذف كل من DMRs. بعد إزالة مغذيات MEF من الثقافات ، تم إجراء كتابة جينية ثانية لتأكيد عدم وجود أليلات النمط البري في H19- و IG-DMRs (الشكل 2B). من ما مجموعه 135 استنساخ الفرعية، حصلنا على 5 خطوط haploid DKO-phESC التي حملت الأليل المحذوفة وكانت خالية من أليلات البرية من كل من H19-DMRوIG-DMR.
تم إدخال متحول CAG-EGFP إلى DKO-phaESCs لدراسة مساهمتها في الأجنة شبه المستنسخة من خلال تصور الفلورسينس الأخضر تحت المجهر(الشكل 3A). للحقن داخل السيتوبلازمي، تم التعامل مع DKO-phaESCs مع demecolcine للقبض عليهم في المرحلة M. وهكذا، تزامنت دورة الخلية من DKO-phaESCs مع تلك التي من البويضات MII. أظهر تحليل تدفق قياس الخلايا 2 السكان المقابلة لمرحلة G2/M القبض haploid (2n) وخلايا ديبلويد (4n) بعد العلاج مع demecolcine (الشكل 3B). وأشار عدم وجود ذروة هابلويد 1n إلى أن اعتقال دورة الخلية كان كاملا إلى حد كبير. ثم تم فرز ESCs haploid المرحلة M وحقنها في البويضات. لهذا، تم تحميل واحد DKO-phaESC في ماصة microinjection وحقنها في السيتوبلازم من البويضات MII (الشكل 3C). تمزق غشاء البلازما من DKO-phaESC عن طريق الأنابيب في غيض من ماصة microinjection.
بعد الحقن، نادرا ما تم الكشف عن التعبير EGFP في الأجنة شبه المستنسخة التي شيدت كما السيتوبلازم من DKO-phaESCs قد تفرقت في السيتوبلازم كبيرة من البويضات(الشكل 3D). في حالات نادرة ، يمكن ملاحظة بقعة مستديرة من تعبير EGFP المكثف داخل ooplasm. ومن المرجح أن تكون هذه الملاحظة ناجمة عن الحقن غير المقصود لمركبات DKO-phaESCs السليمة. الفشل في تمزق غشاء الخلية DKO-phaESC من المرجح أن لا يتوافق مع مزيد من نمو الجنين وينبغي تجنبه. بعد ساعة واحدة من الحقن ، تم تنشيط الأجنة عن طريق العلاج بكلوريد السترونتيوم18. بعد ست ساعات من بدء التنشيط ، لوحظ ما يصل إلى 3 أجسام قطبية تحت المجهر(الشكل 3E). هذه الهيئات القطبية تتوافق مع الهيئات القطبية الأولى والثانية من البويضات والجسم القطبي الزائف من DKO-phaESC7. وبالإضافة إلى ذلك، لوحظ اثنين من بروتونوكلي تحت المجهر التباين تداخل التفاضلية، والتي تشبه المرحلة pronuclear من zygotes بعد الإخصاب الطبيعي مع الحيوانات المنوية.
ولإثبات كفاءة النمو، تم استزراع الأجنة شبه المستنسخة إلى مرحلة الكيسة الأريمية(الشكل 5A). وعلاوة على ذلك، تم الحصول على فأر كامل المدة بعد نقل أجنة مرحلة شبه مستنسخة من خليتي الخلية إلى oviducts للأنثى المتلقية(الشكل 5B). وكما هو متوقع، كان الفأر المشتق من جنين شبه مستنسخ أنثى حيث لا تحمل البويضات ولا الكتائب المشتقة من البويضات كروموسوم Y. كان الفأر شبه المستنسخ طبيعيا بشكل علني وأنتج ذرية صحية عندما تزاوج مع ذكر ويبستر سويسري من النوع البري. وحتى الان ، ظل الفأر شبه المستنسخ حيا لفترة تزيد على 600 يوم دون اية مشكلات صحية واضحة .
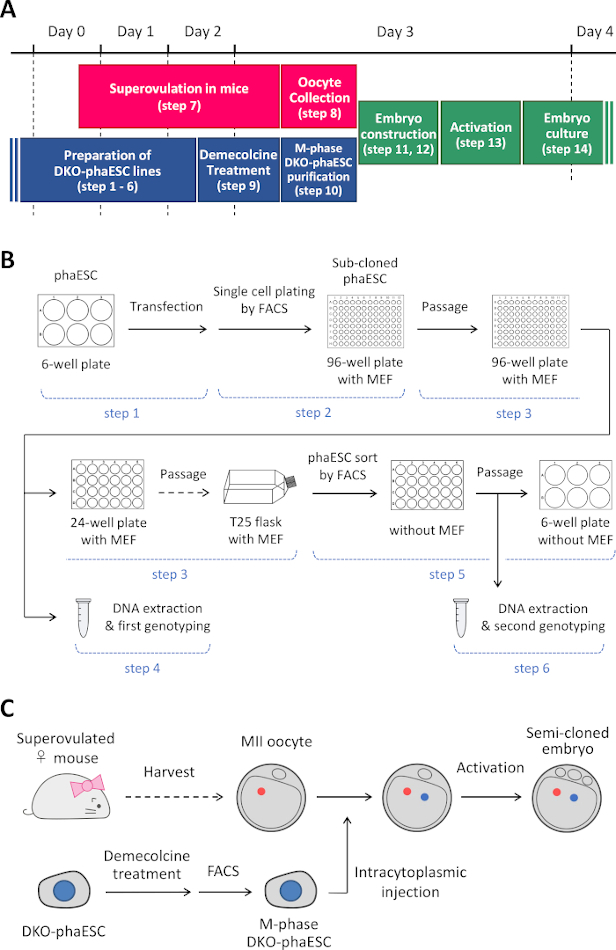
الشكل 1: نظرة عامة على تطبيق DKO-phaESCs كبديل للحيوانات المنوية. (أ)إطار زمني لإجراءات البروتوكول. (ب)يبين المخطط الخطوات اللازمة لإنشاء خطوط DKO-phaESC (الخطوات 1-6). (ج)يظهر المخطط خطوات بناء أجنة شبه مستنسخة عن طريق الحقن داخل السيتوبلازم من DKO-phaESC في البويضات MII (الخطوات 7-14). الاختصارات: DKO = الضربة القاضية المزدوجة؛ phaESC = الخلايا الجذعية الجنينية الهيملوجينية. FACS = فرز الخلايا المنشطة بالفلورسينس؛ MEF = الخلايا الليفية الجنينية الماوس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
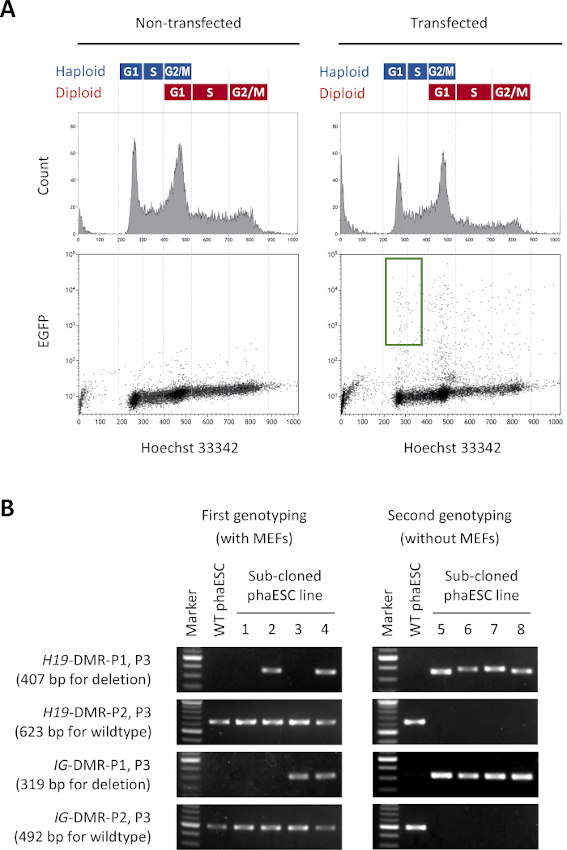
الشكل 2: إنشاء خطوط DKO-phaESC بواسطة عمليات حذف CRISPR/Cas9 بوساطة H19- و IG-DMRs. (أ)تحليل تدفق قياس الخلايا من phaESCs بعد transfection مع piggyBac plasmids للتعبير EGFP مستقرة ومع 4 كريسبر / Cas9 البلازميدات. تظهر الكتائب غير المصابة كعنصر تحكم. يظهر ملف الحمض النووي (أعلى) توزيع دورة الخلية للخلايا haploid وd diploid. يشار إلى الخلايا haploid G1/S-المرحلة التي تعبر عن EGFP من قبل البوابة الخضراء (أسفل، يمين). (ب)جينوتيبينج من النسخ الفرعية phaESC التي نمت على MEFs (أول genotyping) وبعد إزالة MEFs (genotyping الثانية). تمثل خطوط phaESC المستنسخة الفرعية 1 و 2 و 3 و 4 خلايا من النوع البري ، وخلايا مع حذف H19- DMR ، مع حذف IG- DMR ، ومع حذف H19- و IG-DMR ، على التوالي. تمتلك خطوط DKO-phaESC 5-8 حذف كل من H19-DMR و IG-DMR وهي خالية من أليلات النمط البري. الاختصارات: DKO = الضربة القاضية المزدوجة؛ phaESC = الخلايا الجذعية الجنينية الهيملوجينية. DMR = منطقة مثيلة بشكل تفاضلي؛ MEF = الماوس الجنينية الليفية; EGFP = البروتين الفلوري الأخضر المحسن. WT = النوع البري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
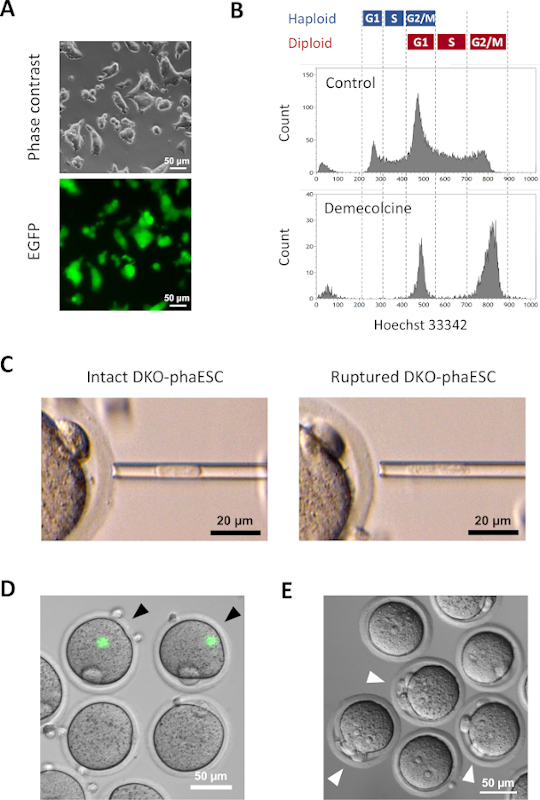
الشكل 3: حقن Mitotically اعتقل DKO-phaESCs في البويضات MII. (أ)مورفولوجيا ثقافة DKO-phaESC التي تحمل تحويل CAG-EGFP وحذف H19- و IG-DMRs؛ مقياس شريط = 50 ميكرومتر. (ب) ممثل تحليل التدفق الخلوي من DKO-phaESCs بعد الاعتقال مع demecolcine لمدة 8 ساعة DKO-phaESCs دون علاج demecolcine تظهر السيطرة. (ج)مورفولوجيا DKO-phaESCs في ماصة الأنابيب الدقيقة. ويظهر واحد سليمة DKO-phaESC قبل (يسار) وبعد (يمين) تمزق غشاء البلازما عن طريق الأنابيب; شريط المقياس = 20 ميكرومتر (D) الأجنة المشيدة في 1 ساعة بعد حقن DKO-phaESCs في البويضات MII. يتم عرض صورة مدمجة من مضان EGFP والمجال الساطع. رؤوس الأسهم السوداء تشير إلى بقع مستديرة من التعبير EGFP مكثفة بعد حقن سليمة DKO-phaESCs، والتي ينبغي تجنبها؛ مقياس شريط = 50 ميكرومتر. (ه) صورة التباين تداخل التفاضلية للأجنة شبه المستنسخة 6 ح بعد بدء التنشيط مع كلوريد السترونتيوم هو مبين. تشير رؤوس الأسهم البيضاء إلى أجنة ذات 3 أجسام قطبية بما في ذلك جسم قطبي زائف واحد من DKO-phaESC المحقون؛ شريط المقياس = 50 ميكرومتر. الاختصارات: DKO = الضربة القاضية المزدوجة؛ phaESC = الخلايا الجذعية الجنينية الهيملوجينية. EGFP = البروتين الفلوري الأخضر المحسن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
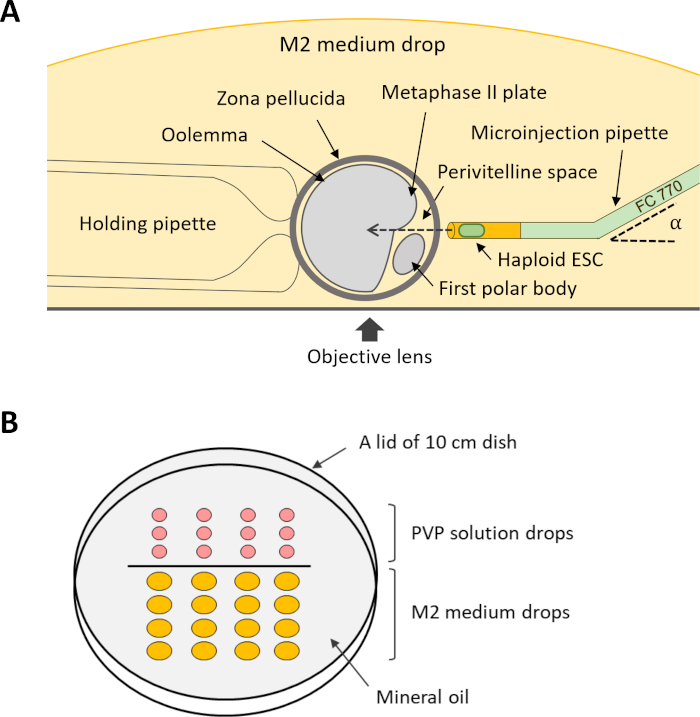
الشكل 4: مخطط الإعداد للحقن داخل السيتوبلازم من DKO-phaESCs في البويضات. (أ)يظهر ترتيب ماصة حقن، ماصة عقد، والبويضات في غرفة الحقن. α، زاوية الانحناء من ماصة microinjection. (ب) تخطيط قطرات في طبق الميكروبانيبيشن للحقن داخل السيتوبلازم. الاختصارات: DKO = الضربة القاضية المزدوجة؛ phaESC = الخلايا الجذعية الجنينية الهيموجينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
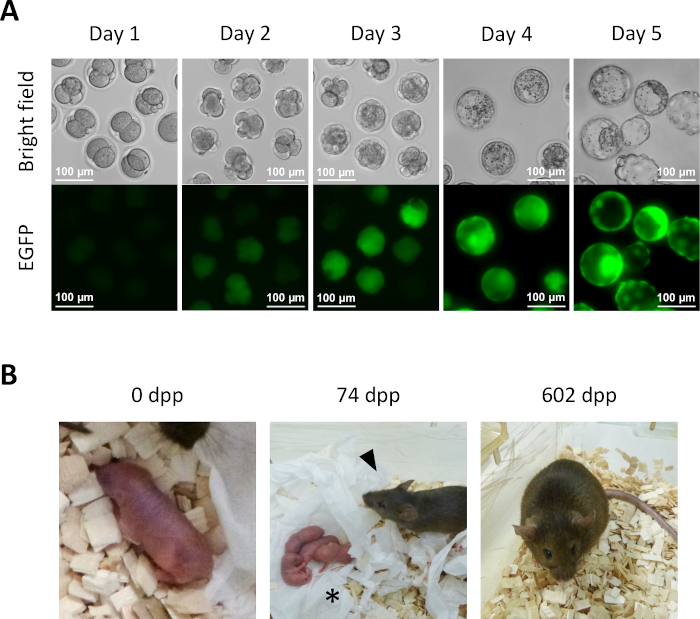
الشكل 5: تطوير الأجنة شبه المستنسخة. (أ)تطوير ما قبل الزرع للأجنة شبه المستنسخة في المختبر. لوحظ تعبير EGFP في البداية في الأجنة ذات الخلايا الأربع في اليوم الثاني بعد الحقن داخل السيتوبلازم. في اليوم 4 ، يمكن ملاحظة تعبير EGFP المكثف في الكيسات الأريمية ؛ شريط المقياس = 100 ميكرومتر (B) فأر شبه مستنسخ تم الحصول عليه بعد نقل جنين من خلية إلى أنثى متلقية. في 74 ديسيبل ، والفأر شبه المستنسخة (رأس السهم) ولدت الجراء الأولى لها (النجمة) عن طريق الولادة الطبيعية بعد التزاوج مع الذكور ويبستر السويسرية نوع البرية. والأجنة شبه المستنسخة والفأر شبه المستنسخ المبين في هذا الشكل متطابقانمع الأجنة المبلغ عنها في أيزاوا وآخرون. الاختصارات: EGFP = البروتين الفلوري الأخضر المحسن؛ .dpp، أيام ما بعد الولادة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| حل الجيلاتين | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| الماء | - | 500 مل | - |
| الجيلاتين | - | 1 غرام | 0.2% |
| هابلويد الخلايا الجذعية الجنينية (HaESC) المتوسطة | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| NDiff 227 | - | 10 مل | - |
| CHIR 99021 | 10 mM | 3 ميكرولتر | 3 ميكرومتر |
| PD 0325901 | 10 mM | 1 ميكرولتر | 1 ميكرومتر |
| ليف | 1 × 106 وحدة/ مل | 10 ميكرولتر | 1,000 وحدة/مل |
| البنسلين ستربتوميسين | 100x | 100 ميكرولتر | 1x |
| المخزن المؤقت للصيانة HaESC | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| متوسطة HaESC | - | 1 مل | - |
| حل HEPES | 1 م | 20 ميكرولتر | 20 مليون متر |
| المخزن المؤقت للغسيل | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| DMEM / F-12 | - | 100 مل | - |
| كسر BSA | 7.5% | 7.1 مل | 0.5% |
| المتوسطة MEF | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| DMEM | - | 500 مل | - |
| FBS | - | 56 مل | 10% |
| β ميركابتوثانول | 14.3 مول/لتر | 3.9 ميكرولتر | 100 ميكرومتر |
| البنسلين ستربتوميسين | 100x | 5.6 مل | 1x |
| مخزن Lysis المؤقت | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| الماء | - | 8.25 مل | - |
| تريس-HCl (pH 8.5) | 1 م | 1 مل | 100 مليون متر |
| EDTA | 0.5 متر | 100 ميكرولتر | 5 مليون متر |
| حل SDS | 10% | 200 ميكرولتر | 0.2% |
| ناكل | 5 م | 400 ميكرولتر | 200 مليون متر |
| بروتيناز K | 20 ملغم/مل | 50 ميكرولتر | 100 ميكروغرام/مل |
| وسيط التنشيط | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| KSOM | - | 1 مل | - |
| كلوريد السترونتيوم | 1 م | 5 ميكرولتر | 5 مليون متر |
| EGTA | 0.5 م، pH 8.0 | 4 ميكرولتر | 2 مليون متر |
| حل PVP | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| متوسط M2 | - | 5 مل | - |
| PVP | - | 0.6 غرام | 12% |
| حل PMSG | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| برنامج تلفزيوني | - | 450 ميكرولتر | - |
| PMSG | 500 وحدة/مل | 50 ميكرولتر | 50 وحدة/مل |
| حل hCG | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| برنامج تلفزيوني | - | 450 ميكرولتر | - |
| hCG | 500 وحدة/مل | 50 ميكرولتر | 50 وحدة/مل |
| وسيطة هيالورونيداز | |||
| مكون | تركيز المخزون | الحجم / الوزن | التركيز النهائي |
| متوسط M2 | - | 380 ميكرولتر | - |
| هيالورونيداز | 10 ملغم/مل | 20 ميكرولتر | 0.5 ملغم/مل |
| المختصرات: LIF = عامل مثبط لسرطان الدم؛ MEF = الماوس الجنينية الليفية; | |||
| FBS = مصل الأبقار الجنينية; DMEM = دولبيكو النسر المعدلة المتوسطة؛ BSA = ألبوم مصل البقر; | |||
| EDTA = حمض الإيثيلينديامينتتراستيك. SDS = دودسيلسلفات الصوديوم; EGTA = الإيثيلين بيس (أوكسيثيلين نيتريلو)حمض التتراستاستيك; | |||
| PBS = المالحة العازلة بالفوسفات؛ PVP = بوليفينيلبيروليدون; hCG = gonadotropin المشيمي البشري; | |||
| PMSG = مصل فرس الحوامل gonadotropin. | |||
الجدول 1: وصفة متوسطة، عازلة، والحل.
| اسم | تسلسل (5' إلى 3 ') | تطبيق | |
| H19-DMR-P1 | GTG GTT AGT TCT ATA TGG GG | جينوتيبينج | |
| H19-DMR-P2 | AGA TGG GGT القط TCT TTT CC | جينوتيبينج | |
| H19-DMR-P3 | TCT تاك AGT CTG GTC TTG GT | جينوتيبينج | |
| IG-DMR-P1 | TGT GCA GCA GCA AAG CTA AG | جينوتيبينج | |
| IG-DMR-P2 | CCA CAA AAA CCT CCC TTT CA | جينوتيبينج | |
| IG-DMR-P3 | ATA CGA TAC GGC AAC CAA CG | جينوتيبينج | |
| H19-DMR-gRNA1-F | كاك CCA TGA ACT CAG AAG AGA CTG | gRNA | |
| H19-DMR-gRNA1-R | AAA CCA GTC TCT TCT GAG TTC ATG | gRNA | |
| H19-DMR-gRNA2-F | CAC CAG GTG AGA ACC ACT GCT GAG | gRNA | |
| H19-DMR-gRNA2-R | AAA CCT CAG CAG TGG TTC TCA CCT | gRNA | |
| IG-DMR-gRNA1-F | كاك CCG تاك AGA GCT CCA TGG CAC | gRNA | |
| IG-DMR-gRNA1-R | AAA CGT مجلس التعاون الخليجي ATG GAG CTC TGT ACG | gRNA | |
| IG-DMR-gRNA2-F | CAC CCT GCT العلامة AGG تاك تاك GCT | gRNA | |
| IG-DMR-gRNA2-R | AAA CAG CGT AGT لجنة التنسيق الإدارية TCT AAG CAG | gRNA | |
الجدول 2: قائمة أوليغونوكليوتيدات.
Discussion
استنساخ الثدييات عن طريق نقل الخلايا الجسدية النووية (SCNT) كانت رائدة في 1990s19،20،21. وجاءت هذه التطورات في أعقاب دراسات الاستنساخ التي أجريت قبل 30 عاما فيالبرمائيات 22. ويعكس التأخير الكبير صعوبة علم الأجنة وبصمات الجينوم في الثدييات. تطوير الثدييات SCNT هو الأساس لتطبيق haESC لاستبدال الحيوانات المنوية ، وهو مفصل في هذا البروتوكول.
مزامنة دورة الخلية هو عامل مهم لنجاح SCNT23. وهذا هو الحال أيضا لحقن haESC في هذا البروتوكول. يتطلب إدخال جينوم المتبرع إلى المتلقي مطابقة مراحل دورة الخلية لتجنب الكسر الكروموسومي أو الأنوبلويدات التي من شأنها إلغاء نمو الجنين. شبه الاستنساخ لديه تعقيد إضافي أن اثنين من الجينوم وstoplast تحتاج إلى أن تكون متوافقة. وقد أثبت تقرير سابق أن حقن ال haESCs الاندروجينية المعتقلين في مرحلة M أسفر عن معدلات نمو أفضل للأجنة شبه المستنسخة من حقن haESCs من مرحلة G1 في البويضات7. ويقترح هذا التقرير المرحلة M كنقطة تزامن مناسبة للاستنساخ شبه. وبناء على ذلك، ألقي القبض على الكتائب ميتوتيتشيلي في مرحلة ميتافيزي مع demecolcine وحقنها في ooplasm من البويضات MII، والتي تم القبض عليها بشكل طبيعي في ميتافاز الثاني من الميوسيس. والأهم من ذلك، يمكن تحقيق الاعتقال في المرحلة M في ESCs الماوس بكفاءة عالية، وتوفير تزامن ممتاز بين دورات الخلية المانحة والمتلقية.
أثناء الانقسام ، ينهار الغشاء النووي وأشكال المغزل التي ترتبط بها الكروموسومات المكررة. بعد حقن M-المرحلة DKO-phaESCs، يتم فصل الكروماتيدات الشقيقة إلى جسم قطبي زائف وzygote7 (الشكل 3E). وبالتالي، تساهم مجموعة واحدة من الكروموسومات من DKO-phaESC في الجنين شبه المستنسخ. ومن الأهمية بمكان أن الكروماتيدات الشقيقة للكروموسومات DKO-phaESC يمكن فصلها بشكل صحيح بعد الحقن. غشاء البلازما من DKO-phaESC سليمة يمنع الفصل في الجسم القطبي الزائف. لقد لاحظنا بالفعل حالات نادرة لم يتم فيها تمزق غشاء البلازما في DKO-phaESCs ، وأظهرت الأجنة DKO-phaESCs سليمة في ooplasm بعد الحقن(الشكل 3D). لذلك ، يجب توخي الحذر لإزالة غشاء البلازما من DKO-phaESCs عن طريق الأنابيب. أثناء الحقن ، من المهم بنفس القدر تجنب تعطيل المغزل الميوتيكي للبويضة ، مما قد يؤدي إلى عيوب فصل الكروموسومات والحث على الانسداد أيضا.
في الثدييات ، يحد البصمة الجينومية من تطبيق الكتائب كبديل للحيوانات المنوية. تمتلك haESCs البارثينوجينية تكوينا أموميا من البصمات الجينومية ، في حين تمتلك الحيوانات المنوية تكوينا أبويا. لذلك ، لم يحدث جيل من الجراء على المدى الكامل بعد حقن الكتائب البرية كبديل للحيوانات المنوية. للتغلب على هذا القيد، يتم تصميم عمليات حذف IG- و H19-DMRs في phaESCs. تعديل التعبير المطبوع في Igf2-H19 الأم وGl2-Dlk1 loci كافية لتغيير تكوين بصمات الجينوم للسماح لتوليد الفئران شبه المستنسخة مع وتيرة أكثر من 5.1٪، على أساس الأجنة المنقولة 2 خلية. تشير هذه الملاحظات إلى أن استهداف جينين مطبوعين يحول جينوم الكتائب إلى تكوين أبوي وظيفي يمكن أن يحل محل الحيوانات المنوية في الفئران. ومع ذلك، يلزم إدخال تعديل وراثي دائم على الكتائب من أجل هذه الاستراتيجية. كاستراتيجية بديلة، يمكن النظر في haESC الاندروجينية. وتستمد haESCs الاندروجينية من جينوم الحيوانات المنوية وتمتلك بصمات الأب. كانت هناك تقارير تفيد بأن haESCs الذكورية البرية ساهمت كبديل للحيوانات المنوية لتوليد الجراء على المدى الكامل على تردد يتراوح بين 1.3٪ و 1.9٪ من الأجنة المنقولة4و7و24. كما تم الحصول على الجراء كاملة المدة عن طريق حقن haESCs الاندروجينية مع حذف IG- وH19-DMRs على تردد 20.2٪ من الأجنة المنقولة من 2 خلايا24. ومن المرجح أن تكون زيادة كفاءة شبه الاستنساخ باستخدام مركبات هايسك الاندروجينية المعدلة بسبب عدم استقرار البصمات في الثقافة. يتم تصحيح عيوب الطباعة عن طريق الحذف الوراثي ل DMRs الحرجة.
وبالنظر إلى صعوبة إدخال تعديلات جينية مباشرة على جينوم البويضات أو الحيوانات المنوية، فإن ال haESCs هي أداة قيمة للتلاعب بالجينوم الأبوي بشكل منفصل. استخدام haESCs كبديل للحيوانات المنوية يوفر ميزة ملحوظة لتحرير الجينوم في الجرثومة الماوس. وقد جمعت دراسة حديثة بين تحرير الجينوم القائم على CRISPR/Cas9 وتطبيق haESCs لتوصيف المناطق المطبوعة التي تعتبر حاسمة للتنمية الجنينية12. حللت هذه الدراسة دور Rasgrf1- DMR بالاشتراك مع H19- و IG- DMRs في تطوير الفئران ثنائية اللون ، ووظيفة 7 DMRs مختلفة في تطوير الفئران ثنائية الترنيخ. شكلت طريقة استبدال haESCs للحيوانات المنوية الأساس لنهج الفحص الجيني لتحديد الأحماض الأمينية الرئيسية داخل بروتين DND1 في تطوير الخلايا الجرثومية البدائية وتحديد الجينات في نمو العظام24و25و26. الدراسات على البصمة الجينومية والفحص الجيني لتحديد العوامل الرئيسية في النمو الجنيني هي نهج كبيرة لتطبيق haESCs كجينوم لعبة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر الدكتور جوليو دي مينين على اشتقاق خطوط الكتائب والدكتور ريمو فريمان على عملية قياس التدفق الخلوي. ونعترف أيضا بالسيدة ميشيل شافنر والسيد توماس م. هينيك للدعم التقني في نقل الأجنة. ودعمت هذا العمل المؤسسة الوطنية السويسرية للعلوم (المنحة 31003A_152814/1).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mLTube | Eppendorf | 0030 125.150 | haESC culture |
| 15 ml Tube | Greiner Bio-One | 188271 | haESC culture |
| 12-well plate | Thermo Scientific | 150628 | haESC culture |
| 24-well plate | Thermo Scientific | 142475 | haESC culture |
| 6-well plate | Thermo Scientific | 140675 | haESC culture |
| 96-well plate | Thermo Scientific | 167008 | haESC culture |
| β-Mercaptoethanol | Merck | M6250 | haESC culture |
| BSA fraction | Gibco | 15260-037 | haESC culture |
| CHIR 99021 | Axon | 1386 | haESC culture |
| Demecolcine solution | Merck | D1925 | haESC culture |
| DMEM | Gibco | 41965-039 | haESC culture |
| DMEM / F-12 | Gibco | 11320-033 | haESC culture |
| DR4 mouse | The Jackson Laboratory | 3208 | haESC culture |
| EDTA | Merck | E5134 | haESC culture |
| FBS | biowest | S1810-500 | haESC culture |
| Freezing medium | amsbio | 11897 | haESC culture |
| Gelatin | Merck | G1890 | haESC culture |
| Hepes solution | Gibco | 15630-056 | haESC culture |
| Irradiated MEF | Gibco | A34966 | haESC culture |
| LIF (Leukemia inhibitory factor) | (Homemade) | - | haESC culture |
| Lipofection reagent | Invitrogen | 11668019 | haESC culture |
| NDiff 227 | Takara | Y40002 | haESC culture |
| PD 0325901 | Axon | 1408 | haESC culture |
| Pen Strep | Gibco | 15140-122 | haESC culture |
| piggyBac plasmid carrying a CAG-EGFP transgene | Addgene | #40973 | haESC culture |
| piggyBac transposase plasmid | System Biosciences | PB210PA-1 | haESC culture |
| pX330 plasmid | Addgene | #42230 | haESC culture |
| pX458 plasmid | Addgene | #48138 | haESC culture |
| Trypsin | Gibco | 15090-046 | haESC culture |
| DNA polymerase | Thermo Scientific | F549S | Genotyping |
| dNTP Mix | Thermo Scientific | R0192 | Genotyping |
| Ethanol | Merck | 100983 | Genotyping |
| Hydrochloric acid | Merck | 100317 | Genotyping |
| Isopropanol | Merck | 109634 | Genotyping |
| Proteinase K | Axon | A3830 | Genotyping |
| SDS | Merck | 71729 | Genotyping |
| Sodium chloride | Merck | 106404 | Genotyping |
| ThermoMixer | Epeendorf | 5384000012 | Genotyping |
| Tris | Merck | T1503 | Genotyping |
| 5 mL Tube | Falcon | 352063 | Flow cytometry |
| 5 mL Tube with cell strainer cap | Falcon | 352235 | Flow cytometry |
| Hoechst 33342 | Invitrogen | H3570 | Flow cytometry |
| MoFlo Astrios EQ | Beckman Coulter | B25982 | Flow cytometry |
| 1 mL syringe | Codan | 62.1640 | Superovulation |
| 30-gauge 1/2 inch needle | Merck | Z192362-100EA | Superovulation |
| B6D2F1 mouse | The Jackson Laboratory | 100006 | Superovulation |
| hCG | MSD animal health | 49451 | Superovulation |
| PBS | Gibco | 10010015 | Superovulation |
| PMSG | Avivasysbio | OPPA1037 5000 IU | Superovulation |
| 10-cm dish | Thermo Scientific | 150350 | Embryo manipulation |
| 4-well plate | Thermo Scientific | 179830 | Embryo manipulation |
| 50 mL tube | Greiner Bio-One | 227261 | Embryo manipulation |
| 6 cm dish | Thermo Scientific | 150288 | Embryo manipulation |
| Center-well dish | Corning | 3260 | Embryo manipulation |
| Digital rocker | Thermo Scientific | 88880020 | Embryo manipulation |
| EGTA | AppliChem | A0878 | Embryo manipulation |
| Hyaluronidase | Merck | H4272 | Embryo manipulation |
| KSOM | Merck | MR-020P-5F | Embryo manipulation |
| M16 medium | Merck | M7292 | Embryo manipulation |
| M2 medium | Merck | M7167 | Embryo manipulation |
| Mineral oil | Merck | M8410 | Embryo manipulation |
| Glass capillary | Merck | P1049-1PAK | Embryo manipulation |
| Stereomicroscope | Nikon | SMZ745 | Embryo manipulation |
| Strontium chloride | Merck | 13909 | Embryo manipulation |
| 5ml syringe | Codan | 62.5607 | Microinjection |
| Borosilicate glass cappilary | Science product | GB100T-8P | Microinjection |
| CellTram 4r Oil | Eppendorf | 5196000030 | Microinjection |
| Fluorinert FC-770 | Merck | F3556 | Microinjection |
| Holding pipette | BioMedical Instruments | - | Microinjection |
| Inverted microscope | Nikon | Eclipse Ti-U | Microinjection |
| Microforge | Narishige | MF-900 | Microinjection |
| Microinjection pipette | BioMedical Instruments | - | Microinjection |
| Microlaoder tips | Eppendorf | 5252 956.003 | Microinjection |
| Micromanipulaor arms | Narishige | NT-88-V3 | Microinjection |
| Micropipette puller | Sutter Instrument | P-1000 | Microinjection |
| PiezoXpert | Eppendorf | 5194000016 | Microinjection |
| PVP (Polyvinylpyrrolidine) | Merck | PVP360 | Microinjection |
| Syringe filter | SARSTEDT | 83.1826.001 | Microinjection |
References
- Ellegren, H., Galtier, N. Determinants of genetic diversity. Nature Reviews: Genetics. 17 (7), 422-433 (2016).
- Huijbers, I. J. Generating genetically modified mice: A decision guide. Methods in Molecular Biology. 1642, 1-19 (2017).
- Aizawa, E., Dumeau, C. E., Freimann, R., Di Minin, G., Wutz, A. Polyploidy of semi-cloned embryos generated from parthenogenetic haploid embryonic stem cells. PloS One. 15 (9), 0233072(2020).
- Li, W., et al. Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature. 490 (7420), 407-411 (2012).
- Li, Z., et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells. Cell Research. 26 (1), 135-138 (2016).
- Wan, H., et al. Parthenogenetic haploid embryonic stem cells produce fertile mice. Cell Research. 23 (11), 1330-1333 (2013).
- Yang, H., et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 149 (3), 605-617 (2012).
- Zhong, C., et al. Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell Research. 26 (1), 131-134 (2016).
- Elling, U., et al. Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell Stem Cell. 9 (6), 563-574 (2011).
- Leeb, M., Wutz, A. Derivation of haploid embryonic stem cells from mouse embryos. Nature. 479 (7371), 131-134 (2011).
- Surani, M. A., Barton, S. C., Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308 (5959), 548-550 (1984).
- Li, Z. K., et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell. 23 (5), 665-676 (2018).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shuai, L., et al. Generation of mammalian offspring by haploid embryonic stem cells microinjection. Current Protocols in Stem Cell Biology. 31, 1-15 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2014).
- O'Neill, G. T., Rolfe, L. R., Kaufman, M. H. Developmental potential and chromosome constitution of strontium-induced mouse parthenogenones. Molecular Reproduction and Development. 30 (3), 214-219 (1991).
- Campbell, K. H., McWhir, J., Ritchie, W. A., Wilmut, I. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569), 64-66 (1996).
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., Campbell, K. H. Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619), 810-813 (1997).
- Gurdon, J. B. Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273 (1962).
- Campbell, K. H., Alberio, R. Reprogramming the genome: role of the cell cycle. Reproduction Supplement. 61, 477-494 (2003).
- Zhong, C., et al. CRISPR-Cas9-mediated genetic screening in mice with haploid embryonic stem cells carrying a guide RNA library. Cell Stem Cell. 17 (2), 221-232 (2015).
- Bai, M., et al. Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development. PLoS Biology. 17 (7), 3000350(2019).
- Li, Q., et al. CRISPR-Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development. Nature Cell Biology. 20 (11), 1315-1325 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved