Method Article
应用小鼠部分遗传类胚胎干细胞作为精子的替代品
摘要
本文旨在证明使用部分遗传性单体胚胎干细胞作为精子的替代品,用于构建半克隆胚胎。
摘要
在具有性繁殖的生物体中,生殖细胞是发育成新个体的托蒂能细胞的来源。在小鼠中,由精子卵母细胞受精会产生一种托蒂波特酶。最近,一些出版物报道说,单体胚胎干细胞(haESCs)可以替代游戏基因组,并有助于胚胎,发展成小鼠。在这里,我们提出了一个协议,应用部分遗传性haESCs作为精子的替代品,通过细胞内注入卵母细胞来构建胚胎。该协议包括准备作为精子替代的haESC,将海斯C染色体注射到卵母细胞中,以及培养半克隆胚胎的步骤。胚胎在胚胎移植后可以产生肥沃的半克隆小鼠。使用haESC作为精子的替代物,有助于基因组编辑的生殖系,胚胎发育的研究,基因组印记的研究。
引言
在哺乳动物中,游戏是唯一向下一代传递遗传信息的细胞。卵母细胞和精子的融合形成了一种双体卵母细胞,发育成成年动物。因此,游戏基因组的突变是由后代遗传的,并推动物种1的基因变异。引入生殖系突变已应用于生产转基因动物的多样化生物学研究,包括基因功能特征和疾病建模。卵母细胞和精子细胞都是绝分和高度专业化的细胞,已经停止增殖。因此,游戏玩家的直接修改在技术上是困难的,并且已经开发出专门的方法。基因改造可以通过将转基因ESC注射到胚波细胞中引入小鼠生殖系,在那里它们融入发育中的胚胎并殖民生殖系。此外,使用基因组编辑方法(包括CRISPR/Cas9系统)对受精卵进行基因改造已被广泛采用。
最近,有报道说,一个杰出的方法,它应用haESC作为游戏基因组3,4,5,6,7,8的替代品。HaESC是干细胞系,源自部分遗传学或雄激素单体胚波细胞的内细胞质量,拥有一组4、7、9、10染色体。已经证明,在细胞内质注射后,部分遗传学和雄激素haESC都可以促进半克隆小鼠的基因组。与其他方法不同,由于自身更新能力,HAESC的基因组可以在培养中直接改变。通过用haESC代替精子,将基因改造引入生殖系,是生物研究的重要方法。它规定了分别培养和操纵产妇或父系基因组的可能性,这些基因组分别来自部分遗传学或雄激素haESC。然后,HaESC 可以用作游戏基因组替代,这尤其有利于基因组印记、等位基因特异性表达和父母特定过程的研究。
在小鼠中,正常胚胎发育需要母体和母体基因组信息。因此,当注射野生型部分遗传体(phaESCs)以取代精子基因组5,8时,无法获得全期幼崽。为了克服发育障碍,需要将部分遗传性 HAESC 母体基因组的基因组印记更正为父系结构。这可以通过操纵不同甲基化区域 (DMR) 来实现。迄今为止,已研究有针对性地删除H19-DMR、Gtl2-Dlk1 IG-DMR和拉斯格夫1-DMR,以抑制第3、5、8、12期的母体表达基因。这些研究表明,删除H19-DMR和IG-DMR都足以将母体转换为可以替代精子染色体的母体印印结构。将两个DMR缺失物移植到卵母细胞中的噬细胞内质注射产生半克隆幼崽,其频率在5.1%至15.5%之间。
本议定书基于删除 H19-DMR 和 IG-DMR的 phaESC 的应用,我们称之为双敲除式噬菌体 (DKO-PHAESCs)。我们为改变噬菌体中的基因组印记以建立DKO-phaESC线、将DKO-phaESC注入卵母细胞以取代精子基因组、将半克隆胚胎培养成胚胎和获得半克隆小鼠提供详细说明。该协议是研究人员的参考,他们需要精确和直接地操纵父系基因组和半克隆胚胎和小鼠的生成。
研究方案
所有动物实验均按照苏黎世州伦理委员会和苏黎世ETH分子健康科学研究所的EPIC动物设施的标准和规定,在ZH152/17许可证下进行。
注:此协议从删除H19和IG- DMR 开始。有关如何建立phaESC行的详细信息,请参阅已发表的报告10、13。本协议的概述和时间框架(第 14 步)在图 1A中提供:媒体、解决方案和缓冲区列在表1 中。建立DKO-phaESC线的程序(步骤1–6)显示在图1B中,构建半克隆胚胎的策略(步骤7–14)在图1C中描述。
1. 在噬菌体中删除 H19 -Dmr 和 Ig -dmr 的质粒的传输
- 准备CRISPR/Cas9质粒,以便共同表达Cas9核糖核酸,并引导RNA针对 H19-DMR和 IG-DMR的删除。利盖特四对指南RNA寡头(H19-DMR-gRNA1-F,R:H19-DMR-gRNA2-F,R:IG-DMR-格纳1-F,R:IG-DMR-gRNA2-F,R列在 表2)到pX330质粒。
注:参照已公布的议定书,详细程序准备这4个CRISPR/Cas9质粒14。或者,一般小鼠菌株的质粒也可以通过存储库(材料表)访问。 - 在 37 °C 的孵育下 10 分钟,用 1 mL 的 0.2% 明胶溶液涂抹 6 井板的一口井的表面。
- 板 2 × 105 野生型噬菌体在明胶涂层井在 HAESC 介质没有抗生素, 并在 37 °C 在 5% CO2 大气中孵育板 1 天.
注意:从介质中省略抗生素,以提高后续唇切除术的效率。我们在第10段使用了野生型的噬菌体。我们建议使用早期通道,但各种通道编号已成功使用8个。通道数与获得半克隆胚胎和小鼠的效率之间的相关性目前尚不清楚。 - 在 6 井板的井中 (从步骤 1.3) 与 6 个质粒同时使用唇切除试剂: 50 ng 小猪巴克 质粒携带 CAG-EGFP 转基因, 50 ng 猪巴克 转置酶质粒, 和 600 ng 的 4 CRISPR/Cas9 质粒 (从步骤 1.1) 。参照制造商关于转染详细程序的协议。
注:两 个猪巴斑 块用于将增强型绿色荧光蛋白(EGFP)无处不在的转子整合到噬菌体的基因组中。如果不需要对细胞进行 GFP 标记,则这两个质粒可以由 CRISPR/Cas9 质粒代替荧光蛋白的瞬时表达(例如 pX458 质粒),而不是 pX330 质粒之一。然后,瞬态 EGFP 表达可用于对瞬变的细胞进行排序。 - 输血两天后,吸气介质,并添加 800 μL 的三氯辛。
- 在 5% CO 2 大气中以 37 °C 孵化板5 分钟。然后,加入 2 mL 的洗涤缓冲器以淬灭 trypsin,并多次使用移液器以获得单个细胞悬架。
- 将细胞悬架转移到 15 mL 管中。
- 在 160 x g 下将管子离心 5 分钟,并去除超自然。
- 将细胞颗粒重新插入 400 μL 的 HAESC 维护缓冲区,并辅以 15 微克/mL 霍奇斯特 33342。
注:为了减少霍奇斯特33342的潜在毒性,使用了1μg/mL霍奇斯特33342和50微米维拉帕米尔,而不是15微克/mL霍奇斯特3334215。 - 在 5% CO2 大气中在 37 °C 孵化细胞悬架 15 分钟。孵化后,通过细胞过滤器盖将细胞悬架转移到 5 mL 管中,并将管保持在 4 °C,直到准备在下一步(第 2 节)中使用。
2. 使用流动细胞仪对转染的噬细胞进行单细胞电镀
- 在分拣已转化的噬菌体的前一天,在明胶涂层的96井板上,板辐照小鼠胚胎成纤维细胞(MEF),密度为4×MEF介质中的104个细胞/厘米2。通常,6 个板准备建立一个有针对性的删除的 phaESC 线。在 5% 的 CO2大气中以 37 °C 孵化板。
注:辐照的 MEF 可在商业上获得。我们使用来自DRS4小鼠E12.5胚胎的MEF。虽然没有 MEF,HAESC 可以在明胶涂层板上生长,但我们建议 MEF 提高分拣单 HAESC 的可行性。 - 在分拣当天,从 96 井板中吸气 MEF 介质,每井添加 120 μL 的新鲜 HAESC 介质。将板保持在 37 °C 的 5% CO2 大气中。
- 根据制造商的说明,使用 100μm 喷嘴设置细胞分拣机。355 nm 紫外线激光器和 488 nm 蓝色激光分别用于激发霍奇斯特 33342 和 EGFP 荧光。
注:或者,通过 405 nm 的激发可以检测到霍赫斯特 33342。 - 使用门对 5 mL 管中的转染性噬细胞进行排序(从步骤 1.10 开始),用于收集 G1/S 阶段显示 EGFP 表达的杂质细胞。从步骤 2.2 将一个单元格沉积到 96 井板的每口井中。
注:对Harchst 33342染色物的检测通常区分3个1n、2n和4nDNA含量的细胞峰值,分别对应于G1阶段的单体细胞、G2/M相中的单体细胞和G1相中的双倍体细胞的混合物,以及G2/M相中的双倍体细胞。G1/S 阶段的类固醇细胞被确定为强度较低的霍奇斯特 33342 荧光的峰值。图 2A中显示了一个具有代表性的结果和一个分拣门。 - 电镀后,在 5% CO2 大气中以 37 °C 的 96 井板孵育。
3. 转染性噬菌体的亚克隆
- 单细胞电镀三天后,可以在显微镜下观察到96井板的几口井。标记只有单个菌落生长的井。
注:根据我们的经验,在96口井板的20%-40%的井中观察到单个菌落。 - 在单细胞电镀后的第 4 天,用单个菌落在井中用新的 HAESC 介质替换一半的介质。
- 传递前一天(单细胞电镀后的第 4 天或第 5 天),板在明胶涂层的 96 井板上辐照 MEF,密度为 4 × 104 细胞/cm2 在 MEF 介质中。将板保持在 37 °C 的 5% CO2 大气中。
- 经过 5 或 6 天的单细胞电镀,选择直径大于 150μm 的 96 井板中的单个菌落的井。
注:最好选择大约 100 口油井,以建立一条带有目标 DMR 删除的 phaESC 生产线。 - 在选定的油井中吸气介质,并添加 30 μL 的三氯辛。在 5% 的 CO2 大气中以 37 °C 的 96 井板孵育 5 分钟。然后,在每口井中加入 30 μL 的洗涤缓冲液,以淬灭试穿素。
- 在每个井中加入 140 μL 的 HAESC 介质,并多次使用移液器以获得单个细胞。
- 从步骤 3.3 准备的 96 井板的井中吸气 MEF 介质。
- 将每口油井的噬菌体从步骤 3.6 转移到新 96 井板的新井中,从步骤 3.7 转移到新井板。
- 在 5% 的 CO2 大气中,在 37 °C 处孵化含有 phaESC 亚clone 的 96 井板。
- 第二天,从每口井中吸气所有介质,并添加 120 μL 的新 haESC 介质。在 5% 的 CO2 大气中以 37 °C 孵化板。
- 在细胞成为通路的汇流器的前一天,在明胶涂层的24井板上将辐照的MEF放在密度为4×104 个细胞/厘米2 的MEF介质上。将板保持在 37 °C 的 5% CO2 大气中。
- 当噬菌体成为通路的汇流物时,吸气介质并添加 30 μL 的 trypsin。在 37 °C 下孵化 96 井板 5 分钟。
- 将 90 μL 的洗涤缓冲器添加到每口井中,以淬灭试穿素。多次派珀特获得单细胞。
- 从步骤 3.11 开始,从 24 井板的井中吸气 MEF 介质,并添加 600 μL 的新鲜 HAESC 介质。
- 将第 3.13 步中每口井中悬浮的 phaESC 子片的 60μL 从步骤 3.14 转移到 24 井板的新井中。在第 4 步中保留每个 phaESC 子片段的剩余悬浮,用于 DNA 提取和基因交配。
- 在 5% 的 CO2 大气中,将 24 井板与 phaESC 子片在 37 °C 中孵化。
- 在细胞培养物达到通过密度的前一天,在明胶涂层的 6 井板上将辐照的 MEF 板放在密度为 4 × 104 细胞/cm2 的 MEF 介质上。将板保持在 37 °C 的 5% CO2 大气中。
- 当噬菌体变得足够汇流通过,吸气介质,并添加250μL的三氯苯二甲酸酯。在 37 °C 下孵化 24 井板 5 分钟。
注意:在第 4.9 步进行基因化后,只需通过删除 H19-DMR 和 IG-DMR的 phaESC 线。 - 将 750 μL 的洗涤缓冲器添加到每口井中,以淬灭试穿素。多次获得单细胞悬架。将细胞悬架转移到 15 mL 管中。
- 以 160 x g 的速度将管子离心 5 分钟,取出超母体,并在 2 mL 的 HAESC 介质中重新注入细胞颗粒。
- 从步骤 3.17 开始,从 6 井板的井中吸气 MEF 介质。将每根管子的phaESC悬架从步骤3.20转移到一口新井中。将板保持在 37 °C 的 5% CO2 大气中。
- 通过重复步骤 3.17 到 3.21 来扩展细胞克隆,并增加板大小和 trypsin、洗涤缓冲器和 haESC 介质的体积。为每个子克隆的 phaESC 系列 MEF 准备一个 T25 烧瓶,用于第 5 步。
注:我们建议在进入第 5 步之前,将每个亚克隆 phaESC 线的注释冻结在 300 μL 的冷冻介质中,并在液氮储存中保留低温素。
4. 与 MEF 的亚克隆噬菌体线的第一次基因对比
- 要从步骤 3.15 的剩余细胞悬架中提取基因组 DNA,在 96 井板的每口井中加入 200 μL 的裂解缓冲器。将细胞悬架转移到 1.5 mL 管中。用额外的 200μL 裂解缓冲器冲洗每口井,以恢复所有剩余的细胞,并收集在同一个 1.5 mL 管中。
- 在 55 °C 的 55 °C 下孵育 1.5 mL 管,混合 3 小时。
- 孵化后,在每根1.5mL管中加入460μL的异丙酚,轻轻混合,直到DNA沉淀物可见。
- 以 10,000 x g ≥ 5 分钟的速度将管子离心,并去除超大物。用 200μL 的 70% 乙醇清洗 DNA 颗粒。
- 以 10,000 x g ≥ 5 分钟的速度将管子离心,并去除超大物。
- 将管子在空气中干燥10分钟,然后用20μL的水补充DNA。
- 按照制造商的协议,使用可热DNA聚合酶执行聚合酶链反应 (PCR)。
注:PCR 的引言对列在表 2中,使用如下:H19-DMR-P1 和 P3(已删除的H19-DMR 为 407 bp);H19-DMR-P2 和 P3(野生型H19-DMR 为 623 bp);IG-DMR-P1和P3(删除IG-DMR的319个基点);IG-DMR-P2和P3(野生类型IG-DMR的492 bp)。所有引言对的 PCR 温度配置文件如下: 30s 98 °C, 35 x (10 s 98 °C, 20s 56 °C, 30 s 72 °C), 5 分钟 72 °C. H19-DMR和IG-DMR删除的放大脱氧核糖核酸片段的长度显示了一些变化,因为与 CRISPR/Cas9 介解编辑相关的非同源端连接。噬菌体是用MEF培养的,其中含有野生型H19-DMR和IG-DMRDNA。 因此,放大野生型DNA片段的H19-DMR-P2/P3和IG-DMR-P2/P3的引物对信息不丰富。 但是,这些引座对包含为控件,并且应在所有反应中给出一个波段。 - 通过糖凝胶电泳分析PCR片段。参照已公布的关于电泳16详细程序的协议。
- 通过删除 H19-DMR和 IG-DMR来识别细胞线。电泳的代表性图像显示在 图2B中。
注:在我们的例子中,在135个亚克隆的phaESC线中发现了8个删除 H19-DMR和 IG-DMR的细胞系。
5. 亚克隆phaESC线的单体细胞净化
- 当步骤 3.22 的 T25 烧瓶中的亚克隆 phaESC 培养物变得足够密集,用于传递时,吸气介质并添加 1.5 mL 的 trypsin。在 37 °C 下孵化烧瓶 5 分钟。然后,添加 4.5 mL 的洗涤缓冲器和移液器几次,以获得单细胞悬架。
- 将每个单元格悬架传输到 15 mL 管中,并在 160 x g 下离心管 5 分钟。去除超自然物,在 400 μL 的 HAESC 维护缓冲区中重新插入细胞颗粒,并辅以 15 μg/mL 霍奇斯特 33342。
- 在 37 °C 下孵化细胞悬架 15 分钟。孵化后,通过细胞过滤器盖将细胞悬架转移到5mL管中。用额外的 400 μL 的 HAESC 维护缓冲器冲洗细胞过滤器盖,并在同一 5 mL 管中收集剩余的细胞。将管子保持在4°C,直到准备排序。
- 根据制造商的说明设置带 100μm 喷嘴的流量细胞计。
注:霍赫斯特33342可在405纳米时通过激发检测到。在这里,355 nm 紫外线激光器用于检测霍赫斯特 33342。 - 设置细胞悬架(从步骤 5.3 开始)和包含 2 mL 的 HAESC 维护缓冲器的新的 15 mL 管,以收集流动细胞计的分拣细胞。
- 开始分析,并设置分拣门,以收集G1/S阶段的类胡萝卜素细胞。请参阅 图 2A 中的直方图,以识别 G1/S 阶段的噬菌体人口。
注:由于第 2 步中双倍体细胞的完全二倍体化或错误电镀,某些亚克隆的噬菌体线可能不包含任何单体细胞。如果在 G1/S 阶段未观察到类固醇细胞,则无需排序即可进入另一个样本。在我们的例子中,5个细胞系包含单体细胞,3个细胞系只包含8个亚克隆phaESC线中的双倍体细胞。 - 细胞分拣后,沿 15 mL 收集管的墙壁添加 5 mL 的洗涤缓冲器。在160 x g 下将管子离心5分钟。去除超自然。
- 根据分拣细胞的数量选择适合培养的板。使用96井板、24井板和12井板的单井分别培养1,000-40,000个细胞、40,000-200,000个细胞和200,000-400,000个细胞。分别以 120 μL、600 μL 和 1.2 mL 的 HAESC 介质来补充细胞颗粒。
注意:在高密度下对细胞进行平板,因为低汇流会导致细胞在分拣后死亡。从现在起,在没有MEF的明胶涂层井上培养噬菌体,以促进第6步的基因化,以及随后从第9步开始申请细胞内注射。 - 将细胞悬架转移到适当大小的明胶涂层井中后,在 5% CO2 大气中以 37 °C 孵育板。
- 继续扩展 phaESC 文化,重复步骤 3.18 到 3.21,增加板尺寸,增加 trypsin、洗涤缓冲器和 HAESC 介质的体积。这些细胞在没有MEF的明胶涂层井上培养。
- 对于每个子克隆的phaESC线,分别在24井板的一口井和6井板的一口井中分别准备一个培养物,用于步骤6和9。
注:在进入第 9 步之前,应将每个亚克隆 phaESC 线的某些细胞冻结在 300 μL 的冷冻介质中,作为液氮储存罐中的低温素。
6. 没有 MEF 的亚克隆噬菌体线的第二次基因对比
注:进行第二轮基因对比,以确认亚克隆的phaESC线具有H19和IG-DMR的缺失,并且在去除MEF后不存在野生型等位基因。
- 在显微镜下确认,第5.11步的24口井板井中的培养物不含MEF。
注意:如果观察到 MEF,则有必要继续传递这些文化,直到 MEF 消失,以避免使用来自 MEF 的野生型 DNA 对 PCR 造成污染物。 - 从汇合培养物中吸气介质,并在 24 井板的每口井中添加 400 μL 的裂解缓冲器。多次管状后,将细胞悬架转移到 1.5 mL 管中。
- 在 55 °C 的 55 °C 下孵育 1.5 mL 管,混合 3 小时。
- 孵化后,在1.5 mL管中加入400μL的异丙酚,轻轻混合,直到DNA沉淀物可见。
- 以 10,000 x g 的≥离心管 5 分钟,取出超自然。用 200μL 的 70% 乙醇清洗 DNA 颗粒。
- 以 10,000 x g 的≥离心管 5 分钟,取出超自然。
- 将管子在空气中干燥10分钟,然后用50微l的水补充DNA。
- 在第 4.7 步之后执行基因型 PCR,在第 4.8 步中进行凝胶电泳,以识别具有 H19和 IG- DMR 的删除并且不含野生类型等位基因的细胞系。
注: 图 2B 中显示了典型的第二代基因分析的图像,以供参考。在我们的例子中,在单体细胞净化(第5步)之后选择的所有5个细胞系都来自野生型等位基因,并且只拥有 H19和 IG-DMR的删除等位基因。 - 使用在此第二个基因输入后选择的子克隆 phaESC 线作为 DKO-phaESC 线。
7. 老鼠的超排卵
- 对于 MII 卵母细胞的生产,在卵母细胞收集前 63–65 h 中,通过在怀孕母马血清性腺激素 (PMSG) 溶液中注射 5 IU 启动超排卵。
注:本协议建议使用B6D2F1小鼠菌株,因为B6D2F1卵母细胞能很好地耐受细胞内注射,并在程序17后表现出很高的发育潜力。 - PMSG注射后48小时,内皮注射5IU的人类胆汁性腺激素溶液到每只小鼠。
8. 卵母细胞集合
- 在一口井中准备一个4井板,其中含有700μL的透明质介质,在剩下的3口井中准备700微升的M2介质。此外,准备一个6厘米的菜与7 mL的M2介质和一个中心井菜与900μL的M16介质。在 5% 的 CO2 大气中,在 37 °C 的温度下预热盘子和菜肴。
- 在细胞内注射的当天,早上8点左右,通过颈椎脱位或CO2 吸入对超排卵女性(从第7.2步开始)实施安乐死。使用钳子和剪刀解剖卵子。将紫菜与 M2 介质放在 6 厘米的菜中。
- 通过用 30 G 针撕裂卵管的安普拉来释放积水细胞复合物 (COCs)。将 COC 转移到预热透明质介质中,并在 5% 的 CO2 大气中保持在 37 °C。
- 2–3分钟后,用口移液器收集无积水卵母细胞,将卵母细胞转移到4井板其他3口井中的新鲜M2介质中洗3次。
- 收集元相II(MII)卵母细胞,它拥有第一极地体,在中井盘与M16介质,并保持板在37°C在5%的CO2 大气,直到用于细胞内注射在第12步。
9. DKO-噬菌体的治疗和收集
- 在无 MEF 的 6 井板井中准备 DKO-phaESC 文化,在细胞内注射前一天以 60-80% 的对流度(从步骤 5.11 开始)。
- 为了在M相诱导细胞周期阻滞,完全吸气介质,并添加含有0.05毫克/mL脱甲酸酯的2mL的haESC介质。
- 经过8小时的脱甲酸酯治疗后,吸气介质,并加入800μL的三氯辛。
- 在 5% CO2 的大气中在 37 °C 下孵化板 5 分钟,然后加入 2 mL 的洗涤缓冲器以淬灭 trypsin,并多次使用移液器获得单细胞悬架。
- 将细胞悬架转移到 15 mL 管中。在 160 x g 下将管子离心 5 分钟,并去除超自然。
- 将细胞颗粒重新插入 400 μL 的 HAESC 维护缓冲区,其中包含 15 μg/mL 霍奇斯特 33342。
- 在 5% CO2 大气中在 37 °C 孵化细胞悬架 15 分钟。孵化后,通过细胞过滤器盖将细胞悬架转移到 5 mL 管中,并将管保持在 4 °C,直到细胞分拣到第 10 步。
10. 净化M相逮捕的DKO-噬菌体
- 根据制造商的说明设置带 100μm 喷嘴的流量细胞计。
注:霍赫斯特33342可在405纳米时通过激发检测到。在这里,355 nm 紫外线激光器用于检测霍赫斯特 33342。 - 从步骤 9.7 中设置 M 相逮捕的 DKO-噬菌体,并开始分析。选择一个合适的分拣门,从用脱甲酸酯处理的样品中收集单体M相细胞(2n)。
注:经过脱甲酸酯治疗后,预计有2个细胞群,与 图3B中显示的单体细胞和双倍体M相逮捕细胞相对应。脱氧核糖核酸治疗后的细胞循环阻滞完成,因此,没有观察到单体1nDNA峰值。这一点很重要,因为单体M相细胞和双体G1细胞具有相同的DNA含量(2n),并会产生重叠的峰值。 - 设置一个包含 2 mL 的 HAESC 维护缓冲器的 15 mL 管,以收集流细胞仪中的排序单元。开始单元格排序。
- 细胞分拣后,沿收集管壁添加 5 mL 的洗涤缓冲。在 160 x g 下将管子离心 5 分钟,并去除超自然。
- 将细胞以适量的 HAESC 维护缓冲器中重新供用,以获得最终浓度为 5 x 105 细胞/mL。
- 将细胞悬架转移到 1.5 mL 管中。将管子保持在冰上,直到准备好在第 12 步进行细胞内注射。
11. 准备持有和微注射移液器
注意:执行内质注射(第12步),需要几个保持和微注射移液器(图4A)。这些移液器可以根据商业供应商的量身定做需求购买,也可以使用微型皮带拉拔器和微型锻件由合适的玻璃毛细管制成。
- 将玻色酸玻璃毛细管拉到微皮拉器上。要拉无细丝的玻色酸玻璃毛细细毛(0.78 x 1.00 x 80 mm),以下参数为燃烧水平拉子(材料表)作为参考, 但其他仪器和玻璃毛细管类型会有所不同:热 510(Ramp 测试 480)、拉 0、速度 150、时间 175 和压力 200 用于握管件:热 510 (Ramp 测试 480), 拉 90, 速度 140, 时间 125 和压力 200 微注入移液器.
注意:最佳参数需要单独定义,因为包括湿度、微皮拉器模型和大量玻璃毛细管在内的几个因素会影响注射移液器的形状。应瞄准具有逐渐锥形的拉长形状。 - 准备手持移液器
- 将第 11.1 步准备的一个拉毛细金设置为微型锻件。将毛细金放在灯丝上的玻璃珠上,降低毛细金,在加热灯丝时与玻璃珠接触。
- 通过关闭加热和从玻璃珠分离来打破毛细金,使其外径为 60–100 μm。
- 水平放置毛细金尖,以面对灯丝上的玻璃珠。
- 加热灯丝,使毛细细金尖的内径融化到直径为 10–20 μm。
- 移动毛细毛,使玻璃珠的位置在一个点~1毫米从毛细金尖没有接触。加热灯丝,使毛细管以 20° 角弯曲。从微型锻件上卸下毛细管,称为手持式移液器。
注意:为了测量毛细纸的大小,最好在微型锻件中安装目镜抽搐。
- 微注射移液器的制备
- 将第 11.1 步准备的一个拉毛细金设置为微型锻件。将毛细金放在灯丝上的玻璃珠上,降低毛细金,在加热灯丝时与玻璃珠接触。
- 关闭加热并脱离玻璃珠的位置,使其外径为 6 μm,从而打破毛细金。
- 移动毛细毛,使玻璃珠的位置在一个点~1毫米从毛细金尖没有接触。加热灯丝,使毛细管以 20° 角向上弯曲。将微注入移液器从微型锻件中拆下,存放在安全箱中供以后使用。
注:微注入移液器具有以下规格:外径6微米:内径,4.5+5μm;弯曲角,20°。定义微注射移液器的最佳设计对于细胞内注射的成功非常重要。内径过大可防止供体DKO-phESC血浆膜破裂(见讨论部分)。如果内径太窄,可能会妨碍捐赠者 DKO-phESC 的平滑管道输送。弯曲角 < lt; 30° 是可取的,因为高弯曲角阻碍了压子脉冲的效果。
12. DKO-噬菌体的细胞内注射
- 在细胞内注射(从步骤 12.2 开始)之前,通过在包含 0.6 克 PVP 的 50 mL 管中加入 5 mL M2 介质并鼓动摇杆上的管子在 4 °C 下搅拌 2 天,准备多基皮罗利酮 (PVP) 溶液。PVP 完全溶解后,溶液经过无菌过滤,储存在 4 °C。
- 在细胞内注射的当天,用 900 μL 的 KSOM 介质准备一个中心井菜,并在 5% CO2 大气中预热 37 °C 的菜。
- 将 5 μL PVP 溶液和 20 μL M2 介质的滴对齐放在倒置的 10 厘米盘盖上,准备微操纵盘。用矿物油盖住水滴,将菜放在注射显微镜的舞台上。
注:微操纵盘的建议排列显示在 图4B中。 - 将手持式移液器安装到微操纵器上。使用微加载器尖端将微注入移液器装满氟碳油,并将其安装在压电执行器上。
- 将微注射移液器浸入液中,用 PVP 溶液和移液器上下多次涂抹 PVP 玻璃,使其不那么粘稠。将少量 PVP 溶液加载到微注入移液器中,并将移液器移动到 M2 介质下滴。
- 将手持式移液器浸入 M2 介质中,并聚焦于掉落底部的移液器。
- 将大约 2μL 的 DKO-phaESC 暂停从步骤 10.6 转移到 M2 中等下降。
- 使用口移液器将 10 MII 卵母细胞从步骤 8.5 转移到相同的 M2 中等下降。
- 对于注塑,在 M2 中下滴中旋转卵母细胞,使周边空间面对微注入移液器,MII 板不位于微注入移液器(图 4A)的路径上。通过通过保持移液器施加负压来保持卵母细胞。
注:MII板在视觉上被识别为卵母体的突出,称为"驼峰",通常位于第一个极地体旁边。MII 板包含带有附加染色体的美感主轴。必须避免触摸微注射移液器和MII板,因为主轴和染色体的机械损伤会破坏胚胎发育。 - 通过施加温和的负压,将一个 DKO-phaESC 加载到微注入移液器的尖端。通过管道破裂DKO-phaESC的等离子膜,以避免注入完好的DKO-phaESC(图3C;见讨论)。
注:如果DKO-噬菌体的等离子膜未通过管道破裂,请丢弃DKO-phaESC并加载另一个DKO-phaESC。 - 将微注入移液器与卵母细胞的佐纳颗粒接触,并在微注入移液器内施加少量负压。
- 应用压子脉冲(强度,20;频率,4)突破僵尸,同时将微注入移液器的尖端推向近视线空间。确认包含主轴和染色体的 MII 板不位于微注入移液器的路径上。
注意:经验上将设置调整到最低的压子脉冲,用于钻穿 Zona,以最大限度地减少对卵母损坏的可能性。 - 从微注入移液器中丢弃佐纳佩卢西达的碎片,并将 DKO-phaESC 放置在移液器的边缘。
- 用微注入移液器穿透卵母细胞,使卵母到达对面。
注意:不要触摸 MII 板,以防止主轴和染色体损坏。 - 应用压子脉冲(强度,6;频率,1)刺穿卵母。确保欧莱玛沿着微注入移液器的轴放松。
注:经验上定义压子脉冲的最低设置,以打破卵母,以尽量减少对卵母细胞的损害。 - 将DKO-phaESC以最小体积的介质注入卵母细胞,并顺利地从卵母细胞中取出微注入移液器。
- 从保持的移液器中释放注入的卵母细胞,并将其放在微滴的一侧,供以后收集。
- 重复 M2 中下垂中其他 MII 卵母细胞从步骤 12.9 到 12.17 的注射过程。
注意:避免将卵母细胞挡在孵化器之外超过20分钟。根据我们的经验,一批10个卵母细胞可以在适当的训练后15分钟内舒适地操纵。 - 将一批注入的卵母细胞从 M2 中等滴转移到带有 KSOM 介质的预热中井盘。
- 将菜保持在37°C的5%CO2 大气中1小时。
- 重复从步骤 12.5 和 12.20 的卵母细胞操作与额外的 MII 卵母细胞组,以获得足够的注射卵母细胞。
13. 激活构造的半克隆胚胎
- 准备两个中心井菜肴,每个 900 μL 的 KSOM 介质和激活介质。准备一个4井板,每口井中配有700μL的KSOM介质。在 5% CO2 的大气中,在 37 °C 的温度下预热菜肴和盘子。
- 在 KSOM 介质中 1 小时后,将注入的卵母细胞从步骤 12.21 转移到具有激活介质的预热中心井盘中。
- 将菜保持在 37 °C 的 6 小时,在 5% 的 CO2 大气中激活。
- 激活后,观察一些半克隆胚胎形成三个极地体,它们是卵母细胞的第一个和第二个极地体,以及来自DKO-phaESC(图3E)的伪极体。
- 将胚胎移植到4井板中带有KSOM介质的新油井中,将胚胎洗3次。
- 将胚胎转移到具有KSOM介质的中井盘中,并将培养皿保持在37°C的5%CO2 大气中,以进一步发展。
14. 开发构造的半克隆胚胎
- 经过KSOM介质从步骤13.6的1天培养,几个半克隆胚胎达到2细胞阶段(图5A)。
- 为了进一步发展体外预植胚胎,在5%的二氧化碳大气中,继续在KSOM介质中以37°C培育半克隆胚胎。在第2天将半克隆胚胎转移到新的KSOM介质中。在第4天,几个胚胎将到达胚波细胞阶段(图5A)。
- 对于半克隆小鼠的衍生,将2细胞胚胎从第14.1步转移到伪怀孕受体女性的卵子中。通过在胚胎移植前一天与输精管切除的男配来识别伪怀孕女性,并根据当天早晨胚胎移植( 0 . 5 天后)有清晰可见的插头来选择她们。大约 19.5 dpc, 全期幼崽自然从接受女性 (图 5B) 交付。
结果
本协议的目的是应用HAESC作为精子的替代品来获得半克隆胚胎和小鼠。为此,生成并用于将携带CAG-EGFP转基因的DKO-phaESC线注入MII卵母细胞。为了获得一个合适的phaESC线与父亲的印记配置,我们进行了基因工程使用Cas9核糖核酸酶。类倍体ESC线包含由于双倍体化10的人身机器人ESC的内在倾向而产生的双体细胞。一组双倍体染色体是成功替代精子基因组的先决条件。通过流动细胞学进行的DNA含量分析显示,在G0/G1-、S和G2/M相(图2A)中,单体细胞和双体细胞的分布情况。
为了建立DKO-phaESC线,野生型phaESC线被传染成 小猪Bac 转基因结构,用于稳定的转基因EGFP表达,并与CRISPR/Cas9质粒一起用于获取 H19和IG-DMR的删除。为了排除二倍体 ESC 和仅隔离表达 EGFP 的生物体 ESC,定义了特定的排序门(图 2A)。然后将单单倍体EGFP阳性细胞镀入96井板的单独井中,以获得亚克隆。MEF喂料机用于提高转染性噬菌体的电镀效率和存活率。在文化扩展之后,PCR 进行了第一轮基因化,以识别同时删除两个 DMR 的子克隆。在MEF馈线被从培养物中移除后,进行了第二次基因对比,以确认 H19和IG-DMR(图2B)中缺乏野生型等位基因。从总共135个亚克隆中,我们获得了5个单体DKO-phESC线,这些线携带删除的等位基因,并且没有 H19-DMR和IG-DMR的野生型等位基因。
在DKO-噬菌体中引入了一种CAG-EGFP转基因,通过显微镜下绿色荧光的可视化来研究它们对半克隆胚胎的贡献(图3A)。对于细胞内注射,DKO-phaESC接受脱甲基辛治疗,在M相中逮捕他们。因此,DKO-噬菌体的细胞周期与MII卵母细胞的细胞周期同步。流动细胞学分析显示,在接受脱甲基苯丙酮(图3B)治疗后,2个人群对应于G2/M相被捕的双体细胞(2n)和双体细胞(4n)。没有1n单体峰值表明细胞周期逮捕已基本完成。然后对M相单体ESC进行排序并注入卵母细胞。为此,将单个DKO-phaESC加载到微注射移液器中,并注射到MII卵母细胞的细胞质(图3C)中。DKO-phaESC 的等离子膜通过管道插入微注入移液器的尖端而破裂。
注射后,在构造的半克隆胚胎中很少检测到EGFP表达,因为DKO-phaESC的细胞质已经分散在卵母细胞的大细胞质(图3D)中。在极少数情况下,在卵母体内可以观察到强烈的EGFP表达的圆点。这一观察可能是由于无意间注射了完好无损的DKO-噬菌体。如果DKO-phaESC细胞膜不能破裂,很可能与进一步的胚胎发育不相容,应避免。注射一小时后,胚胎被氯化钛18治疗激活。启动6小时后,在显微镜下观察到多达3个极地天体(图3E)。这些极地天体对应于卵母细胞的第一和第二极体,以及来自DKO-phaESC7的伪极地体。此外,在微分干扰对比显微镜下观察到两个原核,这类似于精子正常受精后酶的亲核阶段。
为了展示发育能力,半克隆胚胎被培养到胚胎年代(图5A)。此外,在将半克隆的2细胞阶段胚胎转移到受体雌性(图5B)的卵泡后,还获得了一只完整的小鼠。不出所料,从半克隆胚胎中提取的老鼠是雌性,因为卵母细胞和卵母细胞衍生的噬细胞都没有携带Y染色体。半克隆小鼠是明显正常的,并产生健康的后代时,与野生型瑞士韦伯斯特雄配。到目前为止,半克隆小鼠已经存活了600多天,没有任何明显的健康问题。
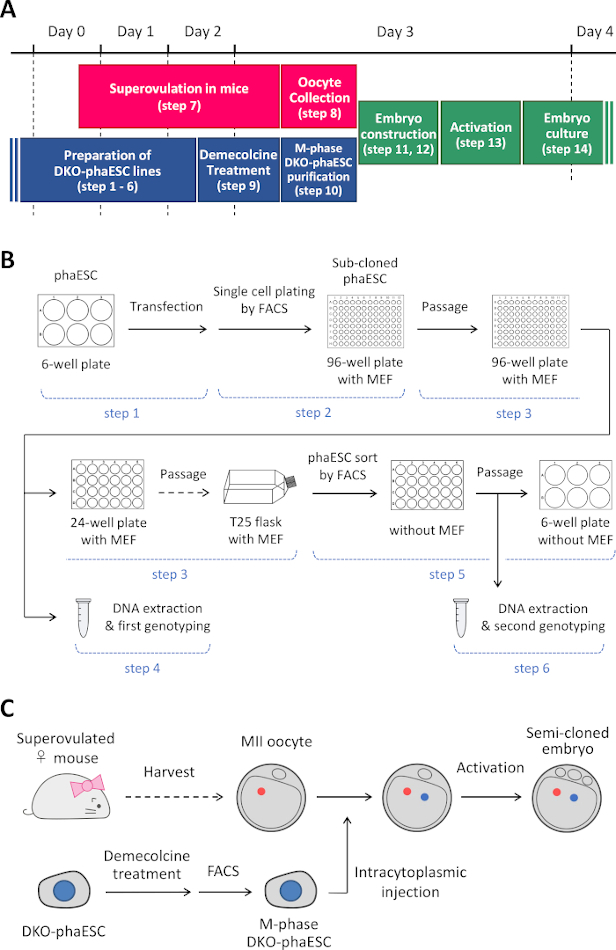
图1:DKO-噬菌体作为精子替代物的应用概述。(A) 议定书程序的时限。(B) 该计划显示了建立DKO-phaESC线路的步骤(步骤1-6)。(C) 该计划显示了通过将DKO-phaESC注射到MII卵母细胞(步骤7-14)中构建半克隆胚胎的步骤。缩写: DKO = 双敲击:phaESC = 部分遗传体位胚胎干细胞;FACS = 荧光激活细胞排序;MEF=小鼠胚胎成纤维细胞。 请单击此处查看此图的更大版本。
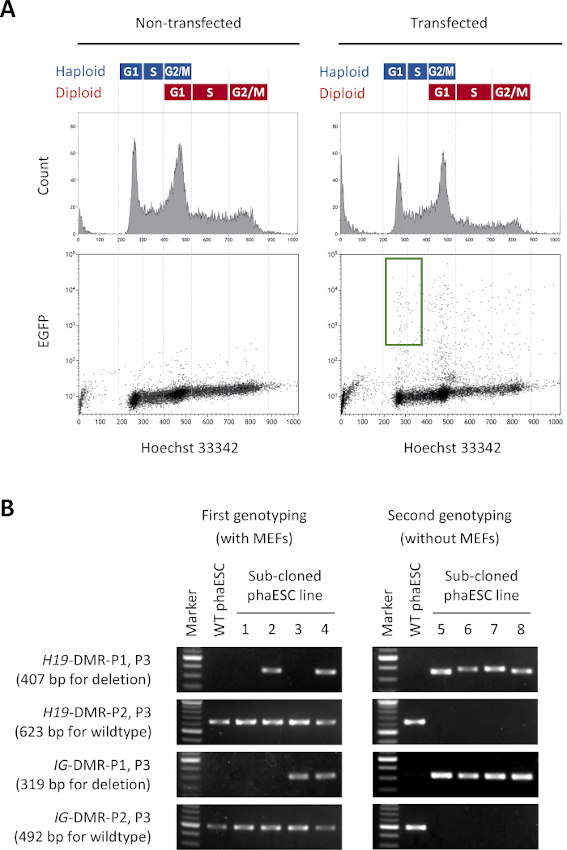
图2:由CRISPR/Cas9调解删除H19和IG-DMR建立DKO-phaESC线。 (A) 流细胞学分析后,与小猪Bac质粒传输后,稳定EGFP表达和4CRISPR/Cas9质粒。非转染性噬菌体显示为控制。DNA图谱(上图)显示单体细胞和双体细胞的细胞周期分布。表示EGFP的G1/S相单体细胞由绿色门(下图,右图)指示。(B) 在MEF(第一基因型)上生长的phaESC子克隆的基因型,以及移除MEF(第二代基因型)后生长的基因。亚克隆的phaESC线1、2、3和4代表野生型细胞,具有H19-DMR删除的细胞,具有IG-DMR删除,并分别具有H19和IG-DMR删除的组合。DKO-phaESC 5–8线同时具有H19-DMR和IG-DMR删除,并且不含野生型等位基因。缩写: DKO = 双敲击:phaESC = 部分遗传体位胚胎干细胞;DMR=微分甲基化区域;MEF=小鼠胚胎成纤维细胞:EGFP = 增强型绿色荧光蛋白;WT=野生类型。请单击此处查看此图的更大版本。
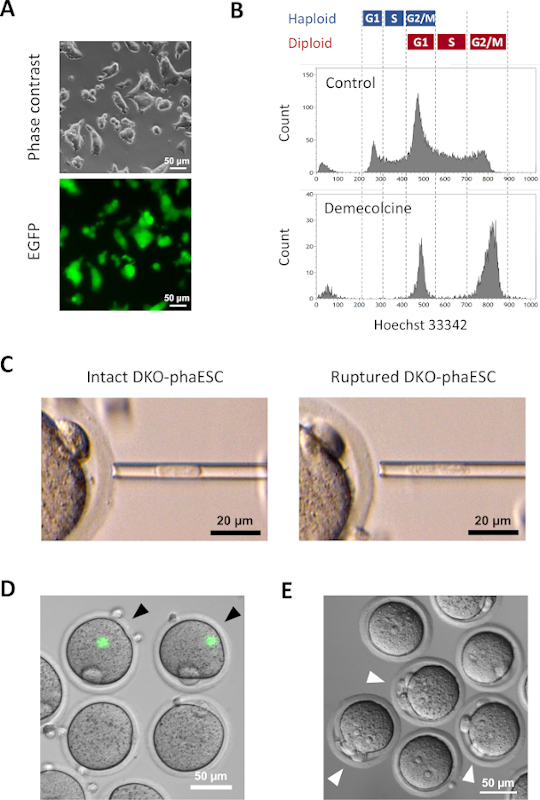
图3:将被密密麻麻地逮捕的DKO-噬菌体注射到MII卵母细胞中。(A) 携带CAG-EGFP转基因和删除H19-和IG-DMR的DKO-phaESC文化的形态学: 比例杆 = 50μm. (B) DKO-噬菌体在被捕后与脱甲基苯丙氨酸8小时的代表流动细胞学分析。没有脱甲基辛治疗的DKO-噬菌体显示为控制。(C) 微注射移液器中DKO-噬菌体的形态学。显示在(左)和(右)通过管道破裂等离子膜之前(左)和之后的一个完整DKO-phaESC:比例杆 = 20μm. (D) 在将 DKO-噬菌体注射到 MII 卵母细胞后,在 1 小时内构建胚胎。显示了EGFP荧光和明亮场的合并图像。黑色箭头表示注射完好的DKO-噬菌体后强烈EGFP表达的圆点,应避免:比例杆 = 50 μm. (E) 显示使用氯化钛启动后 6 h 的半克隆胚胎的微分干扰对比图像。白色箭头表示有3个极地体的胚胎,包括注射的DKO-phaESC中的一个伪极地体:比例栏=50μm。缩写: DKO = 双敲击:phaESC = 部分遗传体位胚胎干细胞;EGFP = 增强型绿色荧光蛋白。请单击此处查看此图的更大版本。
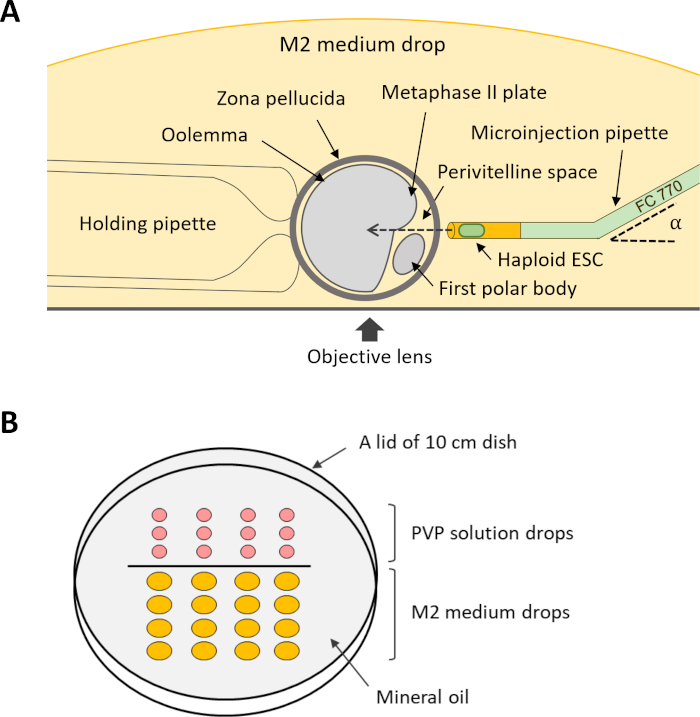
图4:将DKO-噬菌体注射到卵母细胞的细胞内质的设置方案。(A) 在注射室中显示注射移液器、手持式移液器和卵母细胞的排列情况。α,微投射移液器的弯曲角度。(B) 微操纵盘中用于内质注射的滴的布局。缩写: DKO = 双敲击:噬菌体=部分遗传体质胚胎干细胞。 请单击此处查看此图的更大版本。
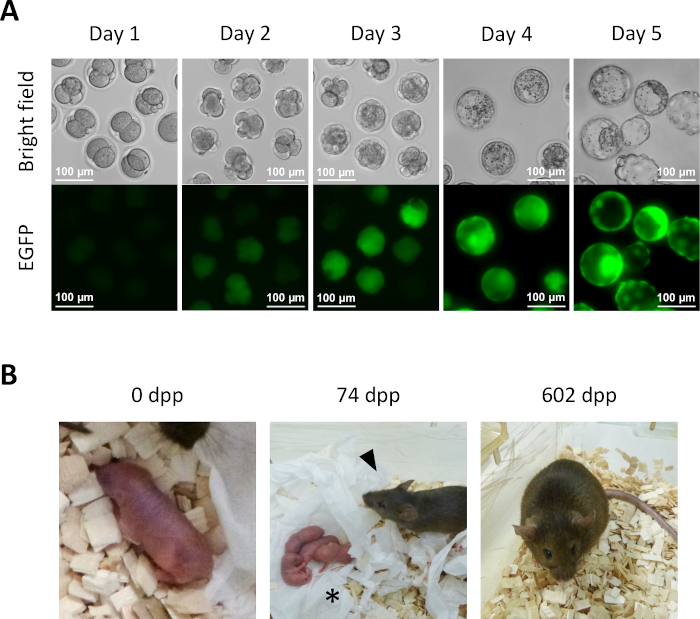
图5:半克隆胚胎的发育。(A) 体外半克隆胚胎的预植发育。EGFP表达最初在细胞内注射后的第2天在四细胞胚胎中观察到。在第 4 天,可在爆炸细胞中观察到强烈的 EGFP 表达:比例杆 = 100μm. (B) 2细胞胚胎移植给受体雌性后获得的半克隆小鼠。74 岁的 dpp ,半克隆小鼠(箭头)在与野生型瑞士韦伯斯特雄配后,自然分娩产下她的第一只幼崽(星号)。图中显示的半克隆胚胎和半克隆小鼠与艾泽等人所报道的胚胎相同。缩写:EGFP=增强型绿色荧光蛋白;。dpp,产后天数。 请单击此处查看此图的更大版本。
| 明胶解决方案 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 水 | - | 500毫升 | - |
| 明胶 | - | 1 克 | 0.2% |
| 类固醇胚胎干细胞(海斯)介质 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 恩迪夫 227 | - | 10升 | - |
| 奇尔 99021 | 10米 | 3μL | 3 微米 |
| PD 0325901 | 10米 | 1μL | 1 微米 |
| 利夫 | 1 x 106 IU/mL | 10 微升 | 1,000 国际联盟/ML |
| 青霉素-链霉素 | 100倍 | 100μL | 1x |
| 海斯C维护缓冲区 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 海斯中等 | - | 1升 | - |
| 赫佩斯解决方案 | 2 . | 20 微升 | 20立方米 |
| 洗涤缓冲区 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 德国马克/F-12 | - | 100毫升 | - |
| BSA 分数 | 7.5% | 7.1升 | 0.5% |
| 梅夫介质 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 德梅姆 | - | 500毫升 | - |
| FBS | - | 56升 | 10% |
| β-默卡普托乙醇 | 14.3 毫升/升 | 3.9 微升 | 100 微米 |
| 青霉素-链霉素 | 100倍 | 5.6升 | 1x |
| 裂解缓冲区 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 水 | - | 8.25毫升 | - |
| 特里斯-赫克 (pH 8.5) | 1 M | 1升 | 100立方米 |
| 埃塔 | 0.5 米 | 100μL | 5米 |
| SDS 解决方案 | 10% | 200μL | 0.2% |
| 纳克 | 5M | 400μL | 200立方米 |
| 蛋白酶 K | 20毫克/升 | 50 微升 | 100微克/升 |
| 激活介质 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| 克索姆 | - | 1升 | - |
| 氯化钛 | 0 升 | 5 微升 | 5米 |
| 埃格塔 | 0.5 米, pH 8.0 | 4μL | 2米 |
| PVP 解决方案 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| M2 介质 | - | 5升 | - |
| PVP | - | 0.6 克 | 12% |
| PMSG 解决方案 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| PBS | - | 450μL | - |
| PMSG | 500 国际联盟/mL | 50 微升 | 50 国际大学/百万升 |
| hCG 解决方案 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| PBS | - | 450μL | - |
| hCG | 500 国际联盟/mL | 50 微升 | 50 国际大学/百万升 |
| 海卢罗尼达塞介质 | |||
| 元件 | 库存集中度 | 体积/重量 | 最终浓度 |
| M2 介质 | - | 380 微升 | - |
| 透明质酸酶 | 10毫克/升 | 20 微升 | 0.5毫克/升 |
| 缩写:LIF = 白血病抑制因子;MEF=小鼠胚胎成纤维细胞: | |||
| FBS=胎儿牛血清;DMEM = 杜尔贝科的改装鹰介质;BSA=牛血清白蛋白; | |||
| EDTA = 乙酰胺乙酰酸;SDS = 钠二硫酸盐;EGTA = 乙烯-比斯(氧化乙烯三氯苯甲酸)四乙酸; | |||
| PBS = 磷酸盐缓冲盐水;PVP=聚乙烯丙酮;hCG=人类胆汁性腺激素: | |||
| PMSG=怀孕的母马血清性腺激素。 | |||
表1:中等、缓冲和解决方案的配方。
| 名字 | 序列 (5' 到 3') | 应用 | |
| H19-DMR-P1 | 格特格特·阿格特·阿塔·塔格·格格 | 基因型平 | |
| H19-DMR-P2 | 阿加T格格特猫TCT抄送 | 基因型平 | |
| H19-DMR-P3 | 泰克塔克阿格特克特克特克特克特克特格特 | 基因型平 | |
| IG-DMR-P1 | 特格特·格卡·加卡·阿格·卡格·阿格·阿格 | 基因型平 | |
| IG-DMR-P2 | 卡卡A一个CCT C卡 | 基因型平 | |
| IG-DMR-P3 | 阿塔· Cga 塔克 · 格格 · 阿卡 · 卡亚 Cg | 基因型平 | |
| H19-DMR-格纳1-F | 中航CCA TGA法案卡格阿格阿加CTG | 格纳 | |
| H19-DMR-格纳1-R | A CCA GTC技术通信技术贸易委员会 | 格纳 | |
| H19-DMR-格纳2-F | 中航卡格GTG阿加AA行动GCT加格 | 格纳 | |
| H19-DMR-格纳2-R | A CCT卡格卡格特克特克特克 | 格纳 | |
| IG-DMR-格纳1-F | 中航 CCG TAC 阿加 GCT 中航 | 格纳 | |
| IG-DMR-格纳1-R | A CGT广电联ATG加格贸易委员会TGT交流 | 格纳 | |
| IG-DMR-格纳2-F | 中航CCT GCT标签AGG塔克塔克广义 | 格纳 | |
| IG-DMR-格纳2-R | A卡格·克格特·阿格特·阿格·阿格·卡格 | 格纳 | |
表2:寡核苷酸清单。
讨论
哺乳动物的克隆体细胞核转移(SCNT)已率先在20世纪90年代19,20,21。这些发展是继30年前在两栖动物22号进行的克隆研究之后发生的。相当的延迟反映了哺乳动物胚胎学和基因组印记的困难。哺乳动物SCNT的发展是应用HAESC替代精子的基础,本协议对此进行了详细的说明。
细胞周期同步是SCNT23成功的重要因素。本协议中也注射了 HAESC。将供体基因组引入接受者需要匹配细胞周期阶段,以避免染色体破裂或会破坏胚胎发育的增异。半克隆具有额外的复杂性,两个基因组和一个细胞质需要兼容。先前的一份报告显示,注射M相逮捕和生化haESCs比将G1相haESC注射到卵母细胞7中,能产生更好的半克隆胚胎发育率。本报告建议将M相作为半克隆的合适同步点。因此,噬菌体在元相中与脱甲基辛一起被分层逮捕,并被注射到MII卵母细胞的卵母细胞中,这些卵母细胞在肌瘤的元二期中自然被捕。重要的是,M相阻塞可以在小鼠ESC中高效实现,为供体和受体细胞周期提供出色的同步。
在间歇期间,核膜分解,并形成复制染色体的主轴形式。注射M相DKO-噬菌体后,姐妹色度被隔离成伪极地体和酶7(图3E)。因此,来自DKO-phaESC的单组染色体有助于半克隆胚胎。至关重要的是,DKO-phaESC染色体的姐妹色度在注射后可以正确隔离。完整的DKO-phaESC的等离子膜防止分离成伪极地体。我们确实观察到极少数情况下,DKO-噬菌体的血浆膜没有破裂,胚胎在注射后在卵石中表现出完整的DKO-噬菌体(图3D)。因此,必须小心通过管道去除DKO-噬菌体的血浆膜。在注射过程中,同样重要的是避免卵母细胞的髓质主轴中断,这可能导致染色体分离缺陷,并诱发厌食症。
在哺乳动物中,基因组印记限制了噬菌体作为精子替代物的应用。部分遗传性 HAESC 具有基因组印记的母体配置,而精子具有父系配置。因此,在注射野生型phaESC作为精子替代后,没有出现过全期幼崽的生成。为了克服这一限制,在分阶段的实验室中设计了IG和H19-DMR的删除。在母体Igf2-H19和Gtl2-Dlk1 loci上修改印迹表达,足以改变基因组印记的配置,使半克隆小鼠的生成频率超过5.1%,基于转移的2细胞胚胎。这些观察表明,针对两个印迹基因将噬菌体的基因组转换成一种功能性的父系结构,可以取代小鼠的精子。然而,这一战略需要对相文进行永久性的基因改造。作为替代策略,可以考虑雄激素haESC。雄激素从精子基因组中提取,并具有父系印记。有报道说,野生型和遗传性海斯特作为精子替代,以1.3%至1.9%的频率产生全期幼崽转移胚胎4,7,24。也通过注射和生化haESC与IG-和H19-DMR的删除频率20.2%的转移24的全期幼崽获得。使用改性雄激素 haESC 进行半克隆效率的提高可能是因为印记在文化中可能变得不稳定。打印缺陷通过关键 DMR 的遗传删除来纠正。
考虑到将基因改造直接引入卵母细胞或精子基因组的困难,HAESC是单独操纵父母基因组的宝贵工具。使用haESC作为精子的替代品,为小鼠生殖系的基因组编辑提供了显著的优势。最近的一项研究将CRISPR/Cas9的基因组编辑与haESC的应用相结合,用于对胚胎发育至关重要的印记区域的特征。这项研究分析了Rasgrf1-DMR与H19和IG-DMR在双子小鼠发育中的作用,以及7种不同的DMR在双父小鼠发育中的作用。用haESC代替精子的方法为基因筛选方法奠定了基础,用于识别DND1蛋白中原始生殖细胞发育中的关键氨基酸,以及识别骨骼发育中的基因24、25、26。基因组印记和基因筛选研究,以确定胚胎发育的关键因素,是将HAESC应用于游戏基因组的重要方法。
披露声明
作者没有什么可透露的。
致谢
我们感谢朱利奥·迪米宁博士对phaESC线的推导和雷莫·弗雷曼博士的流动细胞术。我们还感谢米歇尔·沙夫纳女士和托马斯·亨内克先生在胚胎移植方面提供的技术支持。这项工作得到了瑞士国家科学基金会的支持(赠款31003A_152814/1)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mLTube | Eppendorf | 0030 125.150 | haESC culture |
| 15 ml Tube | Greiner Bio-One | 188271 | haESC culture |
| 12-well plate | Thermo Scientific | 150628 | haESC culture |
| 24-well plate | Thermo Scientific | 142475 | haESC culture |
| 6-well plate | Thermo Scientific | 140675 | haESC culture |
| 96-well plate | Thermo Scientific | 167008 | haESC culture |
| β-Mercaptoethanol | Merck | M6250 | haESC culture |
| BSA fraction | Gibco | 15260-037 | haESC culture |
| CHIR 99021 | Axon | 1386 | haESC culture |
| Demecolcine solution | Merck | D1925 | haESC culture |
| DMEM | Gibco | 41965-039 | haESC culture |
| DMEM / F-12 | Gibco | 11320-033 | haESC culture |
| DR4 mouse | The Jackson Laboratory | 3208 | haESC culture |
| EDTA | Merck | E5134 | haESC culture |
| FBS | biowest | S1810-500 | haESC culture |
| Freezing medium | amsbio | 11897 | haESC culture |
| Gelatin | Merck | G1890 | haESC culture |
| Hepes solution | Gibco | 15630-056 | haESC culture |
| Irradiated MEF | Gibco | A34966 | haESC culture |
| LIF (Leukemia inhibitory factor) | (Homemade) | - | haESC culture |
| Lipofection reagent | Invitrogen | 11668019 | haESC culture |
| NDiff 227 | Takara | Y40002 | haESC culture |
| PD 0325901 | Axon | 1408 | haESC culture |
| Pen Strep | Gibco | 15140-122 | haESC culture |
| piggyBac plasmid carrying a CAG-EGFP transgene | Addgene | #40973 | haESC culture |
| piggyBac transposase plasmid | System Biosciences | PB210PA-1 | haESC culture |
| pX330 plasmid | Addgene | #42230 | haESC culture |
| pX458 plasmid | Addgene | #48138 | haESC culture |
| Trypsin | Gibco | 15090-046 | haESC culture |
| DNA polymerase | Thermo Scientific | F549S | Genotyping |
| dNTP Mix | Thermo Scientific | R0192 | Genotyping |
| Ethanol | Merck | 100983 | Genotyping |
| Hydrochloric acid | Merck | 100317 | Genotyping |
| Isopropanol | Merck | 109634 | Genotyping |
| Proteinase K | Axon | A3830 | Genotyping |
| SDS | Merck | 71729 | Genotyping |
| Sodium chloride | Merck | 106404 | Genotyping |
| ThermoMixer | Epeendorf | 5384000012 | Genotyping |
| Tris | Merck | T1503 | Genotyping |
| 5 mL Tube | Falcon | 352063 | Flow cytometry |
| 5 mL Tube with cell strainer cap | Falcon | 352235 | Flow cytometry |
| Hoechst 33342 | Invitrogen | H3570 | Flow cytometry |
| MoFlo Astrios EQ | Beckman Coulter | B25982 | Flow cytometry |
| 1 mL syringe | Codan | 62.1640 | Superovulation |
| 30-gauge 1/2 inch needle | Merck | Z192362-100EA | Superovulation |
| B6D2F1 mouse | The Jackson Laboratory | 100006 | Superovulation |
| hCG | MSD animal health | 49451 | Superovulation |
| PBS | Gibco | 10010015 | Superovulation |
| PMSG | Avivasysbio | OPPA1037 5000 IU | Superovulation |
| 10-cm dish | Thermo Scientific | 150350 | Embryo manipulation |
| 4-well plate | Thermo Scientific | 179830 | Embryo manipulation |
| 50 mL tube | Greiner Bio-One | 227261 | Embryo manipulation |
| 6 cm dish | Thermo Scientific | 150288 | Embryo manipulation |
| Center-well dish | Corning | 3260 | Embryo manipulation |
| Digital rocker | Thermo Scientific | 88880020 | Embryo manipulation |
| EGTA | AppliChem | A0878 | Embryo manipulation |
| Hyaluronidase | Merck | H4272 | Embryo manipulation |
| KSOM | Merck | MR-020P-5F | Embryo manipulation |
| M16 medium | Merck | M7292 | Embryo manipulation |
| M2 medium | Merck | M7167 | Embryo manipulation |
| Mineral oil | Merck | M8410 | Embryo manipulation |
| Glass capillary | Merck | P1049-1PAK | Embryo manipulation |
| Stereomicroscope | Nikon | SMZ745 | Embryo manipulation |
| Strontium chloride | Merck | 13909 | Embryo manipulation |
| 5ml syringe | Codan | 62.5607 | Microinjection |
| Borosilicate glass cappilary | Science product | GB100T-8P | Microinjection |
| CellTram 4r Oil | Eppendorf | 5196000030 | Microinjection |
| Fluorinert FC-770 | Merck | F3556 | Microinjection |
| Holding pipette | BioMedical Instruments | - | Microinjection |
| Inverted microscope | Nikon | Eclipse Ti-U | Microinjection |
| Microforge | Narishige | MF-900 | Microinjection |
| Microinjection pipette | BioMedical Instruments | - | Microinjection |
| Microlaoder tips | Eppendorf | 5252 956.003 | Microinjection |
| Micromanipulaor arms | Narishige | NT-88-V3 | Microinjection |
| Micropipette puller | Sutter Instrument | P-1000 | Microinjection |
| PiezoXpert | Eppendorf | 5194000016 | Microinjection |
| PVP (Polyvinylpyrrolidine) | Merck | PVP360 | Microinjection |
| Syringe filter | SARSTEDT | 83.1826.001 | Microinjection |
参考文献
- Ellegren, H., Galtier, N. Determinants of genetic diversity. Nature Reviews: Genetics. 17 (7), 422-433 (2016).
- Huijbers, I. J. Generating genetically modified mice: A decision guide. Methods in Molecular Biology. 1642, 1-19 (2017).
- Aizawa, E., Dumeau, C. E., Freimann, R., Di Minin, G., Wutz, A. Polyploidy of semi-cloned embryos generated from parthenogenetic haploid embryonic stem cells. PloS One. 15 (9), 0233072 (2020).
- Li, W., et al. Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature. 490 (7420), 407-411 (2012).
- Li, Z., et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells. Cell Research. 26 (1), 135-138 (2016).
- Wan, H., et al. Parthenogenetic haploid embryonic stem cells produce fertile mice. Cell Research. 23 (11), 1330-1333 (2013).
- Yang, H., et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 149 (3), 605-617 (2012).
- Zhong, C., et al. Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell Research. 26 (1), 131-134 (2016).
- Elling, U., et al. Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell Stem Cell. 9 (6), 563-574 (2011).
- Leeb, M., Wutz, A. Derivation of haploid embryonic stem cells from mouse embryos. Nature. 479 (7371), 131-134 (2011).
- Surani, M. A., Barton, S. C., Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308 (5959), 548-550 (1984).
- Li, Z. K., et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell. 23 (5), 665-676 (2018).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shuai, L., et al. Generation of mammalian offspring by haploid embryonic stem cells microinjection. Current Protocols in Stem Cell Biology. 31, 1-15 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923 (2012).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual. , (2014).
- O'Neill, G. T., Rolfe, L. R., Kaufman, M. H. Developmental potential and chromosome constitution of strontium-induced mouse parthenogenones. Molecular Reproduction and Development. 30 (3), 214-219 (1991).
- Campbell, K. H., McWhir, J., Ritchie, W. A., Wilmut, I. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569), 64-66 (1996).
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., Campbell, K. H. Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619), 810-813 (1997).
- Gurdon, J. B. Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273 (1962).
- Campbell, K. H., Alberio, R. Reprogramming the genome: role of the cell cycle. Reproduction Supplement. 61, 477-494 (2003).
- Zhong, C., et al. CRISPR-Cas9-mediated genetic screening in mice with haploid embryonic stem cells carrying a guide RNA library. Cell Stem Cell. 17 (2), 221-232 (2015).
- Bai, M., et al. Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development. PLoS Biology. 17 (7), 3000350 (2019).
- Li, Q., et al. CRISPR-Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development. Nature Cell Biology. 20 (11), 1315-1325 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。