Method Article
Sperm Yerine Fare Partenogenetik Haploid Embriyonik Kök Hücrelerin Uygulanması
Bu Makalede
Özet
Bu makale, yarı klonlanmış embriyoların yapımında sperm yerine partenogenetik haploid embriyonik kök hücrelerin kullanımını göstermeyi amaçlamaktadır.
Özet
Cinsel üremeye sahip organizmalarda, mikrop hücreleri yeni bireylere dönüşen totipotent hücrelerin kaynağıdır. Farelerde, bir oositin bir spermatozoon tarafından döllenmesi totipotent bir zigot oluşturur. Son zamanlarda, birkaç yayın haploid embriyonik kök hücrelerin (hemECS) gametik genomların yerini tutabileceğini ve farelere dönüşen embriyolara katkıda bulunabileceğini bildirmektedir. Burada, oositlere intrasitoplazmik enjeksiyon ile embriyo oluşturmak için sperm yerine partenogenetik hemECC'lerin uygulanması için bir protokol sunuyoruz. Bu protokol, haESC'lerin sperm replasmanı olarak hazırlanması, haESC kromozomlarının oositlere enjeksiyonu ve yarı klonlanmış embriyo kültürü için adımlardan oluşur. Embriyolar embriyo transferinden sonra verimli yarı klonlanmış fareler verebilir. Sperm replasmanı olarak HESC'lerin kullanılması mikrop hattında genom düzenlemesini, embriyonik gelişim çalışmalarını ve genomik baskıların araştırılmasını kolaylaştırır.
Giriş
Memelilerde, gametler genetik bilgileri bir sonraki nesle ileten tek hücrelerdir. Bir oosit ve spermatozonun füzyonu, yetişkin bir hayvana dönüşen bir diploid zigot oluşturur. Gametik genomlardaki mutasyonlar böylece yavrular tarafından kalıtsaldır ve türlerde genetik varyasyonu yönlendirmektedir1. Mikroptaki mutasyonların tanıtılması, gen fonksiyonunun karakterizasyonu ve hastalık modellemesi de dahil olmak üzere çeşitli biyolojik çalışmalar için genetiği değiştirilmiş hayvanlar üretmek için uygulanmıştır. Hem oositler hem de spermatozoa, çoğalma sona eren ölümcül farklılaşmış ve son derece uzmanlaşmış hücrelerdir. Bu nedenle, gametlerin doğrudan modifikasyonu teknik olarak zordur ve özel yaklaşımlar geliştirilmiştir. Genetik değişiklikler, genetiği değiştirilmiş ESC'lerin gelişmekte olan embriyoya entegre oldukları ve germline kolonileştikleri blastosistlere enjekte edilmesiyle fare germline sokulabilir. Ek olarak, CRISPR/ Cas9 sistemi de dahil olmak üzere genom düzenleme yaklaşımlarını kullanan zigotların genetik modifikasyonu yaygın olarak benimsenmiştir2.
Son zamanlarda, bir gametik genom 3 , 4,5,6,7,8yerine haESC'leri uygulayan olağanüstü bir yaklaşımbildirilmiştir. HESC'ler, partenogenetik veya androgenetik haploid blastosistlerin iç hücre kütlesinden elde edilen kök hücre hatlarıdır ve tek bir kromozom kümesine sahiptir4,7,9,10. Hem partenogenetik hem de androgenetik hemECC'lerin oositlere intrasitoplazmik enjeksiyondan sonra yarı klonlanmış farelerin genomuna katkıda bulunabileceği gösterilmiştir. Diğer yaklaşımların aksine, hemAC'lerin genomları, kendi kendini yenileme kapasiteleri nedeniyle kültürde doğrudan değiştirilebilir. Spermin yerine hemESK'ler konarak mikrop hattına genetik modifikasyonların getirilmesi biyolojik çalışmalar için önemli bir yöntemdir. Sırasıyla partenogenetik veya androgenetik hemECS'lerden türetilen anne veya baba genomlarını ayrı ayrı kültüre etme ve manipüle etme imkanı sağlar. Daha sonra HESC'ler, özellikle genomik baskı, alel özgü ifade ve ebeveyne özgü süreçler için avantajlı olan gametik genom replasmanı olarak kullanılabilir.
Farelerde normal embriyo gelişimi için hem anne hem de baba genomik bilgi gereklidir11. Bu nedenle, sperm genom5,8yerine vahşi tip partenogenetik hemECS (faESC) enjekte edildiğinde tam süreli yavrular elde edilemedi. Gelişimsel bloğun üstesinden gelmek için, partenogenetik hemECC'lerin maternal genomunun genomik baskısının bir baba yapılandırmasına düzeltilmesi gerekir. Bu, farklı metillenmiş bölgelerin (DMR' ler) manipülasyonu ile elde edilebilir. Bugüne kadar, H19-DMR, Gtl2-Dlk1 IG-DMR ve Rasgrf1-DMR'nin hedeflenen silmeleri, 3 ,5,8,12falclerinde doğumla ifade edilen genleri bastırmak için çalışılmıştır. Bu çalışmalar, hem H19-DMR hem de IG-DMR'nin silinmelerinin, bir anneyi sperm kromozomlarının yerini tutabilecek bir baba künyesi yapılandırmasına dönüştürmek için yeterli olduğunu göstermiştir. İki DMR delesyonlarını oositlere taşıyan fazEZ'lerin intrasitoplazmik enjeksiyonu, transfer edilen 2 hücreli embriyoların% 5.1 ila% 15.5'i arasında bir frekansa sahip yarı klonlanmış yavrular verdi.
Bu protokol, çift nakavtlı fadeskler (DKO-phaESC) olarak adlandırdığımız hem H19-DMR hem de IG-DMR silmeleri olan fakların uygulanmasına dayanmaktadır. DKO-phaESC hatları kurmak için faesklerde genomik baskı modifikasyonu, sperm genomunun yerine Oositlere DKO-faesk enjeksiyonu, yarı klonlanmış embriyoların blastosistlere kültürü ve yarı klonlanmış fareler elde etmek için ayrıntılı talimatlar sunuyoruz. Bu protokol, baba genomunun kesin ve doğrudan manipülasyonu ve yarı klonlanmış embriyo ve farelerin üretilmesini gerektiren araştırmacılar için bir referanstır.
Protokol
Tüm hayvan deneyleri, Kanton Etik Komisyonu Zürih ve ETH Zürih Moleküler Sağlık Bilimleri Enstitüsü'ndeki EPIC hayvan tesisinin standartlarına ve yönetmeliklerine uygun olarak ZH152/17 lisansı altında gerçekleştirildi.
NOT: Bu protokol, H19- ve IG-DMR'lerin fazEZ'lerde silinmesiyle başlar. PhaESC hatlarının nasıl oluşturulana ilişkin ayrıntılar için lütfen yayınlananraporlar 10,13'e bakın. Şekil 1A'dabu protokole genel bir bakış ve zaman dilimi (adım 1–14) verilmiştir; ortam, çözümler ve arabellekler Tablo 1'de listelenmiştir. DKO-phaESC hatları kurma prosedürü (adım 1–6) Şekil 1B'degösterilmiştir ve yarı klonlanmış embriyolar oluşturma stratejisi (adım 7-14) Şekil 1C'degösterilmiştir.
1. Fagislerde H19-DMR ve IG-DMR'nin silinmesi için plazmidlerin transfeksiyonu
- Cas9 çekirdeklerinin birlikte ifade etmesi için CRISPR/Cas9 plazmidleri hazırlayın ve RNA'ları H19-DMR ve IG-DMR'nin hedef silmelerine yönlendirin. Dört çift kılavuz RNA oligos (H19-DMR-gRNA1-F, R; H19-DMR-gRNA2-F, R; IG-DMR-gRNA1-F, R; IG-DMR-gRNA2-F, Tablo 2'delistelenen R ) pX330 plazmidlerine.
NOT: Bu 4 CRISPR/Cas9 plazmidlerinin hazırlanması için ayrıntılı prosedür hakkında yayınlanan protokole bakın14. Alternatif olarak, genel fare suşları için mevcut plazmidlere bir depodan da erişilebilir (Malzeme Tablosu). - 6 kuyulu bir plakanın yüzeyini 10 dakika boyunca 37 °C'de inkübasyonla% 0,2 jelatin çözeltisinin 1 mL'si ile kaplayın.
- Plaka 2 × antibiyotiksiz haESC ortamında jelatin kaplı kuyuda10 5 wildtype faesc ve plakayı 1 gün boyunca% 5 CO2 atmosferinde 37 ° C'de kuluçkaya yatırın.
NOT: Antibiyotikler, sonraki lipofeksiyonun verimliliğini artırmak için ortamdan atlanır. 10. geçitte wildtype fadezleri kullandık. Erken geçiş falcleri kullanmanızı öneririz, ancak çeşitli geçiş numarası başarıyla kullanılmıştır8. Yarı klonlanmış embriyo ve farelerin elde edilmesi için geçiş sayısı ve verimliliği arasındaki korelasyon şu anda bilinmemektedir. - Lipofeksiyon reaktifi kullanılarak aynı anda 6 plazmid ile 6 kuyu plakasının kuyusunda (adım 1.3'ten) transfect fazlar: CAG-EGFP transgene taşıyan 50 ng piggyBac plazmid, 50 ng piggyBac transposase plazmid ve 4 CRISPR/Cas9 plazmidlerinin her birinin 600 ng'si (adım 1.1'den itibaren). Transfection'ın ayrıntılı prosedürü hakkında üreticinin protokolüne bakın.
NOT: Gelişmiş yeşil floresan proteinin (EGFP) her yerde ekspresyonu için bir transpozonu faesklerin genomuna entegre etmek için iki piggyBac plazmid kullanılır. Hücrelerin GFP işareti gerekli değilse, bu iki plazmid, pX330 plazmidlerinden biri yerine floresan proteinlerin (örneğin, pX458 plazmid) geçici ekspresyumu için crispr/cas9 plazmid ile değiştirilebilir. Geçici EGFP ifadesi daha sonra transfected hücreleri sıralamak için kullanılabilir. - Transfeksiyondan iki gün sonra, ortamı aspire edin ve 800 μL tripsin ekleyin.
- Plakayı 37 °C'de% 5 CO 2 atmosferinde5 dakika boyunca kuluçkaya yatırın. Ardından, trypsin'i söndürmek için 2 mL yıkama tamponu ve tek bir hücre süspansiyonu elde etmek için birkaç kez pipet ekleyin.
- Hücre süspansiyonu 15 mL'lik bir tüpe aktarın.
- Tüpü 5 dakika boyunca 160 x g'da santrifüj edin ve süpernatantı çıkarın.
- Hücre peletini 15 μg/mL Hoechst 33342 ile desteklenmiş 400 μL haESC bakım tamponunda yeniden biriktirin.
NOT: Hoechst 33342'nin potansiyel toksisitesini azaltmak için 15 μg/mL Hoechst 33342 15 yerine 1 μg/mL Hoechst 33342 ve50μM verapamil kullanılmıştır. - Hücre süspansiyonu 37 °C'de% 5 CO2 atmosferinde 15 dakika boyunca kuluçkaya yaslanın. Kuluçkadan sonra, hücre süspansiyonunu bir hücre süzgeç kapağından 5 mL'lik bir tüpe aktarın ve tüpü bir sonraki adımda kullanıma hazır olana kadar 4 °C'de tutun (bölüm 2).
2. Bir akış sitometresi kullanarak transfected fadesklerin tek hücreli kaplaması
- Transfected faesklerin sıralanmadan bir gün önce, MEF ortamında 4 ×10 4 hücre/cm 2 yoğunlukta jelatin kaplı 96 kuyu plakalarında plaka ışınlanmış fare embriyonik fibroblastları (MEF'ler). Tipik olarak, hedeflenen silmelere sahip bir phaESC hattı kurmak için 6 plaka hazırlanır. Plakaları %5 CO2 atmosferde 37 °C'de kuluçkaya yatırın.
NOT: Işıtılmış MEF'ler ticari olarak mevcuttur. DR4 farelerinin E12.5 embriyolarından elde edilen MEF'leri kullanıyoruz. HemECC'ler JELATIN kaplı plakalarda MEF'ler olmadan büyüyebilse de, sıralanmış tek HEMEC'lerin uygulanabilirliğini artırmak için MEF'leri öneririz. - Sıralama gününde, MEF ortamını 96 kuyu plakalarından epire edin ve kuyu başına 120 μL taze haESC ortamı ekleyin. Plakaları %5 CO2 atmosferde 37 °C'de tutun.
- Üreticinin talimatlarına göre 100 μm nozüllü bir hücre sıralayıcısı kurun. Hoechst 33342 ve EGFP floresanlarının çıkarılması için sırasıyla 355 nm UV lazer ve 488 nm mavi lazer kullanılmaktadır.
NOT: Alternatif olarak, Hoechst 33342 405 nm ile ekscitasyon ile tespit edilebilir. - G1/S fazında EGFP ekspresyonını gösteren haploid hücrelerini toplamak için bir kapı kullanarak 5 mL tüpteki (adım 1.10'dan itibaren) transfected fadezleri sıralayın. Adım 2.2'den itibaren 96 kuyu plakalarının her kuyusuna tek bir hücre koyun.
NOT: Hoechst 33342 boyamasının tespiti genellikle G1 fazındaki haploid hücrelere, G2/M fazındaki haploid hücrelerin ve G1 fazındaki diploid hücrelerin ve G2/M fazındaki diploid hücrelerin bir karışımına karşılık gelen 1n, 2n ve 4n DNA içeriğine sahip 3 hücre tepe noktasını ayırır. G1/S fazındaki haploid hücreler Hoechst 33342 floresan düşük yoğunluklu zirve olarak tanımlanır. Şekil 2A'datemsili bir sonuç ve sıralama kapısı gösterilmiştir. - Kaplamadan sonra, 96 kuyu plakalarını% 5 CO2 atmosferinde 37 ° C'de kuluçkaya yatırın.
3. Transfected phaESC'lerin alt klonlama
- Tek hücreli kaplamadan üç gün sonra, koloniler mikroskop altında 96 kuyu plakalarının birkaç kuyusunda gözlemlenebilir. Sadece tek kolonilerin büyüdüğü kuyuları işaretleyin.
NOT: Deneyimlerimize göre, 96 kuyu plakalarının kuyularının% 20-40'ında tek koloniler gözlenmiştir. - Tek hücreli kaplamadan sonraki 4. günde, kuyulardaki ortamın yarısını yeni haESC ortamıyla tek kolonilerle değiştirin.
- Geçmeden bir gün önce (tek hücreli kaplamadan sonra 4 veya 5. günde), plaka MEF'leri JELATIN kaplı 96 kuyu plakalarına MEF ortamında 4 × 104 hücre/cm2 yoğunlukta ışınladı. Plakaları %5 CO2 atmosferde 37 °C'de tutun.
- 5 veya 6 günlük tek hücreli kaplamadan sonra, çapı 150 μm'den büyük tek koloniler içeren 96 kuyu plakalarının kuyularını seçin.
NOT: Hedeflenen DMR silmeleri ile bir phaESC hattı oluşturmak için tercihen yaklaşık 100 kuyu seçilir. - Seçilen kuyulardaki ortamı aspire edin ve 30 μL tripsin ekleyin. 96 kuyu plakalarını 37 °C'de% 5 CO 2 atmosferinde5 dakika kuluçkaya yatırın. Ardından, trypsin'i söndürmek için her kuyuya 30 μL yıkama tamponu ekleyin.
- Her kuyuya 140 μL haESC ortamı ekleyin ve tek hücre elde etmek için birkaç kez pipet ekleyin.
- MEF ortamını adım 3.3'te hazırlanan 96 kuyu plakalarının kuyularından aspire edin.
- Her kuyudaki fazları adım 3.6'dan 3.7 adımından yeni 96 kuyu plakasının yeni bir kuyusuna aktarın.
- 37 °C'de phaESC alt muhafazaları içeren 96 kuyu plakalarını %5 CO2 atmosferde kuluçkaya yatırın.
- Ertesi gün, her kuyudan tüm ortamı aspire edin ve 120 μL yeni haESC ortamı ekleyin. Plakaları %5 CO2 atmosferde 37 °C'de kuluçkaya yatırın.
- Hücreler geçiş için birleştiğinde, ışınlanmış MEF'leri jelatin kaplı 24 kuyu plakalarına MEF ortamında 4 × 104 hücre/cm2 yoğunlukta plakalayın. Plakaları %5 CO2 atmosferde 37 °C'de tutun.
- FazEZ'ler pas geçmek için birleştiğinde, ortamı aspire edin ve 30 μL tripsin ekleyin. 96 kuyu plakalarını 37 °C'de 5 dakika kuluçkaya yatırın.
- Trypsin'i söndürmek için her kuyuya 90 μL yıkama tamponu ekleyin. Tek hücre elde etmek için birkaç kez pipet.
- MEF ortamını adım 3.11'den itibaren 24 kuyu plakalarının kuyularından aspire edin ve 600 μL taze haESC ortamı ekleyin.
- 3.13 adımındaki her bir kuyudan phaESC altclones süspansiyonunun 60 μL'lik kısmını adım 3.14'ten 24 kuyu plakalarının yeni bir kuyusuna aktarın. DNA ekstraksiyonu ve genotipleme için her bir fazESC alt bendinin kalan süspansiyonunun 4.
- 24 kuyulu plakaları 37 °C'de phaESC altclones ile %5 CO2 atmosferde kuluçkaya yatırın.
- Hücre kültürleri geçiş yoğunluğuna ulaşmadan bir gün önce, ışınlanmış MEF'leri JELATIN kaplı 6 kuyulu plakalara MEF ortamında 4 × 104 hücre/cm2 yoğunlukta plakalayın. Plakaları %5 CO2 atmosferde 37 °C'de tutun.
- FazEZler geçmek için yeterince birleştiğinde, ortamı aspire edin ve 250 μL tripsin ekleyin. 24 kuyu plakasını 37 °C'de 5 dakika kuluçkaya yatırın.
NOT: Adım 4.9'da genotiplemeden sonra, yalnızca hem H19-DMR hem de IG-DMR'nin silinen phaESC çizgilerinin geçirilmesi gerekir. - Trypsin'i söndürmek için her kuyuya 750 μL yıkama tamponu ekleyin. Pipet tek bir hücre süspansiyonu elde etmek için birkaç kez. Hücre süspansiyonu 15 mL'lik bir tüpe aktarın.
- Tüpü 160 x g'da 5 dakika santrifüj edin, süpernatantı çıkarın ve hücre peletini 2 mL haESC ortamında yeniden diriltin.
- MEF ortamını adım 3.17'den itibaren 6 kuyu plakalarının kuyularından aspire edin. PhaESC süspansiyonu her tüpten adım 3.20'den yeni bir kuyuya aktarın. Plakaları %5 CO2 atmosferde 37 °C'de tutun.
- 3,17 ile 3,21 arası adımları yineleyerek ve plaka boyutunu ve tripsin, yıkama tamponu ve haESC ortamının hacimlerini artırarak hücre klonlarını genişletin. 5. adım için her alt klonlanmış phaESC MEF hattı için bir T25 şişesi hazırlayın.
NOT: 5. adıma geçmeden önce her alt klonlanmış fazESC hattının bir aliquot'unun 300 μL donma ortamında dondurulmasını ve sıvı azot deposunda bir kriyostock tutulmasını öneririz.
4. MEF'lerle alt klonlanmış phaESC hatlarının ilk genotipletimi
- Kalan hücre süspansiyonundan 3.15 adımından genomik DNA çıkarmak için, 96 kuyu plakalarının her kuyusuna 200 μL lizis tamponu ekleyin. Hücre süspansiyonu 1,5 mL tüpe aktarın. Kalan tüm hücreleri kurtarmak ve aynı 1,5 mL tüpte toplamak için her kuyuyu ek 200 μL lizis tamponu ile durulayın.
- 1,5 mL'lik tüpü karıştırma ile 3 saat boyunca 55 °C'de kuluçkaya yatırın.
- Kuluçkadan sonra, her 1,5 mL tüpe 460 μL izopropanol ekleyin ve bir DNA çökeltisi görünene kadar hafifçe karıştırın.
- Tüpleri 5 dakika boyunca 10.000 x g'≥ santrifüj edin ve süpernatantı çıkarın. DNA peletlerini% 70 etanol 200 μL ile yıkayın.
- Tüpleri 5 dakika boyunca 10.000 x g'≥ santrifüj edin ve süpernatantı çıkarın.
- Tüpleri havada 10 dakika kurutun ve ardından DNA'yı 20 μL suya yeniden koyun.
- Üreticinin protokolünü izleyerek termostable DNA polimeraz kullanarak polimeraz zincir reaksiyonu (PCR) gerçekleştirin.
NOT: PCR için astar çiftleri Tablo 2'de listelenmiştir ve şu şekilde kullanılır: H19-DMR-P1 ve P3 (silinen H19-DMR için 407 bp); H19-DMR-P2 ve P3 (H19-DMR wildtype için 623 bp); IG-DMR-P1 ve P3 (silinen IG-DMR için 319 bp); IG-DMR-P2 ve P3 (wildtype IG-DMR için 492 bp). Tüm astar çiftleri için PCR sıcaklık profili aşağıdaki gibidir: 30 s 98 °C, 35 x (10 s 98 °C, 20 s 56 °C, 30 sn 72 °C), 5 dk 72 °C. H19-DMR ve IG-DMR silmeleri için güçlendirilmiş DNA parçalarının uzunluğu, CRISPR/ Cas9 aracılı düzenleme ile ilişkili homolog olmayan uç birleştirme nedeniyle bazı farklılıklar göstermektedir. PhaESC'ler, H19-DMR ve IG-DMR DNA'sı içeren MOF'larla kültürlendi. Bu nedenle, wildtype DNA parçalarını güçlendiren H19-DMR-P2/P3 ve IG-DMR-P2/P3 astar çiftleri bilgilendirici değildir. Ancak, bu astar çiftleri kontrol olarak dahil edilir ve tüm reaksiyonlarda bir bant vermelidir. - PCR parçalarını agarose jel elektroforez ile analiz edin. Elektroforez16'nınayrıntılı prosedürü hakkında yayınlanan protokole bakın.
- Hem H19-DMR hem de IG-DMR silmeleri olan hücre hatlarını tanımlayın. Elektroforezin temsili bir görüntüsü Şekil 2B'degösterilmiştir.
NOT: Olgumuzda 135 alt klonlanmış fazESC hattı arasında hem H19-DMR hem de IG-DMRdelesyonları olan sekiz hücre hattı tanımlanmıştır.
5. Alt klonlanmış fazESC hatlarının haploid hücre saflaştırılması
- Adım 3.22'den T25 şişelerindeki alt klonlanmış phaESC kültürleri geçmek için yeterince yoğun hale geldiğinde, ortamı aspire edin ve 1,5 mL tripsin ekleyin. Matarayı 37 °C'de 5 dakika kuluçkaya yatırın. Ardından, tek hücreli bir süspansiyon elde etmek için birkaç kez 4,5 mL yıkama tamponu ve pipet ekleyin.
- Her hücre süspansiyonu 15 mL'lik bir tüpe aktarın ve tüpü 5 dakika boyunca 160 x g'da santrifüj edin. Süpernatantı çıkarın ve hücre peletlerini 15 μg/mL Hoechst 33342 ile desteklenmiş 400 μL haESC bakım tamponunda yeniden biriktirin.
- Hücre süspansiyonlarını 37 °C'de 15 dakika kuluçkaya yatırın. Kuluçkadan sonra, hücre süspansiyonlarını bir hücre süzgeç kapağından 5 mL'lik bir tüpe aktarın. Hücre süzgeç kapağını ek 400 μL haESC bakım tamponu ile durulayın ve kalan hücreleri aynı 5 mL tüpte toplayın. Sıralamaya hazır olana kadar tüpü 4 °C'de tutun.
- Üreticinin talimatlarına göre 100 μm nozullu bir akış sitometresi kurun.
NOT: Hoechst 33342, 405 nm'de ekscitasyon ile tespit edilebilir. Burada Hoechst 33342'nin tespiti için 355 nm UV lazer kullanılmaktadır. - Akış sitometresindeki sıralanmış hücreleri toplamak için hücre süspansiyonu (adım 5.3'ten itibaren) ve 2 mL haESC bakım tamponu içeren yeni bir 15 mL tüp kurun.
- Analizi başlatın ve G1/S fazında haploid hücreleri toplamak için sıralama kapısını kurun. G1/S faz fazESC popülasyonunu tanımlamak için Şekil 2A'daki histograma bakın.
NOT: Bazı alt klonlanmış fazESC çizgileri, adım 2'deki diploid hücrelerin tamamen diploidizasyonu veya hatalı kaplaması nedeniyle herhangi bir haploid hücresi içermeyebilir. Haploid hücreler G1/S fazında gözlenmezse, sıralama yapmadan başka bir örneğe geçin. Olgumuzda 5 hücre hattında haploid hücre, 3 hücre hattında ise 8 alt klonlanmış faESC hattından sadece diploid hücreler vardı. - Hücre sıralamadan sonra, 15 mL toplama tüpünün duvarı boyunca 5 mL yıkama tamponu ekleyin. Tüpü 5 dakika boyunca 160 x g'da santrifüj edin. Üsttekini çıkarın.
- Sıralanmış hücrelerin sayısına bağlı olarak kültleme için uygun boyutta bir plaka seçin. Sırasıyla 1.000-40.000 hücre, 40.000-200.000 hücre ve 200.000-400.000 hücreyi kültüre etmek için 96 kuyulu bir plaka, 24 kuyulu bir plaka ve 12 kuyulu bir plaka kullanın. Hücre peletini sırasıyla 120 μL, 600 μL ve 1,2 mL haESC ortamında yeniden ıslatır.
NOT: Düşük izdiham sıraladıktan sonra hücrelerin hücre ölümüne neden olabileceğinden, hücreleri yüksek yoğunlukta plakalayın. Bu noktadan itibaren, fazEZ'ler, adım 6'da genotiplemeyi ve 9. - Hücre süspansiyonu uygun boyutta jelatin kaplı bir kuyuya aktardıktan sonra, plakayı% 5 CO2 atmosferinde 37 ° C'de kuluçkaya yatırın.
- Artan plaka boyutları ve trypsin, yıkama tamponu ve haESC ortamı hacimlerini artırarak 3,18 ile 3,21 adımlarını tekrarlayarak phaESC kültürlerini genişletmeye devam edin. Hücreler, MEF'leri olmayan jelatin kaplı kuyularda kültürlenir.
- Her alt klonlanmış phaESC hattı için, sırasıyla 6 ve 9 adımları için 24 kuyulu bir plakanın bir kuyusunda ve 6 kuyulu bir plakanın bir kuyusunda bir kültür hazırlayın.
NOT: Alt klonlanmış her fazESC hattının bazı hücreleri, 9.
6. MEF'ler olmadan alt klonlanmış phaESC hatlarının ikinci genotiplemesi
NOT: Alt klonlanmış fazESC çizgilerinin hem H19hem de IG-DMR'lerin silmelerine sahip olduğunu ve MET'lerin çıkarılmasından sonra wildtype alellerinin bulunmadığını doğrulamak için ikinci bir genotipleme turu gerçekleştirilir.
- Mikroskop altında, adım 5.11'deki 24 kuyu plakalarının kuyularındaki kültürlerin MEF'lerden arındırılmış olduğunu onaylayın.
NOT: MF'ler gözlenirse, PCR'nin MEF'lerden wildtype DNA ile kirlenmesini önlemek için MEF'ler kaybolana kadar kültürleri geçirmeye devam etmek gerekir. - Ortamı birleştiği kültürlerden apire edin ve 24 kuyu plakasının kuyusu başına 400 μL lizis tamponu ekleyin. Birkaç kez pipetlemeden sonra, hücre süspansiyonu 1,5 mL'lik bir tüpe aktarın.
- 1,5 mL'lik tüpü karıştırma ile 3 saat boyunca 55 °C'de kuluçkaya yatırın.
- Kuluçkadan sonra, 1,5 mL'lik tüpe 400 μL izopropanol ekleyin ve bir DNA çökeltisi görünene kadar hafifçe karıştırın.
- Tüpü 5 dakika boyunca 10.000 x g ≥ santrifüj edin ve süpernatantı çıkarın. DNA peletini% 70 etanol 200 μL ile yıkayın.
- Tüpü 5 dakika boyunca 10.000 x g ≥ santrifüj edin ve süpernatantı çıkarın.
- Tüpü havada 10 dakika kurutun ve ardından DNA'yı 50 μL suya yeniden koyun.
- Hem H19hem de IG-DMR'ların silmelerine sahip olan ve wildtype alellerinden arındırılmış hücre hatlarını tanımlamak için 4.7.
NOT: Referans için Şekil 2B'de tipik bir ikinci genotipleme analizinin görüntüsü gösterilmiştir. Olgumuzda, haploid hücre saflaştırmasından sonra seçilen 5 hücre hattının tümü (adım 5) wildtype alellerinden arındırılmış ve sadece H19- ve IG-DMR'ların silme alellerine sahipti. - Bu ikinci genotiplemeden sonra seçilen alt klonlanmış fazESC çizgilerini DKO-phaESC satırları olarak kullanın.
7. Farelerin süper yumurtlama
- MII oosit üretimi için, oosit koleksiyonundan önce her B6D2F1 dişi fareye (4-5 haftalık) 63-65 saat hamile mare serum gonadotropin (PMSG) çözeltisinin 5 IU'su intraperitoneal enjeksiyonu ile süper yumurtlamayı başlatın.
NOT: B6D2F1 oositleri intrasitoplazmik enjeksiyonu iyi tolere ettiği ve işlemden sonra yüksek gelişim potansiyeli gösterdiği için bu protokol için B6D2F1 fare zorlanması önerilir17. - PMSG enjeksiyonundan kırk sekiz saat sonra, intraperitoneally her fareye 5 IU insan koryonik gonadotropin çözeltisi enjekte edin.
8. Oosit koleksiyonu
- Bir kuyuda 700 μL hyaluronidaz ortamı ve kalan 3 kuyuda 700 μL M2 ortamı içeren 4 kuyulu bir plaka hazırlayın. Ayrıca, 7 mL M2 orta ile 6 cm'lik bir tabak ve 900 μL M16 orta ile bir merkez kuyu yemeği hazırlayın. Tabağı ve yemekleri % 5 CO2 atmosferinde 37 °C'de önceden ısıtın.
- İntrasitoplazmik enjeksiyon gününde, süperovulated dişileri (adım 7.2'den itibaren) servikal çıkık veya SABAH 8 civarında CO2 soluma ile ötenazi. Cımbız ve makas kullanarak yumurta kanallarını parçalara ayrıştırın. Oviducts M2 orta ile 6 cm'lik yemeğe yerleştirin.
- Kümülüs-oosit komplekslerini (COC' ler) oviducts ampullasını 30 G iğne ile yırtarak serbest bırakın. COC'leri önceden ısıtılmış hyaluronidaz ortamına aktarın ve % 5 CO2 atmosferinde 37 °C'de tutun.
- 2-3 dk sonra, bir ağız pipeti ile kümülüs içermeyen oositleri toplayın ve oositleri 4 kuyulu tabağın diğer 3 kuyusunda taze M2 ortamına aktararak 3 kez yıkayın.
- İlk kutup cisimlerine sahip olan metafaz II (MII) oositlerini M16 orta boy bir merkez kuyu kabında toplayın ve12. adımda intrasitoplazmik enjeksiyon için kullanılana kadar plakayı% 5 CO 2 atmosferinde 37 °C'de tutun.
9. DKO-phaESC'lerin tedavisi ve toplanması
- İntrasitoplazmik enjeksiyondan bir gün önce %60-80 oranında BOF'lar olmadan 6 kuyulu bir tabakta DKO-phaESC kültürü hazırlayın (adım 5.11'den itibaren).
- M fazında hücre döngüsü durmasına neden olmak için, ortamı tamamen aspire edin ve 0.05 mg/mL demekolsin içeren 2 mL haESC ortamı ekleyin.
- 8 saat demecolcine tedavisinden sonra, ortamı aspire edin ve 800 μL tripsin ekleyin.
- Plakayı 5 dakika boyunca% 5 CO2 atmosferinde 37 ° C'de kuluçkalayın, ardından tripsinleri söndürmek için 2 mL yıkama tamponu ve tek hücreli süspansiyon elde etmek için birkaç kez pipet ekleyin.
- Hücre süspansiyonu 15 mL'lik bir tüpe aktarın. Tüpü 5 dakika boyunca 160 x g'da santrifüj edin ve süpernatantı çıkarın.
- Hücre peletini 15 μg/mL Hoechst 33342 içeren 400 μL haESC bakım tamponunda yeniden biriktirin.
- Hücre süspansiyonu 37 °C'de% 5 CO2 atmosferinde 15 dakika boyunca kuluçkaya yaslanın. Kuluçkadan sonra, hücre süspansiyonunu bir hücre süzgeç kapağından 5 mL'lik bir tüpe aktarın ve 10.
10. M fazlı DKO-fako-fakoların saflaştırılması
- Üreticinin talimatlarına göre 100 μm nozullu bir akış sitometresi kurun.
NOT: Hoechst 33342, 405 nm'de ekscitasyon ile tespit edilebilir. Burada Hoechst 33342'nin tespiti için 355 nm UV lazer kullanılmaktadır. - M fazlı tutuklanan DKO-phaESC'leri 9.7 adımından ayarlayın ve analize başlayın. Demecolcine ile tedavi edilen numuneden haploid M faz hücrelerini (2n) toplamak için uygun bir sıralama kapısı seçin.
NOT: Demekolsin tedavisinden sonra, Şekil 3B'degösterildiği gibi haploid ve diploid M fazlı tutuklu hücrelere karşılık gelen 2 hücre popülasyonu beklenmektedir. Demekolsin tedavisinden sonra hücre döngüsü durması tamamlanır, böylece haploid 1n DNA zirvesi gözlenmez. Haploid M fazlı hücreler ve diploid G1 hücreleri aynı DNA içeriğine (2n) sahip olduğu ve üst üste binen zirveler üreteceği için bu önemlidir. - Akış sitometresindeki sıralanmış hücreleri toplamak için 2 mL haESC bakım tamponu içeren 15 mL'lik bir tüp kurun. Hücre sıralamayı başlatın.
- Hücre sıralamadan sonra, toplama tüpünün duvarı boyunca 5 mL yıkama tamponu ekleyin. Tüpü 5 dakika boyunca 160 x g'da santrifüj edin ve süpernatantı çıkarın.
- 5 x 105 hücre/mL'lik son konsantrasyon elde etmek için hücreleri uygun bir haESC bakım tamponu hacminde yeniden biriktirin.
- Hücre süspansiyonu 1,5 mL'lik bir tüpe aktarın. 12. adımda intrasitoplazmik enjeksiyona hazır olana kadar tüpü buzda tutun.
11. Tutma ve mikroenjeksiyon pipetlerinin hazırlanması
NOT: İntrasitoplazmik enjeksiyonun (adım 12) gerçekleştirilmesi için birkaç tutma ve mikroenjeksiyon pipeti gereklidir (Şekil 4A). Bu pipetler ticari bir tedarikçiden özel talep üzerine satın alınabilir veya bir mikropipette çekme ve bir mikroforge kullanılarak uygun cam kılcal damarlardan yapılabilir.
- Borosilikat cam kılcal damarları bir mikropipette çekme üzerine çekin. Filamentsiz (0,78 x 1,00 x 80 mm) borosilikat cam kılcal damarları çekmek için, referans olarak alevli bir yatay çekme(Malzeme Masası)için aşağıdaki parametreler verilmiştir, ancak diğer aletler ve cam kılcal tipler için farklılık gösterecektir: Isı 510 (Rampa testi 480), Çekme 0, Hız 150, Zaman 175 ve Basınç 200 pipet tutmak için; Isı 510 (Rampa testi 480), Mikroenjeksiyon pipetleri için Çekme 90, Hız 140, Zaman 125 ve Basınç 200.
NOT: En uygun parametrelerin ayrı ayrı tanımlanması gerekir, çünkü nem, mikropipette çekme modeli ve cam kılcal damarların çoğu enjeksiyon pipetlerinin şeklini etkileyebilir. Kademeli konik ile uzun bir şekil hedeflenmelidir. - Tutma pipetlerinin hazırlanması
- 11.1. adımda hazırlanan bir çekilmiş kılcal damarı mikroforge'a ayarlayın. Kılcal damarı filament üzerindeki cam boncuk üzerine yerleştirin ve filamenti ısıtırken cam boncukla temas etmek için kılcal damarı diriltin.
- Dış çapı 60-100 μm olacak şekilde ısıtmayı kapatarak ve cam boncuktan ayrılarak kılcal damarı kırın.
- Kılcal ucu filament üzerindeki cam boncukla yüzleşecek şekilde yatay olarak yerleştirin.
- Kılcal ucun iç çapının 10-20 μm çapa erimesini sağlamak için filamenti ısıtın.
- Kılcal damarı, cam boncuk temas etmeden kılcal uçtan ~1 mm'lik bir noktaya yerleştirilecek şekilde hareket ettirİn. Kılcal damarların 20° açıyla bükülmesini sağlamak için filamenti ısıtın. Bir tutma pipeti olarak terimlenen kılcal damarı mikroforge'dan sökün.
NOT: Kılcal damarın boyutunu ölçmek için tercihen mikroforge içine bir göz merceği retikül monte edilir.
- Mikroenjeksiyon pipetlerinin hazırlanması
- 11.1. adımda hazırlanan bir çekilmiş kılcal damarı mikroforge'a ayarlayın. Kılcal damarı filament üzerindeki cam boncuk üzerine yerleştirin ve filamenti ısıtırken cam boncukla temas etmek için kılcal damarı diriltin.
- Dış çapı 6 μm olan bir konumda ısıtmayı kapatarak ve cam boncuktan ayrılarak kılcal damarı kırın.
- Kılcal damarı, cam boncuk temas etmeden kılcal uçtan ~1 mm'lik bir noktaya yerleştirilecek şekilde hareket ettirİn. Kılcal damarların 20° açıyla yukarı doğru bükülmesini sağlamak için filamenti ısıtın. Mikroenjeksiyon pipetini mikroforge'dan sökün ve daha sonra kullanmak üzere güvenli bir kutuda saklayın.
NOT: Mikroenjeksiyon pipetleri aşağıdaki özelliklerle hazırlanmıştır: dış çap, 6 μm; iç çap, 4,5–5 μm; büküm açısı, 20°. Mikroenjeksiyon pipetinin optimal tasarımını tanımlamak intrasitoplazmik enjeksiyonun başarısı için önemlidir. Çok büyük bir iç çap, donör DKO-phESC'lerin plazma zarının yırtılmasını önleyebilir (bkz. tartışma bölümü). İç çapı çok darsa, donör DKO-phESC'lerin düzgün pipetlemini engelleyebilir. Yüksek büküm açısı piezo darbelerinin etkisini etkilediği için büküm açısı < 30° tercih edilir.
12. DKO-fakesklerin intrasitoplazmik enjeksiyonu
- İntrasitoplazmik enjeksiyondan önce (adım 12.2'den itibaren), 0.6 g PVP içeren 50 mL'lik bir tüpe 5 mL M2 ortamı ekleyerek ve tüpü 2 gün boyunca 4 °C'de bir rocker üzerinde çalkalayarak bir polivinylpyrrolidone (PVP) çözeltisi hazırlayın. PVP tamamen çözüldükten sonra, çözelti steril filtrelendirilir ve 4 ° C'de saklanır.
- İntrasitoplazmik enjeksiyon gününde, 900 μL KSOM orta ile merkez kuyulu bir yemek hazırlayın ve yemeği% 5 CO2 atmosferinde 37 ° C'de önceden ısıtın.
- Baş aşağı yerleştirilmiş 10 cm'lik bir kabın kapağına 5 μL PVP çözeltisi ve 20 μL M2 ortamı damlalarını hizalayarak bir mikromanipülasyon kabı hazırlayın. Damlaları mineral yağ ile örtün ve yemeği enjeksiyon mikroskobu aşamasına yerleştirin.
NOT: Mikromanipülasyon kabının önerilen düzenlemesi Şekil 4B'de gösterilmiştir. - Mikromanipülatöre bir tutma pipet takın. Mikroenjeksiyon pipetini bir mikro doldurucu ucu kullanarak florokarbon yağı ile doldurun ve piezo aktüatöre monte edin.
- Camı PVP ile kaplamak ve daha az yapışkan hale getirmek için mikroenjeksiyon pipetini PVP çözeltisi ve pipet ile birkaç kez bir damlaya batırın. Mikroenjeksiyon pipetine küçük hacimli bir PVP çözeltisi yükleyin ve pipetleri M2 ortamı ile bir damlaya taşıyın.
- Tutma pipetini M2 ortamına daldırın ve damlanın altındaki pipete odaklanın.
- Adım 10,6'dan M2 orta damlasına yaklaşık 2 μL DKO-phaESC süspansiyon aktarın.
- Bir ağız pipeti kullanarak 10 MII oositini adım 8.5'ten aynı M2 orta damlasına aktarın.
- Enjeksiyon için, M2 orta damlasında bir oosit döndürün, böylece perivitellin uzayı mikroenjeksiyon pipetine bakar ve MII plakası mikroenjeksiyon pipetinin yolunda bulunmaz (Şekil 4A). Tutma pipetinden negatif basınç uygulayarak oosit tutun.
NOT: Bir MII plakası görsel olarak "kambur" olarak adlandırılan ve genellikle ilk kutup gövdesinin yanında bulunan bir ooplazma çıkıntısı olarak tanımlanır. MII plakası, ekli kromozomlara sahip meiotik iğleri içerir. Milin ve kromozomların mekanik hasarı embriyo gelişimini bozabileceğinden mikroenjeksiyon pipetine ve MII plakasına dokunmaktan kaçınılmalıdır. - Hafif negatif basınç uygulayarak mikroenjeksiyon pipet ucuna bir DKO-phaESC yükleyin. Sağlam bir DKO-phaESC enjeksiyonunu önlemek için pipetleme yaparak bir DKO-phaESC'nin plazma zarını yırtın (Şekil 3C; bkz. tartışma).
NOT: Bir DKO-phaESC'nin plazma zarının pipetleme ile yırtılmazsa, DKO-phaESC'yi atın ve başka bir DKO-phaESC yükleyin. - Mikroenjeksiyon pipetini oosit zona pellucida ile temas halinde yerleştirin ve mikroenjeksiyon pipeti içinde az miktarda negatif basınç uygulayın.
- Mikroenjeksiyon pipetinin ucunu perivitelline uzayına doğru iterken zonayı kırmak için piezo impulsları (yoğunluk, 20; frekans, 4) uygulayın. Bir mil ve kromozom içeren MII plakasının mikroenjeksiyon pipetinin yolunda yer almadığını onaylayın.
NOT: Oolemma'nın hasar görme olasılığını en aza indirmek için ayarı zonayı delmek için en düşük piezo darbelerine ampirik olarak ayarlayın. - Zona pellucida parçasını mikroenjeksiyon pipetinden atın ve DKO-phaESC'yi pipetin kenarına yerleştirin.
- Oosit mikroenjeksiyon pipeti ile nüfuz edin, böylece oolemma karşı tarafa ulaşır.
NOT: Mil ve kromozomların zarar görmesini önlemek için MII plakasına dokunmayın. - Oolemmayı delmek için bir piezo darbesi (yoğunluk, 6; frekans, 1) uygulayın. Oolemmanın mikroenjeksiyon pipetinin şaftı boyunca gevşeyici olduğundan emin olun.
NOT: Oosit hasarını en aza indirmek için oolemmayı kırmak için piezo darbesinin en düşük ayarını ampirik olarak tanımlayın. - DKO-phaESC'yi ooplazma minimum miktarda ortam ile enjekte edin ve mikroenjeksiyon pipetini oositten sorunsuz bir şekilde çekin.
- Enjekte edilen oositleri tutma pipetinden serbest bırakın ve daha sonra toplanması için mikro damlanın yanına yerleştirin.
- M2 orta damlasındaki diğer MII oositleri için enjeksiyon prosedürünü 12,9 ila 12,17 arasında tekrarlayın.
NOT: Oositleri 20 dakikadan fazla kuvözden uzak tutmaktan kaçının. Deneyimlerimize göre, 10 oositlik bir grup, uygun eğitimden sonra 15 dakika içinde rahatça manipüle edilebilir. - Enjekte edilen oositlerin grubunu M2 orta damlasından KSOM ortamı ile önceden ısıtılmış bir merkez kuyu kabına aktarın.
- Yemeği %5 CO 2 atmosferde 37 °C'de1 saat bekletin.
- Yeterli enjekte edilen oositleri elde etmek için ek MII oosit gruplarıyla 12.5 ve 12.20 adımlarındaki oosit manipülasyonu tekrarlayın.
13. yapılı yarı klonlanmış embriyoların aktivasyonu
- KSOM ortamının her biri 900 μL ve aktivasyon ortamı ile iki merkez kuyu yemeği hazırlayın. Her kuyuda 700 μL KSOM ortamlı 4 kuyulu bir plaka hazırlayın. %5 CO2 atmosferde bulaşıkları ve tabağı 37 °C'de önceden ısıtın.
- KSOM ortamında 1 saat sonra, enjekte edilen oositleri adım 12.21'den aktivasyon ortamı ile önceden ısıtılmış merkez kuyu kabına aktarın.
- Aktivasyon için yemeği %5 CO 2 atmosferde 37 °C'de6 saat tutun.
- Aktivasyondan sonra, bazı yarı klonlanmış embriyoların, oositlerin birinci ve ikinci kutup cisimleri olan üç kutup gövdesini ve DKO-phaESC'den sahte kutup gövdesini oluşturduğunu gözlemleyin (Şekil 3E).
- Embriyoları 4 kuyulu bir tabakta KSOM ortamı ile yeni kuyulara aktararak 3 kez yıkayın.
- Embriyoları KSOM ortamı ile merkez kuyu kabına aktarın ve daha fazla gelişme için yemeği% 5 CO2 atmosferinde 37 ° C'de tutun.
14. İnşa edilmiş yarı klonlanmış embriyoların geliştirilmesi
- Adım 13.6'dan itibaren KSOM ortamında 1 günlük kültürden sonra, birkaç yarı klonlanmış embriyo 2 hücreli aşamaya ulaşır (Şekil 5A).
- Preimplantasyon embriyolarının in vitro olarak daha da geliştirilmesi için, yarı klonlanmış embriyoları KSOM ortamında% 5 CO2 atmosferinde 37 ° C'de kültleştirmeye devam edin. Yarı klonlanmış embriyoları 2. günde taze KSOM ortamına aktarın. 4. günde, birkaç embriyo blastosist aşamasına ulaşacaktır (Şekil 5A).
- Yarı klonlanmış farelerin türetlenmesi için, 2 hücreli embriyoları adım 14.1'den sahte hamile alıcı kadınların yumurta kanallarına aktarın. Embriyo transferinden bir gün önce vazektomi olmuş erkeklerle çiftleşerek sözde hamile kadınları tanımlayın ve embriyo transferi için günün sabahında açıkça görülebilen bir fişin varlığına dayanarak seçin (0,5 gün post-coitum (dpc)). Yaklaşık 19,5 dpc, tam süreli yavrular alıcı dişilerden doğal olarak teslim edilir (Şekil 5B).
Sonuçlar
Bu protokolün amacı, yarı klonlanmış embriyo ve fare elde etmek için sperm yerine HESK'leri uygulamaktır. Bu amaçla, CAG-EGFP transgene taşıyan bir DKO-phaESC hattı üretildi ve MII oositlerine intrasitoplazmik enjeksiyon için kullanıldı. Baba künye konfigürasyonu ile uygun bir fazESC hattı elde etmek için Cas9 çekirdeklerini kullanarak genetik mühendisliği gerçekleştirdik. Bir haploid ESC hattı, diploidizasyon için haploid ESC'lerin doğal eğilimi nedeniyle ortaya çıkan haploid ve diploid hücreleri içerir10. Haploid kromozom seti, sperm genomunun başarılı bir şekilde değiştirilmesi için bir ön koşuldur. Akış sitometrisine göre DNA içerik analizi, haploid ve diploid hücrelerin G0/G1-, S-ve G2/M fazlarındaki dağılımını göstermektedir (Şekil 2A).
DKO-phaESC hatlarını kurmak için, wildtype phaESC hatları stabil transgenik EGFP ekspresyonu için piggyBac transposon yapıları ve H19ve IG-DMR'lerin silinmesi için CRISPR / Cas9 plazmidleri ile trans enfekte edildi. Diploid ESC'leri dışlamak ve sadece EGFP'yi ifade eden haploid ESC'leri izole etmek için belirli bir sıralama kapısı tanımlanmıştır (Şekil 2A). Tek haploid EGFP pozitif hücreler daha sonra alt klonlar elde etmek için 96 kuyu plakalı bireysel kuyulara kaplandı. MEF besleyiciler, transfected fakların kaplama verimliliğini ve hayatta kalmasını artırmak için kullanıldı. Kültürlerin genişlemesinden sonra, pcr tarafından her iki DMR'nin silinmelerini taşıyan alt klonları tanımlamak için ilk genotipleme turu gerçekleştirildi. MEF besleyiciler kültürlerden çıkarıldıktan sonra, H19ve IG-DMR'lerde wildtype alellerinin yokluğunu doğrulamak için ikinci bir genotipleme yapıldı (Şekil 2B). Toplam 135 alt klondan, silinen alelleri taşıyan ve hem H19-DMR hem de IG-DMR'nin wildtype alellerinden arındırılmış 5 haploid DKO-phESC hattı elde ettik.
Mikroskop altında yeşil floresan görselleştirmesi yapılarak yarı klonlanmış embriyolara katkılarını incelemek üzere DKO-fazlere cag-EGFP transjeni sokuldu (Şekil 3A). İntrasitoplazmik enjeksiyon için, DKO-fakeskler M fazında tutuklanmaları için demekolsin ile tedavi edildi. Böylece, DKO-fazEZ'lerin hücre döngüsü MII oositlerininkiyle senkronize edildi. Akış sitometrisi analizi, demekolin ile tedaviden sonra G2/M fazı tutuklu haploid (2n) ve diploid hücrelere (4n) karşılık gelen 2 popülasyon göstermiştir (Şekil 3B). 1n haploid zirvesinin yokluğu, hücre döngüsü durmasının büyük ölçüde tamamlandığını gösterdi. M fazlı haploid ESC'ler daha sonra sıralandı ve oositlere enjekte edildi. Bunun için, mikroenjeksiyon pipetine tek bir DKO-phaESC yüklendi ve bir MII oosit sitoplazmına enjekte edildi (Şekil 3C). DKO-phaESC'nin plazma zarı mikroenjeksiyon pipetinin ucuna pipetle sokularak yırtıldı.
Enjeksiyondan sonra, DKO-phaESC'lerin sitoplazma oositin büyük sitoplazmında dağıldığı için, inşa edilen yarı klonlanmış embriyolarda EGFP ekspresyolü nadiren tespit edildi (Şekil 3D). Nadir durumlarda, ooplazm içinde yoğun EGFP ekspresyonunun yuvarlak bir noktası gözlenebilir. Bu gözlem muhtemelen bozulmamış DKO-fazların yanlışlıkla enjektelenmesinden kaynaklanmıştır. DKO-phaESC hücre zarın yırtılmaması muhtemelen daha fazla embriyo gelişimi ile uyumlu değildir ve kaçınılmalıdır. Enjeksiyondan bir saat sonra, embriyolar stronsiyum klorür18ile tedavi ile aktive edildi. Aktivasyonun başlatılmasından altı saat sonra, mikroskop altında en fazla 3 kutup cisimleri gözlenmiştir (Şekil 3E). Bu kutup cisimleri, oositlerin birinci ve ikinci kutup gövdelerine ve DKO-phaESC7'densahte bir kutup gövdesine karşılık gelir. Ek olarak, sperm ile normal döllenmeden sonra zigotların pronükleer aşamasına benzeyen diferansiyel girişim kontrast mikroskobu altında iki pronüklei gözlendi.
Gelişimsel yeterliliği göstermek için yarı klonlanmış embriyolar blastosist aşamasına kültürlendi (Şekil 5A). Ayrıca, yarı klonlanmış 2 hücreli evre embriyoların alıcı bir dişinin yumurtalıklarına aktarılmasından sonra tam süreli bir fare elde edildi (Şekil 5B). Beklendiği gibi, yarı klonlanmış bir embriyodan elde edilen fare, ne oositler ne de oosit türevi faklar Y kromozomu taşımazken dişiydi. Yarı klonlanmış fare aşırı derecede normaldi ve vahşi bir İsviçre Webster erkeğiyle çiftleştiğinde sağlıklı yavrular üretti. Şimdiye kadar, yarı klonlanmış fare 600 günden fazla bir süredir belirgin bir sağlık sorunu olmadan hayattaydı.
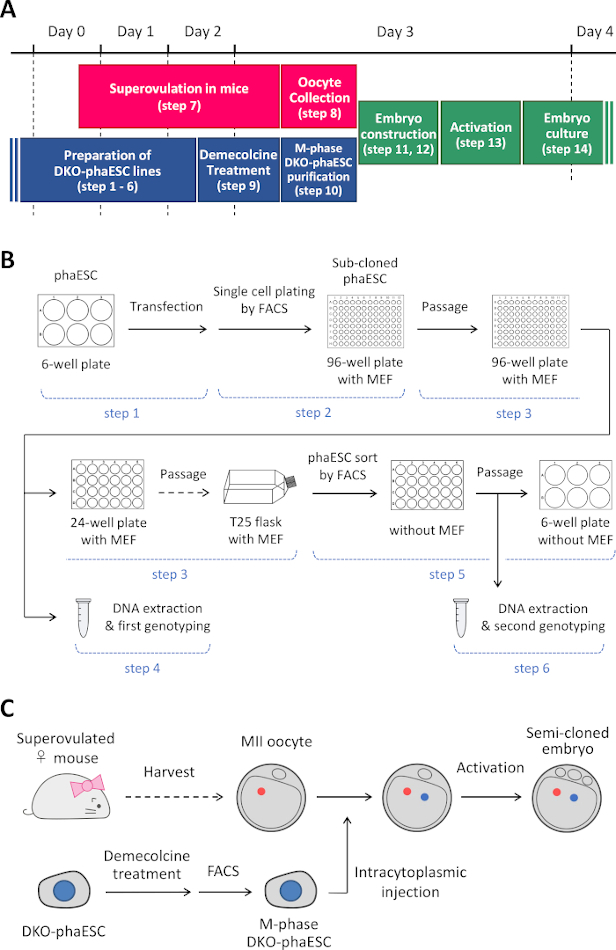
Şekil 1: DKO-fakesklerin sperm replasmanı olarak uygulanmasına genel bakış. (A) Protokolün prosedürlerinin bir zaman dilimi. (B) Şema, DKO-phaESC hatları oluşturma adımlarını gösterir (adım 1-6). (C) Şema, bir DKO-phaESC'nin mii oosit içine intrasitoplazmik enjeksiyonu ile yarı klonlanmış embriyoları oluşturma adımlarını gösterir (adım 7-14). Kısaltmalar: DKO = çift nakavt; phaESC = parthogenetik haploid embriyonik kök hücre; FACS = floresanla etkinleştirilen hücre sıralama; MEF = fare embriyonik fibroblast. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
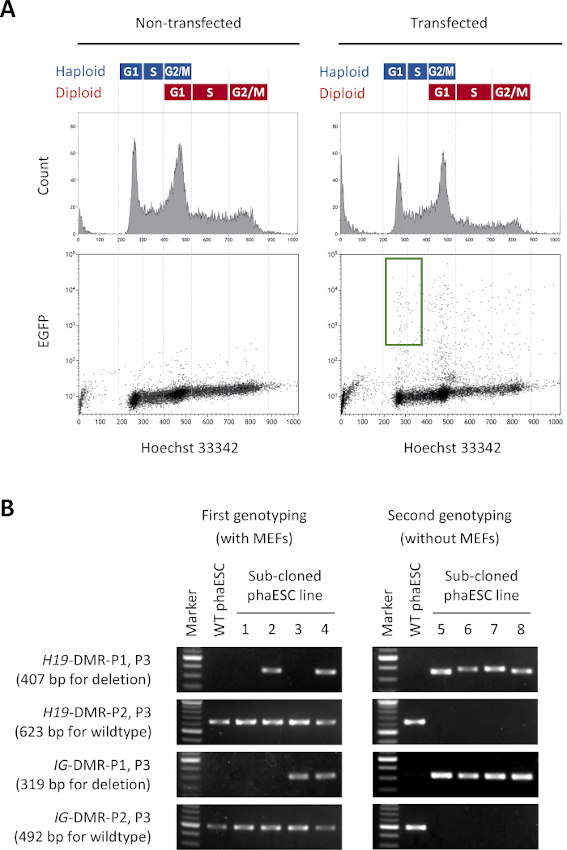
Şekil 2: H19ve IG-DMR'ların CRISPR/Cas9 aracılı silmeleri ile DKO-phaESC hatlarının kurulması. (A) Stabil EGFP ekspresyonu için piggyBac plazmidleri ve 4 CRISPR/Cas9 plazmidleri ile transfeksiyondan sonra fadeklerin akış sitometri analizi. Transfected olmayan fades'ler kontrol olarak gösterilir. DNA profili (üstte) haploid ve diploid hücrelerin hücre döngüsü dağılımını gösterir. EGFP'yi ifade eden G1/S fazlı haploid hücreler yeşil kapı (alt, sağ) ile gösterilir. (B) MEF'lerde yetişen phaESC alt klonlarının genotiplenimi (ilk genotipleme) ve MOF'ların çıkarılmasından sonra (ikinci genotipleme). Alt klonlanmış fazESC çizgileri 1, 2, 3 ve 4, sırasıyla wildtype hücrelerini, H19-DMR silmeli hücreleri, IG-DMR silme ve birleşik H19- ve IG-DMR silmeleri ile temsil eder. 5–8 DKO-phaESC hatları hem H19-DMR hem de IG-DMR silmelerine sahiptir ve wildtype alellerinden arındırılmıştır. Kısaltmalar: DKO = çift nakavt; phaESC = parthogenetik haploid embriyonik kök hücre; DMR = diferansiyel metillenmiş bölge; MEF = fare embriyonik fibroblast; EGFP = gelişmiş yeşil floresan protein; WT = wildtype. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
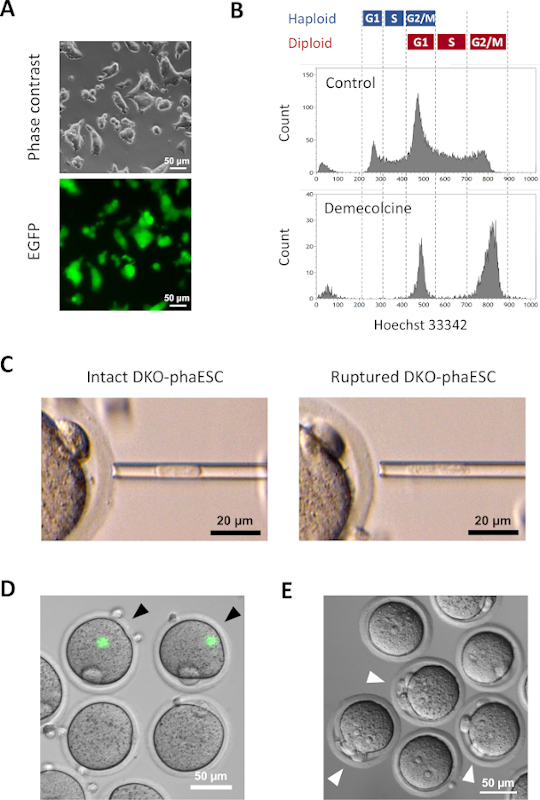
Şekil 3: Miyotik olarak tutuklanan DKO-phaESC'lerin MII oositlerine enjeksiyonu. (A) H19 ve IG-DMR'lerin CAG-EGFP transgene ve silmelerini taşıyan bir DKO-phaESCkültürünün morfolojisi; ölçek çubuğu = 50 μm. (B) DKO-fazezlerin 8 saat boyunca demecolcine ile tutuklandıktan sonra temsili akış sitometri analizi, demekolsin tedavisi olmayan DKO-fazler kontrol olarak gösterilmiştir. (C) Mikroenjeksiyon pipetinde DKO-fadezlerin morfolojisi. Plazma zarını pipetleme ile yırtmadan önce (solda) ve sonra (sağda) tek bir bozulmamış DKO-phaESC gösterilir; ölçek çubuğu = 20 μm. (D) MII oositlerine DKO-phaESC enjekte edildikten sonra 1 saat içinde embriyolar inşa edildi. EGFP floresan ve parlak alanın birleştirilmiş görüntüsü gösterilmiştir. Siyah ok uçları, kaçınılması gereken sağlam DKO-phaESC enjeksiyonundan sonra yoğun EGFP ekspresyonunun yuvarlak noktalarını gösterir; ölçek çubuğu = 50 μm. (E) Stronsiyum klorür ile aktivasyonun başlatılmasından 6 saat sonra yarı klonlanmış embriyoların diferansiyel girişim kontrast görüntüsü gösterilmiştir. Beyaz ok uçları, enjekte edilen DKO-phaESC'den bir sahte kutup gövdesi de dahil olmak üzere 3 kutup gövdesine sahip embriyoları gösterir; ölçek çubuğu = 50 μm. Kısaltmalar: DKO = çift nakavt; phaESC = parthogenetik haploid embriyonik kök hücre; EGFP = gelişmiş yeşil floresan protein. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
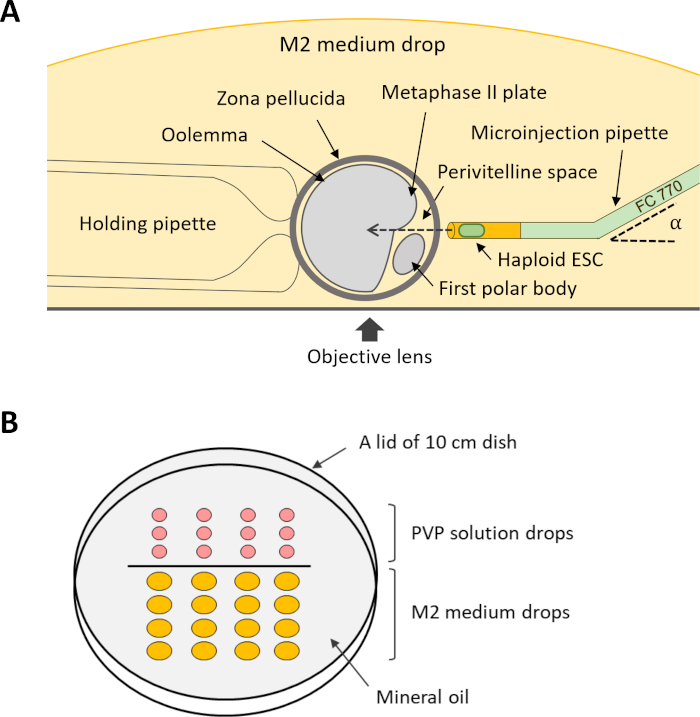
Şekil 4: DKO-phaESC'lerin oositlere intrasitoplazmik enjeksiyonu için kurulumun şeması. (A) Enjeksiyon odasında bir enjeksiyon pipeti, bir tutma pipeti ve bir oosit düzenlenmesi gösterilmiştir. α, mikroenjeksiyon pipetinin büküm açısı. (B) İntrasitoplazmik enjeksiyon için mikromanipülasyon kabındaki damlaların düzeni. Kısaltmalar: DKO = çift nakavt; phaESC = parthogenetik haploid embriyonik kök hücre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
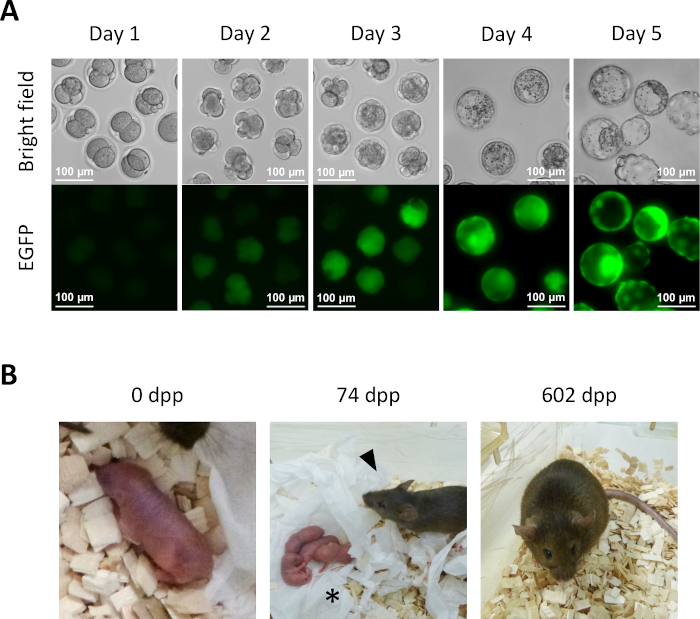
Şekil 5: Yarı klonlanmış embriyoların gelişimi. (A) Yarı klonlanmış embriyoların in vitro preimplantasyon gelişimi. EGFP ekspresyasyonu ilk olarak intrasitoplazmik enjeksiyondan sonra 2. günde dört hücreli embriyolarda gözlenir. 4. günde, blastosistlerde yoğun EGFP ekspresyolü görülebilir; ölçek çubuğu = 100 μm. (B) Alıcı bir kadına 2 hücreli embriyo transferinden sonra elde edilen yarı klonlanmış bir fare. 74 dpp'de, yarı klonlanmış fare (ok ucu), vahşi bir İsviçre Webster erkeğiyle çiftleştikten sonra ilk yavrularını (yıldız işareti) doğal doğumla teslim etti. Yarı klonlanmış embriyolar ve bu şekilde gösterilen yarı klonlanmış fare, Aizawa ve ark.3'te bildirilenlerle aynıdır. Kısaltmalar: EGFP = gelişmiş yeşil floresan protein; .dpp, doğum sonrası günler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Jelatin çözeltisi | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| Su | - | 500 mL | - |
| Jelatin | - | 1 g | 0.2% |
| Haploid embriyonik kök hücre (HaESC) ortamı | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| NDiff 227 | - | 10 mL | - |
| CHIR 99021 | 10 mM | 3 μL | 3 μM |
| PD 0325901 | 10 mM | 1 μL | 1 μM |
| Lıf | 1 x 106 IU/mL | 10 μL | 1.000 IU/mL |
| Penisilin-Streptomisin | 100x | 100 μL | 1x |
| HaESC bakım tamponu | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| HaESC ortamı | - | 1 mL | - |
| HEPES çözümü | 1 M | 20 μL | 20 mM |
| Yıkama arabelleği | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| DMEM / F-12 | - | 100 mL | - |
| BSA kesir | 7.5% | 7,1 mL | 0.5% |
| MEF ortamı | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| DMEM | - | 500 mL | - |
| Fbs | - | 56 mL | 10% |
| β-Mercaptoethanol | 14.3 mol/L | 3,9 μL | 100 μM |
| Penisilin-Streptomisin | 100x | 5,6 mL | 1x |
| Lizis arabelleği | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| Su | - | 8,25 mL | - |
| Tris-HCl (pH 8.5) | 1 M | 1 mL | 100mm |
| Edta | 0,5 M | 100 μL | 5 mM |
| SDS çözümü | 10% | 200 μL | 0.2% |
| Nacl | 5 M | 400 μL | 200 mM |
| Proteinaz K | 20 mg/mL | 50 μL | 100 μg/mL |
| Etkinleştirme ortamı | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| KSOM | - | 1 mL | - |
| Stronsiyum klorür | 1 M | 5 μL | 5 mM |
| EGTA | 0,5 M, pH 8,0 | 4 μL | 2 mM |
| PVP çözümü | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| M2 orta | - | 5 mL | - |
| Pvp | - | 0,6 g | 12% |
| PMSG çözümü | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| Pbs | - | 450 μL | - |
| PMSG | 500 IU/mL | 50 μL | 50 IU/mL |
| hCG çözümü | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| Pbs | - | 450 μL | - |
| Hcg | 500 IU/mL | 50 μL | 50 IU/mL |
| Hyaluronidaz ortamı | |||
| Bileşen | Stok konsantrasyonu | Hacim / ağırlık | Son konsantrasyon |
| M2 orta | - | 380 μL | - |
| Hyaluronidaz | 10 mg/mL | 20 μL | 0,5 mg/mL |
| Kısaltmalar: LIF = lösemi inhibitör faktörü; MEF = fare embriyonik fibroblast; | |||
| FBS = fetal sığır serumu; DMEM = Dulbecco'nun Modifiye Kartal Ortası; BSA = sığır serum albümin; | |||
| EDTA = etileniamintetraasetik asit; SDS = sodyum dodecylsulfate; EGTA = etilen-bis(oksitilennitrilo)tetraasetik asit; | |||
| PBS = fosfat tamponlu salin; PVP = poliviniliptirolidon; hCG = insan koryonik gonadotropin; | |||
| PMSG = hamile kısrak serum gonadotropin. | |||
Tablo 1: Orta, tampon ve çözelti tarifi.
| Adı | Sıra (5' ila 3') | Uygulama | |
| H19-DMR-P1 | GTG GTT AGT TCT ATA TGG GG | Genotipleme | |
| H19-DMR-P2 | AGA TGG GGT CAT TCT TTT CC | Genotipleme | |
| H19-DMR-P3 | TCT TAC AGT CTG GTC TTG GT | Genotipleme | |
| IG-DMR-P1 | TGT GCA GCA GCA AAG CTA AG | Genotipleme | |
| IG-DMR-P2 | CCA CAA AAA CCT CCC TTT CA | Genotipleme | |
| IG-DMR-P3 | ATA CGA TAC GGC AAC CAA CG | Genotipleme | |
| H19-DMR-gRNA1-F | CAC CCA TGA ACT CAG AAG AGA CTG | gRNA | |
| H19-DMR-gRNA1-R | AAA CCA GTC TCT TCT GAG TTC ATG | gRNA | |
| H19-DMR-gRNA2-F | CAC CAG GTG AGA ACC ACT GCT GAG | gRNA | |
| H19-DMR-gRNA2-R | AAA CCT CAG CAG TGG TTC TCA CCT | gRNA | |
| IG-DMR-gRNA1-F | CAC CCG TAC AGA GCT CCA TGG CAC | gRNA | |
| IG-DMR-gRNA1-R | AAA CGT GCC ATG GAG CTC TGT ACG | gRNA | |
| IG-DMR-gRNA2-F | CAC CCT GCT ETIKETI AGG TAC TAC GCT | gRNA | |
| IG-DMR-gRNA2-R | AAA CAG CGT AGT ACC TCT AAG CAG | gRNA | |
Tablo 2: Oligonükleotidlerin listesi.
Tartışmalar
Memelilerin somatik hücre nükleer transferi (SCNT) ile klonlaması 1990'larda19,20,21'deöncü olmuştur. Bu gelişmeler amfibilerde 30 yıl önce yapılan klonlama çalışmalarının ardından22. Önemli gecikme, memelilerde embriyoloji ve genomik baskı zorliğini yansıtır. Memeli SCNT'nin gelişimi, bu protokolde ayrıntılı olarak açıklanan sperm yerine haESC uygulamasının temelidir.
Hücre döngüsü senkronizasyonu SCNT23'ünbaşarısı için önemli bir faktördür. Bu protokolde haESC enjeksiyonu için de durum böyledir. Bir alıcıya donör genomu sokulması, embriyo gelişimini bozacak kromozomal kırılmayı veya aneuploidileri önlemek için hücre döngüsü aşamalarının eşleşmesini gerektirir. Yarı klonlama, iki genom ve bir sitoplastın uyumlu olması gereken ek karmaşıklığa sahiptir. Daha önceki bir rapor, M fazlı tutuklanmış androgenetik hESC'lerin enjeksiyonunun, yarı klonlanmış embriyoların G1 fazlı hESC'lerin oositlere enjeksiyonundan daha iyi gelişimsel oranlar sağladığını göstermiştir7. Bu rapor, yarı klonlama için uygun bir eşitleme noktası olarak M fazı önermektedir. Buna göre, fakihler metatatozda demekolsin ile mitotik olarak tutuklandı ve doğal olarak meiosis II metafazında tutuklanan MII oositlerinin ooplazmına enjekte edildi. Daha da önemlisi, M fazlı arrest, donör ve alıcı hücre döngüleri arasında mükemmel senkronizasyon sağlayan yüksek verimli fare ESC'lerinde elde edilebilir.
Mitoz sırasında, nükleer zar parçalanır ve çoğaltılan kromozomların bağlandığı bir mil oluşur. M fazlı DKO-fadezlerin enjeksiyonundan sonra, kardeş kromatlar sahte bir kutup gövdesine ve zigot7'ye (Şekil 3E) ayrılmıştır. Sonuç olarak, bir DKO-phaESC'den tek bir kromozom kümesi yarı klonlanmış embriyoya katkıda bulunur. DKO-phaESC kromozomlarının kardeş kromatlarının enjeksiyondan sonra doğru bir şekilde ayrıştırılabilmesi önemlidir. Sağlam bir DKO-phaESC'nin plazma zarı, sahte bir kutup gövdesine ayrımı önler. DKO-fazesklerin plazma zarının yırtılmadığı ve embriyoların enjeksiyondan sonra ooplazmada bozulmamış DKO-fakESC'ler sergilediği nadir vakaları gözlemledik (Şekil 3D). Bu nedenle DKO-fazesklerin plazma zarının pipetleme ile çıkarılmasına özen gösterilmelidir. Enjeksiyon sırasında, kromozom ayrım kusurlarına yol açabilecek ve aneuploidiye de neden olabilecek oosit meiotik milinin bozulmasını önlemek eşit derecede önemlidir.
Memelilerde, genomik baskı sperm replasmanı olarak fadezlerin uygulanmasını sınırlar. Partenogenetik hemECC'ler genomik izlerin anne yapılandırmasına sahipken, sperm bir baba yapılandırmasına sahiptir. Bu nedenle, tam süreli yavruların üretimi, sperm replasmanı olarak wildtype faesklerin enjekte edildikten sonra gerçekleşmedi. Bu sınırlamanın üstesinden gelmek için, IG- ve H19-DMR'lerin silinmesi faklarda tasarlanmıştır. Maternal Igf2-H19 ve Gtl2-Dlk1 loci'deki baskılı ifadenin değiştirilmesi, aktarılan 2 hücreli embriyolara dayanarak% 5,1'in üzerinde bir frekansa sahip yarı klonlanmış farelerin üretilmesine izin vermek için genomik baskıların yapılandırmasını değiştirmek için yeterlidir. Bu gözlemler, iki baskılı genin hedeflenmesi, fadeslerin genomunun farelerdeki spermlerin yerini alan işlevsel bir baba yapılandırmasına geçtiğini göstermektedir. Bununla birlikte, bu strateji için fadeslerin kalıcı bir genetik modifikasyonu gereklidir. Alternatif bir strateji olarak androgenetik haESC düşünülebilir. Androgenetik hESC'ler sperm genomundan türetilir ve baba izlerine sahiptir. Wildtype androgenetik hESC'lerin, transfer edilen embriyoların% 1.3 ila% 1.9'u arasında bir sıklıkta tam süreli yavrular üretmek için sperm replasmanı olarak katkıda bulunduğuna dair raporlar vardır4,7,24. Tam süreli yavrular ayrıca,transfer edilen 2 hücreli embriyoların% 20.2'si oranında IG ve H19-DMR'lerin silinmesi ile androgenetik hESC'lerin enjekte ederek elde edilmiştir24. Modifiye androgenetik hESC'ler kullanılarak yarı klonlamanın artan verimliliği, künyelerin kültürde kararsız hale gelebilmesinden muhtemeldir. Baskı kusurları kritik DMR'lerin genetik silmeleri ile düzeltilir.
Genetik modifikasyonların doğrudan oosit veya sperm genomlarına sokulmasındaki zorluk göz önüne alındığında, hESC'ler ebeveyn genomlarını ayrı ayrı manipüle etmek için değerli bir araçtır. Sperm yerine HESC'leri kullanmak, fare mikrop hattında genom düzenleme için olağanüstü bir avantaj sağlar. Yeni bir çalışma CRISPR/ Cas9 tabanlı genom düzenlemeyi embriyonik gelişim için kritik olan baskı bölgelerinin karakterizasyonu için HESK'lerin uygulanması ile birleştirdi12. Bu çalışma, Rasgrf1-DMR'nin bimaternal farelerin gelişiminde H19ve IG-DMR'lerle birlikte rolünü ve biipaternal farelerin gelişiminde 7 farklı DMR'nin işlevini analiz etti. Sperm için HESC'lerin ikame edilmesi yöntemi, ilkel mikrop hücresi gelişiminde DND1 proteini içindeki anahtar amino asitleri tanımlamak ve kemik gelişimindeki genleri tanımlamak için genetik tarama yaklaşımlarının temelini oluşturmuştur24,25,26. Embriyonik gelişimdeki temel faktörleri belirlemek için genomik baskı ve genetik tarama üzerine yapılan çalışmalar, HESC'lerin gametik genom olarak uygulanması için önemli yaklaşımlardır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
PhaESC hatlarının türeyen dr. Giulio Di Minin'e ve akış sitometrisi operasyonu için Dr. Remo Freimann'a teşekkür ederiz. Ayrıca Bayan Michèle Schaffner ve Bay Thomas M. Hennek'i embriyo transferi konusunda teknik destek için kabul ediyoruz. Bu çalışma İsviçre Ulusal Bilim Vakfı (grant 31003A_152814/1) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mLTube | Eppendorf | 0030 125.150 | haESC culture |
| 15 ml Tube | Greiner Bio-One | 188271 | haESC culture |
| 12-well plate | Thermo Scientific | 150628 | haESC culture |
| 24-well plate | Thermo Scientific | 142475 | haESC culture |
| 6-well plate | Thermo Scientific | 140675 | haESC culture |
| 96-well plate | Thermo Scientific | 167008 | haESC culture |
| β-Mercaptoethanol | Merck | M6250 | haESC culture |
| BSA fraction | Gibco | 15260-037 | haESC culture |
| CHIR 99021 | Axon | 1386 | haESC culture |
| Demecolcine solution | Merck | D1925 | haESC culture |
| DMEM | Gibco | 41965-039 | haESC culture |
| DMEM / F-12 | Gibco | 11320-033 | haESC culture |
| DR4 mouse | The Jackson Laboratory | 3208 | haESC culture |
| EDTA | Merck | E5134 | haESC culture |
| FBS | biowest | S1810-500 | haESC culture |
| Freezing medium | amsbio | 11897 | haESC culture |
| Gelatin | Merck | G1890 | haESC culture |
| Hepes solution | Gibco | 15630-056 | haESC culture |
| Irradiated MEF | Gibco | A34966 | haESC culture |
| LIF (Leukemia inhibitory factor) | (Homemade) | - | haESC culture |
| Lipofection reagent | Invitrogen | 11668019 | haESC culture |
| NDiff 227 | Takara | Y40002 | haESC culture |
| PD 0325901 | Axon | 1408 | haESC culture |
| Pen Strep | Gibco | 15140-122 | haESC culture |
| piggyBac plasmid carrying a CAG-EGFP transgene | Addgene | #40973 | haESC culture |
| piggyBac transposase plasmid | System Biosciences | PB210PA-1 | haESC culture |
| pX330 plasmid | Addgene | #42230 | haESC culture |
| pX458 plasmid | Addgene | #48138 | haESC culture |
| Trypsin | Gibco | 15090-046 | haESC culture |
| DNA polymerase | Thermo Scientific | F549S | Genotyping |
| dNTP Mix | Thermo Scientific | R0192 | Genotyping |
| Ethanol | Merck | 100983 | Genotyping |
| Hydrochloric acid | Merck | 100317 | Genotyping |
| Isopropanol | Merck | 109634 | Genotyping |
| Proteinase K | Axon | A3830 | Genotyping |
| SDS | Merck | 71729 | Genotyping |
| Sodium chloride | Merck | 106404 | Genotyping |
| ThermoMixer | Epeendorf | 5384000012 | Genotyping |
| Tris | Merck | T1503 | Genotyping |
| 5 mL Tube | Falcon | 352063 | Flow cytometry |
| 5 mL Tube with cell strainer cap | Falcon | 352235 | Flow cytometry |
| Hoechst 33342 | Invitrogen | H3570 | Flow cytometry |
| MoFlo Astrios EQ | Beckman Coulter | B25982 | Flow cytometry |
| 1 mL syringe | Codan | 62.1640 | Superovulation |
| 30-gauge 1/2 inch needle | Merck | Z192362-100EA | Superovulation |
| B6D2F1 mouse | The Jackson Laboratory | 100006 | Superovulation |
| hCG | MSD animal health | 49451 | Superovulation |
| PBS | Gibco | 10010015 | Superovulation |
| PMSG | Avivasysbio | OPPA1037 5000 IU | Superovulation |
| 10-cm dish | Thermo Scientific | 150350 | Embryo manipulation |
| 4-well plate | Thermo Scientific | 179830 | Embryo manipulation |
| 50 mL tube | Greiner Bio-One | 227261 | Embryo manipulation |
| 6 cm dish | Thermo Scientific | 150288 | Embryo manipulation |
| Center-well dish | Corning | 3260 | Embryo manipulation |
| Digital rocker | Thermo Scientific | 88880020 | Embryo manipulation |
| EGTA | AppliChem | A0878 | Embryo manipulation |
| Hyaluronidase | Merck | H4272 | Embryo manipulation |
| KSOM | Merck | MR-020P-5F | Embryo manipulation |
| M16 medium | Merck | M7292 | Embryo manipulation |
| M2 medium | Merck | M7167 | Embryo manipulation |
| Mineral oil | Merck | M8410 | Embryo manipulation |
| Glass capillary | Merck | P1049-1PAK | Embryo manipulation |
| Stereomicroscope | Nikon | SMZ745 | Embryo manipulation |
| Strontium chloride | Merck | 13909 | Embryo manipulation |
| 5ml syringe | Codan | 62.5607 | Microinjection |
| Borosilicate glass cappilary | Science product | GB100T-8P | Microinjection |
| CellTram 4r Oil | Eppendorf | 5196000030 | Microinjection |
| Fluorinert FC-770 | Merck | F3556 | Microinjection |
| Holding pipette | BioMedical Instruments | - | Microinjection |
| Inverted microscope | Nikon | Eclipse Ti-U | Microinjection |
| Microforge | Narishige | MF-900 | Microinjection |
| Microinjection pipette | BioMedical Instruments | - | Microinjection |
| Microlaoder tips | Eppendorf | 5252 956.003 | Microinjection |
| Micromanipulaor arms | Narishige | NT-88-V3 | Microinjection |
| Micropipette puller | Sutter Instrument | P-1000 | Microinjection |
| PiezoXpert | Eppendorf | 5194000016 | Microinjection |
| PVP (Polyvinylpyrrolidine) | Merck | PVP360 | Microinjection |
| Syringe filter | SARSTEDT | 83.1826.001 | Microinjection |
Referanslar
- Ellegren, H., Galtier, N. Determinants of genetic diversity. Nature Reviews: Genetics. 17 (7), 422-433 (2016).
- Huijbers, I. J. Generating genetically modified mice: A decision guide. Methods in Molecular Biology. 1642, 1-19 (2017).
- Aizawa, E., Dumeau, C. E., Freimann, R., Di Minin, G., Wutz, A. Polyploidy of semi-cloned embryos generated from parthenogenetic haploid embryonic stem cells. PloS One. 15 (9), 0233072(2020).
- Li, W., et al. Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature. 490 (7420), 407-411 (2012).
- Li, Z., et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells. Cell Research. 26 (1), 135-138 (2016).
- Wan, H., et al. Parthenogenetic haploid embryonic stem cells produce fertile mice. Cell Research. 23 (11), 1330-1333 (2013).
- Yang, H., et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 149 (3), 605-617 (2012).
- Zhong, C., et al. Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell Research. 26 (1), 131-134 (2016).
- Elling, U., et al. Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell Stem Cell. 9 (6), 563-574 (2011).
- Leeb, M., Wutz, A. Derivation of haploid embryonic stem cells from mouse embryos. Nature. 479 (7371), 131-134 (2011).
- Surani, M. A., Barton, S. C., Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308 (5959), 548-550 (1984).
- Li, Z. K., et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell. 23 (5), 665-676 (2018).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shuai, L., et al. Generation of mammalian offspring by haploid embryonic stem cells microinjection. Current Protocols in Stem Cell Biology. 31, 1-15 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2014).
- O'Neill, G. T., Rolfe, L. R., Kaufman, M. H. Developmental potential and chromosome constitution of strontium-induced mouse parthenogenones. Molecular Reproduction and Development. 30 (3), 214-219 (1991).
- Campbell, K. H., McWhir, J., Ritchie, W. A., Wilmut, I. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569), 64-66 (1996).
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., Campbell, K. H. Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619), 810-813 (1997).
- Gurdon, J. B. Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273 (1962).
- Campbell, K. H., Alberio, R. Reprogramming the genome: role of the cell cycle. Reproduction Supplement. 61, 477-494 (2003).
- Zhong, C., et al. CRISPR-Cas9-mediated genetic screening in mice with haploid embryonic stem cells carrying a guide RNA library. Cell Stem Cell. 17 (2), 221-232 (2015).
- Bai, M., et al. Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development. PLoS Biology. 17 (7), 3000350(2019).
- Li, Q., et al. CRISPR-Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development. Nature Cell Biology. 20 (11), 1315-1325 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır