Method Article
יישום של עכבר פרתנוגנטי תאי גזע עובריים הפלואיד כתחליף של זרע
In This Article
Summary
מאמר זה נועד להדגים את השימוש בתאי גזע עובריים הפלואידיים פרתנוגנטיים כתחליף לזרע לבניית עוברים משובטים למחצה.
Abstract
באורגניזמים עם רבייה מינית, תאי נבט הם המקור לתאים totipotent המתפתחים לאנשים חדשים. בעכברים, הפריה של ביצית על ידי זרעון יוצר זיגוטה totipotent. לאחרונה, מספר פרסומים דיווחו כי תאי גזע עובריים haploid (haESCs) יכול להיות תחליף גנומים גמטיים ולתרום עוברים, אשר מתפתחים לעכברים. כאן, אנו מציגים פרוטוקול ליישם haESCs parthenogenetic כתחליף של זרע כדי לבנות עוברים על ידי הזרקה intracytoplasmic לתוך ביציות. פרוטוקול זה מורכב שלבים להכנת haESCs כתחליף זרע, להזרקת כרומוזומי haESC לתוך ביציות, ולתרבות של עוברים משובטים למחצה. העוברים יכולים להניב עכברים פוריים משובטים למחצה לאחר העברת העובר. שימוש ב- haESCs כתחליף זרע מקל על עריכת הגנום בחיידק, מחקרים על התפתחות עוברית וחקירת הטבעה גנומית.
Introduction
ביונקים, גמטות הן התאים היחידים שמעבירים מידע גנטי לדור הבא. היתוך של ביצית וזרעון יוצר זיגוטה דיפלואידית המתפתחת לחיה בוגרת. מוטציות בגנומים גמטיים עוברות בירושה לצאצאים ונוהגות וריאציה גנטית במינים1. מבוא של מוטציות הנבט הוחל לייצר בעלי חיים מהונדסים גנטית למחקרים ביולוגיים מגוונים כולל אפיון של תפקוד גנים ומידול מחלות. הן ביציות והן זרעונים הם תאים מובחנים סופניים ומתמחים מאוד שהפסיקו את התפשטותם. לכן, שינוי ישיר של gametes הוא קשה מבחינה טכנית, וגישות מיוחדות פותחו. שינויים גנטיים ניתן להכניס לתוך נבט העכבר על ידי הזרקת ESCs מהונדסים גנטית לתוך blastocysts, שם הם משתלבים העובר המתפתח ליישב את הנבט. בנוסף, שינוי גנטי של זיגוטים באמצעות גישות עריכת גנום, כולל מערכת CRISPR / Cas9,הפך מאומץנרחב 2 .
לאחרונה דווח על גישה יוצאת דופן, המיישמת haESCs כתחליף לגנום גמטי3,4,5,6,7,8. HaESCs הם קווי תאי גזע הנגזרים ממסת התא הפנימית של בלסטוציסטים הפלואידיים פרתנוגנטיים או אנדרוגנטיים ובעלי קבוצה אחת של כרומוזומים4,7,9,10. הוכח כי הן haESCs parthenogenetic ו אנדרוגנטית יכול לתרום הגנום של עכברים משובטים למחצה לאחר הזרקה intracytoplasmic לתוך ביציות. בניגוד לגישות אחרות, הגנומים של haESCs ניתן לשנות ישירות בתרבות בשל יכולת ההתחדשות העצמית שלהם. החדרת שינויים גנטיים לתוך הנבט על ידי החלפת זרע עם haESCs היא שיטה חשובה למחקרים ביולוגיים. הוא מספק אפשרות בנפרד תרבות ולתפעל את הגנום האימהי או האבהי, אשר נגזרים haESCs parthenogenetic או אנדרוגנטית, בהתאמה. לאחר מכן ניתן להשתמש ב- HaESCs כתחליף גנום גמטי, אשר יתרון במיוחד עבור מחקרים של הטבעה גנומית, ביטוי ספציפי לאל ותהליכים ספציפיים להורים.
בעכברים, מידע גנומי אימהי וגברי נדרש להתפתחות עוברית תקינה11. לכן, גורים לטווח מלא לא ניתן היה להשיג כאשר haESCs פרתנוגנטיים מסוג בר (phaESCs) הוזרקו להחליף את הגנום הזרע5,8. כדי להתגבר על הבלוק ההתפתחותי, יש לתקן את ההטבעה הגנומית הגנומית האימהית של ה- haESCs הפרתנוגנטיים לתצורה אבהית. זה יכול להיות מושגת על ידי מניפולציה של אזורים מתילציה דיפרנציאלית (DMRs). עד כה, מחיקות ממוקדות של H19-DMR, Gtl2-Dlk1 IG-DMR, ו Rasgrf1-DMR נחקרו כדי להדחיק גנים מבוטאים אימהית ב phaESCs3,5,8,12. מחקרים אלה הראו כי מחיקות של H19-DMR ו- IG-DMR מספיקות כדי להמיר אימהי לתצורת חותם אבהי שיכולה להחליף כרומוזומי זרע. הזרקה תוך-טופלסמית של phaESCs הנושאים את שתי מחיקות DMR לתוך ביציות הניבו גורים משובטים למחצה בתדירות שבין 5.1% ל -15.5% מהעוברים הדו-תאיים שהועברו.
פרוטוקול זה מבוסס על היישום של phaESCs עם מחיקות של H19-DMR ו- IG-DMR, אשר אנו במונח כפול נוקאאוט phaESCs (DKO-phaESCs). אנו מספקים הוראות מפורטות לשינוי ההטבעה הגנומית ב- phaESCs כדי להקים קווי DKO-phaESC, להזרקת DKO-phaESCs לביוציטים כתחליף לגנום זרע, לתרבות של עוברים משובטים למחצה לבסטוציסטים, ולקבלת עכברים משובטים למחצה. פרוטוקול זה הוא התייחסות לחוקרים הזקוקים למניפולציה מדויקת וישירה של הגנום האבהי ודור של עוברים ועכברים משובטים למחצה.
Protocol
כל הניסויים בבעלי חיים בוצעו תחת הרישיון ZH152/17 בהתאם לסטנדרטים ולתקנות של ועדת האתיקה הקנטונלית בציריך ומתקן בעלי החיים EPIC במכון למדעי הבריאות המולקולרית, ETH ציריך.
הערה: פרוטוקול זה מתחיל עם המחיקה של H19- ו- IG-DMRs ב- phaESCs. לקבלת פרטים על אופן הקמת קווי phaESC, עיין בדוחות שפורסמו10,13. סקירה כללית ומסגרת זמן של פרוטוקול זה (שלבים 1–14) ניתנים באיור 1A; מדיה, פתרונות ומאגרים מפורטים בטבלה 1. ההליך להקמת קווי DKO-phaESC (שלבים 1–6) מוצג באיור 1B, והאסטרטגיה לבניית עוברים משובטים למחצה (שלבים 7-14) מתוארת באיור 1C.
1. החלקה של פלסמידים למחיקה של H19-DMR ו- IG-DMR ב- phaESCs
- הכן פלסמידים CRISPR/Cas9 לביטוי משותף של גרעיני Cas9 והנחה RNAs למקד מחיקות של H19-DMR ו- IG-DMR. Ligate ארבעה זוגות של אוליגוס RNA מדריך (H19-DMR-gRNA1-F, R; H19-DMR-gRNA2-F, R; IG-DMR-gRNA1-F, R; IG-DMR-gRNA2-F, R רשום בטבלה 2) לתוך pX330 פלסמידים.
הערה: עיין בפרוטוקול שפורסם על ההליך המפורט להכנת אלה 4 CRISPR / Cas9 פלסמידים14. לחלופין, פלסמידים זמינים עבור זנים כלליים של העכבר נגישים גם באמצעות מאגר(שולחן החומרים). - מצפים את פני השטח של באר אחת של צלחת 6-באר עם 1 מ"ל של 0.2% פתרון ג'לטין על ידי דגירה ב 37 מעלות צלזיוס במשך 10 דקות.
- צלחת 2 × 105 phaESCs סוג בר על ג'לטין מצופה היטב במדיום haESC ללא אנטיביוטיקה, ולהדגיר את הצלחת ב 37 °C (70 °F) באווירה 5% CO2 במשך יום אחד.
הערה: אנטיביוטיקה מושמטים מן המדיום כדי להגדיל את היעילות של lipofection הבאים. השתמשנו ב-phaESCs פראיים במעבר 10. אנו ממליצים להשתמש phaESCs מעבר מוקדם, אבל מגוון של מספר המעבר שימשו בהצלחה8. המתאם בין מספר המעבר לבין היעילות של השגת עוברים ועכברים משובטים למחצה אינו ידוע כיום. - phaESCs transfect בבאר של צלחת 6-באר (משלב 1.3) עם 6 פלסמידים בו זמנית באמצעות מגיב lipofection: 50 ng piggyBac פלסמיד נושאת TRANSGENE CAG-EGFP, 50 ng piggyBac טרנספוסה פלסמיד, ו 600 ng של כל אחד 4 CRISPR / Cas9 פלסמידים (משלב 1.1). עיין בפרוטוקול היצרן בנוגע להליך מפורט של ההעברה.
הערה: שני פלסמידים piggyBac משמשים לשילוב טרנספוזון לביטוי בכל מקום של חלבון פלואורסצנטי ירוק משופר (EGFP) לתוך הגנום של phaESCs. אם סימון GFP של התאים אינו נדרש, שני פלסמידים אלה יכולים להיות מוחלפים על ידי פלסמיד CRISPR /Cas9 לביטוי חולף של חלבוני פלואורסצנטיות (למשל, pX458 פלסמיד) במקום אחד פלסמידים pX330. לאחר מכן ניתן להשתמש בביטוי EGFP ארעי למיון תאים שעברו ניתוק. - יומיים לאחר transfection, לשאוף את המדיום, ולהוסיף 800 μL של טריפסין.
- דגירה את הצלחת ב 37 מעלות צלזיוס באווירה 5% CO2 במשך 5 דקות. לאחר מכן, להוסיף 2 מ"ל של מאגר לשטוף כדי להרוות את טריפסין, פיפטה מספר פעמים כדי לקבל השעיה תא יחיד.
- להעביר את השעיית התא לתוך צינור 15 מ"ל.
- צנטריפוגה הצינור ב 160 x g במשך 5 דקות, ולהסיר את supernatant.
- Resuspend גלולת התא ב 400 μL של מאגר תחזוקה haESC בתוספת 15 מיקרוגרם / מ"ל Hoechst 33342.
הערה: כדי להפחית את הרעילות הפוטנציאלית של Hoechst 33342, 1 מיקרוגרם / מ"ל Hoechst 33342 ו 50 μM verapamil שימשו במקום 15 מיקרוגרם / מ"ל Hoechst 3334215. - דגירה את התא השעיה ב 37 °C (69 °F) ב 5% CO2 אווירה במשך 15 דקות. לאחר הדגירה, להעביר את המתלה התא לתוך צינור 5 מ"ל דרך כובע מסננת התא, ולשמור על הצינור ב 4 מעלות צלזיוס עד מוכן לשימוש בשלב הבא (סעיף 2).
2. ציפוי תא יחיד של phaESCs מוחצנים באמצעות ציטומטר זרימה
- יום אחד לפני מיון phaESCs transfected, פיברובלסטים עוברי עכבר מוקרן צלחת (MEFs) על לוחות מצופים ג'לטין 96-באר בצפיפות של 4 × 104 תאים / ס"מ2 במדיום MEF. בדרך כלל, 6 לוחות מוכנים להקים קו phaESC עם מחיקות ממוקדות. דגירה הצלחות ב 37 °C (69 °F) באווירה 5% CO2.
הערה: קבצי MEF מוקרנים זמינים מסחרית. אנו משתמשים ב- MEFs הנגזרים מעוברים E12.5 של עכברי DR4. למרות haESCs יכול לגדול על צלחות מצופות ג'לטין ללא MEFs, אנו ממליצים MEFs להגדלת הכדאיות של haESCs יחיד ממוין. - ביום המיון, שאפו את מדיום ה-MEF מצלחות ה-96 באר, והוסיפו 120 μL של מדיום haESC טרי לבאר. שמור את הצלחות ב 37 °C (60 °F) באווירה 5% CO2.
- הגדר סדרן תאים עם זרבובית 100 מיקרומטר בהתאם להוראות היצרן. לייזר UV 355 ננומטר לייזר כחול 488 ננומטר משמשים עירור של Hoechst 33342 ו EGFP פלואורסצנטיות, בהתאמה.
הערה: לחלופין, Hoechst 33342 ניתן לזהות על ידי עירור עם 405 ננומטר. - מיין את phaESCs transected בצינור 5 מ"ל (משלב 1.10) באמצעות שער לאיסוף תאים haploid בשלב G1/S המציגים ביטוי EGFP. להפקיד תא אחד לתוך כל באר של צלחות 96-באר משלב 2.2.
הערה: זיהוי של Hoechst 33342 כתמים בדרך כלל מבחין 3 פסגות של תאים עם 1n, 2n, ו 4n תוכן ה-DNA, אשר תואמים תאים haploid בשלב G1, תערובת של תאים haploid בשלב G2/M ותאי דיפלואיד בשלב G1, ותאי דיפלואיד בשלב G2/M, בהתאמה. תאי הפלואיד בשלב G1/S מזוהים כשיא בעוצמה נמוכה יותר של פלואורסצנטיות Hoechst 33342. באיור 2Aמוצגים תוצאה מייצגת ושער מיון . - לאחר הציפוי, דגירה את צלחות 96-באר ב 37 °C (77 °F) באווירה 5% CO2.
3. שיבוט משנה של phaESCs שנדבקו
- שלושה ימים לאחר ציפוי תא יחיד, ניתן לצפות במושבות בכמה בארות של לוחות 96 בארות תחת מיקרוסקופ. סמן את הבארות שבהן רק מושבות בודדות גדלות.
הערה: מניסיוננו, מושבות בודדות נצפו ב-20%-40% מהבארות של צלחות 96-well. - ביום 4 לאחר ציפוי תא יחיד, להחליף מחצית המדיום עם מדיום haESC חדש בבארות עם מושבות בודדות.
- יום אחד לפני המעבר (ביום 4 או 5 לאחר ציפוי תא יחיד), פלטה מוקרנת MEFs על צלחות מצופות ג'לטין 96-באר בצפיפות של 4 × 104 תאים / ס"מ2 במדיום MEF. שמור את הצלחות ב 37 °C (60 °F) באווירה 5% CO2.
- לאחר 5 או 6 ימים של ציפוי חד-תאי, בחר בארות של לוחות 96 באר המכילים מושבות בודדות בקוטר גדול מ 150 מיקרומטר.
הערה: כ -100 בארות נבחרות עדיף להקים קו phaESC עם מחיקות DMR ממוקדות. - שאפו את המדיום בבארות שנבחרו והוסיפו 30 μL של טריפסין. דגירה 96-באר צלחות ב 37 °C (77 °F) באווירה 5% CO2 במשך 5 דקות. לאחר מכן, להוסיף 30 μL של חוצץ לשטוף לכל באר כדי להרוות את טריפסין.
- הוסף 140 μL של מדיום haESC לתוך כל באר, פיפטה מספר פעמים כדי להשיג תאים בודדים.
- שאפו את מדיום ה-MEF מהבארות של צלחות ה-96 באר שהוכנו בשלב 3.3.
- העבר את ה-phaESCs מכל באר משלב 3.6 לבאר חדשה של צלחת 96 באר חדשה משלב 3.7.
- דגירה 96-באר צלחות המכילות phaESC subclones ב 37 °C (77 °F) באווירה 5% CO2.
- למחרת, לשאוף את כל המדיום מכל באר, ולהוסיף 120 μL של מדיום חדש haESC. דגירה הצלחות ב 37 °C (69 °F) באווירה 5% CO2.
- יום אחד לפני שהתאים הופכים להיות חד פעמיים עבור passaging, צלחת MEFs מוקרן על צלחות מצופות ג'לטין 24-באר בצפיפות של 4 × 104 תאים / ס"מ2 במדיום MEF. שמור את הצלחות ב 37 °C (60 °F) באווירה 5% CO2.
- כאשר phaESCs הפכו למפגש עבור passaging, לשאוף את המדיום ולהוסיף 30 μL של טריפסין. דגירה את צלחות 96-באר ב 37 מעלות צלזיוס במשך 5 דקות.
- הוסף 90 μL של חוצץ לשטוף לתוך כל באר כדי להרוות את טריפסין. פיפטה מספר פעמים כדי להשיג תאים בודדים.
- שאפו את מדיום ה- MEF מהבארות של צלחות 24 הבאר משלב 3.11, והוסיפו 600 μL של מדיום haESC טרי.
- העבר 60 μL של ההשעיה של subclones phaESC מכל באר בשלב 3.13 לתוך באר חדשה של 24-באר צלחות משלב 3.14. שמור את ההשעיה הנותרת של כל תת-קלון phaESC עבור מיצוי DNA ו genotyping בשלב 4.
- דגירה צלחות 24-באר עם subclones phaESC ב 37 °C (69 °F) באווירה 5% CO2.
- יום אחד לפני תרביות התא להגיע לצפיפות עבור passaging, צלחת MEFs מוקרן על ג'לטין מצופה 6-באר צלחות בצפיפות של 4 × 104 תאים / ס"מ2 במדיום MEF. שמור את הצלחות ב 37 °C (60 °F) באווירה 5% CO2.
- כאשר phaESCs הופכים להיות משולבים מספיק כדי לעבור, לשאוף את המדיום ולהוסיף 250 μL של טריפסין. דגירה 24-באר צלחות ב 37 מעלות צלזיוס במשך 5 דקות.
הערה: לאחר genotyping בשלב 4.9, רק שורות phaESC עם מחיקות של H19-DMR ו- IG-DMR צריך להיות מעבר. - הוסף 750 μL של חוצץ לשטוף לתוך כל באר כדי להרוות את טריפסין. פיפטה מספר פעמים כדי להשיג השעיה של תא אחד. להעביר את השעיית התא לתוך צינור 15 מ"ל.
- צנטריפוגה הצינור ב 160 x g במשך 5 דקות, להסיר את supernatant, ו resuspend גלולה התא ב 2 מ"ל של מדיום haESC.
- שאפו את מדיום MEF מהבארות של צלחות 6 באר משלב 3.17. העבר את ההשעיה phaESC מכל צינור משלב 3.20 לתוך באר חדשה. שמור את הצלחות ב 37 °C (60 °F) באווירה 5% CO2.
- הרחב את שיבוטי התאים על-ידי חזרה על שלבים 3.17 עד 3.21 והגדלת גודל הצלחת ונפחי הנסיון, מאגר השטיפה והבינוני של haESC. הכינו בקבוקון T25 לכל שורת phaESC משוכפלת של קבצי MEFs לשלב 5.
הערה: אנו ממליצים להקפיא aliquot של כל קו phaESC משוכפל משנה ב 300 μL של מדיום הקפאה ושמירה על cryostock באחסון חנקן נוזלי לפני שתמשיך לשלב 5.
4. הגנוטיפינג הראשון של קווי phaESC משוכפלים עם MEFs
- כדי לחלץ דנ"א גנומי מהשעיית התא הנותר משלב 3.15, הוסף 200 μL של מאגר תמוגה לכל באר של 96-באר צלחות. העבר את השעיית התא לצינור 1.5 מ"ל. לשטוף כל באר עם תוספת של 200 μL של מאגר תמוגה כדי לשחזר את כל התאים הנותרים ולאסוף באותו צינור 1.5 מ"ל.
- דגירה צינור 1.5 מ"ל ב 55 מעלות צלזיוס עבור 3 שעות עם ערבוב.
- לאחר הדגירה, מוסיפים 460 μL של isopropanol לכל צינור 1.5 מ"ל, ומערבבים בעדינות עד משקע DNA הופך גלוי.
- צנטריפוגה הצינורות ב ≥ 10,000 x g במשך 5 דקות ולהסיר את supernatant. לשטוף את כדורי DNA עם 200 μL של 70% אתנול.
- צנטריפוגה הצינורות ב ≥ 10,000 x g במשך 5 דקות ולהסיר את supernatant.
- יבש את הצינורות באוויר במשך 10 דקות ולאחר מכן resuspend את ה- DNA ב 20 μL של מים.
- בצע תגובת שרשרת פולימראז (PCR) באמצעות פולימראז DNA תרמוסטי בעקבות פרוטוקול היצרן.
הערה: זוגות פריימר עבור PCR מפורטים בטבלה 2 ומשמשים כדלקמן: H19-DMR-P1 ו- P3 (407 bp עבור H19-DMR שנמחק); H19-DMR-P2 ו- P3 (623 bp עבור סוג פראי H19-DMR); IG-DMR-P1 ו- P3 (319 bp עבור IG-DMR שנמחק); IG-DMR-P2 ו- P3 (492 bp עבור סוג פראי IG-DMR). פרופיל הטמפרטורה של PCR עבור כל זוגות פריימר הוא כדלקמן: 30 s 98 °C (78 °F), 5 דקות 72 °C (72 °F). אורך שברי הדנ"א המוגברים למחיקות H19-DMR ו- IG-DMR מראה שונות מסוימת עקב צירוף קצה לא הומולוגי המשויך לעריכה בתיווך CRISPR/Cas9. PhaESCs היו תרבותיים עם MEFs, אשר מכילים סוג פראי H19-DMR ו- IG-DMR DNA. לכן, זוגות פריימר של H19-DMR-P2/P3 ו- IG-DMR-P2/P3, אשר מגבירים שברי DNA מסוג בר, אינם אינפורמטיביים. עם זאת, זוגות פריימר אלה כלולים כפקדים וצריכים לתת רצועה בכל התגובות. - לנתח את שברי PCR על ידי אלקטרופורזה ג'ל agarose. עיין בפרוטוקול שפורסם על ההליך המפורט של האלקטרופורזה16.
- זהה שורות תאים עם מחיקות הן של H19-DMR והן של IG-DMR. באיור 2Bמוצגת תמונה מייצגת של אלקטרופורזה .
הערה: במקרה שלנו, שמונה שורות תא עם מחיקות של H19-DMR ו- IG-DMR זוהו בין 135 קווי phaESC משוכפלים משנה.
5. טיהור תאים הפלואידיים של קווי phaESC תת-משובטים
- כאשר תרביות ה-phaESC התת-משוכפלות בבקבוקי T25 משלב 3.22 הופכות צפופות מספיק כדי לעבור, שאפו את המדיום והוסיפו 1.5 מ"ל של טריפסין. דגירה את הבקבוק ב 37 מעלות צלזיוס במשך 5 דקות. לאחר מכן, להוסיף 4.5 מ"ל של חוצץ לשטוף פיפטה מספר פעמים כדי להשיג השעיה של תא יחיד.
- מעבירים כל מתלה תא לצינור של 15 מ"ל וצנטריפוגה הצינור ב 160 x g במשך 5 דקות. הסר את supernatant ו resuspend כדורי התא ב 400 μL של מאגר תחזוקה haESC בתוספת 15 מיקרוגרם / מ"ל Hoechst 33342.
- דגירה את המתלים התא ב 37 °C (69 °F) במשך 15 דקות. לאחר הדגירה, להעביר את המתלים התא לתוך צינור 5 מ"ל דרך כובע מסננת התא. לשטוף את מכסה מסננת התא עם תוספת של 400 μL של מאגר תחזוקה haESC, ולאסוף את התאים הנותרים באותו צינור 5 מ"ל. שמור על הצינור ב 4 מעלות צלזיוס עד מוכן למיין.
- הגדר ציטומטר זרימה עם זרבובית 100 מיקרומטר על פי הוראות היצרן.
הערה: Hoechst 33342 ניתן לזהות על ידי עירור ב 405 ננומטר. כאן, לייזר UV 355 ננומטר משמש לגילוי של Hoechst 33342. - הגדר את השעיית התא (משלב 5.3) וצינור חדש של 15 מ"ל המכיל 2 מ"ל של מאגר תחזוקת haESC כדי לאסוף תאים ממוינים בציטומטר הזרימה.
- התחל את הניתוח והגדר את שער המיון כדי לאסוף תאי הפלואיד בשלב G1/S. עיין בהיסטוגרמה באיור 2A לזיהוי אוכלוסיית הפאזה phaESC של שלב G1/S.
הערה: קווי phaESC תת-משוכפלים מסוימים עשויים שלא להכיל תאים הפלוידים עקב דיפלודיזציה מלאה או ציפוי שגוי של תאים דיפלואידים בשלב 2. אם תאי הפלואיד אינם נצפו בשלב G1/S, המשך לדגימה אחרת ללא מיון. במקרה שלנו, 5 קווי תאים הכילו תאי הפלואיד ו -3 קווי תאים הכילו רק תאים דיפלואידים מתוך 8 קווי phaESC משוכפלים. - לאחר מיון התא, להוסיף 5 מ"ל של חוצץ לשטוף לאורך הקיר של צינור איסוף 15 מ"ל. צנטריפוגה הצינור ב 160 x g במשך 5 דקות. הסר את העל-טבעי.
- בחר צלחת בגודל מתאים עבור culturing בהתאם למספר התאים ממוינים. השתמש בבאר אחת של צלחת של 96 באר, צלחת של 24 בארות וצלחת של 12 בארות לתרבות של 1,000-40,000 תאים, 40,000-200,000 תאים ו-200,000-400,000 תאים, בהתאמה. Resuspend גלולת התא ב 120 μL, 600 μL, ו 1.2 מ"ל של מדיום haESC, בהתאמה.
הערה: צלחת התאים בצפיפות גבוהה כי מפגש נמוך יכול לגרום למוות תאים של התאים לאחר המיון. מנקודה זו ואילך, phaESCs מתורבתים על בארות מצופות ג'לטין ללא MEFs כדי להקל על genotyping בשלב 6 ואת היישום הבא עבור הזרקה intracytoplasmic משלב 9. - לאחר העברת המתלה התא לתוך באר מצופה ג'לטין בגודל המתאים, דגירה את הצלחת ב 37 °C (69 °F) באווירה 5% CO2.
- המשך להרחיב את תרביות ה- phaESC על-ידי חזרה על שלבים 3.18 עד 3.21 עם הגדלת גודל הלוח והגדלת כמויות גדולות של טריפסין, חוצץ שטיפה ובינוני haESC. התאים מתורבתים על בארות מצופות ג'לטין ללא MEFs.
- עבור כל קו phaESC תת-משוכפל, הכינו תרבות בבאר אחת של צלחת של 24 באר ובבאר אחת של צלחת 6 בארות לשלבים 6 ו-9, בהתאמה.
הערה: תאים מסוימים של כל קו phaESC משוכפל יש להקפיא ב 300 μL של מדיום הקפאה כמו cryostock במיכל אחסון חנקן נוזלי לפני שתמשיך לשלב 9.
6. genotyping השני של קווי phaESC משוכפלים ללא MEFs
הערה: סבב שני של genotyping מבוצע כדי לאשר כי שורות phaESC משוכפל משנה יש מחיקות של H19- ו- IG-DMRs, וכי אללים wildtype נעדרים לאחר הסרת MEFs.
- אשרו תחת המיקרוסקופ שהתרביות בבארות של 24 בארות משלב 5.11 חופשיות מ- MEFs.
הערה: אם MEFs נצפו, יש צורך להמשיך להעביר את התרבויות עד MEFs נעלמו כדי למנוע זיהום PCR עם DNA wildtype מ- MEFs. - לשאוף את המדיום מתרבויות confluent ולהוסיף 400 μL של מאגר תמוגה לכל באר של צלחת 24-well. לאחר pipeting מספר פעמים, להעביר את המתלה התא לצינור 1.5 מ"ל.
- דגירה צינור 1.5 מ"ל ב 55 מעלות צלזיוס עבור 3 שעות עם ערבוב.
- לאחר הדגירה, מוסיפים 400 μL של isopropanol לצינור 1.5 מ"ל, ומערבבים בעדינות עד משקע DNA הופך גלוי.
- צנטריפוגה הצינור ב ≥ 10,000 x g במשך 5 דקות ולהסיר את supernatant. לשטוף את גלולת ה-DNA עם 200 μL של 70% אתנול.
- צנטריפוגה הצינור ב ≥ 10,000 x g במשך 5 דקות ולהסיר את supernatant.
- יבש את הצינור באוויר במשך 10 דקות ולאחר מכן resuspend את ה- DNA ב 50 μL של מים.
- בצע את ה- PCR genotyping לאחר שלב 4.7 ואלקטרופורזה ג'ל בשלב 4.8 כדי לזהות קווי תאים, אשר יש מחיקות של H19- ו- IG-DMRs והם חופשיים אללים wildtype.
הערה: תמונה של ניתוח גנוטיפינג שני טיפוסי מוצגת באיור 2B לעיון. במקרה שלנו, כל 5 קווי התאים שנבחרו לאחר טיהור תאי הפלואיד (שלב 5) היו חופשיים מאללים מסוג פראי והיו ברשותם רק את אללי המחיקה של H19- ו- IG-DMRs. - השתמש בשורות phaESC משוכפלות המשנה שנבחרו לאחר genotyping השני הזה כמו קווי DKO-phaESC.
7. ביוץ של עכברים
- לייצור ביציות MII, ליזום ביוץ על ידי הזרקה תוך-פרטית של 5 יחב"ל של סוסה בהריון סרום גונדוטרופין (PMSG) פתרון לתוך כל עכבר B6D2F1 נקבה (4-5 שבועות) 63-65 שעות לפני אוסף ביציות.
הערה: זן העכבר B6D2F1 מומלץ עבור פרוטוקול זה כי ביציות B6D2F1 לסבול הזרקה תוך-טופלסמית היטב ולהראות פוטנציאל התפתחותי גבוה לאחר ההליך17. - ארבעים ושמונה שעות לאחר הזרקת PMSG, להזריק תוך-פרטית 5 IU של פתרון גונדוטרופין כוריוני אנושי לתוך כל עכבר.
8. אוסף ביצית
- הכן צלחת 4-well המכיל 700 μL של מדיום hyaluronidase בבאר אחת ו 700 μL של מדיום M2 בשאר 3 בארות. בנוסף, הכינו מנה של 6 ס"מ עם 7 מ"ל בינונית ומנה במרכז באר עם 900 μL של מדיום M16. מחממים מראש את הצלחת והמנות ב-37 מעלות צלזיוס באווירה של 5% CO2.
- ביום ההזרקה intracytoplasmic, המתת הנקבות סופר ביוץ (משלב 7.2) על ידי נקע בצוואר הרחם או שאיפת CO2 בסביבות 8 בבוקר. לנתח את oviducts באמצעות פינצטה ומספריים. מניחים את oviducts בצלחת 6 ס"מ עם M2 בינוני.
- שחרר את קומולוס-ביצית קומפלקסים (COCs) על ידי קריעת ampulla של oviducts עם מחט 30 גרם. העבר COCs לתוך בינוני hyaluronidase מחומם מראש ולשמור על 37 °C (70 °F) באווירה 5% CO2.
- לאחר 2-3 דקות, לאסוף ביציות ללא קומולוס עם פיפטה בפה ולשטוף את ביציות 3 פעמים על ידי העברתם למדיום M2 טרי ב 3 בארות אחרות של צלחת 4-well.
- לאסוף מטפזה II (MII) ביציות, אשר בעלי גופי הקוטב הראשון, בצלחת מרכז היטב עם M16 בינוני ולשמור את הצלחת ב 37 °C (70 °F) ב 5% CO2 אטמוספרה עד לשימוש עבור הזרקה intracytoplasmic בשלב 12.
9. טיפול ואיסוף של DKO-phaESCs
- הכינו תרבות DKO-phaESC בבאר של צלחת של 6 בארות ללא MEFs ב-60-80% מפגש יום לפני ההזרקה תוך-טופלסמית (משלב 5.11).
- כדי לגרום למעצר מחזור התא M-שלב, לשאוף את המדיום לחלוטין ולהוסיף 2 מ"ל של מדיום haESC המכיל 0.05 מ"ג / מ"ל demecolcine.
- לאחר 8 שעות של טיפול demecolcine, לשאוף את המדיום ולהוסיף 800 μL של טריפסין.
- דגירה את הצלחת ב 37 מעלות צלזיוס באווירה 5% CO2 במשך 5 דקות, ולאחר מכן להוסיף 2 מ"ל של חוצץ לשטוף כדי להרוות את טריפסין, פיפטה מספר פעמים כדי לקבל השעיה של תא יחיד.
- להעביר את השעיית התא לתוך צינור 15 מ"ל. צנטריפוגה הצינור ב 160 x g במשך 5 דקות ולהסיר את supernatant.
- Resuspend גלולת התא ב 400 μL של מאגר תחזוקה haESC המכיל 15 מיקרוגרם / מ"ל Hoechst 33342.
- דגירה את התא השעיה ב 37 °C (69 °F) ב 5% CO2 אווירה במשך 15 דקות. לאחר הדגירה, להעביר את השעיית התא לתוך צינור 5 מ"ל דרך כובע מסננת התא, ולשמור על הצינור ב 4 מעלות צלזיוס עד מיון התא בשלב 10.
10. טיהור של DKO-phaESCs שנעצרו בשלב M
- הגדר ציטומטר זרימה עם זרבובית 100 מיקרומטר על פי הוראות היצרן.
הערה: Hoechst 33342 ניתן לזהות על ידי עירור ב 405 ננומטר. כאן, לייזר UV 355 ננומטר משמש לגילוי של Hoechst 33342. - הגדר את DKO-phaESCs שנעצרו בשלב M-phase משלב 9.7 והתחל את הניתוח. בחר שער מיון מתאים לאיסוף תאי שלב M haploid (2n) מהמדגם שטופלו demecolcine.
הערה: לאחר טיפול בדקולצין, צפויות 2 אוכלוסיות תאים, המתאימות לתאי הפלואיד והתעודה M-phase שנעצרו כפי שמוצג באיור 3B. מעצר מחזור התא לאחר טיפול demecolcine הושלם, ובכך, אין פסגת DNA 1n haploid נצפתה. זה חשוב כמו תאי שלב M haploid ותאי G1 דיפלואידים בעלי אותו תוכן DNA (2n) ויפיק פסגות חופפות. - הגדר צינור 15 מ"ל המכיל 2 מ"ל של מאגר תחזוקת haESC כדי לאסוף את התאים הממוינים בציטומטר הזרימה. התחל מיון תאים.
- לאחר מיון התא, להוסיף 5 מ"ל של חוצץ לשטוף לאורך הקיר של צינור האיסוף. צנטריפוגה הצינור ב 160 x g במשך 5 דקות ולהסיר את supernatant.
- השהה מחדש את התאים בנפח מתאים של מאגר תחזוקת haESC כדי להשיג ריכוז סופי של 5 x 105 תאים / מ"ל.
- להעביר את השעיית התא לתוך צינור 1.5 מ"ל. שמור את הצינור על הקרח עד מוכן להזרקה intracytoplasmic בשלב 12.
11. הכנת פיפטות החזקה ומיקרו-נדיקציה
הערה: לביצוע הזרקה תוך-טופלסמית (שלב 12), נדרשות מספר פיפטות אחזקה ומיקרו-ג'ינג' (איור 4A). פיפטות אלה ניתן לרכוש על פי דרישה מותאמת אישית מספק מסחרי או עשוי נימי זכוכית מתאימים באמצעות מושך micropipette ו microforge.
- משוך נימי זכוכית בורוסיליקט על פולר מיקרופיפט. כדי למשוך נימי זכוכית borosilicate ללא חוטים (0.78 x 1.00 x 80 מ"מ) הפרמטרים הבאים ניתנים עבור מושך אופקי בוער(טבלה של חומרים)כהפניה, אבל יהיה שונה עבור מכשירים אחרים וסוגי נימי זכוכית: חום 510 (מבחן רמפה 480), למשוך 0, מהירות 150, זמן 175 ולחץ 200 להחזקת פיפטות; חום 510 (מבחן רמפה 480), משיכה 90, מהירות 140, זמן 125 ולחץ 200 עבור פיפטות microinjection.
הערה: הפרמטרים האופטימליים צריכים להיות מוגדרים בנפרד כי מספר גורמים כולל לחות, המודל של מושך micropipette והרבה נימי זכוכית יכול להשפיע על הצורה של פיפטות הזרקה. צורה מוארכת עם התחדדות הדרגתית צריכה להיות מכוונת. - הכנת החזקת פיפטות
- הגדר נימי משך אחד מוכן בשלב 11.1 למיקרופורג'. מניחים את נימי על חרוזי הזכוכית על חוט להנמיך את נימי כדי ליצור קשר עם חרוז הזכוכית תוך חימום חוט.
- לשבור את נימי על ידי כיבוי החימום וניתוק מן חרוז הזכוכית כך הקוטר החיצוני שלה הוא 60-100 מיקרומטר.
- מקם את הקצה נימי אופקית כדי להתמודד עם חרוז הזכוכית על חוט הים.
- מחממים את הסיב כדי לאפשר לקוטר הפנימי של הקצה נימי להמיס לקוטר של 10-20 מיקרומטר.
- להזיז את נימי כך חרוז זכוכית עמדות בנקודה ~ 1 מ"מ מן הקצה נימי ללא מגע. מחממים את חוט הים כדי לאפשר נימי להתכופף בזווית של 20°. להוריד את נימי, נקרא פיפטה מחזיקה, מהמיקרופורג'.
הערה: כדי למדוד את גודל נימי, רטיקל עינית מותקן רצוי microforge.
- הכנת פיפטות מיקרו-טין
- הגדר נימי משך אחד מוכן בשלב 11.1 למיקרופורג'. מניחים את נימי על חרוזי הזכוכית על חוט להנמיך את נימי כדי ליצור קשר עם חרוז הזכוכית תוך חימום חוט.
- לשבור את נימי על ידי כיבוי החימום וניתוק מן חרוז הזכוכית בתנוחה כי הקוטר החיצוני שלה הוא 6 מיקרומטר.
- להזיז את נימי כך חרוז זכוכית עמדות בנקודה ~ 1 מ"מ מן הקצה נימי ללא מגע. מחממים את חוט הים כדי לאפשר נימי להתכופף כלפי מעלה בזווית של 20°. בטל את טעינת המיקרו-אינג'ינג פיפטה מהמיקרו-פורג' ואחסן בתיבה מאובטחת לשימוש מאוחר יותר.
הערה: פיפטות microinjection מוכנים עם המפרטים הבאים: קוטר חיצוני, 6 מיקרומטר; קוטר פנימי, 4.5-5 מיקרומטר; זווית כיפוף, 20 מעלות. הגדרת העיצוב האופטימלי של פיפטה microinjection חשוב להצלחת הזרקת intracytoplasmic. קוטר פנימי גדול מדי יכול למנוע את הקריעה של קרום הפלזמה של DKO-phESCs התורם (ראה סעיף דיון). אם הקוטר הפנימי צר מדי, זה יכול לעכב pipetting חלקה של DKO-phESCs התורם. זווית כיפוף < 30° עדיפה כמו זווית עיקול גבוהה מעכבת את ההשפעה של פולסים piezo.
12. הזרקה תוך-טופלסמית של DKO-phaESCs
- לפני הזרקת intracytoplasmic (משלב 12.2), להכין פתרון polyvinylpyrrolidone (PVP) על ידי הוספת 5 מ"ל של מדיום M2 לתוך צינור 50 מ"ל המכיל 0.6 גרם של PVP ומתסיס את הצינור על נדנדה ב 4 מעלות צלזיוס במשך 2 ימים. לאחר שה-PVP התפוגג לחלוטין, הפתרון מסונן סטרילי ומאוחסן ב-4 מעלות צלזיוס.
- ביום ההזרקה התוך-טופלזמית, הכינו מנה במרכז באר עם 900 μL של KSOM בינוני וחם מראש את המנה ב-37°C באווירה של 5% CO2.
- הכינו צלחת מיקרומניפולציה על ידי יישור טיפות של 5 μL של פתרון PVP ו 20 μL של מדיום M2 על מכסה של צלחת 10 ס"מ כי הוא ממוקם במהופך. מכסים את הטיפות בשמן מינרלי ומניחים את המנה על במת המיקרוסקופ של ההזרקה.
הערה: הסידור המומלץ של מנת המיקרומניפולציה מוצג באיור 4B. - התקן פיפטה מחזיקה על המיקרומניפולטור. מלאו את המיקרו-אינג'קטור פיפטה בשמן הפלואורוקרבון בעזרת קצה מיקרו-מטען, והרכיבו אותו על מפעיל הפיזו.
- לטבול את פיפטה microinjection בירידה עם פתרון PVP פיפטה למעלה ולמטה מספר פעמים כדי לצפות את הזכוכית עם PVP ולהפוך אותו פחות דביק. לטעון נפח קטן של פתרון PVP לתוך פיפטה microinjection, ולהעביר את פיפטה לירידה עם M2 בינוני.
- לטבול את פיפטה מחזיק במדיום M2, ולהתמקד פיפטה בחלק התחתון של הירידה.
- העבר כ 2 μL של השעיית DKO-phaESC משלב 10.6 לתוך טיפה בינונית M2.
- העבר 10 ביציות MII משלב 8.5 לאותה טיפה בינונית M2 באמצעות פיפטה בפה.
- להזרקה, סובבו ביצית בירידה הבינונית M2 כך שמרחב הצמיגים יפונה אל פיפט המיקרו-אינג'קציה, ולוחית ה-MII לא תמוקם בנתיב של פיפטה המיקרו-אינג'רטי(איור 4A). החזק את ביצית על ידי הפעלת לחץ שלילי דרך פיפטה מחזיק.
הערה: לוח MII מזוהה חזותית כבליטה של ooplasm המכונה "דבשת" ולעתים קרובות ממוקם ליד גוף הקוטב הראשון. לוחית ה-MII מכילה ציר מיוטי עם כרומוזומים מחוברים. נגיעה של פיפטה microinjection ואת צלחת MII יש להימנע כמו נזק מכני של ציר כרומוזומים יכול לשבש את התפתחות העובר. - טען DKO-phaESC אחד לקצה פיפטה microinjection על ידי הפעלת לחץ שלילי עדין. קרע את קרום הפלזמה של DKO-phaESC על ידי pipetting כדי למנוע הזרקה של DKO-phaESC שלם (איור 3C; ראה דיון).
הערה: במקרה קרום הפלזמה של DKO-phaESC אינו נקרע על ידי pipetting, להשליך את DKO-phaESC ולטעון אחר DKO-phaESC. - מניחים את פיפטה microinjection במגע עם pellucida zona של ביצית, ולהחיל כמות קטנה של לחץ שלילי בתוך פיפטה microinjection.
- החל דחפי פיזו (עוצמה, 20; תדירות, 4) כדי לפרוץ את ה zona תוך דחיפת קצה פיפטה microinjection לכיוון החלל perivitelline. ודא כי צלחת MII, המכיל ציר וכרומוזומים, אינו ממוקם בנתיב של פיפטה microinjection.
הערה: להתאים באופן אמפירי את ההגדרה לפולסים piezo הנמוך ביותר עבור קידוח דרך zona כדי למזער את האפשרות של נזק oolemma. - השלך את השבר של pellucida zona מן פיפטה microinjection, ולמקם את DKO-phaESC בקצה פיפטה.
- לחדור את ביצית עם פיפטה microinjection כך oolemma מגיע לצד הנגדי.
הערה: אין לגעת בצלחת ה-MII כדי למנוע נזק לציפוי וכרומוזומים. - החל דופק פיזו (אינטנסיביות, 6; תדירות, 1) כדי לנקב את oolemma. ודא כי oolemma מרגיע לאורך הפיר של פיפטה microinjection.
הערה: הגדר באופן אמפירי את ההגדרה הנמוכה ביותר של פעימת הפיזו לשבירת ה-oolemma כדי למזער את הנזק לבוצית. - הזרק את DKO-phaESC עם נפח מינימלי של מדיום לתוך ooplasm, ולמשוך את פיפטה microinjection בצורה חלקה מן ביצית.
- שחררו את ביצית המוזרקת מהפיפט המחזיקה, והניחו אותה בצד המיקרו-דרופ לאיסוף מאוחר יותר.
- חזור על הליך ההזרקה משלבים 12.9 עד 12.17 עבור ביציות MII האחרות בירידה הבינונית M2.
הערה: הימנעו מהשארת ביציות מחוץ לאינקובטור למשך יותר מ-20 דקות. מניסיוננו, ניתן לתמרן קבוצה של 10 ביציות בנוחות תוך 15 דקות לאחר אימון מתאים. - מעבירים את האצווה של ביציות מוזרקות מהטיפה הבינונית M2 לצלחת מרכז-באר מחוממת מראש עם מדיום KSOM.
- שמור את המנה במשך 1 שעה ב 37 מעלות צלזיוס באווירה 5% CO2.
- חזור על מניפולציית ביציות משלבים 12.5 ו- 12.20 עם קבוצות נוספות של ביציות MII כדי להשיג מספיק ביציות מוזרקות.
13. הפעלה של עוברים משוכפלים למחצה בנויים
- הכינו שתי מנות במרכז באר עם 900 μL כל אחד בינוני KSOM ובינוני הפעלה. הכינו צלחת של 4 בארות עם 700 μL של מדיום KSOM בכל באר. מחממים מראש את הכלים ואת הצלחת ב 37 מעלות צלזיוס באווירה 5% CO2.
- לאחר שעה במדיום KSOM, מעבירים את ביציות מוזרקות משלב 12.21 לתוך צלחת מרכז-באר מחוממת מראש עם מדיום הפעלה.
- שמור את המנה במשך 6 שעות ב 37 מעלות צלזיוס באווירה 5% CO2 להפעלה.
- לאחר ההפעלה, יש להבחין בעוברים משובטים למחצה היוצרים שלושה גופי קוטב, שהם גופי הקוטב הראשון והשני של ביצית, וגוף הקוטב המדומה מ-DKO-phaESC(איור 3E).
- לשטוף את העוברים 3 פעמים על ידי העברת אותם בארות חדשות עם מדיום KSOM בצלחת 4-well.
- מעבירים את העוברים לצלחת הבאר המרכזית עם מדיום KSOM, ושומרים על המנה ב-37 מעלות צלזיוס באווירת CO2 של 5% להמשך פיתוח.
14. פיתוח עוברים בנויים משובטים למחצה
- לאחר יום אחד של תרבות במדיום KSOM משלב 13.6, מספר עוברים משובטים למחצה מגיעים לשלב הדו-תאי(איור 5A).
- להתפתחות נוספת של עוברים טרום-השתלה במבחנה, המשיכו ללטף את העוברים המשובטים למחצה במדיום KSOM ב-37 °C (69 °F) באטמוספרת CO2 5%. מעבירים את העוברים המשובטים למחצה למדיום KSOM טרי ביום השני. ביום הרביעי יגיעו מספר עוברים לשלב ה-blastocyst (איור 5A).
- לניעה של עכברים משובטים למחצה, להעביר עוברים 2 תאים משלב 14.1 לתוך oviducts של נקבות נמען פסאודו בהריון. זהה נקבות בהריון מדומה על ידי הזדווגות לזכרים שעברו כריתת צינור הזרע יום לפני העברת העובר ובחר אותם על בסיס נוכחות של תקע גלוי בבירור בבוקר היום להעברת העובר (0.5 ימים לאחר הזדווגות (dpc)). בסביבות 19.5 dpc, גורים לטווח מלא מועברים באופן טבעי מנקבות המטופל(איור 5B).
תוצאות
מטרת פרוטוקול זה היא להחיל haESCs כתחליף של זרע כדי להשיג עוברים משובטים למחצה ועכברים. למטרה זו, קו DKO-phaESC הנושא את טרנסג'ין CAG-EGFP נוצר ושימש להזרקה תוך-טופלסמית לתוך ביציות MII. כדי להשיג קו phaESC מתאים עם תצורת חותם אבהי, ביצענו הנדסה גנטית באמצעות גרעיני Cas9. קו ESC haploid מכיל תאים haploid ו diploid המתעוררים בשל נטייה אינהרנטית של ESCs haploid עבור דיפלודיזציה10. סט כרומוזום הפלואיד הוא תנאי מוקדם להחלפה מוצלחת של גנום הזרע. ניתוח תוכן דנ"א לפי ציטומטריית זרימה מראה את התפלגות תאי הפלואיד והדיפלויד בשלבי G0/G1, S ו-G2/M(איור 2A).
כדי להקים את קווי DKO-phaESC, קווי phaESC מסוג פראי היו מצטלבים עם מבנים transposon piggyBac עבור ביטוי EGFP מהונדס יציב עם CRISPR / Cas9 פלסמידים להשגת מחיקות של H19- ו- IG-DMRs. כדי לא לכלול ESCs דיפלואיד ולבודד רק ESCs haploid המבטא EGFP, שער מיון ספציפי הוגדר (איור 2A). תאים יחידים EGFP חיוביים היו אז מצופה לתוך בארות בודדות של לוחות 96-באר כדי להשיג שיבוטים תת. מאכילי MEF שימשו להגברת יעילות הציפוי והישרדותם של ה-phaESCs המוחצנים. לאחר הרחבת התרבויות, סבב ראשוני של genotyping בוצע על ידי PCR כדי לזהות שיבוטים משנה הנושאים מחיקות של שני DMRs. לאחר שמאכילי MEF הוסרו מהתרבויות, בוצע גנוטיפינג שני כדי לאשר את היעדרם של אללים פראיים ב- H19- ו- IG-DMRs (איור 2B). מתוך סך של 135 שיבוטים משנה, השגנו 5 קווי DKO-phESC haploid שנשאו את האללים שנמחקו היו חופשיים של אללים wildtype הן של H19-DMR ו IG-DMR.
טרנסג'ין CAG-EGFP הוכנס לתוך DKO-phaESCs כדי ללמוד את תרומתם לעוברים משובטים למחצה על ידי הדמיה של פלואורסצנטיות ירוקה תחת מיקרוסקופ (איור 3A). להזרקה תוך-טופלסמית, DKO-phaESCs טופלו עם demecolcine לעצור אותם בשלב M. לכן, מחזור התא של DKO-phaESCs היה מסונכרן עם זה של ביציות MII. ניתוח ציטומטריה זרימה הראה 2 אוכלוסיות המתאימות לשלב G2/M נעצר haploid (2n) ותאי דיפלואיד (4n) לאחר הטיפול עם demecolcine (איור 3B). היעדר שיא 1n haploid הצביע על כך מעצר מחזור התא הושלם במידה רבה. לאחר מכן מוינו והוזרקו ESCs של הפלואיד שלב M לתוך ביציות. לצורך כך, DKO-phaESC יחיד נטען לתוך פיפטה microinjection והוזרק לתוך הציטופלסמה של ביצית MII(איור 3C). קרום הפלזמה של DKO-phaESC נקרע על ידי צינור לקצה פיפטה microinjection.
לאחר ההזרקה, ביטוי EGFP זוהה לעתים רחוקות בעוברים המשובטים למחצה שנבנו כאשר הציטופלסמה של DKO-phaESCs התפזרה בציטופלסמה הגדולה של ביצית(איור 3D). במקרים נדירים, נקודה עגולה של ביטוי EGFP אינטנסיבי ניתן לראות בתוך ooplasm. תצפית זו נגרמה ככל הנראה על ידי הזרקה לא מכוונת של DKO-phaESCs שלמים. כישלון לקרוע את קרום התא DKO-phaESC סביר שאינו תואם להתפתחות עובר נוספת ויש להימנע ממנו. שעה לאחר ההזרקה, עוברים הופעלו על ידי טיפול עם סטרונציום כלוריד18. שש שעות לאחר תחילת ההפעלה נצפו עד 3 גופי קוטב מתחת למיקרוסקופ (איור 3E). גופי קוטב אלה תואמים לגופי הקוטב הראשון והשני של ביצית וגוף קוטב מדומה מן DKO-phaESC7. בנוסף, שני pronuclei נצפו תחת מיקרוסקופ ניגוד הפרעה דיפרנציאלית, אשר דמה לשלב pronuclear של זיגוטים לאחר הפריה נורמלית עם זרע.
כדי להפגין יכולת התפתחותית, עוברים משובטים למחצה היו בתרבית לשלב בלסטוציסט(איור 5A). יתר על כן, עכבר לטווח מלא הושג לאחר העברת עוברים בשלב 2 תאים משובטים למחצה לתוך oviducts של נקבה הנמען (איור 5B). כצפוי, העכבר הנגזר מעובר משובט למחצה היה נקבה, שכן לא ביציות ולא phaESCs שמקורם ביציות נושאים כרומוזום Y. העכבר המשובט למחצה היה רגיל באופן גלוי והפיק צאצאים בריאים כאשר הזדווג עם זכר וובסטר שוויצרי פראי. עד עכשיו, העכבר המשובט למחצה חי כבר יותר מ-600 יום ללא בעיות בריאותיות לכאורה.
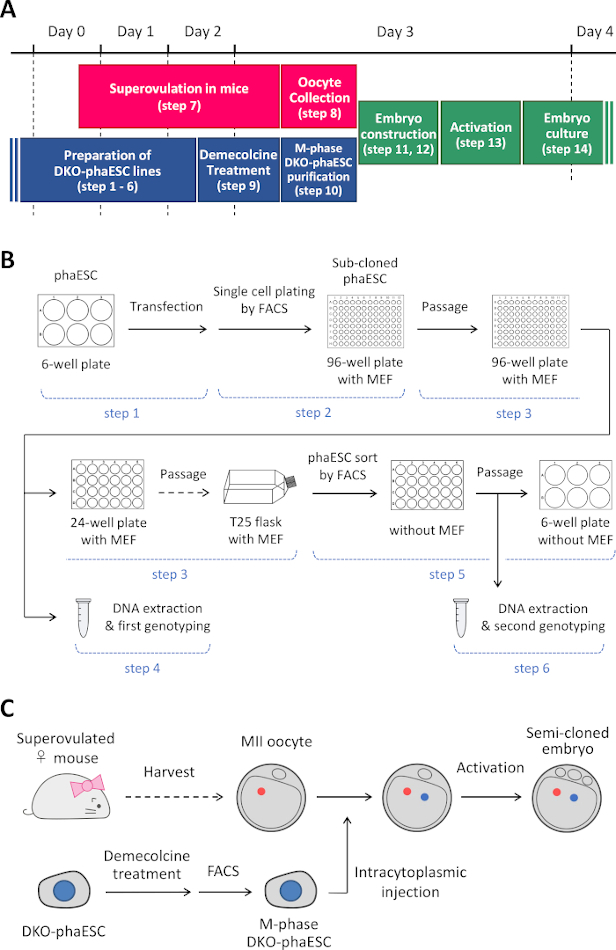
איור 1: מבט כולל על היישום של DKO-phaESCs כתחליף זרע. (A) מסגרת זמן של ההליכים של הפרוטוקול. (ב)הערכה מציגה את השלבים להקמת קווי DKO-phaESC (שלבים 1-6). (C) התוכנית מציגה את השלבים לבניית עוברים משובטים למחצה על ידי הזרקה תוך-טופלזמית של DKO-phaESC לתוך ביצית MII (שלבים 7-14). קיצורים: DKO = נוקאאוט כפול; phaESC = תא גזע עוברי הפלואידי פרתוגנטי; FACS = מיון תאים המופעל על-ידי פלואורסצנטיות; MEF = פיברובלסט עוברי עכבר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
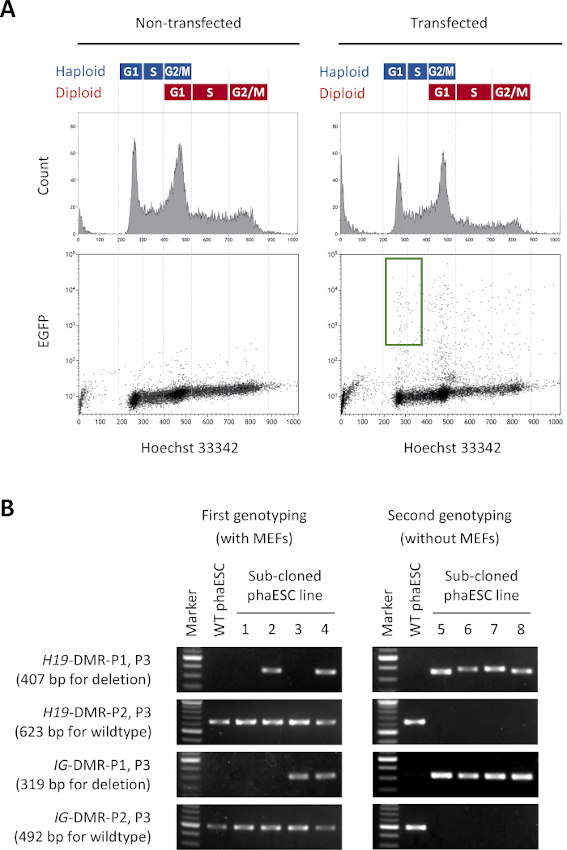
איור 2: הקמת קווי DKO-phaESC על ידי מחיקות בתיווך CRISPR/Cas9 של H19- ו- IG-DMRs. (A) ניתוח ציטומטריה זרימה של phaESCs לאחר transfection עם פלסמידים piggyBac עבור ביטוי EGFP יציב עם 4 CRISPR / Cas9 פלסמידים. מחשבי PHAESCs שאינם מוחצנים מוצגים כפקד. פרופיל ה- DNA (למעלה) מראה את התפלגות מחזור התא של תאי הפלואיד והתעודה. תאי הפלואיד שלב G1/S המבטאים EGFP מסומנים על-ידי השער הירוק (למטה, מימין). (B)Genotyping של שיבוטים תת-phaESC שגודלו על MEFs (genotyping הראשון) ולאחר הסרת MEFs (genotyping השני). שורות phaESC משוכפלות משנה 1, 2, 3 ו- 4 מייצגות תאים סוג בר, תאים עם מחיקת H19-DMR, עם מחיקת IG-DMR, ועם מחיקות משולבות של H19- ו- IG-DMR, בהתאמה. קווי DKO-phaESC 5-8 מחזיקים הן במחיקות H19-DMR והן מחיקות IG-DMRוהם חופשיים מאללים פראיים. קיצורים: DKO = נוקאאוט כפול; phaESC = תא גזע עוברי הפלואידי פרתוגנטי; DMR = אזור מתילציה דיפרנציאלי; MEF = פיברובלסט עוברי עכבר; EGFP = חלבון פלואורסצנטי ירוק משופר; WT = סוג פראי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
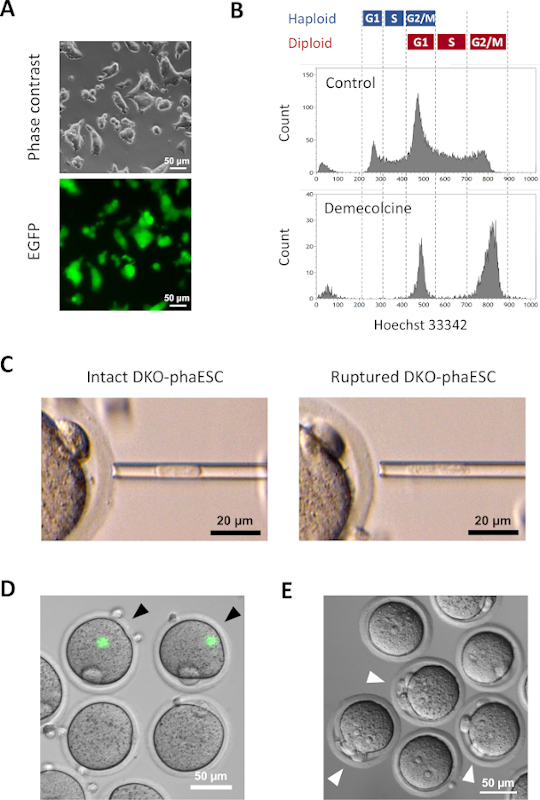
איור 3: הזרקה של DKO-phaESCs שנעצרו באופן מיטוטי לתוך ביציות MII. (A)מורפולוגיה של תרבות DKO-phaESC הנושאת טרנסג'ין CAG-EGFP ומחיקות של H19- ו- IG-DMRs; סרגל קנה מידה = 50 מיקרומטר. (B) ניתוח cytometry זרימה ייצוגית של DKO-phaESCs לאחר מעצר עם demecolcine עבור 8 h. DKO-phaESCs ללא טיפול demecolcine מוצגים כשליטה. (C)מורפולוגיה של DKO-phaESCs בפיפט microinjection. DKO-phaESC שלם יחיד לפני (שמאל) ואחרי (ימין) קרע קרום הפלזמה על ידי pipetting מוצג; סרגל קנה מידה = 20 מיקרומטר. (D) עוברים בנויים בשעה אחת לאחר הזרקת DKO-phaESCs לתוך ביציות MII. מוצגת תמונה ממוזגת של פלואורסצנטיות EGFP ושדה בהיר. ראשי חץ שחורים מציינים כתמים עגולים של ביטוי EGFP אינטנסיבי לאחר הזרקה של DKO-phaESCs שלמים, אשר יש להימנע; סרגל קנה מידה = 50 מיקרומטר. (E) תמונת ניגודיות הפרעה דיפרנציאלית של עוברים משובטים למחצה 6 שעות לאחר תחילת ההפעלה עם סטרונציום כלוריד מוצג. ראשי חץ לבנים מצביעים על עוברים עם 3 גופי קוטב כולל גוף קוטב מדומה אחד מ- DKO-phaESC המוזרק; סרגל קנה מידה = 50 מיקרומטר. קיצורים: DKO = נוקאאוט כפול; phaESC = תא גזע עוברי הפלואידי פרתוגנטי; EGFP = חלבון פלואורסצנטי ירוק משופר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
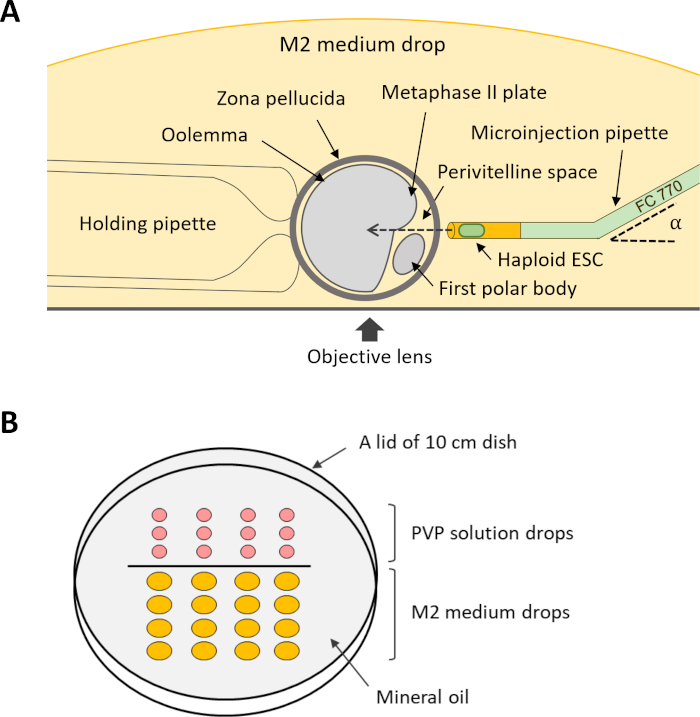
איור 4: ערכת ההתקנה להזרקה תוך-טופלסמית של DKO-phaESCs לתוך ביציות. (A)הסידור של פיפטה הזרקה, פיפטה מחזיקה, וביצית בתא ההזרקה מוצג. α, לכופף את הזווית של פיפטה microinjection. (B)פריסת הטיפות בצלחת המיקרומניפולציה להזרקה תוך-טופלסמית. קיצורים: DKO = נוקאאוט כפול; phaESC = תא גזע עוברי הפלואידי פרתוגנטי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
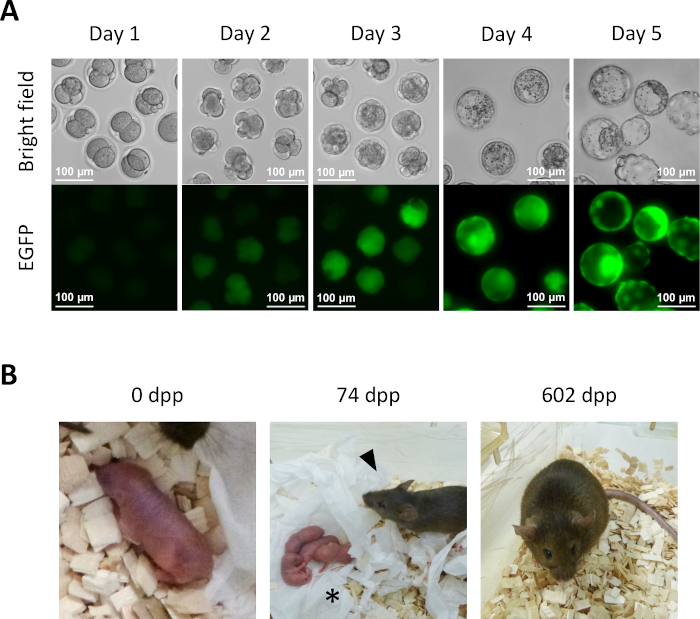
איור 5: התפתחות עוברים משובטים למחצה. (A)פיתוח קדם-השתלה של עוברים משובטים למחצה במבחנה. ביטוי EGFP נצפתה בתחילה בעוברים של ארבעה תאים ביום 2 לאחר הזרקה תוך-תאית. ביום 4, ביטוי EGFP אינטנסיבי ניתן לראות blastocysts; סרגל קנה מידה = 100 מיקרומטר. (B) עכבר משובט למחצה שהושג לאחר העברת עובר דו-תאי לנקבת נמען. בגיל 74 dpp, העכבר המשובט למחצה (ראש חץ) יילד את הגורים הראשונים שלה (כוכבית) על ידי לידה טבעית לאחר הזדווגות עם זכר וובסטר שוויצרי פראי. עוברים משובטים למחצה והעכבר המשובט למחצה המוצג באיור זה זהים לאלה שדווחו ב- Aizawa et al.3. קיצורים: EGFP = חלבון פלואורסצנטי ירוק משופר; .dpp, ימים לאחר לידה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| תמיסת ג'לטין | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| מים | - | 500 מ"ל | - |
| ג'לטין | - | 1 גרם | 0.2% |
| תא גזע עוברי הפלויד (HaESC) בינוני | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| NDiff 227 | - | 10 מ"ל | - |
| צ'יר 99021 | 10 מ"מ | 3 מיקרומטר | 3 מיקרומטר |
| PD 0325901 | 10 מ"מ | μL אחד | μM אחד |
| תעודת LIF | 1 x 106 זל"ל/מ"ל | 10 μL | 1,000 ת"ל/מ"ל |
| פניצילין-סטרפטומיצין | 100x | 100 μL | פי 1 |
| מאגר תחזוקה של HaESC | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| מדיום האסC | - | 1 מ"ל | - |
| פתרון HEPES | 1 מ' | 20 μL | 20 מ"מ |
| מאגר שטיפה | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| DMEM / F-12 | - | 100 מ"ל | - |
| שבר BSA | 7.5% | 7.1 מ"ל | 0.5% |
| מדיום MEF | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| DMEM | - | 500 מ"ל | - |
| FBS | - | 56 מ"ל | 10% |
| β-מרקפטותנול | 14.3 מול/ל' | 3.9 μL | 100 מיקרומטר |
| פניצילין-סטרפטומיצין | 100x | 5.6 מ"ל | פי 1 |
| מאגר תמוגה | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| מים | - | 8.25 מ"ל | - |
| טריס-HCl (עמ' 8.5) | 1 מ' | 1 מ"ל | 100 מ"ר |
| אדטה (EDTA) | 0.5 מטר | 100 μL | 5 מ"מ |
| פתרון SDS | 10% | 200 μL | 0.2% |
| נקלה (נקל) | 5 מטר | 400 μL | 200 מ"מ |
| פרוטאין קיי | 20 מ"ג/מ"ל | 50 μL | 100 מיקרוגרם/ מ"ל |
| מדיום הפעלה | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| KSOM | - | 1 מ"ל | - |
| סטרונציום כלוריד | 1 מ' | 5 μL | 5 מ"מ |
| EGTA (EGTA) | 0.5 M, עמ' 8.0 | 4 μL | 2 מ"מ |
| פתרון PVP | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| מדיום M2 | - | 5 מ"ל | - |
| Pvp | - | 0.6 גר' | 12% |
| פתרון PMSG | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| Pbs | - | 450 μL | - |
| PMSG | 500 זל"ל/מ"ל | 50 μL | 50 10 יגה-ל'/מ"ל |
| פתרון hCG | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| Pbs | - | 450 μL | - |
| Hcg | 500 זל"ל/מ"ל | 50 μL | 50 10 יגה-ל'/מ"ל |
| מדיום היאלורונידדאז | |||
| רכיב | ריכוז מלאי | נפח / משקל | ריכוז סופי |
| מדיום M2 | - | 380 μL | - |
| היולורונידדאז | 10 מ"ג/מ"ל | 20 μL | 0.5 מ"ג/מ"ל |
| קיצורים: LIF = גורם מעכב לוקמיה; MEF = פיברובלסט עוברי עכבר; | |||
| FBS = סרום שור עוברי; DMEM = מדיום הנשר שונה של Dulbecco; BSA = אלבומין סרום שור; | |||
| EDTA = חומצה אתילנדיאמינטית; SDS = נתרן דודקילסולפט; EGTA = אתילן-ביס (אוקסיתילניטרילו)חומצה טטראאצטית; | |||
| PBS = מלוחים עם מאגר פוספט; PVP = פוליווינילפירולידון; hCG = גונדוטרופין כוריוני אנושי; | |||
| PMSG = סוסה בהריון סרום גונדוטרופין. | |||
טבלה 1: מתכון של בינוני, חיץ ופתרון.
| שם | רצף (5' עד 3') | יישום | |
| H19-DMR-P1 | GTG GTT AGT TCT אתא TGG GG | גנוטיפינג (סימן גנוטיפינג) | |
| H19-DMR-P2 | AGA TGG GGT חתול TCT TTT CC | גנוטיפינג (סימן גנוטיפינג) | |
| H19-DMR-P3 | TCT TAC AGT CTG GTC TTG GT | גנוטיפינג (סימן גנוטיפינג) | |
| IG-DMR-P1 | TGT GCA GCA GCA AAG CTA AG | גנוטיפינג (סימן גנוטיפינג) | |
| IG-DMR-P2 | CCA CAA AAA CCT CCC TTT CA | גנוטיפינג (סימן גנוטיפינג) | |
| IG-DMR-P3 | אתא CGA טק GGC AAC CAA CG | גנוטיפינג (סימן גנוטיפינג) | |
| H19-DMR-gRNA1-F | CAC CCA TGA ACT קאג אג אגה CTG | gRNA | |
| H19-DMR-gRNA1-R | AAA CCA GTC TCT TCT איסור פרסום TTC ATG | gRNA | |
| H19-DMR-gRNA2-F | CAC CAG GTG AGA ACC ACT GCT איסור פרסום | gRNA | |
| H19-DMR-gRNA2-R | AAA CCT CAG CAG TGG TTC TCA CCT | gRNA | |
| IG-DMR-gRNA1-F | CAC CCG טק AGA GCT CCA TGG CAC | gRNA | |
| IG-DMR-gRNA1-R | AAA CGT GCC ATG איסור פרסום CTC TGT ACG | gRNA | |
| IG-DMR-gRNA2-F | CAC CCT GCT תג AGG TAC GCT | gRNA | |
| IG-DMR-gRNA2-R | AAA CAG CGT AGT ACC TCT AAG CAG | gRNA | |
טבלה 2: רשימת אוליגונוקלאוטידים.
Discussion
שיבוט של יונקים על ידי העברה גרעינית תא סומטי (SCNT) כבר חלוץ בשנות ה-90 19,20,21. התפתחויות אלה בעקבות מחקרי שיבוט שנערכו 30 שנה קודם לכן דו-חיים22. העיכוב הניכר משקף את הקושי באמברולוגיה ובהטבעה גנומית ביונקים. הפיתוח של SCNT יונקים הוא הבסיס ליישום של haESC להחלפת זרע, אשר מפורט בפרוטוקול זה.
סינכרון מחזור התא הוא גורם חשוב להצלחת SCNT23. זה גם המקרה להזרקה של haESC בפרוטוקול זה. החדרת גנום תורם לנמען דורשת להתאים את שלבי מחזור התא כדי למנוע שבירה כרומוזומלית או aneuploidies שיבטל את התפתחות העובר. שיבוט למחצה יש את המורכבות הנוספת כי שני גנומים ציטופלסט צריך להיות תואם. דו"ח קודם הוכיח כי הזרקה של M-שלב נעצר אנדרוגנטיקה haESCs הניב שיעור התפתחותי טוב יותר של עוברים משובטים למחצה מאשר הזרקה של G1-שלב haESCs לתוך ביציות7. דוח זה מציע M-phase כנקודת סינכרון מתאימה לשכפול למחצה. בהתאם לכך, phaESCs נעצרו במיטוזה עם demecolcine והוזרק לתוך ooplasm של ביציות MII, אשר נעצרו באופן טבעי מטפאאז השני של מיוזיס. חשוב לציין, מעצר שלב M יכול להיות מושגת ב- ESCs העכבר ביעילות גבוהה, מתן סנכרון מעולה בין מחזורי תא התורם הנמען.
במהלך המיטוזיס, הקרום הגרעיני מתפרק וצורות ציר שאליהן מתחברים הכרומוזומים המשוכפלים. לאחר הזרקת DKO-phaESCs שלב M, כרומטידים אחות מופרדים לתוך גוף קוטב מדומה ואת zygote7 (איור 3E). כתוצאה מכך, קבוצה אחת של כרומוזומים מ- DKO-phaESC תורמת לעובר המשובט למחצה. זה קריטי כי כרומטידים אחות של כרומוזומי DKO-phaESC ניתן להפריד כראוי לאחר הזרקה. קרום הפלזמה של DKO-phaESC שלם מונע הפרדה לגוף קוטב מדומה. אכן ראינו מקרים נדירים שבהם קרום הפלזמה של DKO-phaESCs לא נקרע, ועוברים הציגו DKO-phaESCs שלמים באופלזמה לאחר ההזרקה(איור 3D). לכן, יש להקפיד להסיר את קרום הפלזמה של DKO-phaESCs על ידי pipetting. במהלך ההזרקה, חשוב באותה מידה כדי למנוע את ההפרעה של ציר meiotic של ביצית, אשר יכול להוביל פגמים בהפרדה כרומוזום לגרום aneuploidy גם כן.
ביונקים, הטבעה גנומית מגבילה את היישום של phaESCs כתחליף זרע. haESCs הפרתנוגנטיים יש תצורה אימהית של הטבעות גנומיות, ואילו הזרע יש תצורה אבהית. לכן, הדור של גורים לטווח מלא לא התרחשה לאחר הזרקת phaESCs סוג פראי כתחליף זרע. כדי להתגבר על מגבלה זו, מחיקות של IG- ו- H19-DMRs מתוכננות ב- phaESCs. שינוי של ביטוי מוטבע ב Igf2-H19 האימהי ו Gtl2-Dlk1 loci מספיק כדי לשנות את התצורה של הטבעות גנומיות המאפשר הדור של עכברים משובטים למחצה בתדירות של מעל 5.1%, בהתבסס על עוברים 2 תאים שהועברו. תצפיות אלה מצביעות על כך שהתמקדות בשני גנים מוטבעים מעבירה את הגנום של phaESCs לתצורה אבהית תפקודית שיכולה להחליף זרע בעכברים. עם זאת, נדרש שינוי גנטי קבוע של ה- phaESCs עבור אסטרטגיה זו. כאסטרטגיה חלופית, ניתן לשקול haESC אנדרוגנטי. ה-HAESCs האנדרוגנטיים נגזרים מגנום הזרע ובעלי הטבעות אבהיות. היו דיווחים כי haESCs אנדרוגנטיים wildtype תרמו כתחליף זרע כדי ליצור גורים לטווח מלא בתדירות בין 1.3% ו 1.9% של עוברים שהועברו4,7,24. גורים לטווח מלא התקבלו גם על ידי הזרקת haESCs אנדרוגנטיים עם מחיקות של IG- ו H19-DMRs בתדירות של 20.2% של עוברים 2 תאים שהועברו24. היעילות המוגברת של שיבוט למחצה באמצעות haESCs אנדרוגנטית שונה סביר כי הטבעות יכול להיות לא יציב בתרבות. פגמים בהטבעה מתוקנים על ידי מחיקות גנטיות של DMRs קריטיים.
בהתחשב בקושי בהחדרת שינויים גנטיים ישירות לתוך גנום ביצית או זרע, haESCs הם כלי רב ערך למניפולציה הגנום ההורי בנפרד. שימוש ב- haESCs כתחליף לזרע מספק יתרון יוצא דופן לעריכת גנום בחיידק העכבר. מחקר שנערך לאחרונה שילב עריכת גנום מבוסס CRISPR /Cas9 עם היישום של haESCs לאפיון אזורי הטבעה שהם קריטיים להתפתחות עוברית12. מחקר זה ניתח את התפקיד של Rasgrf1-DMR בשילוב עם H19-ו- IG-DMRs בפיתוח של עכברים דו-מטרניים, ואת הפונקציה של 7 DMRs שונים בהתפתחות של עכברים דו-קוטביים. השיטה להחלפת haESCs לזרע היוותה את הבסיס לגישות סינון גנטי לזיהוי חומצות אמינו מרכזיות בתוך חלבון DND1 בהתפתחות תאי נבט ראשוניים ולזיהוי גנים בהתפתחותהעצם 24,25,26. מחקרים על הטבעה גנומית והקרנה גנטית כדי לזהות גורמי מפתח בהתפתחות העוברית הם גישות ניכרות ליישום של haESCs כמו גנומים גמטיים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לד"ר ג'וליו די מינין על הפקת קווי phaESC וד"ר רמו פריימן על ניתוח ציטומטריית זרימה. אנו גם מכירים בגברת מיכל שפנר ומר תומאס מ. הנאק על תמיכה טכנית בהעברת עוברים. עבודה זו נתמכה על ידי הקרן הלאומית למדע של שווייץ (מענק 31003A_152814/1).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mLTube | Eppendorf | 0030 125.150 | haESC culture |
| 15 ml Tube | Greiner Bio-One | 188271 | haESC culture |
| 12-well plate | Thermo Scientific | 150628 | haESC culture |
| 24-well plate | Thermo Scientific | 142475 | haESC culture |
| 6-well plate | Thermo Scientific | 140675 | haESC culture |
| 96-well plate | Thermo Scientific | 167008 | haESC culture |
| β-Mercaptoethanol | Merck | M6250 | haESC culture |
| BSA fraction | Gibco | 15260-037 | haESC culture |
| CHIR 99021 | Axon | 1386 | haESC culture |
| Demecolcine solution | Merck | D1925 | haESC culture |
| DMEM | Gibco | 41965-039 | haESC culture |
| DMEM / F-12 | Gibco | 11320-033 | haESC culture |
| DR4 mouse | The Jackson Laboratory | 3208 | haESC culture |
| EDTA | Merck | E5134 | haESC culture |
| FBS | biowest | S1810-500 | haESC culture |
| Freezing medium | amsbio | 11897 | haESC culture |
| Gelatin | Merck | G1890 | haESC culture |
| Hepes solution | Gibco | 15630-056 | haESC culture |
| Irradiated MEF | Gibco | A34966 | haESC culture |
| LIF (Leukemia inhibitory factor) | (Homemade) | - | haESC culture |
| Lipofection reagent | Invitrogen | 11668019 | haESC culture |
| NDiff 227 | Takara | Y40002 | haESC culture |
| PD 0325901 | Axon | 1408 | haESC culture |
| Pen Strep | Gibco | 15140-122 | haESC culture |
| piggyBac plasmid carrying a CAG-EGFP transgene | Addgene | #40973 | haESC culture |
| piggyBac transposase plasmid | System Biosciences | PB210PA-1 | haESC culture |
| pX330 plasmid | Addgene | #42230 | haESC culture |
| pX458 plasmid | Addgene | #48138 | haESC culture |
| Trypsin | Gibco | 15090-046 | haESC culture |
| DNA polymerase | Thermo Scientific | F549S | Genotyping |
| dNTP Mix | Thermo Scientific | R0192 | Genotyping |
| Ethanol | Merck | 100983 | Genotyping |
| Hydrochloric acid | Merck | 100317 | Genotyping |
| Isopropanol | Merck | 109634 | Genotyping |
| Proteinase K | Axon | A3830 | Genotyping |
| SDS | Merck | 71729 | Genotyping |
| Sodium chloride | Merck | 106404 | Genotyping |
| ThermoMixer | Epeendorf | 5384000012 | Genotyping |
| Tris | Merck | T1503 | Genotyping |
| 5 mL Tube | Falcon | 352063 | Flow cytometry |
| 5 mL Tube with cell strainer cap | Falcon | 352235 | Flow cytometry |
| Hoechst 33342 | Invitrogen | H3570 | Flow cytometry |
| MoFlo Astrios EQ | Beckman Coulter | B25982 | Flow cytometry |
| 1 mL syringe | Codan | 62.1640 | Superovulation |
| 30-gauge 1/2 inch needle | Merck | Z192362-100EA | Superovulation |
| B6D2F1 mouse | The Jackson Laboratory | 100006 | Superovulation |
| hCG | MSD animal health | 49451 | Superovulation |
| PBS | Gibco | 10010015 | Superovulation |
| PMSG | Avivasysbio | OPPA1037 5000 IU | Superovulation |
| 10-cm dish | Thermo Scientific | 150350 | Embryo manipulation |
| 4-well plate | Thermo Scientific | 179830 | Embryo manipulation |
| 50 mL tube | Greiner Bio-One | 227261 | Embryo manipulation |
| 6 cm dish | Thermo Scientific | 150288 | Embryo manipulation |
| Center-well dish | Corning | 3260 | Embryo manipulation |
| Digital rocker | Thermo Scientific | 88880020 | Embryo manipulation |
| EGTA | AppliChem | A0878 | Embryo manipulation |
| Hyaluronidase | Merck | H4272 | Embryo manipulation |
| KSOM | Merck | MR-020P-5F | Embryo manipulation |
| M16 medium | Merck | M7292 | Embryo manipulation |
| M2 medium | Merck | M7167 | Embryo manipulation |
| Mineral oil | Merck | M8410 | Embryo manipulation |
| Glass capillary | Merck | P1049-1PAK | Embryo manipulation |
| Stereomicroscope | Nikon | SMZ745 | Embryo manipulation |
| Strontium chloride | Merck | 13909 | Embryo manipulation |
| 5ml syringe | Codan | 62.5607 | Microinjection |
| Borosilicate glass cappilary | Science product | GB100T-8P | Microinjection |
| CellTram 4r Oil | Eppendorf | 5196000030 | Microinjection |
| Fluorinert FC-770 | Merck | F3556 | Microinjection |
| Holding pipette | BioMedical Instruments | - | Microinjection |
| Inverted microscope | Nikon | Eclipse Ti-U | Microinjection |
| Microforge | Narishige | MF-900 | Microinjection |
| Microinjection pipette | BioMedical Instruments | - | Microinjection |
| Microlaoder tips | Eppendorf | 5252 956.003 | Microinjection |
| Micromanipulaor arms | Narishige | NT-88-V3 | Microinjection |
| Micropipette puller | Sutter Instrument | P-1000 | Microinjection |
| PiezoXpert | Eppendorf | 5194000016 | Microinjection |
| PVP (Polyvinylpyrrolidine) | Merck | PVP360 | Microinjection |
| Syringe filter | SARSTEDT | 83.1826.001 | Microinjection |
References
- Ellegren, H., Galtier, N. Determinants of genetic diversity. Nature Reviews: Genetics. 17 (7), 422-433 (2016).
- Huijbers, I. J. Generating genetically modified mice: A decision guide. Methods in Molecular Biology. 1642, 1-19 (2017).
- Aizawa, E., Dumeau, C. E., Freimann, R., Di Minin, G., Wutz, A. Polyploidy of semi-cloned embryos generated from parthenogenetic haploid embryonic stem cells. PloS One. 15 (9), 0233072(2020).
- Li, W., et al. Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature. 490 (7420), 407-411 (2012).
- Li, Z., et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells. Cell Research. 26 (1), 135-138 (2016).
- Wan, H., et al. Parthenogenetic haploid embryonic stem cells produce fertile mice. Cell Research. 23 (11), 1330-1333 (2013).
- Yang, H., et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 149 (3), 605-617 (2012).
- Zhong, C., et al. Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell Research. 26 (1), 131-134 (2016).
- Elling, U., et al. Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell Stem Cell. 9 (6), 563-574 (2011).
- Leeb, M., Wutz, A. Derivation of haploid embryonic stem cells from mouse embryos. Nature. 479 (7371), 131-134 (2011).
- Surani, M. A., Barton, S. C., Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308 (5959), 548-550 (1984).
- Li, Z. K., et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell. 23 (5), 665-676 (2018).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shuai, L., et al. Generation of mammalian offspring by haploid embryonic stem cells microinjection. Current Protocols in Stem Cell Biology. 31, 1-15 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2014).
- O'Neill, G. T., Rolfe, L. R., Kaufman, M. H. Developmental potential and chromosome constitution of strontium-induced mouse parthenogenones. Molecular Reproduction and Development. 30 (3), 214-219 (1991).
- Campbell, K. H., McWhir, J., Ritchie, W. A., Wilmut, I. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569), 64-66 (1996).
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., Campbell, K. H. Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619), 810-813 (1997).
- Gurdon, J. B. Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273 (1962).
- Campbell, K. H., Alberio, R. Reprogramming the genome: role of the cell cycle. Reproduction Supplement. 61, 477-494 (2003).
- Zhong, C., et al. CRISPR-Cas9-mediated genetic screening in mice with haploid embryonic stem cells carrying a guide RNA library. Cell Stem Cell. 17 (2), 221-232 (2015).
- Bai, M., et al. Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development. PLoS Biology. 17 (7), 3000350(2019).
- Li, Q., et al. CRISPR-Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development. Nature Cell Biology. 20 (11), 1315-1325 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved