Method Article
정자의 대체로 마우스 파르테노유전학 Haploid 배아 줄기 세포의 응용 프로그램
요약
이 문서는 반 복제 배아의 건설을 위한 정액을 대신하기 위하여 parthenogenetic haploid 배아 줄기 세포의 사용을 입증하는 것을 작정입니다.
초록
성적 번식을 가진 유기체에서, 생식 세포는 새로운 개별으로 발전하는 강성 성 세포의 근원입니다. 마우스에서는 정자에 의한 난미세포의 수정은 완도성 zygote를 만듭니다. 최근, 몇몇 간행물은 haploid 배아 줄기 세포 (haESCs)가 게임 게놈을 대체하고 마우스로 발전하는 태아에 기여할 수 있다는 것을 보고했습니다. 여기서, 우리는 난모세포로 내트라토플라스믹 주입에 의해 배아를 구성하는 정액의 대용품으로 parthenogenetic haESCs를 적용하는 프로토콜을 제시합니다. 이 프로토콜은 정자 대체로 haESCs를 준비하고, 하ESC 염색체를 난모세포로 주입하고, 반 복제 된 배아의 문화를위한 단계로 구성됩니다. 배아는 배아 전달 후에 비옥한 반 복제 마우스를 산출할 수 있습니다. 정자 교체로 haESC를 사용하면 생식선에서 게놈 편집, 배아 발달 연구 및 게놈 각인에 대한 조사가 용이합니다.
서문
포유류에서, gametes는 차세대로 유전 정보를 전송하는 유일한 세포입니다. 오키트와 정자의 융합은 성인 동물로 발전하는 디플로이드 zygote를 형성합니다. 게임성 게놈의 돌연변이는 자식에 의해 상속되고 종1의유전적 변이를 유도한다. 생식선에 돌연변이의 도입은 유전자 기능 및 질병 모델링의 특성화를 포함하여 다양한 생물학적 연구를 위해 유전자 변형 동물을 생산하기 위해 적용되었습니다. 난모세포와 정자 는 모두 말기 분화 하 고 증식을 중단 한 고도로 전문화 된 세포. 따라서 게임테를 직접 수정하는 것은 기술적으로 어렵고 전문적인 접근 방식이 개발되었습니다. 유전자 변형은 유전자 변형 된 ESC를 발아 세포로 주입하여 마우스 세균에 도입 될 수 있으며, 여기서 개발 배아에 통합되어 생식선을 식민지화할 수 있습니다. 또한 CRISPR/Cas9 시스템을 포함한 게놈 편집 접근법을 이용한 zygotes의 유전자 변형이 널리 채택되고있다 2.
최근에는 게임게놈3,4,5,6,7,8을대체할 수 있는 haESC를 적용하는 뛰어난접근법이보고되었다. HaESCs는 파르테노유전학 또는 및 rorogenetic haploid blastocysts의 내부 세포 질량에서 파생된 줄기 세포주이며 염색체4,7,9,10의단일 세트를 소유한다. 파르테노유전학과 안드로유전학 적 haESCs 모두 난모세포로 내트라토플라스믹 주입 후 반 복제 된 마우스의 게놈에 기여할 수 있음을 입증되었습니다. 다른 접근법과는 달리, haESCs의 게놈은 자기 갱신 능력 때문에 배양에서 직접 수정될 수 있습니다. 정자를 haESCs로 대체하여 생식선에 유전자 변형을 도입하는 것은 생물학적 연구를위한 중요한 방법입니다. 그것은 개별적으로 문화를 제공하고 각각 parthenogenetic 또는 androgenetic haESCs에서 파생되는 모계 또는 친자 게놈을 조작할 가능성을 제공합니다. HaESCs는 그 때 유전체 각인, 진상성 표현 및 부모 특정 프로세스의 연구 결과에 특히 유리한 게임 게놈 대체로 이용될 수 있습니다.
마우스에서는 정상적인 배아발달(11)에모계 및 친자 게놈 정보가 모두 요구된다. 따라서, 전체 기간 새끼는 야생형 파르테노유전학 적 haESC(phaESC)가 정자 게놈5,8을대체하기 위해 주입되었을 때 얻을 수 없었다. 발달 블록을 극복하기 위해, 파르테노유전학 적 haESCs의 모계 게놈의 게놈 각인은 아버지 구성으로 교정될 필요가 있다. 이는 차별화된 메틸화된 영역(DM)을 조작하여 달성할 수 있다. 현재까지 H19-DMR, Gtl2-Dlk1 IG-DMR및 Rasgrf1-DMR의표적 삭제는 phaESC3,5,8,12에서모성 발현 유전자를 억압하기 위해 연구되었다. 이러한 연구는 H19-DMR과 IG-DMR모두의 삭제가 정자 염색체를 대체할 수 있는 친자 각인 구성으로 모계를 변환하기에 충분하다는 것을 보여주었습니다. 두 DMR 삭제를 난피세포로 운반하는 phaESC의 내트라피토프라진 주사는 전송된 2세포 배아의 5.1%와 15.5% 사이의 주파수를 가진 반 복제 새끼를 산출하였다.
이 프로토콜은 H19-DMR과 IG-DMR모두의 삭제와 phaESC의 응용 프로그램을 기반으로하며, 이는 이중 녹아웃 phaESC (DKO-phaESC)를 용어. 우리는 DKO-phaESC 라인을 확립하기 위해 phaESC에서 게놈 각인의 수정에 대한 자세한 지침을 제공합니다, 정자 게놈의 대용으로 난동구에 DKO-phaESC의 주입, 배반 복제 배아의 배양에 대한, 및 반 복제 된 마우스를 얻기위한. 이 프로토콜은 친자 게놈의 정확하고 직접적인 조작을 필요로 하는 연구원을 위한 참고및 반 복제된 태아 및 마우스의 생성입니다.
프로토콜
모든 동물 실험은 취리히 주 윤리위원회및 ETH 취리히 분자 건강 과학 연구소의 EPIC 동물 시설의 표준 및 규정에 따라 ZH152/17 라이센스에 따라 수행되었습니다.
참고: 이 프로토콜은 PhaESC에서 H19및 IG-DMR을 삭제하는 것으로 시작합니다. phaESC 라인을 설정하는 방법에 대한 자세한 내용은 게시 된 보고서10,13을참조하십시오. 이 프로토콜의 개요 및 기간(1-14단계)은 그림 1A에 제공됩니다. 미디어, 솔루션 및 버퍼가 표 1에나열됩니다. DKO-phaESC 라인(1-6단계)을 설정하는 절차는 도 1B에나타내며, 반복제 배아(단계 7-14)를 구성하는 전략이 도 1C에묘사된다.
1. PhaESC에서 H19-DMR및 IG-DMR의삭제를 위한 플라스미드의 트랜스포싱
- Cas9 뉴클레아제의 공동 발현을 위해 CRISPR/Cas9 플라스미드를 준비하고 RnA를 안내하여 H19-DMR및 IG-DMR의삭제를 표적으로 합니다. 가이드 RNA 올리고스의 4쌍의 리게이트 (H19-DMR-gRNA1-F, R; H19-DMR-gRNA2-F, R; IG-DMR-gRNA1-F, R; IG-DMR-gRNA2-F, 표 2에나열된 R) pX330 플라스미드로.
참고: 이 4 CRISPR/Cas9 플라스미드14의준비를 위한 자세한 절차에 대해 게시된 프로토콜을 참조하십시오. 또는 일반 마우스 균주에 사용할 수있는 플라스미드는 저장소(재료 표)를통해 액세스 할 수 있습니다. - 10 분 동안 37 °C에서 배양하여 0.2 % 젤라틴 용액의 1 mL로 6 웰 플레이트의 표면을 코팅합니다.
- 플레이트 2 × 105 야생형 팬스크를 항생제 없이 haESC 배지에서 잘 코팅하고, 1일 동안 5%CO2 분위기에서 37°C에서 플레이트를 배양한다.
참고: 항생제는 후속 지방 흡입의 효율성을 높이기 위해 배지에서 생략됩니다. 우리는 10 번 통로에서 야생 형 팬에스크를 사용했습니다. 초기 통로 phaESC를 사용하는 것이 좋지만 다양한 통로 번호가 성공적으로 사용되었습니다8. 반 복제 배아와 마우스를 얻기의 통로 수와 효율성 사이의 상관 관계는 현재 알려져 있지 않다. - 6웰 플레이트(1.3단계에서) 6플라스미드를 동시에 사용하여 립포계 시약을 사용하는 Transfect phaESC: CAG-EGFP 트랜스진을 운반하는 50 ng 피기박 플라스미드, 50 ng 피기박 트랜스포사제 플라스미드, 그리고 각각 4개의 CRISPR/Cas9 플라스미드(1.1)의 600ng ng). 전환의 자세한 절차에 대한 제조업체의 프로토콜을 참조하십시오.
참고: 두 개의 돼지박 플라스미드는 향상된 녹색 형광 단백질(EGFP)의 유비쿼터스 발현을 위한 트랜스포슨을 phaESC의 게놈에 통합하는 데 사용됩니다. 세포의 GFP 표시가 필요하지 않은 경우, 이 두 플라스미드는 pX330 플라스미드 대신 형광 단백질(예를 들어, pX458 플라스미드)의 일시적인 발현을 위해 CRISPR/Cas9 플라스미드로 대체될 수 있다. 그런 다음 과도 EGFP 발현을 사용하여 감염된 세포를 정렬할 수 있습니다. - 형질 전환 후 이틀 후, 매체를 흡인하고 트립신의 800 μL을 추가합니다.
- 5 분 동안 5 % CO2 분위기에서 37 °C에서 플레이트를 배양합니다. 이어서, 트립신을 담금질하기 위해 2mL의 워시 버퍼를 추가하고, 파이펫을 여러 번 사용하여 단일 셀 서스펜션을 얻습니다.
- 셀 서스펜션을 15mL 튜브로 옮킨다.
- 튜브를 160 x g에서 5 분 동안 원심 분리하고 상체를 제거합니다.
- 15 μg/mL Hoechst 33342로 보충된 haESC 유지 보수 버퍼의 400 μL에서 셀 펠릿을 다시 중단합니다.
참고: Hoechst 33342, 1 μg/mL Hoechst 33342 및 50 μM 베라파밀의 잠재적 독성을 줄이기 위해 15 μg/mL Hoechst 3334215대신 사용되었습니다. - 세포 현탁액을 37°C에서 15분 동안 5%CO2 분위기에서 배양한다. 인큐베이션 후, 세포 서스펜션을 셀 스트레이너 캡을 통해 5mL 튜브로 옮기고 다음 단계(2절)에서 사용할 준비가 될 때까지 튜브를 4°C로 유지한다.
2. 유동 세포계를 사용하여 전염된 phaESC의 단일 세포 도금
- 하루 전에 전감염된 phaESC를 분류하기 전에, MEF 배지에서 4 × 104 세포/cm2의 밀도로 젤라틴 코팅 된 96 웰 플레이트에 마우스 배아 섬유아세포 (MEFs)를 조사하였다. 전형적으로, 6 플레이트는 표적 삭제와 phaESC 라인을 설정하도록 준비된다. 5% CO2 분위기에서 플레이트를 37°C로 배양합니다.
참고: 조사된 MEF는 시판됩니다. 우리는 DR4 마우스의 E12.5 배아에서 파생된 MEFs를 사용합니다. haESC는 MEF없이 젤라틴 코팅 플레이트에서 성장할 수 있지만 정렬 된 단일 haESC의 생존 가능성을 높이기 위해 MEF를 권장합니다. - 선별 당일, 96웰 플레이트에서 MEF 배지를 흡인하고, 120 μL의 신선한 haESC 배지를 잘 넣습니다. 플레이트를 37°C로 5%CO2 분위기에서 유지합니다.
- 제조업체의 지침에 따라 100 μm 노즐로 셀 선별기를 설정합니다. 355 nm UV 레이저와 488 nm 블루 레이저Hoechst 33342 및 EGFP 형광의 흥분에 각각 사용 됩니다.
참고 : 또는 Hoechst 33342는 405 nm로 여기로 감지 할 수 있습니다. - EGFP 발현을 보여주는 G1/S 단계에서 haploid 세포를 수집하기 위한 게이트를 이용하여 5mL 튜브(1.10단계로부터)에서 전염된 phaESC를 정렬합니다. 2.2단계에서 96웰 플레이트의 각 웰에 단일 셀을 증착합니다.
참고: Hoechst 33342 염색의 검출은 일반적으로 G1 상에 있는 haploid 세포에 대응하는 1n, 2n 및 4n DNA 함량을 가진 세포의 3개의 피크를, G1 상에 있는 G2/M 상 및 디플로이드 세포의 혼합물, G2/M 상에 있는 디플로이드 세포의 혼합물을 각각 구별합니다. G1/S 상에서 Haploid 세포는 Hoechst 33342 형광의 낮은 강도와 피크로 확인됩니다. 대표적인 결과와 정렬 게이트는 도 2A에표시됩니다. - 도금 후, 5% CO2 분위기에서 37°C에서 96웰 플레이트를 배양한다.
3. 전염된 phaESC의 하위 복제
- 단세포 도금 후 3일 후, 콜로니는 현미경으로 96웰 플레이트의 여러 우물에서 관찰될 수 있다. 하나의 식민지만 성장하는 우물을 표시합니다.
참고 : 우리의 경험에서, 단일 식민지는 96 웰 플레이트의 우물의 20 %-40 %에서 관찰되었다. - 1세포 도금 후 4일째에, 배지의 절반을 우물에 새 haESC 배지로 단일 콜로니로 교체한다.
- 패세이징 하루 전(단세포 도금 후 4일 또는 5일째) 플레이트는 MEF 배지에서 4× 104세포/cm 2의 밀도로 젤라틴 코팅 96웰 플레이트에 대한 MEF를 조사하였다. 플레이트를 37°C로 5%CO2 분위기에서 유지합니다.
- 5 또는 6일 간의 단일 세포 도금 후, 150 μm보다 큰 직경을 가진 단일 콜로니를 포함하는 96웰 플레이트의 우물을 선택합니다.
참고: 약 100개의 우물이 표적 DMR 삭제와 함께 phaESC 라인을 확립하도록 선택되는 것이 바람직하다. - 선택한 우물에서 배지를 흡인하고 트립신의 30 μL을 추가합니다. 96웰 플레이트를 37°C에서 5분 동안 5% CO2 분위기에서 배양한다. 그런 다음 각 웰에 30 μL의 워시 버퍼를 추가하여 트립신을 담금질합니다.
- 각 우물에 haESC 배지 의 140 μL을 추가하고 파이펫을 여러 번 추가하여 단일 셀을 얻습니다.
- 3.3 단계에서 제조된 96웰 플레이트의 우물에서 MEF 배지를 흡인한다.
- 3.6단계에서 각 우물에서 새로운 96웰 플레이트의 신선한 웰로 phaESC를 전송합니다.
- 5% CO2 대기에서 37°C에서 파ESC 서브클론을 함유한 96웰 플레이트를 배양한다.
- 다음 날, 각 우물에서 모든 매체를 흡인하고, 새로운 haESC 배지의 120 μL을 추가합니다. 5% CO2 분위기에서 플레이트를 37°C로 배양합니다.
- 세포가 패혈을 위해 컨실루가 되기 하루 전에, MEF 배지에서 4 × 104 세포/cm2의 밀도로 젤라틴 코팅 24웰 플레이트에 조사된 MEF를 플레이트. 플레이트를 37°C로 5%CO2 분위기에서 유지합니다.
- phaESC가 패싱을 위해 수렴되면 매체를 흡인하고 트립신의 30 μL을 추가합니다. 96웰 플레이트를 37°C에서 5분 동안 배양합니다.
- 트립신을 담금질하기 위해 각 우물에 90 μL의 워시 버퍼를 추가합니다. 파이펫은 단일 셀을 얻기 위해 여러 번.
- 3.11 단계에서 24웰 플레이트의 우물에서 MEF 배지를 흡인하고 신선한 haESC 배지600 μL을 추가합니다.
- 3.13 단계에서 각 웰에서 phaESC 서브클론의 서스펜션60 μL을 3.14 단계에서 24웰 플레이트의 새로운 우물로 옮킨다. DNA 추출 및 기형 에 대한 각 phaESC 서브클론의 나머지 현탁액을 4 단계에서 보관하십시오.
- 5% CO2 분위기에서 37°C에서 파ESC 서브클론으로 24웰 플레이트를 배양한다.
- 세포 배양은 패혈을 위한 밀도에 도달하기 하루 전에, MEF 배지에서 4 × 104 세포/cm2의 밀도로 젤라틴 코팅 된 6 웰 플레이트에 조사 된 MEF를 플레이트. 플레이트를 37°C로 5%CO2 분위기에서 유지합니다.
- phaESC가 패싱을 위해 충분히 혼잡해지면 매체를 흡인하고 트립신 250 μL을 추가합니다. 24웰 플레이트를 37°C에서 5분 동안 배양합니다.
참고: 4.9 단계에서 지피한 후 H19-DMR과IG-DMR을 모두 삭제한 phaESC 라인만 통과해야 합니다. - 트립신을 담금질하기 위해 각 우물에 750 μL의 워시 버퍼를 추가합니다. 파이펫은 단일 셀 서스펜션을 얻기 위해 여러 번. 셀 서스펜션을 15mL 튜브로 옮킨다.
- 5 분 동안 160 x g에서 튜브를 원심 분리하고, 상류체를 제거하고, haESC 배지의 2 mL에서 세포 펠릿을 다시 분리합니다.
- 단계 3.17에서 6 웰 플레이트의 우물에서 MEF 배지를 흡인. 각 튜브에서 3.20 단계에서 새로운 우물로 phaESC 서스펜션을 전송합니다. 플레이트를 37°C로 5%CO2 분위기에서 유지합니다.
- 3.17 ~ 3.21 단계를 반복하고 트립신, 세척 버퍼 및 haESC 배지의 플레이트 크기와 부피를 증가시킴으로써 셀 클론을 확장한다. 5단계MEF의 각 하위 복제 phaESC 라인에 대해 T25 플라스크를 준비합니다.
참고: 5단계로 진행하기 전에 각 하위 복제 phaESC 라인의 300 μL에 동결 배지를 동결하고 액체 질소 저장에 극저온스톡을 유지하는 것이 좋습니다.
4. MEF와 하위 복제 phaESC 라인의 첫 번째 지평
- 3.15 단계에서 남은 세포 현탁액으로부터 게놈 DNA를 추출하려면, 96웰 플레이트의 각 웰에 200 μL의 용해 버퍼를 추가한다. 셀 서스펜션을 1.5mL 튜브로 이송합니다. 잔류 셀을 모두 복구하고 동일한 1.5mL 튜브에서 수집하기 위해 200 μL의 추가 200 μL의 리시스 버퍼로 각각 잘 헹구십시오.
- 혼합과 함께 3 시간 동안 55 °C에서 1.5 mL 튜브를 배양합니다.
- 인큐베이션 후 각 1.5mL 튜브에 460 μL의 이소프로판올을 넣고 DNA 침전이 보일 때까지 부드럽게 섞습니다.
- 튜브를 ≥ 10,000 x g에서 5분 동안 원심분리하고 상체를 제거합니다. DNA 펠릿을 70% 에탄올의 200 μL로 세척합니다.
- 튜브를 ≥ 10,000 x g에서 5분 동안 원심분리하고 상체를 제거합니다.
- 10 분 동안 공기중의 튜브를 건조 한 다음 20 μL의 물에 DNA를 다시 중단합니다.
- 제조업체의 프로토콜에 따라 열안정 DNA 폴리머라제를 사용하여 폴리머라제 연쇄 반응(PCR)을 수행합니다.
참고: PCR의 프라이머 쌍은 표 2에 나열되어 있으며 다음과 같이 사용됩니다: H19-DMR-P1 및 P3 (삭제된 H19-DMR의경우 407bp); H19-DMR-P2 및 P3 (야생 형 H19-DMR의 경우 623 bp); IG-DMR-P1 및 P3 (삭제 된 IG-DMR에 대한 319 bp); IG-DMR-P2 및 P3 (야생형 IG-DMR의 경우 492bp). 모든 프라이머 쌍에 대한 PCR의 온도 프로파일은 다음과 같습니다 : 30 s 98 ° C, 35 x (10 s 98 ° C, 20 s 56 ° C, 30 s 72 °C), 5 분 72 °C. H19-DMR및 IG-DMR삭제를 위한 증폭된 DNA 단편의 길이는 CRISPR/Cas9 중재 편집과 관련된 비동동체 끝 결합 으로 인해 일부 변형을 나타낸다. PhaESC는 야생 형 H19-DMR 및 IG-DMR DNA를 포함하는 MEFs로 배양되었습니다. 따라서 야생형 DNA 단편을 증폭시키는 H19-DMR-P2/P3 및 IG-DMR-P2/P3의프라이머 쌍은 유익하지 않다. 그러나 이러한 프라이머 쌍은 컨트롤로 포함되어 있으며 모든 반응에서 밴드를 제공해야합니다. - 아가로즈 젤 전기포에 의해 PCR 단편을 분석한다. 전기전동(16)의상세한 절차에 대해 게시된 프로토콜을 참조한다.
- H19-DMR및 IG-DMR의삭제를 통해 세포주를 식별합니다. 전기전도의 대표적인 이미지는 도 2B에도시된다.
참고: 우리의 경우, H19-DMR과 IG-DMR모두의 삭제를 가진 8개의 세포주가 135개의 서브 복제 phaESC 라인 사이에서 확인되었습니다.
5. 서브 복제 된 phaESC 라인의 Haploid 세포 정화
- 3.22 단계에서 T25 플라스크에서 서브 복제 된 phaESC 문화가 패시징을 위해 충분히 조밀해지면 매체를 흡인하고 트립신 1.5 mL을 추가하십시오. 플라스크를 37°C에서 5분 동안 배양합니다. 이어서, 4.5mL의 워시 버퍼와 파이펫을 여러 번 추가하여 단일 셀 서스펜션을 얻습니다.
- 각 셀 서스펜션을 15mL 튜브로 옮기고 튜브를 160 x g에서 5분 동안 원심분리합니다. 15 μg/mL Hoechst 33342로 보충된 haESC 유지 보수 버퍼의 400 μL에서 상체를 제거하고 셀 펠릿을 재연합니다.
- 세포 현탁액을 37°C에서 15분 동안 배양합니다. 인큐베이션 후 셀 스트레이너 캡을 통해 셀 서스펜션을 5mL 튜브로 이송합니다. 하ESC 유지 보수 버퍼의 추가 400 μL로 셀 스트레이너 캡을 헹구고 동일한 5mL 튜브에 남아있는 세포를 수집합니다. 튜브를 정렬할 준비가 될 때까지 4°C로 유지합니다.
- 제조업체의 지침에 따라 100 μm 노즐로 유동 사이토계를 설정합니다.
참고: Hoechst 33342는 405 nm에서 여기로 감지할 수 있습니다. 여기서, 355 nm UV 레이저는 Hoechst 33342의 검출을 위해 사용됩니다. - 유동 세포 계에서 선별된 세포를 수집하기 위해 2mL의 haESC 유지 보수 버퍼를 포함하는 세포 현탁액(step 5.3에서)과 새로운 15mL 튜브를 설정합니다.
- 분석을 시작하고 G1/S 단계에서 haploid 세포를 수집하기 위해 정렬 게이트를 설정합니다. G1/S 상 phaESC 인구를 식별하기 위한 도 2A의 히스토그램을 참조하십시오.
참고: 일부 서브 복제 phaESC 라인은 2단계에서 디플로이드 세포의 완전한 디플로이드화 또는 잘못된 도금 으로 인해 어떤 haploid 세포를 포함하지 않을 수 있습니다. G1/S 단계에서 haploid 세포가 관찰되지 않으면 정렬없이 다른 샘플로 진행하십시오. 우리의 경우에, 5 세포주 포함 haploid 세포와 3 세포주 만 포함 디플로이드 세포 밖으로 8 하위 복제 phaESC 라인. - 셀 정렬 후 15mL 수집 튜브의 벽을 따라 5mL의 워시 버퍼를 추가합니다. 5 분 동안 160 x g에서 튜브를 원심 분리합니다. 상부체를 제거합니다.
- 정렬된 셀 수에 따라 배양에 적합한 크기의 플레이트를 선택합니다. 각각 96웰 플레이트, 24웰 플레이트, 12웰 플레이트를 사용하여 1,000-40,000세포, 40,000-200,000세포, 200,000-400,000세포를 배양한다. 각각 120 μL, 600 μL 및 1.2 mL의 하세C 배지에서 세포 펠릿을 다시 중단합니다.
참고: 낮은 결합이 정렬 후 세포의 세포 사멸을 일으킬 수 있기 때문에 고밀도에서 세포를 플레이트. 이 시점부터 phaESC는 MEF없이 젤라틴 코팅 된 우물에서 배양되어 6 단계에서 지피를 용이하게하고 9 단계에서 intracytoplasmic 주입을위한 후속 응용 프로그램. - 셀 서스펜션을 적절한 크기의 젤라틴 코팅 우물로 옮김한 후, 5%CO2 분위기에서 37°C로 플레이트를 배양한다.
- 플레이트 크기가 증가하고 트립신, 세척 버퍼 및 haESC 배지의 볼륨이 증가함에 따라 3.18에서 3.21 단계로 반복하여 phaESC 배양을 계속 확장하십시오. 세포는 MEF없이 젤라틴 코팅 우물에 배양된다.
- 각 서브 복제 phaESC 라인에 대해, 각각 6 단계와 9 단계에 대한 24 웰 플레이트와 6 웰 플레이트의 하나의 우물에서 문화를 준비합니다.
참고: 각 서브 복제 phaESC 라인의 일부 세포는 9단계로 진행하기 전에 액체 질소 저장 탱크에서 극저온원료로서 동결 배지의 300 μL에서 동결되어야 합니다.
6. MEF없이 하위 복제 phaESC 라인의 두 번째 지평
참고: 두 번째 고정 은 하위 복제 phaESC 라인이 H19와 IG-DMRs의 삭제를 소유하고 있음을 확인하고, 야생 형 송내는 MEFs의 제거 후 결석것을 확인합니다.
- 5.11 단계에서 24웰 플레이트의 우물에서 배양하는 것이 MEF로부터 자유롭다는 것을 현미경으로 확인하십시오.
참고: MEF가 관찰되는 경우 MEF가 사라져 서 MEF의 야생 형 DNA로 PCR을 오염시키는 것을 피하기 위해 문화를 계속 통과시켜야합니다. - 컨물 컬쳐에서 배지를 흡인하고 24웰 플레이트의 웰당 400 μL의 용해 버퍼를 추가합니다. 여러 번 파이펫을 한 후 셀 서스펜션을 1.5 mL 튜브로 이송합니다.
- 혼합과 함께 3 시간 동안 55 °C에서 1.5 mL 튜브를 배양합니다.
- 인큐베이션 후 1.5mL 튜브에 이소프로파놀 400 μL을 넣고 DNA 침전이 보일 때까지 부드럽게 섞습니다.
- 5 분 동안 ≥ 10,000 x g에서 튜브를 원심 분리하고 상체를 제거합니다. DNA 펠릿을 70% 에탄올의 200 μL로 세척합니다.
- 5 분 동안 ≥ 10,000 x g에서 튜브를 원심 분리하고 상체를 제거합니다.
- 10 분 동안 공기에서 튜브를 건조 한 다음 물의 50 μL에서 DNA를 다시 중단.
- 4.7 단계와 젤 전기포고다음 지평PCR을 수행하여 H19및 IG-DM의 삭제를 모두 소유하고 야생형 송어가 없는 세포주를 식별합니다.
참고: 일반적인 제2 기형 분석의 이미지는 참조를 위해 도 2B에 도시된다. 우리의 경우, haploid 세포 정화 후 선택 된 모든 5 세포주 (단계 5) 야생 형 유전자에서 무료이며 H19의삭제 알레일만 소유 - 및 IG-DMR. - 이 두 번째 지평 후 선택된 하위 복제 phaESC 라인을 DKO-phaESC 라인으로 사용한다.
7. 마우스의 과속
- MII oocytes의 생산을 위해, 임신 암말 혈청 gonadotropin (PMSG) 각 B6D2F1 여성 마우스 (4-5 주 이전) 63-65 h oocyte 수집 전에 용액의 5 IU의 회대 주사에 의해 초경화를 시작합니다.
참고: B6D2F1 마우스 스트레인은 B6D2F1 난모세포가 인트라토플라스믹 주입을 잘 견디고절차(17)후 높은 발달 잠재력을 나타내기 때문에 이 프로토콜에 권장됩니다. - PMSG 주입 후 48 시간, 각 마우스에 인간의 융기 생식선 용액의 5 IU를 주입.
8. 오사이클 컬렉션
- 나머지 3개의 우물에서 700 μL의 히알루로니다제 배지를 1개의 우물에, 700 μL의 M2 배지를 포함하는 4웰 플레이트를 준비한다. 또한 M2 중간 크기 7mL의 6cm 접시와 M16 배지 900 μL의 중앙 우물 요리를 준비합니다. 접시와 접시를 37°C에서 5%CO2 분위기에서 미리 데워보세요.
- 인트라토플라스믹 주사 당일, 오전 8시경 자궁경부 탈구 또는 CO2 흡입으로 초보화된 암컷(7.2단계)을 안락사시킵니다. 핀셋과 가위를 사용하여 oviducts를 해부합니다. M2 배지가 있는 6cm 접시에 oviducts를 놓습니다.
- 30 G 바늘로 oviducts의 암풀라를 찢어서 적수-오사이클 복합체(COC)를 방출합니다. COC를 미리 데운 히알루로니다제 배지로 옮기고 37°C에서 5%CO2 분위기에서 유지하십시오.
- 2-3분 후, 입 파이펫으로 적분없는 난모구를 모으고 4웰 플레이트의 다른 3개의 우물에서 신선한 M2 배지로 옮기면 난소구를 3번 씻습니다.
- M16 배지가 있는 중앙우물 접시에 첫 극지 바디를 보유한 메타위상 II(MII) 난모세포를 수집하고 12단계에서 내트라토플라스믹 주사에 사용할 때까지 5%CO2 분위기에서 플레이트를 37°C로 유지한다.
9. DKO-phaESC의 치료 및 컬렉션
- MeF없이 6 웰 플레이트의 우물에서 DKO-phaESC 문화를 준비 60-80% intracytoplasmic 주입 전에 하루 (단계에서 5.11).
- M-phase에서 세포 주기 체포를 유도하기 위해, 배지를 완전히 흡인시키고 0.05 mg/mL 디메콜신을 함유한 haESC 배지의 2mL를 추가한다.
- 8 h의 데메콜신 처리 후, 배지를 흡인하고 트립신800 μL을 추가합니다.
- 플레이트를 5분 동안 5%CO2 분위기에서 37°C로 배양한 다음, 트립신을 담금질하기 위해 2mL의 세척 버퍼를 추가하고, 파이펫을 여러 번 추가하여 단일 셀 서스펜션을 얻습니다.
- 셀 서스펜션을 15mL 튜브로 옮킨다. 튜브를 160 x g에서 5 분 동안 원심 분리하고 상체를 제거합니다.
- 15 μg/mL Hoechst 33342를 포함하는 haESC 유지 보수 버퍼의 400 μL에서 셀 펠릿을 다시 중단합니다.
- 세포 현탁액을 37°C에서 15분 동안 5%CO2 분위기에서 배양한다. 인큐베이션 후, 세포 현탁액을 세포 스트레이너 캡을 통해 5mL 튜브로 옮기고, 10단계에서 세포가 정렬될 때까지 튜브를 4°C로 유지한다.
10. M단계 체포 DKO-phaESC의 정화
- 제조업체의 지침에 따라 100 μm 노즐로 유동 사이토계를 설정합니다.
참고: Hoechst 33342는 405 nm에서 여기로 감지할 수 있습니다. 여기서, 355 nm UV 레이저는 Hoechst 33342의 검출을 위해 사용됩니다. - 9.7 단계에서 M-phase 체포 DKO-phaESC를 설정하고 분석을 시작합니다. 데메콜신으로 처리된 시료로부터 haploid M-위상 세포(2n)를 수집하기 위한 적합한 선별 게이트를 선택한다.
참고: 데메콜신 치료 후, 도 3B에도시된 바와 같이 2개의 세포 집단이 예상되며, 이는 haploid 및 diploid M 상 체포 세포에 해당한다. 데메콜신 치료가 완료된 후 세포 주기 체포가 완료되므로 haploid 1n DNA 피크가 관찰되지 않습니다. 이것은 haploid M-위상 세포및 diploid G1 세포가 동일한 DNA 함량 (2n)을 소유하고 겹치는 피크를 생성할 것이기 때문에 중요합니다. - 하세C 유지 보수 버퍼2m를 포함하는 15mL 튜브를 설정하여 유동 세포계에서 정렬된 세포를 수집합니다. 셀 정렬을 시작합니다.
- 셀 정렬 후, 수집 튜브의 벽을 따라 워시 버퍼 5mL을 추가합니다. 튜브를 160 x g에서 5 분 동안 원심 분리하고 상체를 제거합니다.
- 5 x 105 셀/mL의 최종 농도를 얻기 위해 적절한 양의 haESC 유지 보수 버퍼로 세포를 다시 중단합니다.
- 세포 현탁액을 1.5 mL 튜브로 옮기십시오. 12단계에서 내트라토플라스믹 주사가 준비될 때까지 튜브를 얼음 위에 보관하십시오.
11. 보유 및 미세 주입 파이펫 준비
참고: 내트라토플라스믹 주입(12단계)을 수행하기 위해서는 여러 개의 보유 및 미세 주입 파이펫이필요합니다(도 4A). 이러한 파이펫은 상용 공급업체의 맞춤형 수요로 구입하거나 마이크로 피펫 풀러및 마이크로포지를 사용하여 적합한 유리 모세 혈관으로 만들 수 있습니다.
- 마이크로 피펫 풀러에 보로실리케이트 유리 모세 혈관을 당깁니다. 필라멘트 (0.78 x 1.00 x 80mm)없이 보로실리케이트 유리 모세혈관을 당기려면 다음과 같은 매개 변수가 타오르고 있는 수평풀러(재료 표)에대해 주어지지만, 다른 악기 및 유리 모세관 유형은 다를 것이다: 열 510 (경사로 테스트 480), 풀 0, 속도 150, 시간 175 및 20 압력 열 510 (램프 테스트 480), 풀 90, 속도 140, 시간 125 및 압력 200 미세 주입 파이펫에 대한.
참고: 습도, 마이크로파이펫 풀러모델, 유리 모세혈관 을 포함한 여러 요인이 사출 파이펫의 모양에 영향을 줄 수 있기 때문에 최적의 파라미터를 개별적으로 정의해야 합니다. 점진적인 테이퍼가 있는 길쭉한 모양을 목표로 해야 합니다. - 파이펫 을 들고 준비
- 11.1 단계에서 제조된 뽑은 모세관을 마이크로포지에 놓습니다. 필라멘트 위에 유리 구슬 위에 모세관을 놓고 모세관을 낮추어 필라멘트를 가열하는 동안 유리 비드와 접촉합니다.
- 외경이 60~100 μm이 되도록 가열을 끄고 유리 구슬에서 분리하여 모세관을 끊습니다.
- 모세관 팁을 수평으로 배치하여 필라멘트에 유리 구슬을 향합니다.
- 필라멘트를 가열하여 모세관 팁의 내경이 10-20 μm의 직경으로 녹도록 합니다.
- 모세관을 움직이기 때문에 유리 비드위치가 접촉 없이 모세관 끝에서 ~1mm 지점에서 위치합니다. 필라멘트를 가열하여 모세관이 20° 각도로 구부러지도록 합니다. 마이크로포지에서 지주 파이펫이라고 불리는 모세관을 분리합니다.
참고: 모세관의 크기를 측정하기 위해, 안면 망막은 바람직하게는 마이크로포지에 설치된다.
- 미세 주입 파이펫 준비
- 11.1 단계에서 제조된 뽑은 모세관을 마이크로포지에 놓습니다. 필라멘트 위에 유리 구슬 위에 모세관을 놓고 모세관을 낮추어 필라멘트를 가열하는 동안 유리 비드와 접촉합니다.
- 가열을 끄고 유리 구슬에서 분리하여 모세관을 분리하여 외부 직경이 6 μm인 위치에서 분리합니다.
- 모세관을 움직이기 때문에 유리 비드위치가 접촉 없이 모세관 끝에서 ~1mm 지점에서 위치합니다. 필라멘트를 가열하여 모세관이 20° 각도로 위쪽으로 구부러지도록 합니다. 마이크로포지에서 미세 주입 파이펫을 분리하고 나중에 사용할 수 있는 안전한 상자에 보관하십시오.
참고 : 미세 주입 파이펫은 다음과 같은 사양으로 제조됩니다 : 외부 직경, 6 μm; 내경, 4.5-5 μm; 굽힘 각도, 20°. 미세 주입 파이펫의 최적의 설계를 정의하는 것은 intracytoplasmic 주입의 성공을 위해 중요합니다. 내경이 너무 커서 기증자 DKO-phESC의 혈장 막파열을 방지할 수 있습니다(토론 섹션 참조). 내경이 너무 좁으면 기증자 DKO-phESC의 부드러운 파이펫팅을 방해할 수 있습니다. 벤드 각도 & 30°는 높은 굽힘 각도가 압전 펄스의 효과를 저해하기 때문에 바람직하다.
12. DKO-phaESC의 인트라토플라스믹 주입
- 인트라토플라스믹 주입(12.2단계로부터)에 앞서, 5mL의 M2 배지를 PVP 0.6g의 PVP를 함유하고 2일 동안 로커에 튜브를 교반하여 50mL 튜브에 5mL의 M2 배지를 추가하여 폴리비닐피로돈(PVP) 용액을 준비한다. PVP가 완전히 용해된 후, 용액은 멸균 여과되어 4°C에 저장됩니다.
- 인트라토플라스믹 주사 당일, KSOM 배지의 900 μL로 중앙 우물 요리를 준비하고 5% CO2 분위기에서 37°C에서 요리를 미리 데워보세요.
- 거꾸로 놓인 10cm 접시 뚜껑에 5 μL 의 PVP 용액과 20 μL의 M2 배지를 정렬하여 미세 조작 접시를 준비합니다. 미네랄 오일로 방울을 덮고 사출 현미경의 무대에 접시를 놓습니다.
참고 : 마이크로 조작 접시의 권장 배열은 그림 4B에표시됩니다. - 마이크로 조작기에 홀딩 파이펫을 설치합니다. 마이크로 로더 팁을 사용하여 플루오로카본 오일로 마이크로 주입 파이펫을 채우고 압착액액에 장착하십시오.
- PVP 용액과 파이펫을 여러 번 위아래로 떨어뜨려 PVP로 유리를 코팅하고 덜 끈적하게 만듭니다. 소량의 PVP 용액을 마이크로 주입 파이펫에 적재하고 파이펫을 M2 배지로 드롭으로 이동합니다.
- M2 배지에 홀딩 파이펫을 담그고 드롭 하단의 파이펫에 집중합니다.
- DKO-phaESC 서스펜션의 약 2μL을 10.6단계에서 M2 중간 낙하로 옮기.
- 10 MII 난소는 입 파이펫을 사용하여 동일한 M2 중간 낙하로 8.5 단계에서 전달합니다.
- 주입의 경우, M2 배지 낙하시에서 난낭을 회전하여 각막 공간은 마이크로주입 파이펫에 직면하고 MII 플레이트는 미세 주입파이펫(도 4A)의경로에 위치하지 않는다. 지주 파이펫을 통해 음의 압력을 가하여 난모를 잡습니다.
참고: MII 플레이트는 시각적으로 "혹"이라고 불리는 ooplasm의 돌출로 식별되며 종종 첫 번째 극지 몸 옆에 위치합니다. MII 플레이트에는 염색체가 부착된 메이오틱 스핀들이 포함되어 있습니다. 스핀들과 염색체의 기계적 손상이 배아 발달을 방해할 수 있기 때문에 미세 주입 파이펫과 MII 플레이트의 접촉은 피해야 합니다. - 부드러운 음압을 적용하여 마이크로 주입 파이펫의 끝에 하나의 DKO-phaESC를로드합니다. 손상되지 않은 DKO-phaESC의 주입을 피하기 위해 파이펫팅하여 DKO-phaESC의 플라즈마 멤브레인을 파열시킵니다(도3C;토론 참조).
참고: DKO-phaESC의 플라즈마 멤브레인이 파이펫팅으로 파열되지 않는 경우 DKO-phaESC를 폐기하고 다른 DKO-phaESC를 로드합니다. - 오키테의 조나 펠루시다와 접촉하여 마이크로주입 파이펫을 놓고, 마이크로주입 파이펫 내에서 소량의 음압을 가한다.
- 압압 충진(강도, 20; 주파수, 4)을 적용하여 요나 관통 공간으로 마이크로주입 파이펫의 끝을 밀어내면서 조나 돌파한다. 스핀들 및 염색체를 포함하는 MII 플레이트가 미세 주입 파이펫의 경로에 위치하지 않는지 확인합니다.
참고: 구역을 드릴링하기 위해 가장 낮은 압압 펄스로 설정을 경험적으로 조정하여 올렘에 손상가능성을 최소화합니다. - 소나 펠루치다의 조각을 미세 주입 파이펫에서 버리고, 파이펫의 가장자리에 DKO-phaESC를 배치합니다.
- oolemma가 반대쪽에 도달할 수 있도록 마이크로 주입 파이펫으로 난미를 관통합니다.
참고: 스핀들 및 염색체의 손상을 방지하기 위해 MII 플레이트를 만지지 마십시오. - 압압 펄스(강도, 6; 주파수, 1)를 적용하여 올렘을 관통합니다. oolemma가 미세 주입 파이펫의 샤프트를 따라 이완되도록 하십시오.
참고: 오낭의 손상을 최소화하기 위해 올렘을 깨는 페조 펄스의 가장 낮은 설정을 경험적으로 정의합니다. - 음막에 최소한의 배지부피로 DKO-phaESC를 주입하고, 오피세포에서 마이크로 주입 파이펫을 원활하게 철회한다.
- 주입된 난소는 홀딩 파이펫에서 방출하고, 나중에 수집할 수 있는 마이크로드롭 의 측면에 놓습니다.
- M2 중간 낙하시의 다른 MII 난모세포에 대해 12.9~12.17단계로부터 주사 절차를 반복한다.
참고: 20분 이상 인큐베이터에서 난모세포를 떼어내지 마십시오. 우리의 경험에서, 10 난초의 배치는 적절한 훈련 후 15 분 이내에 편안하게 조작 할 수 있습니다. - M2 중간 낙하에서 KSOM 배지를 사용하여 미리 따뜻워진 센터웰 접시로 주입된 난모세포의 배치를 전달합니다.
- 5% CO2 분위기에서 37°C에서 1시간 동안 접시를 보관하십시오.
- 12.5 및 12.20 단계에서 OOCYTE 조작을 MII 난모세포의 추가 그룹으로 반복하여 충분한 주입 된 난모세포를 얻습니다.
13. 건설 된 반 복제 배아의 활성화
- KSOM 중간 및 활성화 매체각각 900 μL로 두 개의 중앙 우물 요리를 준비합니다. 각 웰에 KSOM 배지 700 μL로 4웰 플레이트를 준비합니다. 5% CO2 분위기에서 37°C에서 요리와 접시를 미리 데우세요.
- KSOM 배지에서 1h 후, 주입된 난모세포를 12.21 단계에서 활성화 배지로 미리 따뜻하게 한 센터웰 접시로 옮깁니다.
- 활성화를 위해 5 % CO2 분위기에서 37 °C에서 6 시간 동안 접시를 유지하십시오.
- 활성화 후, 일부 반 복제 배아를 관찰하여 3개의 극성 체체를 형성하며, 이는 난낭체의 제1 및 제2 극체이며, DKO-phaESC(도3E)로부터의 의사 극성 체체를 형성한다.
- 배아를 4웰 플레이트에 KSOM 배지로 새로운 우물로 이송하여 3회 세척합니다.
- 배아를 KSOM 배지로 중앙우물 요리로 옮기고, 요리를 5%CO2 분위기에서 37°C로 유지하여 추가 개발을 한다.
14. 건설 된 반 복제 배아의 개발
- 13.6단계에서 KSOM 배지에서 1일간의 배양 후, 여러 반 복제 배아는 2세포단계(도 5A)에도달한다.
- 시험관내 의 전 이식 배아의 추가 개발을 위해, KSOM 배지에서 반 복제 배아를 5%CO2 대기에서 37°C에서 계속 배양한다. 2일째에 반복제된 배아를 신선한 KSOM 배지로 옮기다. 4일째에는 여러 배아가 배반성단계(그림 5A)에도달합니다.
- 반 복제 된 마우스의 파생을 위해, 의사 임신 한 받는 사람의 oviducts로 단계 14.1에서 2 세포 배아를 전송. 배아 전이 전날 혈관질화된 수컷에 짝짓기하여 의사 임신한 암컷을 식별하고 배아 전이(0.5일 후 코이툼(dpc)를 위해 아침에 명확하게 보이는 플러그의 존재에 기초하여 이를 선택한다. 약 19.5 dpc, 전체 기간 새끼는 자연스럽게 받는 사람 여성(그림 5B)에서전달됩니다.
결과
이 프로토콜의 목적은 반 복제 배아와 마우스를 얻기 위해 정자의 대체로 haESCs를 적용하는 것입니다. 이를 위해, CAG-EGFP 트랜스진을 운반하는 DKO-phaESC 라인이 생성되어 MII 난모세포로 의 내트라토플라스믹 주입에 사용되었다. 친자 각인 구성으로 적합한 phaESC 라인을 얻기 위해 Cas9 뉴클레아제를 사용하여 유전 공학을 수행했습니다. haploid ESC 라인은 디플로이드 에대한 고유의 경향으로 인해 발생하는 haploid 및 디플로이드 세포를 함유하고있다 10. haploid 염색체 세트는 정액 게놈의 성공적인 교체를 위한 전제 조건입니다. 혈류 세포측정에 의한 DNA 함량 분석은 G0/G1-, S-및 G2/M-phases(그림2A)에서haploid 및 디플로이드 세포의 분포를 나타낸다.
DKO-phaESC 라인을 확립하기 위해 야생형 phaESC 라인은 안정적인 형질 전환 EGFP 발현을 위해 돼지박 트랜스포슨 구조와 H19및 IG-DMR의 삭제를 얻기 위한 CRISPR/Cas9 플라스미드로 전염되었습니다. DIPLOID ESC를 제외하고 EGFP를 표현하는 haploid ESC만 격리하기 위해 특정 정렬 게이트가 정의되었습니다(그림2A). 단일 haploid EGFP 양성 세포는 그 때 서브 클론을 얻기 위하여 96 웰 플레이트의 개별 우물로 도금되었다. MEF 피더는 트랜스페드 phaESC의 도금 효율 및 생존을 증가시키기 위해 사용되었다. 배양의 확장 후, PCR에 의해 초기 지노티핑 라운드가 수행되어 두 DMR의 삭제를 수행하는 하위 클론을 식별했습니다. MEF 피더가 배양에서 제거된 후, H19에서야생형 송계의 부재를 확인하기 위해 두 번째 유전자를 수행하였다- 및 IG-DMR(도2B). 총 135개의 서브 클론에서, 우리는 삭제된 송계를 운반하고 H19-DMR과IG-DMR 둘 다의 야생형 송계유전자가 없는 5haploid DKO-phESC 라인을 획득했습니다.
CAG-EGFP 트랜스진은현미경(그림 3A)에따라 녹색 형광의 시각화에 의한 반 복제 배아에 대한 기여를 연구하기 위해 DKO-phaESC에 도입되었다. 인트라토플라스혈 주사를 위해 DKO-phaESCs는 M-단계에서 그들을 체포하기 위해 데메콜신으로 치료되었습니다. 따라서, DKO-phaESC의 세포 주기는 MII 난모세포의 세포와 동기화되었다. 유동 세포측정 분석은 디메콜신(도3B)으로치료한 후 G2/M 상 체포 된 haploid (2n) 및 디플로이드 세포 (4n)에 해당하는 2명의 인구를 나타냈다. 1n haploid 피크의 부재는 세포 주기 체포가 크게 완료되었다는 것을 표시했습니다. M-위상 haploid ESC는 그 때 분류되고 난모세포로 주입되었습니다. 이를 위해, 단일 DKO-phaESC는 마이크로주입 파이펫에 적재되어 MII oocyte(그림3C)의세포질에 주입되었다. DKO-phaESC의 플라즈마 멤브레인은 미세 주입 파이펫의 끝으로 피펫을 주입하여 파열되었다.
주사 후, EGFP 발현은 DKO-phaESCs의 세포질이 난낭의 큰 세포질에 분산되었기 때문에 생성된 반 복제 배아에서 거의 검출되지않았다(도 3D). 드문 경우, 강렬한 EGFP 발현의 둥근 반점이 옴플라스내에서 관찰될 수 있다. 이 관찰은 손상되지 않은 DKO-phaESC의 부주의한 주입에 의해 발생했을 가능성이 있습니다. DKO-phaESC 세포막을 파열하지 않는 것은 추가 배아 발달과 호환되지 않을 가능성이 있으며 피해야한다. 주사 후 1시간 후, 배아는 염화염산염18로 치료에 의해 활성화되었다. 활성화개시 후 6시간 후,현미경(도 3E)하에서최대 3개의 극성 체체가 관찰되었다. 이러한 극지 체는 DKO-phaESC7으로부터난마세포 및 의사 극체의 제1 및 제2 극성 체에 해당한다. 또한, 2개의 프로핵은 정자와 정상 수정 후 zygotes의 프로핵 단계를 닮은 차동 간섭 대조 현미경의 밑에 관찰되었다.
발달 능력을 입증하기 위해 반 복제 된 배아는 배아 단계(그림 5A)로배양되었습니다. 더욱이, 전기 마우스는 반복제된 2세포 단계 배아를 받는 여성의 oviducts(도5B)로이송한 후 수득하였다. 예상대로, 반 복제 된 배아에서 파생 된 마우스는 난모세포나 난모세포 유래 phaESC가 Y 염색체를 운반하지 않는 여성이었다. 반 복제 된 마우스는 매우 정상이었고 야생 형 스위스 웹스터 남성과 짝을 이면 건강한 자손을 생산했습니다. 지금까지, 반 복제 된 마우스는 명백한 건강 문제없이 600 일 이상 살아있다.
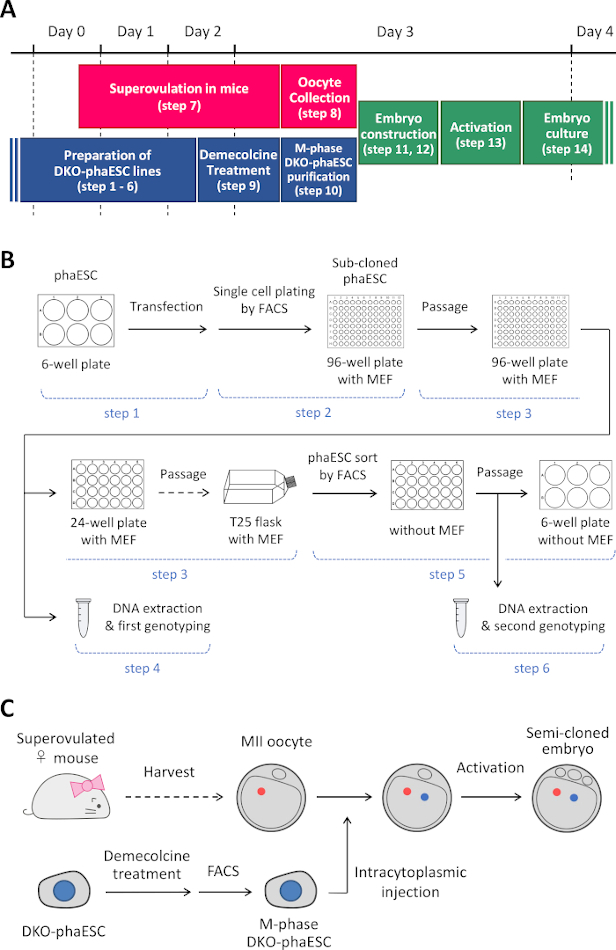
그림 1: 정자 대체로 DKO-phaESC의 적용에 대한 개요. (A)프로토콜의 절차의 시간 프레임. (B)이 계획은 DKO-phaESC 선(1~6단계)을 설정하는 단계를 보여줍니다. (C)이 계획은 MiI oocyte(단계 7-14)로 DKO-phaESC의 내트라피토프라증 주입에 의해 반 복제 배아를 구성하는 단계를 보여줍니다. 약어: DKO = 더블 녹아웃; phaESC = 부분 유전 적 haploid 배아 줄기 세포; FACS = 형광 활성화 셀 분류; MEF = 마우스 배아 섬유아세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
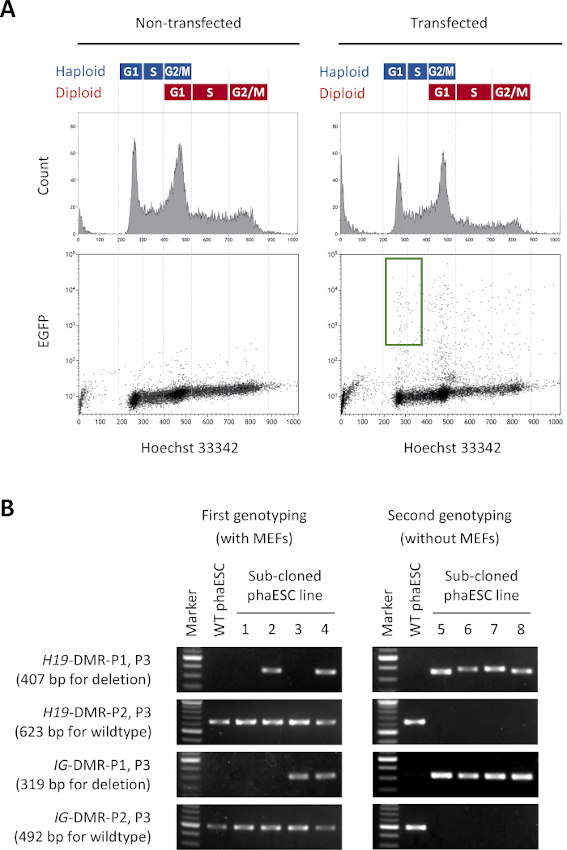
그림 2: CrispR/Cas9 매개 삭제 - 및 IG-DMRs에 의해 DKO-phaESC 라인의 설립. (A)안정적인 EGFP 발현을 위한 피기박 플라스미드와 4개의 CRISPR/Cas9 플라스미드를 통해 피기박 플라스미드로 트랜스포메이션한 후 phaESC의 유동 세포측정 분석. 비트랜스감염 된 phaESC는 대조군으로 표시됩니다. DNA 프로파일(상단)은 haploid 및 diploid 세포의 세포 주기 분포를 나타낸다. EGFP를 발현하는 G1/S상 haploid 세포는 녹색 게이트(아래쪽, 오른쪽)에 의해 표시됩니다. (B)MEFs(제1 기형)에서 재배된 phaESC 서브 클론의 지노티핑과 MEFs(제2 기형)의 제거 후. 서브 복제 된 phaESC 라인 1, 2, 3 및 4는 야생 형 세포, H19-DMR 삭제, IG-DMR 삭제 및 결합 된 H19- 및 IG-DMR삭제를 각각 나타냅니다. DKO-phaESC 라인 5-8H19-DMR및 IG-DMR삭제를 모두 소유 하 고 야생 형 알 것에서 무료입니다. 약어: DKO = 더블 녹아웃; phaESC = 부분 유전 적 haploid 배아 줄기 세포; DMR = 차별화된 메틸화 영역; MEF = 마우스 배아 섬유아세포; EGFP = 향상된 녹색 형광 단백질; WT = 야생형. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
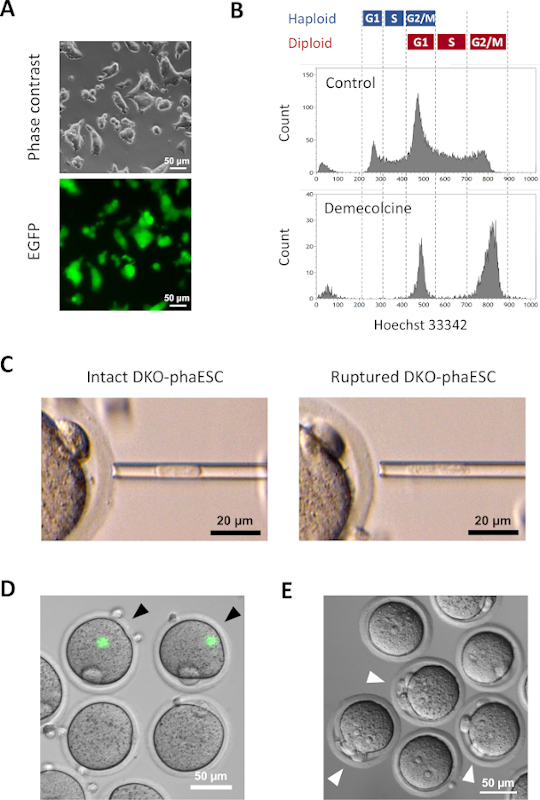
그림 3: Mitotically 체포 된 DKO-phaESC를 MII 난미세포로 주입합니다. (a) H19-및 IG-DMR의 CAG-EGFP 유전자 및 삭제를 전달하는 DKO-phaESC 배양의 형태; 스케일 바 = 50 μm.(B)디메콜신 처리 없이 데메콜신으로 체포된 후 DKO-phaESC의 대표적인 유동 세포 분석이 대조군으로 나타났다. (C)미세 주입 파이펫에서 DKO-phaESC의 형태. 파이펫팅에 의해 플라즈마 멤브레인을 파열하기 전(왼쪽) 및 후(오른쪽) 단일 손상형 DKO-phaESC가 도시되어 있다. 스케일 바 = 20 μm.(D)MII 난모세포에 DKO-phaESC를 주입 한 후 1 h에서 배아를 구성. EGFP 형광 및 밝은 필드의 병합 된 이미지가 표시됩니다. 검은 색 화살촉은 피할 수 있어야 하는 손상되지 않은 DKO-phaESC를 주입한 후 강렬한 EGFP 발현의 둥근 반점을 나타냅니다. 스케일 바 = 50 μm.(E)스트론튬 염화물로 활성화가 개시된 후 6h 반 복제 배아의 차동 간섭 대비 이미지가 나타났다. 백색 화살촉은 주입된 DKO-phaESC에서 1개의 의사 극성 바디를 포함하여 3개의 극성 바디를 가진 배아를 표시합니다; 스케일 바 = 50 μm. 약어: DKO = 더블 녹아웃; phaESC = 부분 유전 적 haploid 배아 줄기 세포; EGFP = 향상된 녹색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
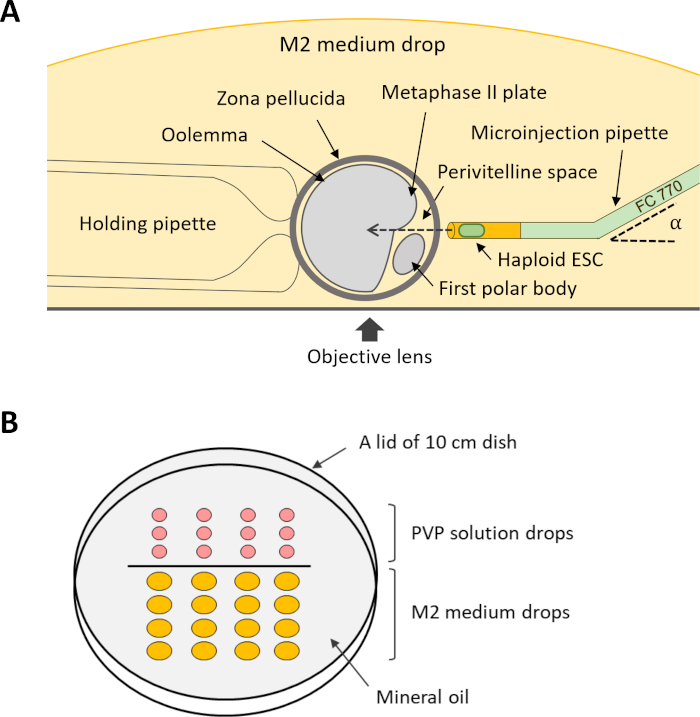
그림 4: DKO-phaESCs를 난마세포로 주입하기 위한 설치 방식. (A)사출 피펫, 홀딩 파이펫 및 사출 챔버내 의 난미가 나타난다. α, 미세 주입 파이펫의 각도를 구부립니다. (B)내트라토플라스솜 주사를 위한 미세 조작 접시에 방울의 레이아웃. 약어: DKO = 더블 녹아웃; phaESC = 부분 유전 적 haploid 배아 줄기 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
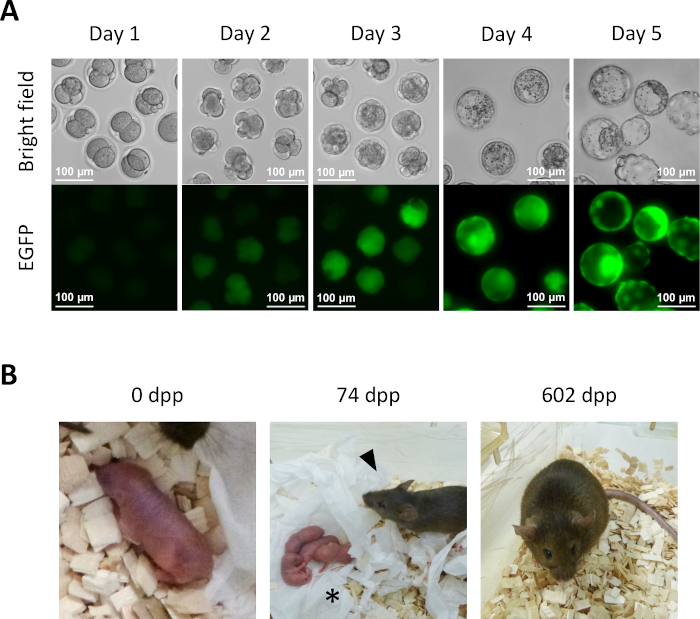
그림 5: 반 복제 된 배아의 개발. (A)시험관내 반 복제 배아의 사전 이식 개발. EGFP 발현은 처음에 4세포 배아에서 관찰된다 2 일째 에 트라이토플라스믹 주사 후. 4일째에, 강렬한 EGFP 발현은 배반구체에서 관찰될 수 있다; 스케일 바 = 100 μm.(b)2세포 배아 전달 후 얻어진 반 복제 마우스가 받는 사람에게 전달된다. 74 dpp에서, 반 복제 마우스 (화살표 머리)는 야생 형 스위스 웹스터 남성과 짝짓기 후 자연 출생에 의해 그녀의 첫 번째 새끼 (별표)를 전달했다. 이 그림에 나타난 반 복제 배아 및 반 복제 된 마우스는 Aizawa 외3에서보고된 것과 동일합니다. 약어: EGFP = 향상된 녹색 형광 단백질; .dpp, 일 산후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 젤라틴 솔루션 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| 물 | - | 500 mL | - |
| 젤라틴 | - | 1 g | 0.2% |
| Haploid 배아 줄기 세포 (HaESC) 배지 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| NDiff 227 | - | 10mL | - |
| CHIR 99021 | 10mM | 3 μL | 3 μM |
| PD 0325901 | 10mM | 1 μL | 1 μM |
| LIF | 1 x 106 IU/mL | 10 μL | 1,000 IU/mL |
| 페니실린-연쇄절제술 | 100x | 100 μL | 1x |
| HaESC 유지 보수 버퍼 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| HaESC 매체 | - | 1 mL | - |
| HEPES 솔루션 | 1 M | 20 μL | 20mM |
| 세척 버퍼 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| DMEM / F-12 | - | 100 mL | - |
| BSA 분획 | 7.5% | 7.1 mL | 0.5% |
| MEF 배지 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| DMEM | - | 500 mL | - |
| FBS | - | 56 mL | 10% |
| β-메르카포에탄올 | 14.3 몰/L | 3.9 μL | 100 μM |
| 페니실린-연쇄절제술 | 100x | 5.6 mL | 1x |
| 리시스 버퍼 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| 물 | - | 8.25 mL | - |
| 트리스-HCl (pH 8.5) | 1 M | 1 mL | 100mM |
| EDTA | 0.5M | 100 μL | 5 mM |
| SDS 솔루션 | 10% | 200 μL | 0.2% |
| 나Cl | 5M | 400 μL | 200 mM |
| 프로틴아제 K | 20 mg/mL | 50 μL | 100 μg/mL |
| 활성화 매체 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| KSOM | - | 1 mL | - |
| 염화 스트론튬 | 1 M | 5 μL | 5 mM |
| EGTA | 0.5M, pH 8.0 | 4 μL | 2 mM |
| PVP 솔루션 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| M2 매체 | - | 5 mL | - |
| PVP | - | 0.6 g | 12% |
| PMSG 솔루션 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| PBS | - | 450 μL | - |
| PMSG | 500 IU/mL | 50 μL | 50 IU/mL |
| hCG 솔루션 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| PBS | - | 450 μL | - |
| hCG | 500 IU/mL | 50 μL | 50 IU/mL |
| 히알루로니다제 배지 | |||
| 구성 요소 | 재고 농도 | 볼륨/무게 | 최종 농도 |
| M2 매체 | - | 380 μL | - |
| 히알루로니다제 | 10 mg/mL | 20 μL | 0.5 mg/mL |
| 약어: LIF = 백혈병 억제 인자; MEF = 마우스 배아 섬유아세포; | |||
| FBS = 태아 소 혈청; DMEM = 덜벡코의 수정된 독수리 매체; BSA = 소 세럼 알부민; | |||
| EDTA = 에틸렌디아민테트라아세산; SDS = 도데킬술페이트 나트륨; EGTA = 에틸렌 비스 (옥시에틸렌니틸로)테트라아세트산; | |||
| PBS = 인산염 완충식식염; PVP = 폴리 비닐피롤리돈; hCG = 인간 융기 생식선 호르몬; | |||
| PMSG = 임신 한 마레 혈청 생식샘 호르몬. | |||
표 1: 중간, 버퍼 및 솔루션 레시피입니다.
| 이름 | 시퀀스(5' ~ 3') | 신청 | |
| H19-DMR-P1 | GTG GTT AGT TCT ATA TGG GG | 지노티핑 | |
| H19-DMR-P2 | AGA TGG GGT CAT TCT TTT CC | 지노티핑 | |
| H19-DMR-P3 | TCT TAC AGT CTG GTC TTG GT | 지노티핑 | |
| IG-DMR-P1 | TGT GCA GCA GCA AAG CTA AG | 지노티핑 | |
| IG-DMR-P2 | CCA CAA AAA CCT CCC TTT CA | 지노티핑 | |
| IG-DMR-P3 | ATA CGA TAC GGC AAC CAA CG | 지노티핑 | |
| H19-DMR-gRNA1-F | CAC CCA TGA ACT CAG AAG AGA CTG | gRNA | |
| H19-DMR-gRNA1-R | AAA CCA GTC TCT TCT 개그 TTC ATG | gRNA | |
| H19-DMR-gRNA2-F | CAC CAG GTG 아가 ACC ACT GCT 개그 | gRNA | |
| H19-DMR-gRNA2-R | AAA CCT CAG CAG TGG TTC TCA CCT | gRNA | |
| IG-DMR-gRNA1-F | CAC CCG TAC AGA GCT CCA TGG CAC | gRNA | |
| IG-DMR-gRNA1-R | AAA CGT GCC ATG 개그 CTC TGT ACG | gRNA | |
| IG-DMR-gRNA2-F | CAC CCT GCT 태그 AGG TAC TAC GCT | gRNA | |
| IG-DMR-gRNA2-R | AAA CAG CGT AGT ACC TCT AAG CAG | gRNA | |
표 2: 올리고뉴클레오티드 목록.
토론
체세포 핵 전달(SCNT)에 의한 포유류 복제는1990년대,20,21년에개척되었다. 이러한 발전은 30년 전에 양서류22에서실시한 복제 연구를 따랐다. 상당한 지연은 포유류에서 배아학 및 게놈 각인의 어려움을 반영합니다. 포유류 SCNT의 발달은 이 프로토콜에 상세히 기술된 정액을 대체하기 위한 haESC의 적용을 위한 기초입니다.
세포 주기 동기화는 SCNT23의성공을 위한 중요한 요소입니다. 이것은 또한이 프로토콜에서 haESC의 주입에 대 한 경우. 기증자 게놈을 수령인으로 도입하려면 배아 발달을 중단하는 염색체 파손 또는 골수 계수를 피하기 위해 세포 주기 단계가 일치하도록 요구합니다. 반 클로닝은 두 개의 게놈과 세포 세포가 호환되어야 한다는 추가복잡성을 가지고 있습니다. 이전 보고서는 M-phase 체포 및 rorogenetic haESC의 주입이 난모세포7에G1 상 haESCs의 주입 보다는 반 복제된 태아의 더 나은 발달 비율을 산출했다는 것을 보여주었습니다. 이 보고서는 M-phase를 반 복제에 적합한 동기화 지점으로 제안합니다. 이에 따라, phaESC는 미토티컬디드 디메콜신과 메타단계에서 체포되어 MII 난우세포의 난소에 주입되었으며, 이는 메이오증의 메타페이오 II에서 자연적으로 체포되었다. 중요한 것은, M-위상 체포는 기증자와 수령인 세포 주기 사이 우수한 동기화를 제공하는 고효율마우스 ESC에서 달성될 수 있습니다.
미토시스 동안 핵막이 분해되고 복제된 염색체가 부착되는 스핀들 형태가 형성됩니다. M-phase DKO-phaESC를 주입한 후, 자매 크로마티드는 의사 극체와 zygote7(그림 3E)으로분리된다. 따라서 DKO-phaESC의 단일 염색체 세트는 반 복제 된 배아에 기여합니다. DKO-phaESC 염색체의 자매 크로마티드는 주사 후에 정확하게 분리될 수 있다는 것이 중요합니다. 손상되지 않은 DKO-phaESC의 플라즈마 멤브레인은 의사 극성 체체로의 분리를 방지합니다. 우리는 실제로 DKO-phaESC의 혈장 막이 파열되지 않은 드문 경우를 관찰했고, 배아는 주입 후 ooplasm에서 그대로 DKO-phaESC를 나타냈다(도 3D). 따라서, 파이프팅에 의해 DKO-phaESC의 플라즈마 멤브레인을 제거하기 위해주의를 기울여야한다. 주입 하는 동안, 염색체의 메이 오 틱 스핀들의 중단을 방지 하 고 염색체 분리 결함으로 이어질 수 있는 동등 하 게 중요 한 결과 뿐만 아니라 aneuploidy를 유도.
포유류에서, 게놈 각인은 정액 보충으로 phaESCs의 적용을 제한합니다. Parthenogenetic haESCs는 유전체 각인의 모계 구성을 소유, 정자는 아버지 구성을 소유 하는 반면. 따라서, 전체 기간 새끼의 생성은 정자 대체로 야생 형 phaESC의 주입 후 발생하지 않았습니다. 이러한 제한을 극복하기 위해 IG및 H19-DMC의삭제는 phaESC에서 설계됩니다. 모계 Igf2-H19 및 Gtl2-Dlk1 loci에서 각인된 발현의 변형은 전송된 2세포 배아에 기초하여 5.1% 이상의 주파수를 가진 반 복제된 마우스의 생성을 허용하기 위한 게놈 각인물의 구성을 바꾸기에 충분하다. 이러한 관찰은 2개의 각인된 유전자를 표적으로 하는 것이 마우스에 있는 정액을 대체할 수 있는 기능적인 아버지 구성으로 phaESCs의 게놈을 전환한다는 것을 건의합니다. 그럼에도 불구 하 고, phaESCs의 영구적인 유전 수정이 전략에 대 한 필요. 대체 전략으로, 및 유전 적 haESC를 고려할 수 있습니다. Androgenetic haESCs는 정자 게놈에서 파생되고 친자 각인을 가지고 있습니다. 야생형 및 유전적 haESC가 정자 대체품으로 기여하여 전이 배아4,7,24의1.3%와 1.9%의 주파수에서 전체 기간새끼를생성하는 데기여했다는보고가 있었습니다. 전체 기간 새끼는 또한 IG의삭제와 함께 및 rorogenetic haESC를 주입하여 얻어졌습니다 - 및 H19-DMRs의주파수에서 20.2% 전송된 2 세포 배아24. 각인이 배양에서 불안정해질 수 있기 때문에 변형된 안드로유전학 적 haESC를 사용하여 반 복제의 효율성이 증가할 가능성이 높습니다. 각인 결함은 중요한 DMR의 유전 적 삭제에 의해 수정됩니다.
난소 또는 정자 게놈에 직접 유전자 변형을 도입하는 어려움을 고려, haESCs는 별도로 부모 게놈을 조작하기위한 가치있는 도구입니다. 정자의 대체로 haESCs를 사용하는 것은 마우스 생식선에서 게놈 편집을위한 놀라운 이점을 제공합니다. 최근 연구는 CRISPR/Cas9 기반 게놈 편집을 배아 발달에 중요한 각각기 영역의 특성화를 위한 haESC의 적용과결합했다(12). 이 연구는 Bi임산부 마우스의 발달에서 H19-및IG-DMR과 병용으로 Rasgrf1-DMR의역할을 분석하고, 양성쥐의 발달에 있어 7가지 DMRs의 기능을 분석하였다. 정자에 대한 haESC를 대체하는 방법은 원시 세균 세포 발달에서 DND1 단백질 내의 주요 아미노산을 식별하고 뼈발달24,25,26에서유전자를 식별하기 위한 유전자 스크리닝 접근법의 기초를 형성하였다. 배아 발달의 주요 요인을 확인하기 위한 게놈 각인 및 유전 검열에 대한 연구는 게임 게놈으로 haESCs의 적용을 위한 상당한 접근입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 phaESC 라인의 파생 에 대한 줄리오 디 미닌 박사와 유동 세포 측정 작업에 대한 박사 레모 프레이만 감사합니다. 우리는 또한 미켈 레 샤프너 씨와 토마스 M. 헤네크 씨가 배아 전이와 기술 지원을 인정합니다. 이 작품은 스위스 국립 과학 재단 (보조금 31003A_152814/1)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mLTube | Eppendorf | 0030 125.150 | haESC culture |
| 15 ml Tube | Greiner Bio-One | 188271 | haESC culture |
| 12-well plate | Thermo Scientific | 150628 | haESC culture |
| 24-well plate | Thermo Scientific | 142475 | haESC culture |
| 6-well plate | Thermo Scientific | 140675 | haESC culture |
| 96-well plate | Thermo Scientific | 167008 | haESC culture |
| β-Mercaptoethanol | Merck | M6250 | haESC culture |
| BSA fraction | Gibco | 15260-037 | haESC culture |
| CHIR 99021 | Axon | 1386 | haESC culture |
| Demecolcine solution | Merck | D1925 | haESC culture |
| DMEM | Gibco | 41965-039 | haESC culture |
| DMEM / F-12 | Gibco | 11320-033 | haESC culture |
| DR4 mouse | The Jackson Laboratory | 3208 | haESC culture |
| EDTA | Merck | E5134 | haESC culture |
| FBS | biowest | S1810-500 | haESC culture |
| Freezing medium | amsbio | 11897 | haESC culture |
| Gelatin | Merck | G1890 | haESC culture |
| Hepes solution | Gibco | 15630-056 | haESC culture |
| Irradiated MEF | Gibco | A34966 | haESC culture |
| LIF (Leukemia inhibitory factor) | (Homemade) | - | haESC culture |
| Lipofection reagent | Invitrogen | 11668019 | haESC culture |
| NDiff 227 | Takara | Y40002 | haESC culture |
| PD 0325901 | Axon | 1408 | haESC culture |
| Pen Strep | Gibco | 15140-122 | haESC culture |
| piggyBac plasmid carrying a CAG-EGFP transgene | Addgene | #40973 | haESC culture |
| piggyBac transposase plasmid | System Biosciences | PB210PA-1 | haESC culture |
| pX330 plasmid | Addgene | #42230 | haESC culture |
| pX458 plasmid | Addgene | #48138 | haESC culture |
| Trypsin | Gibco | 15090-046 | haESC culture |
| DNA polymerase | Thermo Scientific | F549S | Genotyping |
| dNTP Mix | Thermo Scientific | R0192 | Genotyping |
| Ethanol | Merck | 100983 | Genotyping |
| Hydrochloric acid | Merck | 100317 | Genotyping |
| Isopropanol | Merck | 109634 | Genotyping |
| Proteinase K | Axon | A3830 | Genotyping |
| SDS | Merck | 71729 | Genotyping |
| Sodium chloride | Merck | 106404 | Genotyping |
| ThermoMixer | Epeendorf | 5384000012 | Genotyping |
| Tris | Merck | T1503 | Genotyping |
| 5 mL Tube | Falcon | 352063 | Flow cytometry |
| 5 mL Tube with cell strainer cap | Falcon | 352235 | Flow cytometry |
| Hoechst 33342 | Invitrogen | H3570 | Flow cytometry |
| MoFlo Astrios EQ | Beckman Coulter | B25982 | Flow cytometry |
| 1 mL syringe | Codan | 62.1640 | Superovulation |
| 30-gauge 1/2 inch needle | Merck | Z192362-100EA | Superovulation |
| B6D2F1 mouse | The Jackson Laboratory | 100006 | Superovulation |
| hCG | MSD animal health | 49451 | Superovulation |
| PBS | Gibco | 10010015 | Superovulation |
| PMSG | Avivasysbio | OPPA1037 5000 IU | Superovulation |
| 10-cm dish | Thermo Scientific | 150350 | Embryo manipulation |
| 4-well plate | Thermo Scientific | 179830 | Embryo manipulation |
| 50 mL tube | Greiner Bio-One | 227261 | Embryo manipulation |
| 6 cm dish | Thermo Scientific | 150288 | Embryo manipulation |
| Center-well dish | Corning | 3260 | Embryo manipulation |
| Digital rocker | Thermo Scientific | 88880020 | Embryo manipulation |
| EGTA | AppliChem | A0878 | Embryo manipulation |
| Hyaluronidase | Merck | H4272 | Embryo manipulation |
| KSOM | Merck | MR-020P-5F | Embryo manipulation |
| M16 medium | Merck | M7292 | Embryo manipulation |
| M2 medium | Merck | M7167 | Embryo manipulation |
| Mineral oil | Merck | M8410 | Embryo manipulation |
| Glass capillary | Merck | P1049-1PAK | Embryo manipulation |
| Stereomicroscope | Nikon | SMZ745 | Embryo manipulation |
| Strontium chloride | Merck | 13909 | Embryo manipulation |
| 5ml syringe | Codan | 62.5607 | Microinjection |
| Borosilicate glass cappilary | Science product | GB100T-8P | Microinjection |
| CellTram 4r Oil | Eppendorf | 5196000030 | Microinjection |
| Fluorinert FC-770 | Merck | F3556 | Microinjection |
| Holding pipette | BioMedical Instruments | - | Microinjection |
| Inverted microscope | Nikon | Eclipse Ti-U | Microinjection |
| Microforge | Narishige | MF-900 | Microinjection |
| Microinjection pipette | BioMedical Instruments | - | Microinjection |
| Microlaoder tips | Eppendorf | 5252 956.003 | Microinjection |
| Micromanipulaor arms | Narishige | NT-88-V3 | Microinjection |
| Micropipette puller | Sutter Instrument | P-1000 | Microinjection |
| PiezoXpert | Eppendorf | 5194000016 | Microinjection |
| PVP (Polyvinylpyrrolidine) | Merck | PVP360 | Microinjection |
| Syringe filter | SARSTEDT | 83.1826.001 | Microinjection |
참고문헌
- Ellegren, H., Galtier, N. Determinants of genetic diversity. Nature Reviews: Genetics. 17 (7), 422-433 (2016).
- Huijbers, I. J. Generating genetically modified mice: A decision guide. Methods in Molecular Biology. 1642, 1-19 (2017).
- Aizawa, E., Dumeau, C. E., Freimann, R., Di Minin, G., Wutz, A. Polyploidy of semi-cloned embryos generated from parthenogenetic haploid embryonic stem cells. PloS One. 15 (9), 0233072(2020).
- Li, W., et al. Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature. 490 (7420), 407-411 (2012).
- Li, Z., et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells. Cell Research. 26 (1), 135-138 (2016).
- Wan, H., et al. Parthenogenetic haploid embryonic stem cells produce fertile mice. Cell Research. 23 (11), 1330-1333 (2013).
- Yang, H., et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 149 (3), 605-617 (2012).
- Zhong, C., et al. Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell Research. 26 (1), 131-134 (2016).
- Elling, U., et al. Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell Stem Cell. 9 (6), 563-574 (2011).
- Leeb, M., Wutz, A. Derivation of haploid embryonic stem cells from mouse embryos. Nature. 479 (7371), 131-134 (2011).
- Surani, M. A., Barton, S. C., Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308 (5959), 548-550 (1984).
- Li, Z. K., et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell. 23 (5), 665-676 (2018).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shuai, L., et al. Generation of mammalian offspring by haploid embryonic stem cells microinjection. Current Protocols in Stem Cell Biology. 31, 1-15 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2014).
- O'Neill, G. T., Rolfe, L. R., Kaufman, M. H. Developmental potential and chromosome constitution of strontium-induced mouse parthenogenones. Molecular Reproduction and Development. 30 (3), 214-219 (1991).
- Campbell, K. H., McWhir, J., Ritchie, W. A., Wilmut, I. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569), 64-66 (1996).
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., Campbell, K. H. Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619), 810-813 (1997).
- Gurdon, J. B. Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273 (1962).
- Campbell, K. H., Alberio, R. Reprogramming the genome: role of the cell cycle. Reproduction Supplement. 61, 477-494 (2003).
- Zhong, C., et al. CRISPR-Cas9-mediated genetic screening in mice with haploid embryonic stem cells carrying a guide RNA library. Cell Stem Cell. 17 (2), 221-232 (2015).
- Bai, M., et al. Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development. PLoS Biology. 17 (7), 3000350(2019).
- Li, Q., et al. CRISPR-Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development. Nature Cell Biology. 20 (11), 1315-1325 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유