Method Article
マウスパルテノジェネティックハプロイド胚性幹細胞の精子代替としての応用
要約
この記事は、半クローン胚の構築のための精子の代わりにパルテノジェネティックハプロイド胚性幹細胞の使用を実証することを目的としています。
要約
性生殖を伴う生物では、生殖細胞は新しい個体に発達する全能性細胞の源である。マウスでは、精子によって卵母細胞の受精は、トーティポテンスの接合子球を作成します。最近、ハプロイド胚性幹細胞(haESC)がガミスティックゲノムの代用となり、マウスに発達する胚に寄与することが報告されています。ここでは、卵母細胞への細胞質注入によって胚を構築する精子の代替としてパルテノジェネティックhaESCを適用するプロトコルを提示する。このプロトコルは、精子置換としてhaESCを調製するためのステップ、卵母細胞へのhaESC染色体の注入、および半クローン胚の培養のためのステップで構成される。胚は、胚移植後に肥沃な半クローンマウスを生み出すことができる。精子置換にHAESCを用い、生殖細胞のゲノム編集、胚発生の研究、ゲノムインプリンティングの研究が容易になります。
概要
哺乳類では、次世代に遺伝情報を伝達する唯一の細胞である。卵母細胞と精子の融合は、成虫動物に発達するジプロイドジゴテを形成する。ガメティックゲノムの変異は、それによって子孫によって継承され、種1の遺伝的変異を駆動する。生殖細胞系列の変異の導入は、遺伝子機能の特徴付けや疾患モデリングを含む多様な生物学的研究のための遺伝子組換え動物を生産するために適用されている。卵母細胞と精子の両方が末端分化され、増殖を停止した高度に特殊化された細胞です。そのため、ディステットの直接改変は技術的に難しく、特殊なアプローチが開発されている。遺伝子組み換えは、遺伝子組み換えESCを胚盤胞に注入することによってマウス生殖細胞系列に導入され、そこで発達中の胚に統合され、生殖細胞系列を植民地化する。また、CRISPR/Cas9システムを含むゲノム編集手法を用いた接合体の遺伝子改変が広く採用されている。
近年、ゲーミティックゲノム3、4、5、6、7、8の代替としてhaESCを適用する顕著なアプローチが報告されている。HaESCsは、パルテノジェネティックまたはアンドロジェネティックハプロイド胚盤胞の内側の細胞塊に由来する幹細胞株であり、染色体4、7、9、10の単一のセットを有する。また、検体ゲノムとアンドロジェネティックhaESCの両方が、卵母細胞への細胞質内注射後に半クローンマウスのゲノムに寄与することが実証されている。他のアプローチとは対照的に、haESCのゲノムは自己再生能力のために培養中に直接改変することができる。精子をhaESCsに置き換えることによって生殖細胞系列に遺伝子組換えを導入することは、生物学的研究にとって重要な方法です。これは、それぞれパルテノジェネティックまたはアンドロジェネティックhaESCに由来する母体または父方のゲノムを分離して培養し、操作する可能性を提供します。その後、HaESCは、ゲノムインプリンティング、アレーレ特異的発現、および親固有のプロセスの研究に特に有利な、ガメティックゲノム置換として使用することができます。
マウスでは、正常胚発生11には母体と父方のゲノム情報の両方が必要である。したがって、精子ゲノム5,8を置換するために野生型パルテノジェネティックhaESC(phaESC)を注入した場合、完全な子犬は得ることができなかった。この発達ブロックを克服するためには、パルテノジェネティックhaESCの母体ゲノムのゲノム刷り込みは、父方の構成に修正する必要があります。これは、微分メチル化領域(DDR)の操作によって達成することができる。現在までに、H19-DMR、Gtl2-Dlk1 IG-DMR、およびRasgrf1-DMRの標的欠失が、phaESC3、5、8、12において母体的に発現した遺伝子を抑制することを研究されてきた。 これらの研究は、H19-DMRとIG-DMRの両方の欠失は、精子染色体の代わりにすることができる父方のインプリント構成に母親を変換するのに十分であることを実証した。卵母細胞に2つのDMR欠失を運ぶphaESCの細胞内皮注入は、移された2細胞胚の5.1%から15.5%の頻度を有する半クローンの子犬を生み出した。
このプロトコルは 、H19-DMR と IG-DMR の両方を削除した phaESC の適用に基づいています。我々は、DKO-phaESCラインを確立するためのファエスクにおけるゲノムインプリンティングの改変、精子ゲノムの代替として卵母細胞へのDKO-phesCの注入、半クローン胚の培養、半クローンマウスの取得に関する詳細な指示を提供する。このプロトコルは、父親のゲノムの正確かつ直接的な操作と半クローン胚およびマウスの生成を必要とする研究者のための参照である。
プロトコル
すべての動物実験は、チューリッヒ州倫理委員会の基準と規制と、ETHチューリッヒ分子保健科学研究所のEPIC動物施設の基準と規制に従って、ライセンスZH152/17の下で行われました。
注: このプロトコルは、PhaESC のH19およびIG-DDR の削除から始まります。phaESCラインの設定方法の詳細については、公表されたレポート10,13を参照してください。このプロトコルの概要と時間枠 (手順 1 ~ 14) は図 1Aに示されています。メディア、ソリューション、およびバッファを表 1に示します。DKO-phaESCラインを確立する手順(ステップ1~6)を図1Bに示し、半クローン胚の構築戦略(ステップ7~14)を図1Cに示します。
1. PhaESCにおける H19-DMRおよび IG-DMRの欠失のためのプラスミドのトランスフェクション
- Cas9ヌクレアーゼの共発現のためのCRISPR/Cas9プラスミドを調製し 、H19-DMRおよび IG-DMRの欠失を標的とするRNAを導く。ガイドRNAオリゴの4組をリゲート (H19-DMR-gRNA1-F, R;H19-DMR-gRNA2-F, R;IG-DMR-gRNA1-F, R;IG-DMR-gRNA2-F, R) を pX330 プラスミドに表 2)に記載した。
注: これら 4 CRISPR/Cas9 プラスミド14の準備のための詳細な手順に公開されているプロトコルを参照してください。あるいは、一般的なマウス株に利用できるプラスミドもリポジトリ(資料表)を通じてアクセスできます。 - 10分間37°Cでインキュベーションして、1 mLの0.2%ゼラチン溶液で6ウェルプレートの1ウェルの表面をコーティングします。
- プレート2×105の野生型ファESCをゼラチンコーティングした高い抗生物質を含まないHAESC培地で、37°Cで5%CO2雰囲気中で1日間インキュベートする。
注:抗生物質は、その後のリポフェクションの効率を高めるために培地から省略されます。我々は、通路10で野生型phaESCを使用した。我々は、早期通過ファESCを使用することをお勧めしますが、様々な通路番号が正常に使用されています8.半クローン胚とマウスを得る通過数と効率との間の相関は現在知られていない。 - 6ウェルプレート(ステップ1.3から)のウェル内のトランスフェックを、リポフェクション試薬を同時に使用して6個のプラスミドを使用する:50 ng ピギーバツ プラスミドは、CAG-EGFPトランスジーン、50ng ピギーバツ トランスポザーゼプラスミド、および4R/CAS9プラスミド(ステップ1.1.1.1.1から)のそれぞれ600 ngを運ぶ。トランスフェクションの詳細な手順については、製造元のプロトコルを参照してください。
注:2つの ピギーバツ プラスミドは、強化された緑色蛍光タンパク質(EGFP)の遍在発現のためのトランスポゾンをファセスクのゲノムに統合するために使用されます。細胞のGFPマーキングが必要でない場合、これら2つのプラスミドは、pX330プラスミドの1つではなく、蛍光タンパク質(例えばpX458プラスミド)の一過性発現のためにCRISPR/Cas9プラスミドによって置換することができる。一時的なEGFP発現は、トランスフェクトされた細胞を選別するために使用することができます。 - トランスフェクションの2日後、培地を吸引し、800μLのトリプシンを加える。
- 5%CO2雰囲気で37°Cで5分間インキュベートします。次いで、2mLの洗浄バッファーを加えてトリプシンをクエンチし、ピペットを数回加えて、単一の細胞懸濁液を得た。
- 細胞懸濁液を15mLチューブに移します。
- チューブを160xgで5分間遠心し、上清を取り除く。
- 15 μg/mL Hoechst 33342 を補った haESC メンテナンスバッファーの 400 μL でセルペレットを再懸濁します。
注意:Hoechst 33342の潜在的な毒性を減らすために、1 μg/mLのHoechst 33342および50 μMのベラパミルは15 μg/mLのHoechst 33342 3334215の代わりに使用されていた。 - 細胞懸濁液を37°Cで5%CO2雰囲気中で15分間インキュベートします。インキュベーション後、セルストレーナーキャップを通して細胞懸濁液を5mLチューブに移し、次のステップで使用できる状態になるまでチューブを4°Cに保ちます(セクション2)。
フローサイトメーターを用いたトランスフェクトphaESCの単細胞めっき
- トランスフェクトされたphaESCを選別する前の1日前に、プレートは、MEF培地中の4×104細胞/cm2の密度でゼラチンコーティング96ウェルプレートにマウス胚性線維芽細胞(MEF)を照射した。典型的には、6つのプレートは、標的削除を伴うphaESCラインを確立するために準備される。37°Cのプレートを5%CO2雰囲気でインキュベートします。
注: 照射された MEF は市販されています。DR4マウスのE12.5胚由来のMEFを用いた。HAESCはMEFなしでゼラチンコーティングされたプレートで成長することができますが、ソートされた単一のHAESCの生存率を高めるためMEFをお勧めします。 - 選別の日に、MEF培地を96ウェルプレートから吸引し、1ウェルあたり120μLの新鮮なHAESC培地を加えます。プレートを37°Cに保ち、5%CO2の雰囲気を保ちます。
- メーカーの指示に従って100 μmノズルを備えたセルソーターを設置します。355 nmの紫外線レーザーおよび488 nm青のレーザーはそれぞれHoechst 33342およびEGFP蛍光の励起のために使用される。
注: または、Hoechst 33342 は 405 nm の励起によって検出できます。 - EGFP発現を示すG1/S相でハプロイド細胞を収集するためのゲートを用いて、5mLチューブ内のトランスフェースファESCを(ステップ1.10から)並べ替えます。ステップ2.2から96ウェルプレートの各ウェルに単一のセルを堆積させます。
注:Hoechst 33342染色の検出は、一般的に、G1相のハプロイド細胞、G1相のハプロイド細胞およびG1相のジプロイド細胞、およびG2/M相のジプロイド細胞の混合物である1n、2n、および4n DNA含有量を有する細胞の3つのピークを区別する。G1/S相のハプロイド細胞は、蛍光ヘヒスト33342の低強度のピークとして同定される。代表的な結果とソートゲートを 図2Aに示します。 - めっきした後、37°Cの96ウェルプレートを5%CO2雰囲気でインキュベートします。
3. トランスフェクトフェースのサブクローニング
- 単細胞めっきの3日後、96ウェルプレートのいくつかのウェルでコロニーを顕微鏡で観察することができる。単一のコロニーだけが成長する井戸に印を付けます。
注:私たちの経験では、単一のコロニーは96ウェルプレートの井戸の20%〜40%で観察されました。 - 単一細胞めっき後4日目に、培地の半分を単一コロニーでウェル内の新しいHAESC培地に置き換えます。
- 合格の1日前(単一細胞めっき後4日目または5日目)、プレートはMEF培地中の4×104細胞/cm2の密度でゼラチンコーティング96ウェルプレートにMEFを照射した。プレートを37°Cに保ち、5%CO2の雰囲気を保ちます。
- 5日または6日間の単細胞めっきの後、直径が150μmを超える単一コロニーを含む96ウェルプレートのウェルを選択します。
注:約100のウェルが好ましくは、ターゲットDMRの削除とphaESCラインを確立するために選択されます。 - 選択したウェルに培地を吸引し、30 μLのトリプシンを加えます。96ウェルプレートを37°Cで5%CO2雰囲気で5分間インキュベートします。その後、各ウェルに30μLの洗浄バッファーを加え、トリプシンを急がれます。
- 各ウェルに140μLのhaESC培地を加え、ピペットを数回加えて単一細胞を得る。
- ステップ3.3で調製した96ウェルプレートのウェルからMEF培地を吸引する。
- ステップ3.6から各井戸からphaESCをステップ3.7から新しい96ウェルプレートの新鮮な井戸に移します。
- PHAESCサブクローンを含む96ウェルプレートを37°Cで5%CO2雰囲気でインキュベートします。
- 翌日、各ウェルからすべての培地を吸引し、120μLの新しいHAESC培地を加えます。37°Cのプレートを5%CO2雰囲気でインキュベートします。
- 細胞が通過のためにコンフルエントになる前日に、照射したMEFをGEF培地中の4×10個の4細胞/cm2の密度でゼラチンコーティングされた24ウェルプレートにプレートします。プレートを37°Cに保ち、5%CO2の雰囲気を保ちます。
- phaESCがパスエージングのコンフルエントになった場合は、培地を吸引し、30 μLのトリプシンを加えます。96ウェルプレートを37°Cで5分間インキュベートします。
- 各ウェルに90μLの洗浄バッファーを加え、トリプシンを急がれます。ピペットは、単一細胞を得るために数回。
- ステップ3.11から24ウェルプレートのウェルからMEF培地を吸引し、600μLの新鮮なHAESC培地を加えます。
- ステップ3.13の各ウェルからphaESCサブクローンの懸濁液の60 μLをステップ3.14から24ウェルプレートの新しいウェルに移します。ステップ4でDNA抽出および遺伝子型入力のために各phaESCサブクローンの残りの懸濁液を保持する。
- 24ウェルプレートを37°CのphaESCサブクローンで5%CO2雰囲気でインキュベートします。
- 細胞培養物が通過密度に達する前日に、被照射したMEFをMEF培地中の4×4個の4細胞/cm2の密度でゼラチンコーティング6ウェルプレートにプレートします。プレートを37°Cに保ち、5%CO2の雰囲気を保ちます。
- phaESCが通過するのに十分なコンフルエントになると、培地を吸引し、250 μLのトリプシンを加えます。24ウェルプレートを37°Cで5分間インキュベートします。
注: ステップ 4.9 でのジェノタイピングの後 、H19-DMR と IG-DMR の両方を削除した phaESC ラインのみを継ぎ継ぐ必要があります。 - 各ウェルに750 μLの洗浄バッファーを加え、トリプシンを急いでクエンチします。ピペットを数回回して、単一の細胞懸濁液を得た。細胞懸濁液を15mLチューブに移します。
- チューブを160xgで5分間遠心し、上清を取り除き、2mLのhaESC培地で細胞ペレットを再懸濁する。
- ステップ3.17から6ウェルプレートのウェルからMEF培地を吸引する。ステップ3.20から各チューブからphaESC懸濁液を新しいウェルに移します。プレートを37°Cに保ち、5%CO2の雰囲気を保ちます。
- ステップ3.17~3.21を繰り返し、プレートサイズとトリプシン、洗浄バッファー、およびHAESC培地の量を増やして、細胞クローンを拡大します。ステップ5のMEFのサブクローニングphaESCラインごとにT25フラスコを準備します。
注:我々は、ステップ5に進む前に、300 μLの凍結培地で各クローン化phaESCラインのアリコートを凍結し、液体窒素貯蔵中のクライオストックを保持することをお勧めします。
4. MEFを使用したサブクローンPHAESCラインの最初のジェノタイピング
- ステップ3.15から残りの細胞懸濁液からゲノムDNAを抽出するには、96ウェルプレートの各ウェルに200 μLのリシスバッファーを加えます。細胞懸濁液を1.5mLチューブに移します。さらに200 μLのライシスバッファーで各ウェルをリンスし、残りのすべての細胞を回収し、同じ1.5 mLチューブに集めます。
- 混合で3時間55°Cで1.5 mLチューブをインキュベートします。
- インキュベーション後、各1.5 mLチューブに460μLのイソプロパノールを加え、DNA沈殿が見えるまで穏やかに混ぜます。
- 5分間≥10,000 x g でチューブを遠心分離し、上清を取り除く。DNAペレットを200μLの70%エタノールで洗浄します。
- 5分間≥10,000 x g でチューブを遠心分離し、上清を取り除く。
- チューブを空気中で10分間乾燥させ、20μLの水で再懸濁します。
- 製造者のプロトコルに従って、耐熱性DNAポリメラーゼを使用してポリメラーゼ連鎖反応(PCR)を行います。
注: PCR 用のプライマー ペアは表 2にリストされており、H19-DMR-P1 および P3 (削除されたH19-DMR の場合は 407 bp) として使用されます。H19-DMR-P2 および P3 (野生型H19-DMR の場合は 623 bp)。IG-DMR-P1 および P3 (削除されたIG-DMR の場合は 319 bp)。IG-DMR-P2 および P3 (野生型IG-DMR の場合は 492 bp)。全プライマー対のPCRの温度プロファイルは以下の通りです:30 s 98°C、35 x(10 s 98°C、20 s 56°C、30 s 72°C)、5分72°C。 H19-DMRおよびIG-DMR欠失のための増幅されたDNA断片の長さは、CRISPR/Cas9媒介編集に関連する非相同末端結合のために、いくつかの変動を示す。PhaESCは、野生型H19-DMRおよびIG-DMR DNAを含むMEFで培養した。したがって、野生型DNA断片を増幅するH19-DMR-P2/P3とIG-DMR-P2/P3のプライマー対は有益ではない。 しかし、これらのプライマーペアはコントロールとして含まれており、すべての反応でバンドを与える必要があります。 - アガロースゲル電気泳動によりPCR断片を解析します。電気泳動16の詳細な手順に関する公開プロトコルを参照してください。
- H19-DMRおよびIG-DMR の両方の欠失を持つ細胞株を識別します。電気泳動の代表的な画像を図2Bに示します。
注: 我々の場合 、H19-DMRおよび IG-DMRの両方の欠失を有する 8 つの細胞株は 135 サブクローン phaESC ラインの間で識別された。
5. サブクローニングphaESCラインのハプロイド細胞浄化
- ステップ3.22からT25フラスコ中のクローン化phaESC培養物が通過するのに十分な密度になると、培地を吸引し、1.5mLのトリプシンを加える。フラスコを37°Cで5分間インキュベートします。次いで、4.5mLの洗浄バッファーとピペットを数回加え、単一細胞懸濁液を得る。
- 各細胞懸濁液を15mLチューブに移し、チューブを160 x g で5分間遠心分離します。上清を取り外し、15 μg/mL Hoechst 33342を補ったhaESCメンテナンスバッファーの400 μLの細胞ペレットを再懸濁します。
- 37°Cで細胞懸濁液を15分間インキュベートする。インキュベーション後、細胞懸濁液を細胞ストレーナーキャップを通して5mLチューブに移します。さらに400 μLのhaESC維持バッファーで細胞ストレーナーキャップをリンスし、残りの細胞を同じ5 mLチューブに集めます。チューブは、並べ替えの準備ができるまで4°Cに保ちます。
- メーカーの指示に従って、100 μmノズルでフローサイトメーターを設置します。
注意: Hoechst 33342は405 nmで励起によって検出することができる。ここでは、355nmのUVレーザーがHoechst 33342の検出に使用される。 - 細胞懸濁液(ステップ5.3から)と2 mLのhaESCメンテナンスバッファを含む新しい15 mLチューブを設定し、フローサイトメーターでソートされた細胞を収集します。
- 解析を開始し、G1/S フェーズでハプロイドセルを収集するソートゲートを設定します。G1/S相phaESC集団を同定するための 図2A のヒストグラムを参照して下さい。
注:一部のサブクローニングphaESCラインは、ステップ2で完全な二量化または誤った二量体細胞のメッキのためにハプロイド細胞を含まないかもしれません。G1/S相でハプロイド細胞が観察されない場合は、並べ替えなしで別のサンプルに進みます。我々の場合、5つの細胞株にはハプロイド細胞が含まれ、3つの細胞株は8つのクローン化されたphaESCラインのうちジプロイド細胞しか含まれなかった。 - 細胞選別後、15 mLのコレクションチューブの壁に沿って5mLの洗浄バッファーを加えます。チューブを160 x g で5分間遠心します。上清を取り除く。
- 選別された細胞の数に応じて、培養に適したサイズのプレートを選択します。96 ウェル プレート、24 ウェル プレート、12 ウェル プレートを使用して、それぞれ 1,000 ~ 40,000 細胞、40,000 ~ 200,000 細胞、200,000 ~ 400,000 細胞を培養します。細胞ペレットを120μL、600μL、1.2mLのhaESC培地で再懸濁します。
注: コンフルエンスが低いと、並べ替え後に細胞の細胞死を引き起こす可能性があるため、セルを高密度にプレートします。この時点以降、phaESCは、ステップ6でのジェノタイピングを容易にし、ステップ9からその後の細胞質注入の適用を容易にするために、MEFのないゼラチンコーティングされた井戸上で培養される。 - 細胞懸濁液を適当なサイズのゼラチンコーティングウェルに移した後、5%CO2雰囲気中で37°Cでプレートをインキュベートする。
- プレートサイズを増加させ、トリプシン、洗浄バッファー、およびHAESC培地の量を増やすことでステップ3.18〜3.21を繰り返すことでphaESC培養を拡大し続けます。細胞は、MEFなしでゼラチンコーティングされた井戸上で培養される。
- 各クローン化phaESCラインごとに、ステップ6と9の24ウェルプレートと6ウェルプレートの1つのウェルに培養を準備します。
注:各クローン化phaESCラインの一部の細胞は、ステップ9に進む前に、液体窒素貯蔵タンク内の凍結培地の300 μLで凍結する必要があります。
6. MEFを含まないサブクローンphaESCラインの第2のジェノタイピング
注:2回目のジェノタイピングが行われ、サブクローニングされたphaESCラインが H19と IG-DDRの両方の削除を持ち、MEFの除去後に野生型対立遺伝子が存在することを確認します。
- ステップ5.11から24ウェルプレートの井戸の培養物がMEFから自由であることを顕微鏡で確認してください。
注: MEF が観察された場合、MEF から野生型 DNA を使用して PCR を汚染しないように、MEF が消失するまで培養物の通過を継続する必要があります。 - コンフルエント培養から培地を吸引し、24ウェルプレートのウェルあたり400 μLのリシスバッファーを加えます。数回ピペット処理した後、細胞懸濁液を1.5mLチューブに移します。
- 混合で3時間55°Cで1.5 mLチューブをインキュベートします。
- インキュベーション後、イソプロパノールを400μLのチューブに加え、DNA沈殿が見えるまで穏やかに混ぜます。
- チューブを10,000 x g≥5 分間遠心し、上清を取り除く。DNAペレットを200μLの70%エタノールで洗浄します。
- チューブを10,000 x g≥5 分間遠心し、上清を取り除く。
- チューブを空気中で10分間乾燥させ、50μLの水で再懸濁します。
- ステップ4.7に続く遺伝子型変換PCRとステップ4.8のゲル電気泳動を行い、H19とIG-DDRの両方の欠失を有し、野生型対立遺伝子を含まない細胞株を同定します。
注: 参考用の図 2Bに、典型的な 2 番目のジェノタイピング分析のイメージを示します。我々の場合、ハプロイド細胞精製後に選択された5個の細胞株(ステップ5)はすべて、野生型対立遺伝子から解放され、H19およびIG-DDRの欠失対立遺伝子のみを有していた。 - この2回目のジェノタイピングの後に選択されたサブクローニングphaESCラインをDKO-phaESCラインとして使用してください。
7. マウスのスーパー排卵
- MII卵母細胞の製造のために、妊娠したマレ血清性ゴナドトロピン(PMSG)溶液の5 IUの腹腔内注射による超排卵を各B6D2F1雌マウス(生後4~5週齢)63~65時間前に卵母細胞コレクションに開始する。
注:B6D2F1卵母細胞は、細胞内皮注入を十分に許容し、手順17の後に高い発達可能性を示すので、B6D2F1マウス株は、このプロトコルに推奨されます。 - PMSG注射後48時間、腹腔内にヒト絨毛性ゴナドトロピン溶液の5IUを各マウスに注入する。
8. 卵母細胞コレクション
- 700 μLのヒアルロニダーゼ培地を1ウェルに、M2培地を残りの3ウェルに700 μL用意します。さらに、M2培地7 mLの6cm皿とM16培地900μLのセンターウェルディッシュを用意します。5%CO2雰囲気の中で37°Cでプレートと料理を予熱します。
- 細胞内挿注射の日に、子宮頸部脱臼またはCO2 吸入のいずれかによって、朝の午前8時頃に超排卵した女性(ステップ7.2から)を安楽死させる。ピンセットとハサミを使って卵管を解剖する。6cm皿にオビダクトをM2培地で入れます。
- 30G針で卵管のアンフェッラを引き裂くことによって、cumulus-oocyte複合体(COC)を放出する。コマを温め込んだヒアルロンダーゼ培地に移し、37°Cで5%のCO2 雰囲気に保ちます。
- 2~3分後、口のピペットでcumulusフリーの卵母細胞を収集し、4ウェルプレートの他の3つのウェルで新鮮なM2培地に移して卵母細胞を3回洗います。
- 第1極体を保有する分母II(MII)卵母細胞をM16培地付きのセンターウェル皿に集め、ステップ12で細胞内皮質注入に使用するまでプレートを5%CO2雰囲気に保ち、37°Cでプレートを5%CO2雰囲気に保ちます。
9. DKO-ファエスクの治療と収集
- DKO-phaESC培養を、細胞内質注入の前日に60~80%の合流率でMEFのない6ウェルプレートのウェルで準備します(ステップ5.11から)。
- M相で細胞周期停止を誘導するために、培地を完全に吸引し、0.05mg/mLデメコルシンを含むhaESC培地2mLを添加する。
- 8時間のデメコルシン処理後、培地を吸引し、800μLのトリプシンを加える。
- 5%CO2雰囲気の中で37°Cのプレートを5分間インキュベートし、2mLの洗浄バッファーを加えてトリプシンをクエンチし、ピペットを数回加えて単一細胞懸濁液を得る。
- 細胞懸濁液を15mLチューブに移します。チューブを160 x g で5分間遠心し、上清を取り除く。
- 15 μg/mL Hoechst 33342 を含む haESC メンテナンスバッファーの 400 μL でセルペレットを再懸濁します。
- 細胞懸濁液を37°Cで5%CO2雰囲気中で15分間インキュベートします。インキュベーション後、細胞懸濁液を細胞ストレーナーキャップを通して5mLチューブに移し、ステップ10で細胞が選別されるまで4°Cでチューブを保持する。
10. M相逮捕DKO-phaESCの浄化
- メーカーの指示に従って、100 μmノズルでフローサイトメーターを設置します。
注意: Hoechst 33342は405 nmで励起によって検出することができる。ここでは、355nmのUVレーザーがHoechst 33342の検出に使用される。 - ステップ 9.7 から M フェーズで逮捕された DKO-phesC をセットアップし、分析を開始します。デメコルシンで処理したサンプルからハプロイドM相細胞(2n)を採取するための適切な選別ゲートを選択する。
注: デメコルシン処理後、 図 3Bに示すように、2 つの細胞集団が予測され、ハプロイドおよびジプロイド M 相逮捕細胞に対応します。デメコルシン処理が完了した後の細胞周期停止は、従って、ハプロイド1nDNAピークは認められない。これは、ハプロイドM相細胞とジプロイドG1細胞が同じDNA含有量(2n)を有し、重なり合うピークを生成するので重要である。 - 2 mLのhaESCメンテナンスバッファを含む15 mLチューブを設置し、フローサイトメーター内のソートされたセルを収集します。セルの並べ替えを開始します。
- 細胞の選別後、コレクションチューブの壁に沿って5mLの洗浄バッファーを加えます。チューブを160 x g で5分間遠心し、上清を取り除く。
- 適切な量のhaESC維持バッファー内の細胞を再中断して、5 x 105 細胞/mL の最終濃度を得る。
- 細胞懸濁液を1.5mLチューブに移します。ステップ12で細胞質注入の準備ができるまでチューブを氷の上に置いておきなさい。
11. 保持およびマイクロインジェクションピペットの調製
注:細胞内質注入(ステップ12)を行う場合、いくつかの保持およびマイクロインジェクションピペットが必要です(図4A)。これらのピペットは、商業サプライヤーからのオーダーメイドの需要に応じて購入するか、マイクロピペットプーラーとマイクロフォージを使用して適切なガラス毛細血管から作ることができます。
- マイクロピペットの引き手にホウケイ酸ガラスの毛細血管を引っ張ります。フィラメントなしのホウケイ酸ガラス毛細血管(0.78 x 1.00 x 80 mm)を引っ張る場合は、フラミング水平引き手(材料表)に対して次のパラメータが与えられますが、他の機器やガラスキャピラリータイプでは異なります:Heat 510(ランプテスト480)、プル0、ベロシティ150、時間175、圧力200熱510(ランプ試験480)、プル90、速度140、時間125およびマイクロインジェクションピペットのための圧力200。
注: 湿度、マイクロピペットプーラーのモデル、ガラス毛細血管の多くを含むいくつかの要因が注入ピペットの形状に影響を与える可能性があるため、最適なパラメータを個別に定義する必要があります。段階的なテーパーを持つ細長い形状を目指すべきです。 - ピペットの保持の準備
- ステップ11.1で調製した1本の引っ張られた毛細管をマイクロフォージにセットする。フィラメントの上にガラスビーズの上にキャピラリーを置き、フィラメントを加熱しながらガラスビーズと接触させるためにキャピラリーを下げます。
- ガラスビーズの外側の直径が 60 ~ 100 μm になるように、加熱をオフにして、ガラスビーズから取り外してキャピラリーを壊します。
- 毛細管先端をフィラメント上のガラスビーズに向けて水平に配置します。
- フィラメントを加熱して、キャピラリーチップの内径を直径10~20μmまで溶かします。
- ガラスビーズが接触せずにキャピラリー先端から1mmの位置になるようにキャピラリーを動かします。フィラメントを加熱して、毛細管を 20° の角度で曲げるようにします。毛細管を取り外し、マイクロフォージから保持ピペットと呼ぶ。
注:毛細管のサイズを測定するために、接眼用レチクルが好ましくはマイクロフォージに設置される。
- マイクロインジェクションピペットの調製
- ステップ11.1で調製した1本の引っ張られた毛細管をマイクロフォージにセットする。フィラメントの上にガラスビーズの上にキャピラリーを置き、フィラメントを加熱しながらガラスビーズと接触させるためにキャピラリーを下げます。
- 暖房をオフにしてキャピラリーを破り、外径が6μmの位置でガラスビーズから取り外します。
- ガラスビーズが接触せずにキャピラリー先端から1mmの位置になるようにキャピラリーを動かします。フィラメントを加熱して、毛細管を 20° の角度で上向きに曲げられるようにします。マイクロフォージからマイクロインジェクションピペットを取り外し、後で使用するために安全な箱に保管してください。
注意:マイクロインジェクションピペットは、外径、6 μmの仕様で用意されています。内径、4.5~5μm;曲げ角度、20°。マイクロインジェクションピペットの最適な設計を定義することは、細胞内質注入の成功にとって重要である。内径が大きすぎると、ドナーDKO-phESCの原形質膜の破裂を防ぐことができます(説明セクションを参照)。内径が狭すぎると、ドナーDKO-phESCの滑らかなピペット化を妨げる可能性があります。曲げ角度<30°は、高ベンド角度がピエゾパルスの効果を妨げるので好ましい。
12. DKO-phaESCの細胞内注入
- イントラストトープラズム注射(ステップ12.2から)に先立ち、0.6 gのPVPを含む50 mLチューブにM2培地5mLを加え、4°Cのロッカーでチューブを2日間攪拌することにより、ポリビニルピロリドン(PVP)溶液を調製します。PVPが完全に溶解した後、溶液は滅菌濾過され、4°Cで保存されます。
- 細胞内質注入の日に、KSOM培地の900 μLとセンターウェル皿を準備し、5%CO2雰囲気の中で37°Cで皿を予熱する。
- 逆さまに置かれた10cm皿の蓋に5μLのPVP溶液と20μLのM2媒体の滴を合わせることによってマイクロマニシング皿を準備する。ミネラルオイルで滴を覆い、注入顕微鏡のステージに皿を置きます。
メモ: マイクロマニピュレーションディッシュの推奨配置を 図 4Bに示します。 - マイクロマニピュレーターに保持ピペットを取り付けます。マイクロローダーチップを使用してフルオロカーボンオイルをマイクロインジェクションピペットに充填し、ピエゾアクチュエータに取り付けます。
- PVP溶液とピペットを数回滴下してマイクロインジェクションピペットを浸し、ガラスにPVPをコーティングし、粘着性を減らします。少量のPVP溶液をマイクロインジェクションピペットに積み込み、M2培地でピペットをドロップに移動します。
- M2培地に保持ピペットを浸し、ドロップの底部のピペットに焦点を当てます。
- ステップ10.6からM2培地ドロップに約2μLのDKO-phaESCサスペンションを移します。
- 口のピペットを使用して、ステップ8.5から同じM2培地ドロップに10 MII卵母細胞を移します。
- 注入の場合、M2培地ドロップで卵母細胞を回転させて、ペリビテリン空間がマイクロインジェクションピペットに面するようにし、MIIプレートがマイクロインジェクションピペットの経路に位置していないようにします(図4A)。保持ピペットを通して負圧を加えて卵母細胞を保持します。
注: MII プレートは、目視で「こぶ」と呼ばれる、最初の極性体の隣に位置する、卵子の突起として識別されます。MIIプレートには、染色体が付いたメオティックスピンドルが含まれています。マイクロインジェクションピペットとMIIプレートの接触は、スピンドルおよび染色体の機械的損傷が胚の発達を妨げ得る可能性があるとして避けなければならない。 - 穏やかな陰圧を加え、マイクロインジェクションピペットの先端に1つのDKO-phaESCをセットします。無傷のDKO-phaESCの注入を避けるためにピペット処理によってDKO-phaESCの原形質膜を破裂させる(図3C;議論参照)。
注:DKO-phaESCの原形質膜がピペットによって破裂しない場合は、DKO-phaESCを捨てて、別のDKO-phaESCをロードしてください。 - 卵母細胞の透明帯に接触してマイクロインジェクションピペットを置き、マイクロインジェクションピペット内に少量の負圧を加えます。
- ピエゾインパルス(強度、20;周波数、4)を適用して、マイクロインジェクションピペットの先端を周回空間に向かって押しながらゾナを突破します。スピンドルと染色体を含むMIIプレートがマイクロインジェクションピペットの経路に存在しないことを確認します。
注:経験的に、オゾン層を掘削するための最も低いピエゾパルスに設定を調整して、オオレンマへの損傷の可能性を最小限に抑えます。 - マイクロインジェクションピペットから透明帯の断片を捨て、ピペットの端にDKO-phaESCを配置します。
- ウーレンマが反対側に到達するように、マイクロインジェクションピペットで卵母細胞を貫通します。
メモ:スピンドルや染色体の損傷を防ぐためにMIIプレートに触れないでください。 - ピエゾパルス(強度、6;周波数、1)を適用して、オーレンマを突き刺します。オオレンマがマイクロインジェクションピペットのシャフトに沿ってリラックスすることを確認します。
注:卵母細胞への損傷を最小限に抑えるために、ウーレンマを壊すためにピエゾパルスの最も低い設定を経験的に定義します。 - DKO-phaESCを最小量の培地を卵卵子に注入し、卵母細胞からマイクロインジェクションピペットを滑らかに引き出します。
- 注入した卵母細胞を保持ピペットから放出し、後のコレクションのためにマイクロドロップの側面に置きます。
- M2中液落下の他のMII卵母細胞について、ステップ12.9から12.17までの注入手順を繰り返します。
注:卵母細胞を20分以上保育器から締め出さないようにしてください。私たちの経験では、10個の卵母細胞のバッチは、適切なトレーニングの後、15分以内に快適に操作することができます。 - 注入した卵母細胞のバッチをM2培地ドロップからKSOM培地で事前に温めたセンターウェル皿に移します。
- 37°Cで1時間、5%CO2雰囲気で保存します。
- MII卵母細胞の追加グループでステップ12.5と12.20の卵母細胞操作を繰り返し、十分な注入卵母細胞を得る。
13. 構築された半クローン胚の活性化
- KSOM培地と活性化培地のそれぞれ900 μLで2つのセンターウェルディッシュを準備します。各ウェルに700 μLのKSOM培地を入した4ウェルプレートを準備します。5%CO2 雰囲気で37°Cで予熱したお皿。
- KSOM培地で1時間後、注入した卵母細胞をステップ12.21から活性化培地付きの事前温めたセンターウェル皿に移す。
- 活性化のために5%CO2雰囲気で37°Cで6時間の皿を保ちます。
- 活性化後、半クローン化された胚が3つの極体を形成し、卵母細胞の第1および第2極体、およびDKO-phaESCからの擬似極体を観察する(図3E)。
- 4ウェルプレートでKSOM培地で新しいウェルに移して胚を3回洗浄します。
- 胚をKSOM培地でセンターウェル皿に移し、さらに発達するために5%CO2雰囲気中の37°Cで皿を保つ。
14. 構築された半クローン胚の開発
- ステップ13.6からKSOM培地で1日目培養した後、いくつかの半クローン胚が2細胞段階に到達する(図5A)。
- インビトロでの着床前胚のさらなる発達のために、5%CO2雰囲気中で37°CのKSOM培地で半クローン胚を培養し続ける。半クローン胚を2日目に新しいKSOM培地に移します。4日目には、いくつかの胚が胚盤胞期に達する(図5A)。
- 半クローンマウスの誘導のために、2細胞胚をステップ14.1から疑似妊娠レシピエント女性の卵管に移す。胚移植の前日に精管切除された男性に交配して疑似妊娠女性を特定し、胚移植のために1日の朝にはっきりと見えるプラグの存在に基づいてそれらを選択する(0.5日後のコイタム(dpc))。約 19.5 dpc, 完全な期間の子犬は、受信者の女性から自然に配信されます (図 5B).
結果
このプロトコルの目的は、半クローンの胚およびマウスを得るために精子の代用としてhaESCを適用することです。この目的のために、CAG-EGFPトランスジーンを運ぶDKO-phaESCラインを生成し、MII卵母細胞への細胞内皮内注射に使用した。父方のインプリント構成で適切なphaESCラインを得るために、Cas9ヌクレアーゼを用いた遺伝子工学を行った。ハプロイドESCラインは、ジプロイド10に対するハプロイドESCの固有の傾向のために生じるハプロイドおよびジプロイド細胞を含む。ハプロイド染色体セットは、精子ゲノムの正常な置換のための前提条件です。フローサイトメトリーによるDNA含有量分析は、G0/G1、S-、およびG2/M相におけるハプロイドおよびジプロイド細胞の分布を示す(図2A)。
DKO-phaESCラインを確立するために、ワイルドタイプphaESCラインは、安定したトランスジェニックEGFP発現のための ピギーバクトランス ポゾンコンストラクトと 、H19およびIG-DDRの欠失を得るためのCRISPR/ Cas9プラスミドでトランスフェクションした。二数二次ESCを除外し、EGFPを表現するハプロイドESCのみを隔離するために、特定のソートゲートが定義されました(図2A)。単一のハプロイドEGFP陽性細胞を、次いで96ウェルプレートの個々のウェルにメッキしてサブクローンを得た。MEFフィーダーは、トランスフェクトファセスクのめっき効率および生存率を高めるために使用された。培養物の拡大後、両方のDDRの欠失を運ぶサブクローンを同定するために、最初の一回の遺伝子型変換をPCRによって行った。MEFフィーダーが培養物から取り除かれた後 、H19-およびIG-DDRにおける野生型対立遺伝子の存在を確認するために第2のジェノタイピングが行われた(図2B)。合計135個のサブクローンから、削除された対立胞を運び 、H19-DMRとIG-DMRの両方の野生型対立体を含まない5つのハプロイドDKO-phESCラインを得た。
顕微鏡下での緑色蛍光の可視化による半クローン胚への寄与を研究するために、CaG-EGFPトランスジーンをDKO-phesCに導入した(図3A)。細胞内質注入のために、DKO-phaESCは、M相でそれらを逮捕するためにデメコルシンで治療された。したがって、DKO-phaESCの細胞周期はMII卵母細胞の細胞周期と同期した。フローサイトメトリー分析は、デメコルシンによる処理後に、G2/M相逮捕ハプロイド(2n)およびジプロイド細胞(4n)に対応する2つの集団を示した(図3B)。1nハプロイドピークの不在は、細胞周期の逮捕が大部分完了したことを示した。M相ハプロイドESCを選別し、卵母細胞に注入した。このために、マイクロインジェクションピペットに1つのDKO-phaESCをロードし、MII卵子の細胞質に注入した(図3C)。DKO-phaESCの原形質膜は、マイクロインジェクションピペットの先端にピペットを入れ、破裂した。
注射後、DKO-phaESCの細胞質が卵母細胞の大きな細胞質に分散していたとして、構築された半クローン胚でEGFP発現はほとんど検出されなかった(図3D)。まれに、大細胞の中で強烈なEGFP発現の丸いスポットが観察される可能性があります。この観察は、無傷のDKO-phaESCの不注意な注射によって引き起こされた可能性が高い。DKO-phaESC細胞膜を破裂させなかった場合、さらなる胚の発達と互換性がない可能性が高く、避けるべきである。注射の1時間後、胚は塩化ストロンチウム18による処理によって活性化された。活性化開始から6時間後、顕微鏡下で最大3個の極体を観察した(図3E)。これらの極体は、卵母細胞の第1及び第2極体及びDKO-phaESC7からの擬似極体に相当する。さらに、精子による正常な受精後の接合体の原核期に似た微分干渉対比顕微鏡下で2つの前核を観察した。
発達能力を実証するために、半クローン胚を胚盤胞期まで培養した(図5A)。さらに、セミクローン化された2細胞期胚をレシピエント女性の卵管に移した後に、全期マウスを得た(図5B)。予想通り、半クローン胚由来のマウスは、卵母細胞も卵母細胞由来ファセスクもY染色体を運ばずに雌であった。半クローンマウスは、野生のタイプのスイスのウェブスターの男性と交配したときに、過度に正常で健康な子孫を生み出しました。これまで、半クローンマウスは明らかな健康上の問題なしに600日以上生きてきました。
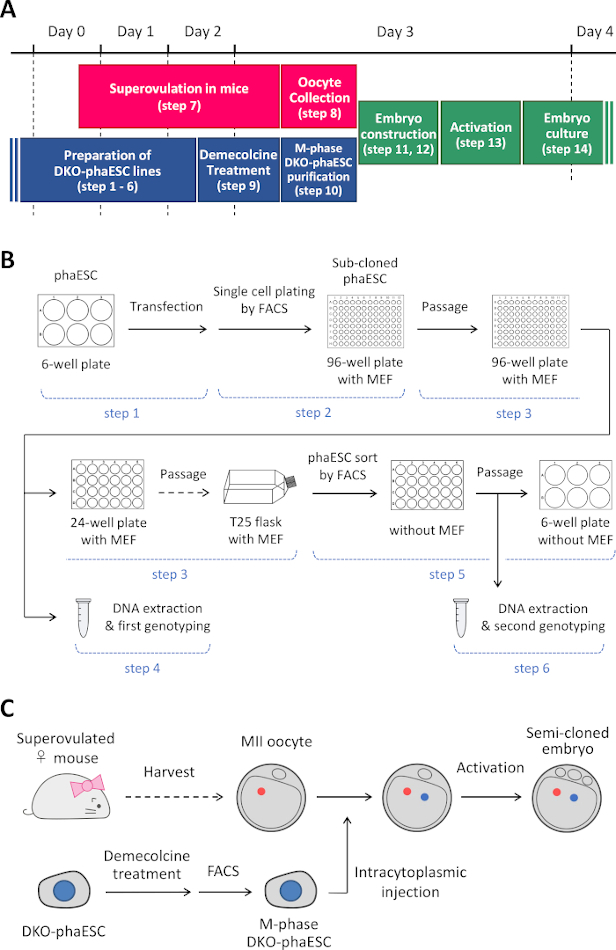
図1:精子置換術としてのDKO-phaESCの適用の概要(A) プロトコルの手順の時間枠。(B) このスキームは、DKO-phaESC ラインを確立する手順を示しています (ステップ 1 ~ 6)。(C) このスキームは、MiI卵母細胞へのDKO-phaESCの細胞質注入による半クローン胚を構築するステップを示す(ステップ7~14)。省略形: DKO = ダブルノックアウト;phaESC = 一部の遺伝的ハプロイド胚性幹細胞;FACS = 蛍光活性化細胞分類;MEF = マウス胚性線維芽細胞。 この図の大きなバージョンを表示するには、ここをクリックしてください。
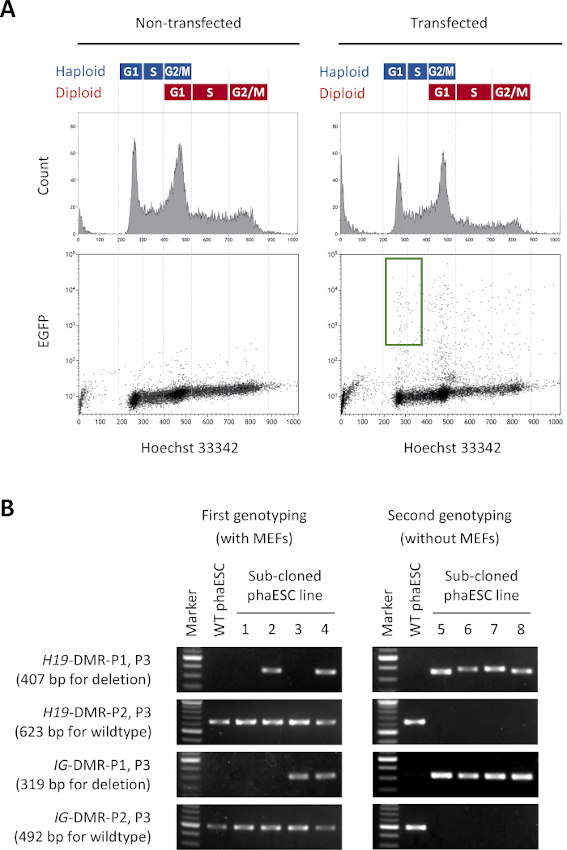
図2:CrispR/Cas9媒介によるH19およびIG-DDRのDKO-phaESCラインの確立(A)ピギーバクプラスミドを用いたトランスフェックのフローサイトメトリー解析を安定したEGFP発現と4 CRISPR/Cas9プラスミドで行う。非トランスフェクトphaESCsはコントロールとして示されています。DNAプロファイル(上)は、ハプロイドおよびジプロイド細胞の細胞周期分布を示す。EGFPを発現するG1/S相ハプロイド細胞は緑色のゲート(下、右)で示されます。(B) MEF (最初のジェノタイピング) と MEF の除去後 (第二のジェノタイピング) で成長したphaESCサブクローンのジェノタイピング。サブクローニングphaESC行1、2、3、および4は、野生型細胞、H19-DMR欠失を有する細胞、IG-DMR欠失を有し、およびH19およびIG-DMR欠失をそれぞれ結合した。DKO-phaESC ライン 5~8 はH19-DMR とIG-DMR の両方の欠失を持ち、野生型対立遺伝子から解放されます。省略形: DKO = ダブルノックアウト;phaESC = 一部の遺伝的ハプロイド胚性幹細胞;DMR = 微分メチル化領域;MEF = マウス胚性線維芽細胞;EGFP = 強化された緑色蛍光タンパク質;WT = ワイルドタイプ。この図の大きなバージョンを表示するには、ここをクリックしてください。
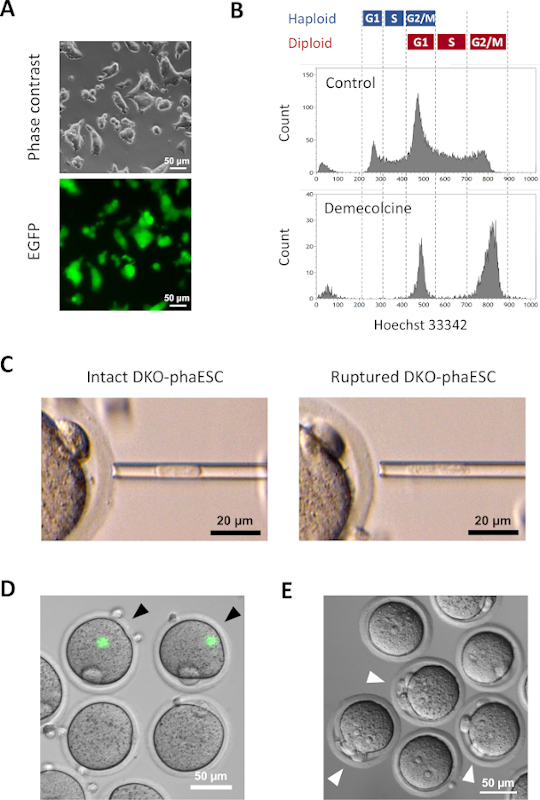
図3 MII卵母細胞への有糸分裂性逮捕DKO-phescの注入(A) CaG-EGFPトランスジーンを運ぶDKO-phaESC文化の形態とH19-およびIG-DDRの欠失;スケールバー=50μm(B)デメコルシンで逮捕後のDKO-ファエックの代表的なフローサイトメクシー解析を8時間、デメコルシン処理なしでDKO-phaESCが制御として示されている。(C) マイクロインジェクションピペット中のDKO-phaESCの形態ピペット処理によって原形質膜を破裂させる前(左)および後(右)単一の無傷のDKO-phaESCが示されている。スケールバー= 20 μm(D) MiI卵母細胞へのDKO-ファセスクの注入後1時間で胚を構築した。EGFP蛍光と明るいフィールドの合成画像を示す。黒い矢印は、インタクトDKO-phaESCの注入後の強烈なEGFP発現の丸い斑点を示し、これは避けるべきである。スケールバー=50μm(E)塩化ストロンチウムによる活性化開始後6時間の半クローン胚の差動干渉コントラスト画像が示されている。白い矢印は、注射されたDKO-phaESCから1つの疑似極性体を含む3つの極性体を有する胚を示す。スケールバー= 50 μm。省略形: DKO = ダブルノックアウト;phaESC = 一部の遺伝的ハプロイド胚性幹細胞;EGFP = 強化された緑色蛍光タンパク質。この図の大きなバージョンを表示するには、ここをクリックしてください。
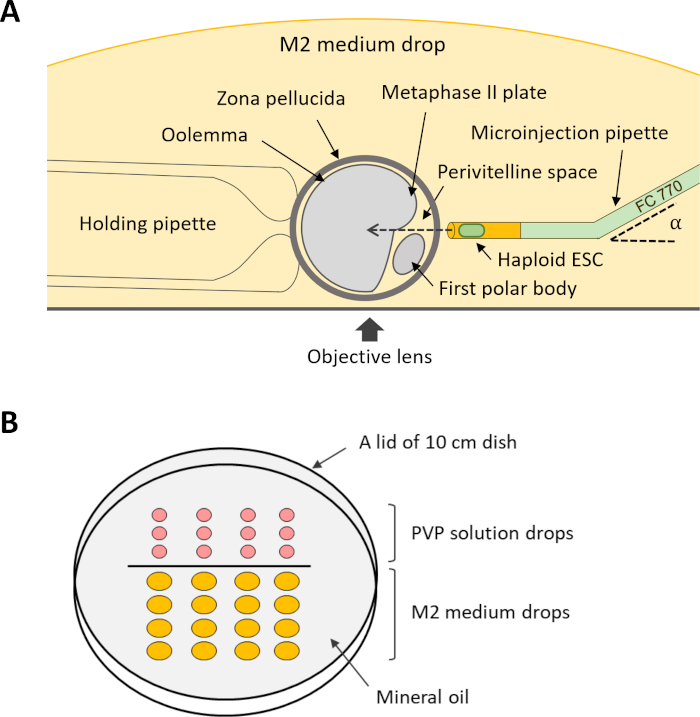
図4:卵母細胞へのDKO-phaESCの細胞内注入のためのセットアップのスキーム。(A)注入のピペット、保持ピペット、および注入室の卵母細胞の配置が示されている。α、マイクロインジェクションピペットのベンド角度。(B)細胞内注入のためのマイクロマニピュレーション皿の滴のレイアウト。省略形: DKO = ダブルノックアウト;phaESC = 一部の遺伝的ハプロイド胚性幹細胞。この図の大きなバージョンを表示するには、ここをクリックしてください。
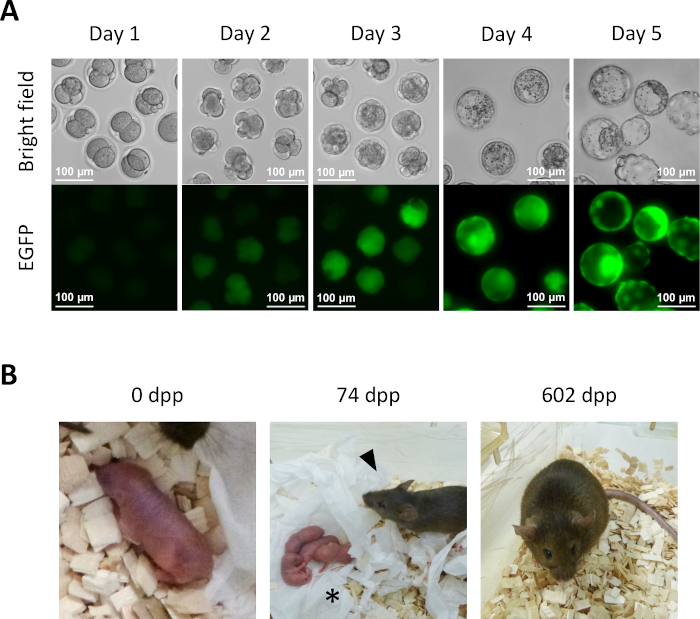
図5:半クローン胚の開発(A)インビトロでの半クローン胚の着床前の開発。EGFP発現は、細胞内細胞質注入後2日目に4細胞胚で最初に観察される。4日目には、激しいEGFP発現が胚盤胞で観察される。スケールバー= 100 μm(B) 2細胞胚転移後に得られた半クローンマウス74 dppで、半クローンマウス(矢印頭)は、野生のタイプのスイスのウェブスターの男性と交配した後、自然出産によって彼女の最初の子犬(アスタリスク)を提供しました。この図に示す半クローン化胚と半クローンマウスは、アイザワら3で報告されたものと同一である。略語: EGFP = 強化された緑色蛍光タンパク質; .dpp, 産後日. この図の大きなバージョンを表示するには、ここをクリックしてください。
| ゼラチン溶液 | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| 水 | - | 500 mL | - |
| ゼラチン | - | 1 g | 0.2% |
| ハプロイド胚性幹細胞(HaESC)培地 | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| NDiff 227 | - | 10 mL | - |
| CHIR 99021 | 10mM | 3 μL | 3 μM |
| PD 0325901 | 10mM | 1 μL | 1 μM |
| LIF | 1 x 106 IU/mL | 10 μL | 1,000 IU/mL |
| ペニシリンストレプトマイシン | 100倍 | 100 μL | 1x |
| HAESC メンテナンスバッファー | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| ハーESC培地 | - | 1 mL | - |
| ヘペス溶液 | 1 M | 20 μL | 20mM |
| 洗浄バッファー | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| DMEM / F-12 | - | 100 mL | - |
| BSA 分数 | 7.5% | 7.1 mL | 0.5% |
| MEF培地 | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| DMEM | - | 500 mL | - |
| FBS | - | 56 mL | 10% |
| β-メルカプトエタノール | 14.3モル/L | 3.9 μL | 100 μM |
| ペニシリンストレプトマイシン | 100倍 | 5.6 mL | 1x |
| リシスバッファー | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| 水 | - | 8.25 mL | - |
| トリス-HCl (pH 8.5) | 1 M | 1 mL | 100mM |
| エドタ | 0.5 M | 100 μL | 5 mM |
| SDS ソリューション | 10% | 200 μL | 0.2% |
| ナクル | 5 M | 400 μL | 200 mM |
| プロテイナーゼ K | 20 mg/mL | 50 μL | 100 μg/mL |
| アクティベーションメディア | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| KSOM | - | 1 mL | - |
| 塩化ストロンチウム | 1 M | 5 μL | 5 mM |
| EGTA | 0.5 M, pH 8.0 | 4 μL | 2 mM |
| PVPソリューション | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| M2培地 | - | 5 mL | - |
| PVP | - | 0.6 g | 12% |
| PMSG ソリューション | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| PBS | - | 450 μL | - |
| PMSG | 500 IU/mL | 50 μL | 50 IU/mL |
| hCG溶液 | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| PBS | - | 450 μL | - |
| hCG | 500 IU/mL | 50 μL | 50 IU/mL |
| ヒアルロンジダーゼ培地 | |||
| コンポーネント | 在庫集中 | 容積/重量 | 最終濃度 |
| M2培地 | - | 380 μL | - |
| ヒアルロニダーゼ | 10 mg/mL | 20 μL | 0.5 mg/mL |
| 略語: LIF = 白血病阻害因子;MEF = マウス胚性線維芽細胞; | |||
| FBS = 牛胎児血清;DMEM = ダルベックの修正イーグルミディアム;BSA = ウシ血清アルブミン; | |||
| EDTA = エチレンアミンテトラ酢酸;SDS = ドデシル硫酸ナトリウム;EGTA = エチレンビス(オキシエチレンニトリロ)テトラ酢酸; | |||
| PBS = リン酸緩衝生理食塩分;PVP = ポリビニルピロリドン;hCG = ヒト絨毛性ゴナドトロピン; | |||
| PMSG =妊娠中のマレ血清性ゴナドトロピン。 | |||
表1:培地、バッファー、および溶液のレシピ。
| 名前 | シーケンス(5'から3'まで) | アプリケーション | |
| H19-DMR-P1 | GTG GTT AGT TCT アタ TGG GG | ジェノタイピング | |
| H19-DMR-P2 | アガ TGG GGT キャット TCT TTT CC | ジェノタイピング | |
| H19-DMR-P3 | TCT TAC AGT GT GTGT GTC TTG GT | ジェノタイピング | |
| IG-DMR-P1 | TGT GCA GCA GCA AAG CTA AG | ジェノタイピング | |
| IG-DMR-P2 | CCA CAA AAA CCT CCC TTT CA | ジェノタイピング | |
| IG-DMR-P3 | アタ CGA TAC GGC AAC CAA CG | ジェノタイピング | |
| H19-DMR-gRNA1-F | CAC CCA TGA ACT CAG AAG アガ CTG | gRNA | |
| H19-DMR-gRNA1-R | AAA CCA GTC TCT TCT ギャグ TTC ATG | gRNA | |
| H19-DMR-gRNA2-F | CAC CAG GTG アガ アクト GCT ギャグ | gRNA | |
| H19-DMR-gRNA2-R | AAA CCT CAG CAG TGG TTC TCA CCT | gRNA | |
| IG-DMR-gRNA1-F | CAC CCG TAC アガ GCT CCA TGG CAC | gRNA | |
| IG-DMR-gRNA1-R | AAA CGT GCC ATG GAG CTC TGT ACG | gRNA | |
| IG-DMR-gRNA2-F | CAC CCT GCT タグ アッグ タック タック GCT | gRNA | |
| IG-DMR-gRNA2-R | AAA CAG CGT AGT ACC TCT AAG CAG | gRNA | |
表2:オリゴヌクレオチドのリスト
ディスカッション
体細胞核移動による哺乳類のクローニング(SCNT)は、1990年代、20年、21年に開拓された。これらの開発は、両生類22で30年前に行われたクローニング研究に続いた。かなりの遅延は、哺乳類における発生学およびゲノム刷り込みの難しさを反映している。哺乳類SCNTの開発は、精子を置換するためのhaESCの適用の基礎であり、このプロトコルで詳述されている。
セル周期同期は、SCNT23の成功の重要な要素です。これは、このプロトコルでのhaESCの注入の場合でもあります。レシピエントにドナーゲノムを導入するには、染色体破損や胚の発達を損なう無数化を避けるために、細胞周期相を一致させる必要があります。セミクローニングは、2つのゲノムと細胞トップラストに互換性を持たねねねなくてはないほど複雑です。以前の報告では、M相逮捕アンドロジェネティックhaESCの注入は、卵母細胞へのG1相haESCの注入よりも半クローン胚のより良い発達率をもたらしたことを実証した7。このレポートは、セミクローニングに適した同期点としてM-phaseを提案します。したがって、ファエスクは、デメコルシンとのメタフェーズでマイトサイト的に逮捕され、MII卵母細胞の卵母斑に注入され、これは自然にマイオシスのメタフェーズIIで逮捕された。重要なことに、M相停止は、ドナーとレシピエント細胞サイクル間の優れた同期を提供し、高効率のマウスESCで達成することができます。
有糸分裂の間、核膜は分解し、複製された染色体が付着する紡錘の形をする。M相DKO-phaESCを注入した後、姉妹クロマチは擬似極体とザイゴテ7 に分離される(図3E)。その結果、DKO-phaESCからの染色体の単一のセットは、半クローン胚に寄与する。DKO-phaESC染色体の姉妹染色体は、注射後に正しく分離できることが重要です。無傷のDKO-phaESCの原形質膜は、疑似極性体への分離を防ぎます。DKO-phaESCの原形質膜が破裂せず、胚が注射後に卵母質に無傷のDKO-phesCを示した稀な症例を実際に観察した(図3D)。したがって、ピペット処理によってDKO-phaESCの原形質膜を除去するために注意する必要があります。注射中に、卵母細胞の大腸スピンドルの破壊を避けることも同様に重要であり、染色体分離欠陥を引き起こし、異数化を誘発する可能性もある。
哺乳類では、ゲノムインプリンティングは、精子置換としてのファセスクの適用を制限する。パルテノジェネティックhaESCはゲノムインプリントの母体構成を有し、精子は父親の構成を有する。したがって、精子置換として野生型ファセスクを注射した後、完全な期間の子犬の生成は起こっていない。この制限を克服するために、IG-およびH19-DDRの欠失はファエックで設計される。母体Igf2-H19およびGtl2-Dlk1 lociにおけるインプリント発現の修飾は、転写された2細胞胚に基づいて、5.1%以上の頻度を有する半クローンマウスの生成を可能にするゲノムインプリントの構成を変更するのに十分である。これらの観察は、2つのインプリントされた遺伝子を標的とすることで、phaESCのゲノムをマウスの精子に置き換えることができる機能的な父方構成に切り替えることを示唆している。それにもかかわらず、この戦略にはphaESCの恒久的な遺伝子組み換えが必要です。代替戦略として、アンドロジェネティックhaESCを検討することができます。アンドロジェネティックなHAESCは、精子ゲノムに由来し、父方のインプリントを所有しています。野生型アンドロジェネティックhaESCが精子置換術として寄与し、移された胚4、7、24の1.3%から1.9%の頻度で全期の子犬を生成したという報告がある。フルタームの子犬はまた、IGの欠失を伴うアンドロジェネティックなhaESCを注入することによって得られた - とH19-DDRは、移された2細胞胚の20.2%の頻度で24。改変アンドロジェネティックhaESCを用いたセミクローニングの効率の向上は、インプリントが培養中に不安定になる可能性があるためである可能性が高い。刻印欠陥は、重要なDDRの遺伝的欠失によって修正される。
卵母細胞や精子のゲノムに遺伝子組み換えを直接導入するのが難しいので、haESCは親のゲノムを別々に操作するための貴重なツールです。精子の代用としてhaESCを使用すると、マウス生殖細胞系列におけるゲノム編集に顕著な利点をもたらします。最近の研究では、CRISPR/Cas9ベースのゲノム編集と、胚発生に不可欠なインプリンティング領域の特性評価のためのhaESCの応用を組み合わせたものであった12。本研究では、母性マウスの開発におけるH19-およびIG-DMRとの組み合わせにおけるRasgrf1-DMRの役割と、卵子子の発達における7つの異なるDMRの機能を分析した。精子に対するhaESCの置換方法は、原始胚芽細胞の発達におけるDND1タンパク質内の主要アミノ酸を同定し、骨発達24、25、26における遺伝子を同定するための遺伝子スクリーニングアプローチの基礎を形成した。胚発生の重要な要因を特定するためのゲノムインプリンティングと遺伝子スクリーニングに関する研究は、haESCをガメティックゲノムとして適用するためのかなりのアプローチです。
開示事項
著者らは開示するものは何もない。
謝辞
ジュリオ・ディ・ミン博士のphaESCラインの誘導、フローサイトメトリー手術のレモ・フライマン博士に感謝します。また、ミシェル・シャフナー氏とトーマス・M・ヘネク氏が胚移植に関する技術支援を行ったことを認めます。この研究は、スイス国立科学財団(助成金31003A_152814/1)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mLTube | Eppendorf | 0030 125.150 | haESC culture |
| 15 ml Tube | Greiner Bio-One | 188271 | haESC culture |
| 12-well plate | Thermo Scientific | 150628 | haESC culture |
| 24-well plate | Thermo Scientific | 142475 | haESC culture |
| 6-well plate | Thermo Scientific | 140675 | haESC culture |
| 96-well plate | Thermo Scientific | 167008 | haESC culture |
| β-Mercaptoethanol | Merck | M6250 | haESC culture |
| BSA fraction | Gibco | 15260-037 | haESC culture |
| CHIR 99021 | Axon | 1386 | haESC culture |
| Demecolcine solution | Merck | D1925 | haESC culture |
| DMEM | Gibco | 41965-039 | haESC culture |
| DMEM / F-12 | Gibco | 11320-033 | haESC culture |
| DR4 mouse | The Jackson Laboratory | 3208 | haESC culture |
| EDTA | Merck | E5134 | haESC culture |
| FBS | biowest | S1810-500 | haESC culture |
| Freezing medium | amsbio | 11897 | haESC culture |
| Gelatin | Merck | G1890 | haESC culture |
| Hepes solution | Gibco | 15630-056 | haESC culture |
| Irradiated MEF | Gibco | A34966 | haESC culture |
| LIF (Leukemia inhibitory factor) | (Homemade) | - | haESC culture |
| Lipofection reagent | Invitrogen | 11668019 | haESC culture |
| NDiff 227 | Takara | Y40002 | haESC culture |
| PD 0325901 | Axon | 1408 | haESC culture |
| Pen Strep | Gibco | 15140-122 | haESC culture |
| piggyBac plasmid carrying a CAG-EGFP transgene | Addgene | #40973 | haESC culture |
| piggyBac transposase plasmid | System Biosciences | PB210PA-1 | haESC culture |
| pX330 plasmid | Addgene | #42230 | haESC culture |
| pX458 plasmid | Addgene | #48138 | haESC culture |
| Trypsin | Gibco | 15090-046 | haESC culture |
| DNA polymerase | Thermo Scientific | F549S | Genotyping |
| dNTP Mix | Thermo Scientific | R0192 | Genotyping |
| Ethanol | Merck | 100983 | Genotyping |
| Hydrochloric acid | Merck | 100317 | Genotyping |
| Isopropanol | Merck | 109634 | Genotyping |
| Proteinase K | Axon | A3830 | Genotyping |
| SDS | Merck | 71729 | Genotyping |
| Sodium chloride | Merck | 106404 | Genotyping |
| ThermoMixer | Epeendorf | 5384000012 | Genotyping |
| Tris | Merck | T1503 | Genotyping |
| 5 mL Tube | Falcon | 352063 | Flow cytometry |
| 5 mL Tube with cell strainer cap | Falcon | 352235 | Flow cytometry |
| Hoechst 33342 | Invitrogen | H3570 | Flow cytometry |
| MoFlo Astrios EQ | Beckman Coulter | B25982 | Flow cytometry |
| 1 mL syringe | Codan | 62.1640 | Superovulation |
| 30-gauge 1/2 inch needle | Merck | Z192362-100EA | Superovulation |
| B6D2F1 mouse | The Jackson Laboratory | 100006 | Superovulation |
| hCG | MSD animal health | 49451 | Superovulation |
| PBS | Gibco | 10010015 | Superovulation |
| PMSG | Avivasysbio | OPPA1037 5000 IU | Superovulation |
| 10-cm dish | Thermo Scientific | 150350 | Embryo manipulation |
| 4-well plate | Thermo Scientific | 179830 | Embryo manipulation |
| 50 mL tube | Greiner Bio-One | 227261 | Embryo manipulation |
| 6 cm dish | Thermo Scientific | 150288 | Embryo manipulation |
| Center-well dish | Corning | 3260 | Embryo manipulation |
| Digital rocker | Thermo Scientific | 88880020 | Embryo manipulation |
| EGTA | AppliChem | A0878 | Embryo manipulation |
| Hyaluronidase | Merck | H4272 | Embryo manipulation |
| KSOM | Merck | MR-020P-5F | Embryo manipulation |
| M16 medium | Merck | M7292 | Embryo manipulation |
| M2 medium | Merck | M7167 | Embryo manipulation |
| Mineral oil | Merck | M8410 | Embryo manipulation |
| Glass capillary | Merck | P1049-1PAK | Embryo manipulation |
| Stereomicroscope | Nikon | SMZ745 | Embryo manipulation |
| Strontium chloride | Merck | 13909 | Embryo manipulation |
| 5ml syringe | Codan | 62.5607 | Microinjection |
| Borosilicate glass cappilary | Science product | GB100T-8P | Microinjection |
| CellTram 4r Oil | Eppendorf | 5196000030 | Microinjection |
| Fluorinert FC-770 | Merck | F3556 | Microinjection |
| Holding pipette | BioMedical Instruments | - | Microinjection |
| Inverted microscope | Nikon | Eclipse Ti-U | Microinjection |
| Microforge | Narishige | MF-900 | Microinjection |
| Microinjection pipette | BioMedical Instruments | - | Microinjection |
| Microlaoder tips | Eppendorf | 5252 956.003 | Microinjection |
| Micromanipulaor arms | Narishige | NT-88-V3 | Microinjection |
| Micropipette puller | Sutter Instrument | P-1000 | Microinjection |
| PiezoXpert | Eppendorf | 5194000016 | Microinjection |
| PVP (Polyvinylpyrrolidine) | Merck | PVP360 | Microinjection |
| Syringe filter | SARSTEDT | 83.1826.001 | Microinjection |
参考文献
- Ellegren, H., Galtier, N. Determinants of genetic diversity. Nature Reviews: Genetics. 17 (7), 422-433 (2016).
- Huijbers, I. J. Generating genetically modified mice: A decision guide. Methods in Molecular Biology. 1642, 1-19 (2017).
- Aizawa, E., Dumeau, C. E., Freimann, R., Di Minin, G., Wutz, A. Polyploidy of semi-cloned embryos generated from parthenogenetic haploid embryonic stem cells. PloS One. 15 (9), 0233072(2020).
- Li, W., et al. Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature. 490 (7420), 407-411 (2012).
- Li, Z., et al. Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells. Cell Research. 26 (1), 135-138 (2016).
- Wan, H., et al. Parthenogenetic haploid embryonic stem cells produce fertile mice. Cell Research. 23 (11), 1330-1333 (2013).
- Yang, H., et al. Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell. 149 (3), 605-617 (2012).
- Zhong, C., et al. Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell Research. 26 (1), 131-134 (2016).
- Elling, U., et al. Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell Stem Cell. 9 (6), 563-574 (2011).
- Leeb, M., Wutz, A. Derivation of haploid embryonic stem cells from mouse embryos. Nature. 479 (7371), 131-134 (2011).
- Surani, M. A., Barton, S. C., Norris, M. L. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature. 308 (5959), 548-550 (1984).
- Li, Z. K., et al. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell. 23 (5), 665-676 (2018).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shuai, L., et al. Generation of mammalian offspring by haploid embryonic stem cells microinjection. Current Protocols in Stem Cell Biology. 31, 1-15 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2014).
- O'Neill, G. T., Rolfe, L. R., Kaufman, M. H. Developmental potential and chromosome constitution of strontium-induced mouse parthenogenones. Molecular Reproduction and Development. 30 (3), 214-219 (1991).
- Campbell, K. H., McWhir, J., Ritchie, W. A., Wilmut, I. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569), 64-66 (1996).
- Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R., Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature. 394 (6691), 369-374 (1998).
- Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., Campbell, K. H. Viable offspring derived from fetal and adult mammalian cells. Nature. 385 (6619), 810-813 (1997).
- Gurdon, J. B. Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273 (1962).
- Campbell, K. H., Alberio, R. Reprogramming the genome: role of the cell cycle. Reproduction Supplement. 61, 477-494 (2003).
- Zhong, C., et al. CRISPR-Cas9-mediated genetic screening in mice with haploid embryonic stem cells carrying a guide RNA library. Cell Stem Cell. 17 (2), 221-232 (2015).
- Bai, M., et al. Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development. PLoS Biology. 17 (7), 3000350(2019).
- Li, Q., et al. CRISPR-Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development. Nature Cell Biology. 20 (11), 1315-1325 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved