Method Article
التهجين الفلوري في الموقع على مستحضرات هالة الحمض النووي للكشف عن الكروموسومات الكاملة والتيلوميرات ومواقع الجينات
In This Article
Erratum Notice
Summary
يتيح الجمع بين مستحضرات هالة الحمض النووي والتهجين الفلوري في الموقع إجراء تحليل عالي الدقة للتفاعلات الجينومية مع الهيكل النووي. يؤدي الجينوم المرفق إلى إشارات فلورية مهجنة تقع داخل النوى المستخرجة المتبقية ، في حين أن الجينوم غير المرتبط موجود في هالة الحمض النووي المحيطة بالنوى المتبقية.
Abstract
يرتبط الجينوم بالعديد من الهياكل داخل نوى الخلية ، من أجل تنظيم نشاطه وتثبيته في مواقع محددة. تعرف هذه التراكيب مجتمعة باسم الهيكل النووي وتشمل الصفيحة النووية والنواة والأجسام النووية. على الرغم من وجود العديد من المتغيرات من التهجين الفلوري في الموقع (FISH) لدراسة الجينوم وتنظيمه ، إلا أنها غالبا ما تكون محدودة بالدقة وتوفر معلومات غير كافية عن ارتباط الجينوم بالهياكل النووية. تستخدم طريقة هالة الحمض النووي تركيزات عالية من الملح والمنظفات غير الأيونية لتوليد حلقات الحمض النووي التي تظل مثبتة على الهياكل داخل النوى من خلال مناطق التعلق داخل الجينوم. هنا ، يتم استخراج البروتينات النووية القابلة للذوبان ، مثل الهستونات والليبيدات والحمض النووي غير المرتبط بإحكام بالمصفوفة النووية. وهذا يؤدي إلى تكوين هالة من الحمض النووي غير المرتبط تحيط بنواة متبقية تحتوي في حد ذاتها على الحمض النووي المرتبط ارتباطا وثيقا بالهياكل النووية الداخلية والبروتينات المقاومة للاستخراج. تتيح خيوط الحمض النووي الممتدة هذه زيادة الدقة ويمكن أن تسهل رسم الخرائط المادية. بالاقتران مع FISH ، تتمتع هذه الطريقة بميزة إضافية تتمثل في دراسة التفاعلات الجينومية مع جميع الهياكل التي يرتكز عليها الجينوم. هذه التقنية ، التي يطلق عليها HALO-FISH ، متعددة الاستخدامات للغاية حيث يمكن أن تقترن هالات الحمض النووي بمجسات الحمض النووي للكشف عن مواقع الجينات والكروموسومات الكاملة وقمر ألفا والتيلوميرات وحتى الحمض النووي الريبي. توفر هذه التقنية نظرة ثاقبة للتنظيم النووي والوظيفة في الخلايا الطبيعية وفي تطور المرض كما هو الحال مع السرطان.
Introduction
تم وصف "المصفوفة النووية" لأول مرة من قبل بيريزني وكوفي في عام 19741. بعد إجراء عمليات الاستخراج ذات المولاريات عالية الملح ومعالجة النيوكلياز على نوى كبد الفئران ، حددوا إطارا هيكليا بروتينيا. تم تكييف إجراء هالة الحمض النووي لاحقا من هذه الطريقة ويتضمن إزالة البروتينات القابلة للذوبان بحيث تستمر فقط المصفوفة النووية (NM) والبروتينات والكروموسومات المرتبطة ب NM. تقع مناطق ارتباط الحمض النووي في قاعدة حلقات الحمض النووي وتسمى المناطق المرفقة بالمصفوفة (MARs) أو مناطق ارتباط السقالة (SARs) ، والتي تقاوم الاستخراج بتركيزات عالية من الملح والمنظفات الأيونية ليثيوم 3،5-ديودوساليسيلات (LIS) على التوالي. في هالات الحمض النووي ، يرتبط الحمض النووي المرتبط ب MARs / SARs داخل النواة المتبقية بينما تمتد حلقات الحمض النووي بعيدا عن هذه المواقع وتشكل هالة الحمض النووي. نحن نعلم الآن أن الجينوم يرتكز عبر المجالات المرتبطة بالصفيحة (LADs) إلى الصفيحة النووية ومن خلال المناطق المرتبطة بالنوى (NADs) وربما من خلال الهياكل النووية الأخرى مثل الأجسام النووية المحددة.
يمكن استخدام طريقة هالة الحمض النووي لرسم الخرائط الفيزيائية للحمض النووي والجينات ومناطق الكروموسومات حيث يوفر الحمض النووي الممتد والكروماتين دقة أكبر لأن الكروماتين يتم تجريده من الهستونات ويتم تمديد الحمض النووي2،3،4،5،6. ومع ذلك ، هناك بعض القيود عند استخدام هالات الحمض النووي لهذا التطبيق. على سبيل المثال ، يمكن أن يكون الحمض النووي المرتبط ارتباطا وثيقا بالنوى المتبقية من هالات الحمض النووي غير قابل للوصول إلى المجسات مما يمنعه من التحليل ورسم الخرائط الفيزيائية6. تقنيات أخرى مثل fiber-FISH2،4،5،7 والتمشيط الجزيئي8 تتيح أيضا رسم الخرائط المادية وتتمتع بميزة كونها سريعة نسبيا وسهلة الأداء. كلاهما يستخدم بشكل تفضيلي لرسم خرائط الحمض النووي للجينات عبر هالات الحمض النووي. تستخرج هذه الطرق ألياف الكروماتين عن طريق استخدام المذيبات أو استخراج الملح من النواة ، ومع ذلك ، يميل التمشيط الجزيئي إلى أن يكون له قابلية استنساخ أفضل 8,9.
هناك أدلة متزايدة على أن الهيكل النووي له دور في دعم العمليات النووية الرئيسية ، مثل مواقع التعلق بالحمض النووي ، وإعادة تشكيل الكروماتين ، ونسخ الحمض النووي ، وإصلاح الحمض النووي ، وتكرار الحمض النووي11,12. على هذا النحو ، تم تطوير تقنية هالة الحمض النووي للتحقيق في التفاعلات بين الهيكل النووي والجينوم خلال هذه الأنشطة الخلوية وتم استخدامها بشكل روتيني والإبلاغ عنها في الأبحاث. كما تم استخدام هذه التقنية للتحقيق في التفاعلات بين الجينوم والهيكل النووي فيما يتعلق بتطور المرض مع تحديد التغيرات المرتبطة بالأورام الخبيثة في البنية النووية11.
كما تم استخدام تقنية هالة الحمض النووي للتحقيق في العلاقة بين الجينوم والهيكل النووي أثناء التطور والتمايز12. استخدم عدد من الدراسات تباينا في تقنية هالة الحمض النووي المعروفة باسم halosperm13 أو SpermHalo-FISH إذا اقترنت ب FISH14. يرتبط كروماتين الحيوانات المنوية ارتباطا وثيقا بالبروتينات المعروفة باسم البروتامين وقد تم تطوير هذه التقنية لتحسين الوصول إلى الحمض النووي للحيوانات المنوية. تم استخدام Halosperm للتحقق من سلامة الحمض النووي للحيوانات المنوية وتحديد ما إذا كان هناك تلف في الحمض النووي. ترتبط الحيوانات المنوية ذات الضرر الأقل في الحمض النووي بحجم هالة أكبر للحمض النووي ، في حين أن الحيوانات المنوية ذات المستويات المتزايدة من الحمض النووي المجزأ والتالف تحتوي إما على هالات صغيرة أو لا شيء على الإطلاق. وبالتالي ، يمكن استخدام هالوزبيرم البذور كعلامة تنبؤية محتملة لجودة الجنين والحمل الناجح مع التلقيح الاصطناعي13. يؤكد هذا المثال على التطبيقات السريرية المحتملة لهذه التقنية. في عملنا ، استخدمنا HALO-FISH لتقييم التغيرات في سلوك الجينوم وتأثير علاجات دوائية محددة في مرض الشيخوخة المبكرة متلازمة هتشينسون جيلفورد بروجيريا (HGPS)15.
تسلط هذه الدراسات وغيرها الضوء على اتساع نطاق العمليات / التطبيقات التي يمكن استخدام تقنية هالة الحمض النووي لدراستها وفائدتها.
Protocol
1. إعداد الشرائح والتعقيم وزراعة الخلايا
- تحضير 500 مل من 10٪ حمض الهيدروكلوريك (v / v) وتصب في دورق كبير.
- إسقاط المجهر ينزلق بشكل فردي في الحمض واحتضان لمدة 1 ساعة في درجة حرارة الغرفة على شاكر مجموعة في 2 × غرام.
تنبيه: حمض الهيدروكلوريك مادة أكالة ومهيجة. قد يسبب حروقا جلدية شديدة وتلفا في العين وتهيجا في الجلد والعينين والجهاز التنفسي. تأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات النتريل وحماية العين ومعطف المختبر. - صب الحمض من الدورق واغسله ينزلق عشر مرات في ماء الصنبور ثم عشر مرات أخرى في الماء منزوع الأيونات.
- شطف الشرائح في الميثانول مرتين والاحتفاظ بها في الميثانول حتى التعقيم عن طريق اللهب.
تنبيه: الميثانول سائل شديد الاشتعال وسام إذا ابتلع أو ملامس الجلد أو إذا تم استنشاقه. بالإضافة إلى ذلك ، قد يتسبب الميثانول في تلف الأعضاء ، وهو تآكل ومهيج. التزم بحدود التعرض في مكان العمل وتأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات بوتيل المطاطية وحماية العين ومعطف المختبر. حيثما أمكن ، تعامل مع خزانة دخان تهوية العادم المحلية (LEV). - باستخدام ملقط معدني أو ملقط طويل، قم بإزالة شريحة مجهرية من الكأس الزجاجية التي تحتوي على الميثانول. اللهب فوق موقد بنسن للتعقيم ، ونقله إلى وعاء زراعة خلية مستطيل يحتوي على أربع حجرات للشرائح ، وتقع بالقرب من موقد بنسن.
تنبيه: يسمح اللهب بالتعقيم الفوري لشرائح المجهر قبل الاستخدام ؛ ومع ذلك ، فإن هذه الطريقة لها مخاطر مرتبطة بها. وبما أن الميثانول شديد الاشتعال، فمن المهم أن توضع الكأس الزجاجية التي تحتوي على الشرائح بعيدا عن موقد بنسن. يجب استخدام ملقط طويل أو ملقط يمسك الشرائح بإحكام. يجب أن يغطي مستوى الميثانول في الدورق الشرائح فقط ، لتقليل كمية الميثانول المستخدمة بحيث تكون نهايات الملقط / الملقط فقط على اتصال بالميثانول. تأكد دائما من تبخر الميثانول من الملقط أو الملقط بعد الاستخدام وأن هذه قد بردت قبل وضعها مرة أخرى في الدورق الذي يحتوي على الشرائح والميثانول. يجب تغطية الكأس الزجاجية بقطعة من ورق الألمنيوم لتجويع الأكسجين في حالة اشتعال الميثانول. لا تنزلق أبدا باللهب داخل غطاء التدفق الصفحي من الفئة الثانية حيث يتم تدوير الهواء. - بدلا من ذلك ، قم بتنفيذ الخطوات من 1.1 إلى 1.4 ، ولكن بدلا من إشعال الشرائح بعد احتضانها بالميثانول ، ضع الشرائح على منديل خال من النسالة لتجف في الهواء. بمجرد أن يجف ، لفها بورق الألمنيوم وضعها في فرن معقم أو الأوتوكلاف.
- تنمو الخلايا في الوسط المناسب مع المصل لمدة 48 ساعة على الأقل عند 37 درجة مئوية في 5٪ CO2 حتى يتم الوصول إلى التقاء 60-70٪. تم تنفيذ هذا البروتوكول على مرور مبكر للخلايا الليفية الجلدية البشرية (HDFs) وعلى الخلايا الليفية الكلاسيكية لمتلازمة هتشينسون جيلفورد بروجيريا (HGPS) (AG06297) والخلايا الليفية غير النمطية من النوع 2 HGPS (AG08466). احصد كل نوع من الخلايا وعد باستخدام مقياس الدم لتحديد كثافة الخلية. البذور 1 × 105 خلايا في 10 مل متوسطة لكل شريحة.
ملاحظة: كثافة الخلية مهمة لأن حلقات الحمض النووي من نوى مختلفة قد تتقارب إذا أصبحت الخلايا متقاربة للغاية. قد تحتاج كثافات البذر إلى التحسين اعتمادا على نوع الخلية المستخدمة حيث قد تتكاثر الخلايا المحولة بسرعة أكبر ، في حين أن مزارع خلايا المرور اللاحقة قد تستغرق وقتا أطول للوصول إلى الالتقاء المطلوب. - إذا كانت هناك حاجة إلى إيقاف الخلايا في G0 لتصبح هادئة ، فقم بالبذور 1 × 105 خلايا (في وسط 10 مل) لكل شريحة واتركها تنمو لمدة 24 ساعة. اغسل الخلايا مرتين بوسط خال من المصل واحتضانها في وسط قياسي يحتوي على تركيز أقل من المصل بنسبة 0.5٪ (مصل ربلة الساق حديث الولادة ، NCS ؛ أو مصل بقري الجنين ، FBS) لمدة 7 أيام.
- إذا كانت الحالة التكاثرية للخلايا مطلوبة لفحص هالة الحمض النووي ، فحدد الخلايا التي مرت عبر S-Phase عن طريق دمج 5-bromo-2'-deoxy-uridine (BrdU) في الحمض النووي أثناء النسخ المتماثل.
- خلايا البذور كالمعتاد وتنمو لمدة 24 ساعة. قم بإزالة وسط الاستزراع واستبدله بوسط يحتوي على BrdU و 5-fluoro-2'-deoxyuridine (3 ميكروغرام / ميكرولتر). بعد 24 ساعة أخرى ، قم بإزالة الوسط ، واغسل الخلايا مرة واحدة بوسط (10٪ NCS) ثم أعد التغذية بوسط جديد (10٪ NCS). احتضان لمدة 24 ساعة إضافية ثم قم بإعداد الشرائح لفحص هالة الحمض النووي.
2. إعداد التحقيق
- مجسات طلاء الكروموسوم الكامل والذراع
- اصنع مجسات كروموسومية من تضخيم الكروموسومات المفرزة أو المشوهة عن طريق تفاعل البلمرة المتسلسل قليل النوكليوتيد المتحلل (DOP-PCR) باستخدام الطريقة التي استخدمها Telenius et al.16. استخدم DOP-PCR لتسمية مجسات الكروموسوم إما بالبيوتين-16-dUTP أو Digoxigenin-11-dUTP كما هو موضح في الجدول 1. يرجى مراجعة تعليمات الشركة المصنعة لملف تعريف التضخيم ، ومع ذلك ، فإن الشروط المستخدمة لهذه التجربة موضحة في الجدول 2.
- قم بإعداد مسبار الذراع أو الكروموسوم الكامل عن طريق جمع 8 ميكرولتر من منتج تفاعل البوليميراز المتسلسل المسمى ، و 7 ميكرولتر من الحمض النووي Cot-1 ، و 3 ميكرولتر من الحيوانات المنوية للرنجة ،وحجم 1 /20 من أسيتات الصوديوم 3 M (درجة الحموضة 5.4) و 2 مجلدات من الإيثانول بنسبة 100٪. احتضن محلول المسبار لمدة لا تقل عن 30 دقيقة عند -80 درجة مئوية.
ملاحظة: يمكن استخدام هذه الطريقة لإنشاء مجسات كروموسوم واحد ، أو مجسات كروموسوم متعددة إذا تم استخدام تسميات مختلفة (مثل Biotin-16-UTP و Digoxigenin-11-dUTP) لكل كروموسوم مهم.
تنبيه: الإيثانول سائل وبخار شديد الاشتعال وقد يسبب تهيجا خطيرا للعين. يحفظ بعيدا عن الحرارة والأسطح الساخنة ومصادر الاشتعال. التزم بحدود التعرض في مكان العمل وتأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات بوتيل المطاطية وحماية العين ومعطف المختبر. حيثما أمكن ، تعامل مع خزانة دخان LEV. - محلول مسبار الطرد المركزي عند 13700 × جم لمدة 15 دقيقة عند 4 درجات مئوية ثم يغسل بإيثانول 70٪. كرر إجراء الطرد المركزي وتخلص من المادة الطافية ، مع الحرص على عدم إزعاج أو فقدان حبيبات الحمض النووي. اترك حبيبات الحمض النووي حتى تجف.
- أضف 12 ميكرولتر من محلول التهجين (50٪ فورماميد ، 10٪ كبريتات ديكستران ، 10٪ 20x سترات الصوديوم المالحة (SSC ؛ 3 M كلوريد الصوديوم ، 0.3 M سترات ثلاثي الصوديوم ؛ درجة الحموضة 7.0) ، 1٪ (v / v) أحادي بولي أوكسي إيثيلين سوربينال (Tween-20)) إلى حبيبات الحمض النووي. اتركيه عند 37 درجة مئوية لمدة 2 ساعة على الأقل حتى تذوب حبيبات الحمض النووي في محلول التهجين.
تنبيه: الفورماميد مسرطن وماسخ لذلك قد يسبب ضررا خطيرا للطفل الذي لم يولد بعد. إذا كانت المرأة حاملا أو تشك في أنها حامل ، فيجب عليها تجنب العمل مع الفورماميد. يجب استخدام الفورماميد في غطاء دخان LEV. التزم بحدود التعرض في مكان العمل وتأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات بوتيل المطاطية وحماية العين ومعطف المختبر.
- عزل الحمض النووي من الكروموسومات الاصطناعية البكتيرية (BACs)
- قم بخط جزء صغير من مخزون الجلسرين من استنساخ BAC على صفيحة أجار Luria-Bertani (LB) (1٪ (W / V) كلوريد الصوديوم ؛ 1٪ (وزن / حجم) تريبتون ، 0.5٪ (وزن / حجم) مستخلص الخميرة ، 1.5٪ (وزن / حجم) أجار تقني ، 12.5 ميكروغرام / مل (وزن / حجم) كلورامفينيكول). احتضان بين عشية وضحاها في 37 درجة مئوية.
- حدد مستعمرة واحدة من اللوحة وقم بتلقيح 10 مل من مرق LB (1٪ (وزن / حجم) كلوريد الصوديوم ، 1٪ (وزن / حجم) باكتوتريبتون ، 0.5٪ (وزن / حجم) مستخلص الخميرة ، 12.5 ميكروغرام / مل (وزن / حجم) كلورامفينيكول). اترك المحلول في حاضنة اهتزاز طوال الليل عند 37 درجة مئوية.
تنبيه: يشتبه في أن الكلورامفينيكول يسبب السرطان. تعامل بحذر وقلل من التعرض. - ثقافة الطرد المركزي عند 1700 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية وأضف 300 ميكرولتر من محلول P1 (15 مللي متر تريس (درجة الحموضة 8) ، 10 مللي متر EDTA ، 100 ميكروغرام / مل RNase A) إلى الحبيبات. دوامة بقوة ونقل الخلايا إلى أنبوب الطرد المركزي 2 مل.
- أضف 300 ميكرولتر من محلول P2 (0.2 M NaOH ، 1٪ (وزن / حجم) كبريتات دوديسيل الصوديوم (SDS) بالتنقيط إلى الخلايا. اقلب أنبوب الطرد المركزي الدقيق المغلق 5 مرات واتركه في درجة حرارة الغرفة لمدة أقصاها 5 دقائق.
تنبيه: هيدروكسيد الصوديوم مادة أكالة وقد تسبب حروقا شديدة في الجلد وتلفا في العين. قد يكون تآكلا للمعادن. تعامل بحذر وقلل من التعرض. الالتزام بحدود التعرض في مكان العمل والتأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات النتريل المطاطية وحماية العين ومعطف المختبر. حيثما أمكن ، تعامل مع خزانة دخان LEV.
تنبيه: كبريتات دوديسيل الصوديوم مادة صلبة قابلة للاشتعال وضارة إذا ابتلعت وقد تسبب تهيج الجلد والجهاز التنفسي. قد يسبب أيضا تلفا خطيرا في العين. تأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات النتريل المطاطية وحماية العين ومعطف المختبر. حيثما أمكن ، تعامل مع خزانة دخان LEV. - أضف 300 ميكرولتر من P3 (3 M أسيتات البوتاسيوم) ببطء إلى الخلايا واخلطها برفق. ضع أنبوب الطرد المركزي الدقيق على الثلج لمدة 10 دقائق.
- جهاز طرد مركزي عند 8100 × جم لمدة 10 دقائق عند 4 درجات مئوية ونقل المادة الطافية إلى أنبوب يحتوي على 800 ميكرولتر من الأيزوبروبانول المثلج البارد. اقلب الأنبوب عدة مرات واحتضانه عند -20 درجة مئوية طوال الليل.
تنبيه: الأيزوبروبانول سائل وبخار شديد الاشتعال وقد يسبب تهيجا خطيرا للعين أو نعاسا أو دوخة. يحفظ بعيدا عن الحرارة والأسطح الساخنة ومصادر الاشتعال. التزم بحدود التعرض في مكان العمل وتأكد من ارتداء الحماية الشخصية المناسبة بما في ذلك قفازات النتريل المطاطية وحماية العين ومعطف المختبر. حيثما أمكن التعامل مع خزانة الدخان. - أجهزة الطرد المركزي عند 8100 × جم لمدة 15 دقيقة عند 4 درجات مئوية. قم بإزالة المادة الطافية ونقلها إلى أنبوب آخر. أضف 500 ميكرولتر من الإيثانول المثلج 70٪. عكس الأنبوب عدة مرات وأجهزة الطرد المركزي عند 8100 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة المادة الطافية وجفف الحبيبات في الهواء في درجة حرارة الغرفة. بمجرد أن تجف الحبيبات ، أعد تعليقها في 40 ميكرولتر من المياه المعالجة بثنائي إيثيل بيروكربونات (معالجة DEPC) واتركها عند 4 درجات مئوية طوال الليل. بمجرد إعادة التعليق بالكامل ، قم بإزالة 5 ميكرولتر من المحلول وقم بتحميله على هلام أغاروز 1٪ للتحقق من وجود الحمض النووي.
- إعداد مسبار جيني واحد ل BACs عبر ترجمة
- استخدم مجموعات ملصقات الترجمة المتوفرة تجاريا. بدلا من ذلك، استخدم البروتوكول التالي. انظر الجدول 3 للاطلاع على المكونات والأحجام.
- أضف المكونات من الجدول 3 معا في أنبوب طرد مركزي دقيق مع إضافة DNA Polymerase I أخيرا ، واخلطها برفق وأجهزة الطرد المركزي لفترة وجيزة لبضع ثوان. احتضان المحلول عند 15 درجة مئوية لمدة 2 ساعة.
- للتحقق من أحجام الشظايا ، قم بتحميل 5 ميكرولتر من المحلول على هلام أغاروز 2٪. يجب أن يتراوح حجم جزء الحمض النووي بين 200-600 نقطة أساس. إذا كانت أحجام شظايا الحمض النووي أكبر ، فاستمر في احتضان المحلول لمدة 15 دقيقة أخرى عند 15 درجة مئوية وقم بتشغيل المنتجات على هلام أغاروز 2٪.
- أوقف تفاعل الترجمة عن طريق إضافة 10 mM EDTA ، 0.1٪ SDS (2.5 ميكرولتر من 0.5 M EDTA ، درجة الحموضة 8.0 في 100 ميكرولتر و 1 ميكرولتر من 10٪ SDS في 100 ميكرولتر). سخني المحلول على حرارة 65 درجة مئوية لمدة 5 دقائق.
- لإزالة النيوكليوتيدات غير المدمجة ، قم بتطبيق مسبار BAC على عمود الدوران. يمكن شراء أعمدة الدوران التجارية ، أو يمكن إنشاؤها باستخدام حقنة على النحو التالي:
- أضف 30 جم من Sephadex G-50 إلى 500 مل من المخزن المؤقت للعمود (10 مللي متر Tris-HCl (pH8) ، 1 mM EDTA ، 0.1٪ SDS). الأوتوكلاف الخليط. أيضا ، اصنع 500 مل من المخزن المؤقت للعمود (بدون Sephadex G-50) والأوتوكلاف.
- اصنع أعمدة دوارة عن طريق إضافة صوف زجاجي معقم إلى قاع حقنة سعة 1 مل. املأ المحقنة سعة 1 مل ب Sephadex G-50 في المخزن المؤقت للعمود. ضع حقنة 1 مل في أنبوب طرد مركزي سعة 15 مل يحتوي على أنبوب طرد مركزي دقيق بدون غطاء في الأسفل. جهاز طرد مركزي عند 1600 × جم لمدة 5 دقائق.
- قم بإزالة المحقنة وتخلص من أنبوب الطرد المركزي الدقيق في الأسفل. أضف أنبوب طرد مركزي جديد مرة أخرى إلى أنبوب الطرد المركزي سعة 15 مل. أضف مخزن مؤقت للعمود (بدون Sephadex G-50) إلى حقنة سعة 1 مل وأعد إدخالها مرة أخرى في أنبوب طرد مركزي سعة 15 مل. جهاز طرد مركزي عند 1600 × جم لمدة 5 دقائق. كرر هذه الخطوة مرة أخرى مرتين.
- قم بإزالة المحقنة وأدخلها في أنبوب طرد مركزي سعة 15 مل يحتوي على أنبوب طرد مركزي نظيف جديد. ضع المسبار على المحقنة وجمع المسبار في أنبوب الطرد المركزي الدقيق.
- لترسيب مسبار الحمض النووي ، أضف 5 ميكرولتر من الحمض النووي للحيوانات المنوية للرنجة (10 مجم / مل) ، و 10 ميكرولتر من أسيتات الصوديوم و 2.25 حجم 100٪ إيثانول إلى محلول الحمض النووي. امزج المحلول برفق واحتضانه عند -80 درجة مئوية لمدة لا تقل عن 1 ساعة. جهاز طرد مركزي عند 13700 × جم لمدة 15 دقيقة عند 4 درجات مئوية.
- تخلص من المادة الطافية واغسل الحبيبات ب 200 ميكرولتر من الإيثانول المثلج 70٪ لمدة 15 دقيقة عند 4 درجات مئوية. قم بإزالة المادة الطافية وجففها في الهواء. بمجرد أن تجف ، أعد تعليق الحبيبات في 20 ميكرولتر من المياه المعالجة من DEPC في درجة حرارة الغرفة لعدة ساعات أو طوال الليل عند 4 درجات مئوية. المسبار جاهز الآن للاستخدام أو قد يتم تخزينه في -20 درجة مئوية.
- لكل شريحة ، امزج الحمض النووي للمسبار سعة 5 ميكرولتر مع الحمض النووي Cot-1 سعة 5 ميكرولتر وجفف باستخدام مكثف فراغ Speed Vac. بمجرد أن تجف الحبيبات ، أعد تعليقها في 12 ميكرولتر من مزيج التهجين.
3. إعداد هالة الحمض النووي
- قم بإزالة طبق الثقافة المربع الذي يحتوي على الشرائح والخلايا المرفقة من الحاضنة. تخلص من الشرائح المتوسطة باستخدام قلم رصاص وضعها في وعاء كوبلين يحتوي على 50 مل من المخزن المؤقت للهيكل الخلوي المثلج (CSK): 100 مللي متر كلوريد الصوديوم ، 3 مللي مول MgCl2 ، 0.3 M السكروز ، 10 mM 1 ، 4-piperazinediethanesulfonic acid (PIPES ؛ درجة الحموضة 7.8) ، 0.5٪ (v / v) Triton X-100 يتكون في ماء منزوع الأيونات. احتضان لمدة 15 دقيقة على الجليد أو على حرارة 4 درجة مئوية.
تنبيه: يمكن أن يسبب Triton X-100 تهيج الجلد وتلف العين الخطير. تعامل مع استخدام معدات الحماية الشخصية المناسبة بما في ذلك قفازات النتريل والنظارات الواقية ومعطف المختبر. - تخلص من المخزن المؤقت CSK واشطف الشرائح بسرعة في 50 مل من 1x عازلة هالة الحمض النووي (DHB ؛ 140 mM NaCl ، 27 mM KCl ، 110 mM NaHPO 4 ، 15 mM KH2PO4 ؛ pH7.4) ثلاث مرات ، أي اغمس الشريحة في جرة كوبلين التي تحتوي على DHB وقم بإزالتها.
- انقل الشرائح إلى جرة كوبلين تحتوي على 50 مل من محلول الاستخراج: 2 M كلوريد الصوديوم ، 10 mM PIPES (درجة الحموضة 6.8) ، 10 mM حمض الإيثيلين ديامينيترايتيك (EDTA) ، 0.1٪ (وزن / حجم) ديجيتونين ، 0.05 مللي متر (v / v) spermine ، 0.125 mM (v / v) spermidine. احتضان لمدة 4 دقائق في درجة حرارة الغرفة.
تنبيه: الديجيتونين سام إذا ابتلع أو لامس الجلد ويكون قاتلا إذا تم استنشاقه. تأكد من التعامل مع الديجيتونين في خزانة دخان LEV وارتداء معطف المختبر وقفازات النتريل (مزدوجة الغلوف) ونظارات السلامة والقناع. قد يسبب كل من السبيرمين والسبيرميدين حروقا جلدية شديدة وتلفا في العين ، بينما يسبب EDTA تهيجا خطيرا للعين ، لذا تعامل مع كل مادة كيميائية بعناية.
ملاحظة: تحضير الديجيتونين بشكل منفصل عن طريق إذابة المسحوق في الماء عند درجة حرارة 60-70 درجة مئوية. أضف الديجيتونين المذاب إلى المخزن المؤقت للاستخراج بمجرد تبريده. أضف السبيرمين والسبيرميدين والديجيتونين أخيرا إلى المخزن المؤقت للاستخراج للحفاظ على النشاط البيولوجي. - احتضان الشرائح على التوالي في 50 مل من 10x DHB (1.4 M كلوريد الصوديوم ، 270 mM KCl ، 1.1 M NaHPO 4 ، 150 mM KH2PO4 ؛ PH7.4) ، 5x ، 2x و 1x DHB لمدة 1 دقيقة لكل منهما.
- تراجع الشرائح (مباشرة للداخل وللخارج) من خلال سلسلة إيثانول متسلسلة 50 مل من الإيثانول بنسبة 10٪ و 30٪ و 70٪ و 95٪ (v / v).
- يجفف الهواء ويخزن في درجة حرارة -80 درجة مئوية حتى يتم إجراء التهجين الفلوري ثنائي الأبعاد في الموقع (2D FISH).
4. مضان ثنائي الأبعاد في التهجين في الموقع
- اصنع 20x SSC: 3 M كلوريد الصوديوم ، 0.3 M سترات ثلاثي الصوديوم ، درجة الحموضة 7.0. يمكن تعقيم هذا المخزن المؤقت وتخزينه في درجة حرارة الغرفة وتخفيفه حسب الحاجة.
- اصنع 70٪ (v / v) فورماميد ، 2x SSC pH 7.0 وسخن إلى 70 درجة مئوية في حمام مائي.
- احتضان الشرائح ، لمدة 5 دقائق لكل منها ، من خلال سلسلة إيثانول متسلسلة سعة 50 مل من الإيثانول 70 و 90 و 100٪.
- ينزلق المجفف في الهواء على طبق دافئ ويخبز في فرن على حرارة 70 درجة مئوية لمدة 5 دقائق.
- قم بتعويش الشرائح عن طريق وضعها في محلول فورماميد 70٪ ، 2x SSC لمدة دقيقتين عند 70 درجة مئوية.
ملاحظة: درجة الحرارة والتوقيت أمران حاسمان للخطوة 4.5. إذا كانت درجة الحرارة ، فلن يتشوه الحمض النووي ولن تهجن المجسات ، ولن يتم الحصول على أي إشارة من هالة الحمض النووي FISH. - ضع الشريحة المشوهة في 50 مل من الإيثانول المثلج البارد بنسبة 70٪ لمدة 5 دقائق وتناوله من خلال سلسلة إيثانول بنسبة 90٪ و 95٪ و 100٪ في درجة حرارة الغرفة لمدة 5 دقائق لكل منهما.
- جفف في الهواء على طبق تسخين
- تعامل مع مجسات الكروموسومات البشرية الكلية المسماة مباشرة وفقا لتعليمات الشركة المصنعة. في هذه التجارب ، استخدمنا دهانات الكروموسوم البشري الكامل 1 و 13 و 15 و 17 و 18. بالإضافة إلى ذلك ، في هذه التجربة ، تم استخدام مجسات الجينات CCND1 و CTNNA1 .
ملاحظة: تم تمييز كل من مجسات الكروموسومات بأكملها والمجسات الخاصة بجين BAC بالبيوتين -11-dUTP وتم اكتشافها بواسطة الستربتافيدين المترافق مع السيانين 3 (Cy3). بالنسبة لمجسات طلاء الكروموسوم التي تم إجراؤها بواسطة (DOP-PCR) و BAC DNA المسمى بترجمة ، سيشار إليها باسم مجسات الحمض النووي من هذه النقطة فصاعدا في البروتوكول وتعامل على النحو التالي. - مسبار الحمض النووي المشوه (طلاء كروموسوم كامل أو مسبار خاص بالجينات) عند 75 درجة مئوية لمدة 10 دقائق في كتلة ساخنة أو حمام مائي.
- يتم فحص الحمض النووي الدافئ عند 37 درجة مئوية لمدة 30 دقيقة في كتلة ساخنة أو حمام مائي قبل سحب 10 ميكرولتر على الشريحة المناسبة.
ملاحظة: هذه الخطوة مهمة لمنع تسلسل الكروموسومات المتكررة. إذا لم يتم إجراء إشارات غير محددة قد تنتج في الحمض النووي Halo FISH. - مسبار تراكب مع غطاء 21 مم × 21 مم وختم باستخدام الأسمنت المطاطي.
- احتضان الشرائح لمدة لا تقل عن 18 ساعة عند 37 درجة مئوية في غرفة تهجين مرطبة.
ملاحظة: يمكن صنع غرف التهجين المرطب من صناديق شطيرة تحتوي على عدة طبقات من الأنسجة المبللة ومنصة مرتفعة مصنوعة من ماصات بلاستيكية مقطوعة سعة 10 مل لإراحة الشرائح عليها. هذا مغطى بورق الألمنيوم لتقليل التعرض للضوء. - قم بإزالة الأسمنت المطاطي بعناية باستخدام الملقط.
- احتضان الشرائح في 50 مل 50٪ (v / v) فورماميد ، 2x SSC ، محلول درجة الحموضة 7.0 الذي تم تسخينه مسبقا إلى 45 درجة مئوية لمدة ثلاث حضانات لمدة 5 دقائق.
ملاحظة: اسمح لانزلاق الغطاء بالسقوط بعيدا عن الشريحة في الحضانة الأولى في محلول فورماميد 50٪ (v / v) ، 2x SSC ، pH 7.0. هذا يمنع تلف إعداد DNA Halo الذي يمكن أن يحدث بسبب "سحب" غطاء الغطاء بعيدا. يمكن تحريك الشرائح في المخزن المؤقت عن طريق الإمساك بالملقط للمساعدة في فصل انزلاق الغطاء. - بعد ذلك ، ضع الشرائح في 50 مل من محلول 0.1x SSC ، pH 7.0 الذي تم تسخينه مسبقا إلى 60 درجة مئوية ولكن تم وضعه في حمام مائي 45 درجة مئوية. احتضان لمدة 5 دقائق واستبدال المخزن المؤقت مرتين أخريين مع 5 دقائق الحضانة.
- ضع الشرائح في برطمان كوبلين يحتوي على 50 مل من محلول 4x SSC ، pH 7.0 في درجة حرارة الغرفة واحتضانها لمدة 15 دقيقة مع ثلاثة تغييرات في المخزن المؤقت.
- ضع 100 ميكرولتر من محلول 4٪ BSA و 4x SSC على كل شريحة وتراكب بقطعة من فيلم البارافين. احتضان في درجة حرارة الغرفة لمدة 10 دقائق. هذا يمنع الارتباط غير المحدد للجسم المضاد.
- للكشف عن المسبار المسمى (البيوتين -16-dUTP) ، احتضان مع 100 ميكرولتر من 1: 200 (صنع في 1 ٪ BSA ، 4x SSC) streptavidin-Cy3 لمدة 1 ساعة في درجة حرارة الغرفة.
ملاحظة: اتبع تعليمات الشركة المصنعة مع تخفيفات الأجسام المضادة واختبار التخفيف قبل التجربة لضمان إنتاج إشارة جيدة - ضع الشرائح في برطمان كوبلين يحتوي على 50 مل من محلول 4x SSC (0.5٪ Tween-20) pH 7.0 في درجة حرارة الغرفة واحتضانها لمدة 15 دقيقة مع ثلاثة تغييرات في المخزن المؤقت. يمكن تركيب الشرائح في هذه المرحلة كما هو موضح في الخطوة 4.21 إذا لم يكن التألق المناعي مطلوبا.
- إذا كانت الحالة التكاثرية للخلايا المصنوعة في هالات الحمض النووي مطلوبة ، فقم بتلطيخها بالأجسام المضادة ل pKi67 بعد خطوات FISH ، قبل التركيب أو البقعة ل BrdU المدمجة.
- اغسل الشرائح 3 مرات لمدة 5 دقائق لكل منها في 50 مل من 1x محلول ملحي مخزن بالفوسفات (PBS) ، متبوعا بالحجب بنسبة 4٪ NCS في PBS لمدة 1 ساعة في درجة حرارة الغرفة.
- ضع 200 ميكرولتر من الجسم المضاد الأساسي الضروري (أرنب مضاد للإنسان pKi67 ؛ الماوس المضاد ل BrdU) على الشريحة ، تراكب بشريط من فيلم البارافين واحتضانه في درجة حرارة الغرفة لمدة 1 ساعة.
- اغسل الشرائح 3 مرات لمدة 5 دقائق في 1x PBS واحتضانها في درجة حرارة الغرفة لمدة 1 ساعة في 200 ميكرولتر من الأجسام المضادة الثانوية المترافقة بالفلوروكروم (pKi67: الخنازير المضادة للأرانب TRITC; BrdU: حمار مكافحة الماوس Cy3). أداء 3 أكثر 5 دقائق يغسل مع برنامج تلفزيوني. يجب إجراء جميع التخفيفات باستخدام 1٪ (v / v) NCS في PBS في نطاق التخفيفات المقترحة من الشركات المصنعة.
- قم بتركيب شرائح بحجم 20 ميكرولتر من الحامل تحتوي على DAPI وتراكب مع غطاء 22 مم × 50 مم.
5. تيلومير بينا فيش
- للكشف عن التيلوميرات ، استخدم مجموعة التيلومير PNA FISH - FITC ؛ نفذ الإجراء وفقا لتعليمات الشركة المصنعة. يجب تنفيذ الإجراء في درجة حرارة الغرفة ، ما لم ينص على خلاف ذلك.
- اغمر الشرائح في محلول ملحي مخزن تريس (TBS ، درجة الحموضة 7.5) لمدة دقيقتين ثم ضعها في 3.7٪ فورمالديهايد (في TBS ؛ v / v) لمدة 2 دقيقة بالضبط.
تنبيه: يحتوي محلول TBS على 10-30٪ تروميتامول و 10-30٪ 2-أمينو-2- (هيدروكسي ميثيل) بروبان-1،3-ديول هيدروكلوريد. قد يتسبب ذلك في تهيج خطير للعين والجلد ، لذا ارتد قفازات واقية ونظارات واقية / حماية للوجه. استخدم في منطقة جيدة التهوية. - اغسل الشرائح في برطمان كوبلين مرتين باستخدام TBS لمدة 5 دقائق لكل منهما.
- اغمر الشرائح في محلول المعالجة المسبقة لمدة 10 دقائق ثم اغسلها مرتين باستخدام TBS لمدة 5 دقائق لكل غسلة.
- بعد ذلك ، خذ الشرائح من خلال سلسلة إيثانول مثلجة تتكون من 50 مل من 70٪ و 85٪ و 95٪ (v / v) من الإيثانول لمدة 2 دقيقة لكل تركيز. بعد ذلك اترك الشرائح تجف في الهواء.
- ضع 10 ميكرولتر من مسبار Telomere PNA / FITC (أو Cy3) اعتمادا على اختيار تلوين علامة الفلورسنت ، على كل شريحة وتراكب الغطاء مع غطاء الغطاء. احتضانها في فرن مسخن مسبقا على حرارة 80 درجة مئوية لمدة 5 دقائق ثم ضعيها في الظلام لمدة 1 ساعة تقريبا.
تنبيه: يحتوي Telomere PNA Probe / FITC على 6-100٪ فورماميد ، والذي يسبب تهيجا خطيرا للعين وهو ماسخ لذلك قد يسبب ضررا خطيرا للطفل الذي لم يولد بعد. إذا كانت المرأة حاملا أو تشك في أنها حامل ، فيجب عليها تجنب العمل مع الفورماميد. يجب استخدام الفورماميد في غطاء دخان LEV ويجب ارتداء واقي مناسب للعين أو الوجه. - لإزالة أغطية الغطاء ، اغمر الشرائح في "محلول الشطف" لمدة 1 دقيقة ثم ضعها في "محلول الغسيل" لمدة 5 دقائق عند 65 درجة مئوية.
تنبيه: يحتوي محلول الغسيل على 1-5٪ بولي أوكسي إيثيلين أوكتيل فينيل إيثر و 1-5٪ كلوريد الصوديوم. هذا تآكل ويمكن أن يسبب أضرارا خطيرة للعين. تأكد من ارتداء النظارات الواقية أو واقي الوجه عند التعامل مع محلول الغسيل. - احتضان الشرائح من خلال 50 مل من سلسلة الإيثانول الجليد البارد (70٪ ، 85٪ و 95٪ (v / v)) لمدة 2 دقيقة لكل تركيز ثم جفف في الهواء. بمجرد أن يجف جبل الشريحة مع المركب الذي يحتوي على DAPI وتراكب مع غطاء الغطاء.
6. التقاط الصور وتحليلها
- لتصور هالات الحمض النووي ومناطق الكروموسوم ، استخدم مجهر التألق (على سبيل المثال ، مجهر Leica DM4000) لالتقاط الصور باستخدام هدف زيت HC PL FLUOTAR 100X / 1.30 وكاميرا DFC365FX.
- التقط صورا ذات تدرج رمادي وحدد اللون لكل قناة تم التقاطها لتمكين التلوين الزائف للصور. تم استخدام برنامج تجاري في هذه التجربة (على سبيل المثال ، برنامج LAS AF الإصدار 4.5.0). تم تصدير قنوات الألوان الفردية على شكل TIFFs.
- تحليل الصور باستخدام برنامج معالجة الصور Java Fiji ImageJ. قم بتحميل الصورة بالضغط على ملف وفتح.
- قم بتحميل قنوات صور منفصلة أو قم بتقسيم صورة مركبة إلى قنوات منفصلة بتدرج الرمادي بالنقر فوق صورة | اللون | تقسيم القنوات. حدد قناة صورة وانقر على صورة | اضبط ثم حدد السطوع والتباين. قم بالتغيير وفقا لذلك وكرر مع القنوات الأخرى.
- قم بإنشاء قناع للنواة المتبقية عن طريق تحديد القناة الملطخة ب DAPI التي تصور النواة. انقر على الصورة | اضبط ثم حدد العتبة. سيظهر مربع حوار حيث يمكن تغيير العتبة ، حدد مربع الخلفية الداكنة . قم بالتغيير حتى تصبح النواة المتبقية واضحة واضغط على تطبيق وأغلق مربع الحوار.
ملاحظة: يؤدي هذا إلى إنشاء قناع ثنائي استنادا إلى كثافة البكسل، حيث تظهر وحدات البكسل البيضاء مناطق الاهتمام وتظهر وحدات البكسل السوداء الخلفية. كرر نفس الإجراء على قناة المسبار. - استخدم التحديد اليدوي لتحديد محيط النواة المتبقية ثم انقر فوق تحرير ومسح الخارج. تراكب قناة المسبار على النواة المتبقية. يمكن القيام بذلك عن طريق الضغط على صورة | اللون | دمج القنوات.
- لضبط مقياس القياس في ImageJ، ارسم خطا على شريط المقياس أو بين نقطتي مسافتين معروفتين. انتقل إلى تحليل واضغط على تعيين المقياس. في مربع الحوار ، أضف طول المسافة وانقر فوق موافق. لقياس المسافات، ارسم خطا بين النقاط التي يتم قياسها وانقر على تحليل | التدبير. سيؤدي هذا إلى نقل قيم المسافة إلى نافذة بيانات.
- قم بقياس شدة DAPI الأكثر سطوعا لأن هذا يتزامن مع مركز النواة. من هذا المقياس المسافة من المركز النووي إلى أبعد حافة منطقة كروموسوم (CTE). قياس المسافة بين المركز النووي والحافة النووية (NE).
- تأكد من تصوير النتائج على أنها نسبة CTE / NE. هنا المسافة من المركز النووي إلى كل حافة منطقة كروموسوم أبعد (CTE) مقسومة على المسافة من المركز النووي إلى كل حافة نووية (NE). يجب إجراء ذلك على 50 نواة على الأقل. قد يتم تصوير هذا على أنه مخطط شريطي أو مربع.
- لتحليل التيلوميرات ، قم بتحليل ما لا يقل عن 30 نواة لكل مجموعة بيانات. يمكن تحليل الصور باستخدام Fiji ImageJ أو يدويا لحساب عدد التيلوميرات داخل النواة المتبقية وداخل هالة الحمض النووي. مكن BrdU أو pKi67 من التمايز بين نوى التكاثر (BrdU / piK67 +) والشيخوخة / الهدوء (BrdU / pKi67-). يمكن تصوير البيانات في المخططات الشريطية مع أشرطة الخطأ المقابلة للخطأ المعياري للمتوسط (SEM).
- استخدم اختبار t للطالب (غير المزاوج) لمقارنة النتائج إحصائيا مع p> 0.05 التي تعتبر مهمة.
النتائج
لقد ساعدتنا طريقة تحضير هالة الحمض النووي هذه في مساعينا لتحديد الاختلافات في سلوك الجينوم داخل الخلايا الشابة والكبيرة ، ولكن أيضا في الخلايا المشتقة من أمراض الشيخوخة المبكرة مع البروتينات النووية الهيكلية الشاذة15. يعرض الشكل 1 أمثلة على هالات الحمض النووي (DNA) حيث يمكن رؤية حافة النواة المتبقية، والحمض النووي المتبقي داخل النواة المتبقية، والحمض النووي غير المرتبط الذي تسرب إلى المنطقة المحيطة، مكونا هالة الحمض النووي (DNA). كما يصور التحليل الذي يوضح كيفية الحصول على النواة المتبقية وقياسات NE و CTE. من الممكن التمييز بين الخلايا المتكاثرة وغير المتكاثرة إما عن طريق دمج نيوكليوتيد مسمى مثل BrdU عندما تكون الخلايا في المرحلة S أو استخدام علامة الانتشار التشخيصية anti-pKi67 ، والتي تكشف عن النواة ، ومناطق heterochromatin في خلايا G117,18. يفترض أن الخلايا الأولية التي تنمو في مصل مرتفع دون تحقيق التقاء ، والتي تكون سلبية لعلامات الانتشار ، هي خلايا شيخوخة. تعتبر الخلايا الأولية التي تنمو في مصل منخفض أو أصبحت متقاربة ، أي مثبطات الاتصال السلبية لعلامات الانتشار هادئة وستكون قادرة على العودة إلى دورة الخلية التكاثرية بالنظر إلى العناصر الغذائية والوضع الصحيحين. لقد مكنتنا القدرة على التمييز بين الخلايا الإيجابية والسالبة Ki67 من تحديد الاختلافات بين الخلايا الليفية الجلدية البشرية المتكاثرة والهادئة والهرمة. يعرض الشكل 2 هالات الحمض النووي للخلايا الليفية الجلدية البشرية المتكاثرة التي تم إنشاؤها من الخلايا حيث تم دمج BrdU فيها أثناء تضاعف الحمض النووي ، وهي آلية لا تحدث في الخلايا غير المتكاثرة ، وبالتالي ملطخة بجسم مضاد ل BrdU. يظهر أيضا التلوين بالجسم المضاد للعلامة التكاثرية المضادة ل pKi67 في الشكل 2. هذا مستضد قوي وينجو من بروتوكول FISH وبالتالي يمكن تلطيخه لما بعد FISH والتركيب المسبق. وبالتالي ، فإن الخلايا المتكاثرة موجبة (حمراء) ل BrdU ومضادة pKi67 (حمراء) في العمود الأيسر والخلايا غير المتكاثرة ، في الواقع يتم عرض الخلايا الهرمة في الشكل 2 في العمود الأيمن. الإشارات الخضراء هي تيلوميرات فردية تم الكشف عنها باستخدام مجموعة تيلومير PNA FISH / FITC. يتيح الجمع بين التألق المناعي وهالات الحمض النووي (DNA) التحليل خلال حالات الخلايا المختلفة، كما هو موضح في الشكل 2 عند دراسة الخلايا المتكاثرة والهادئة والهرمة. اعتمادا على الجسم المضاد المختار ، يمكن فحص الحالات الأخرى ، مثل التمايز وتلف الحمض النووي عن طريق التشعيع وما إلى ذلك.
يمكن أيضا تصور مناطق الكروموسوم داخل هالات الحمض النووي باستخدام FISH. نظرا لأن التحضير يسمح بإخراج الحمض النووي من النوى ، يمكن أن يختل شكل منطقة الكروموسوم ، مع وجود كميات أصغر أو أكبر من الكروموسوم في هالة الحمض النووي ، اعتمادا على تثبيت الجينوم داخل النواة المتبقية وهياكلها. يوضح الشكل 3 لوحة من هالات الحمض النووي (DNA) حيث تم الكشف عن كروموسومات فردية باستخدام مجسات طلاء كروموسوم الذراع بالكامل (حمراء) للكروموسومات 1 و 13 و 17 و 18. تم استخدام Anti-pKi67 (الأخضر) لتمييز الخلايا المتكاثرة وغيابها داخل نفس الثقافة ، على نفس الشريحة ، للدلالة على الخلايا الهرمة. من الواضح جدا من الصور والبيانات المقدمة على أنها CTE / NE أن الكروموسوم الصغير الفقير بالجينات 18 هو كروموسوم يحتوي على عدد قليل من المرفقات والبكرات في هالة الحمض النووي بعيدا عن النوى المتبقية وهو أبعد بكثير عن مركز النوى المتبقية من الكروموسومات الأخرى. لكن هذا ينطبق أيضا على الكروموسوم 1 أيضا. باستخدام العلامة التكاثرية المضادة ل pKi67 ، كان من الممكن أيضا مقارنة التكاثر مع الخلايا الهرمة ، داخل نفس الثقافة ، وعلى نفس الشريحة ، وقد كشف هذا التحليل أن الكروموسومات داخل هاتين الحالتين الخلويتين المختلفتين للغاية لا تختلف اختلافا كبيرا عن بعضها البعض ، فيما يتعلق بالتعلق بالهياكل النووية المتبقية.
ومن المثير للاهتمام أن الجينات تظهر أيضا اختلافات ذات دلالة إحصائية بين الخلايا المتكاثرة والخلايا الهرمة فيما يتعلق بالبقاء داخل نواة متبقية أو وجودها في هالة الحمض النووي. يوضح الشكل 4 ذلك من خلال مواضع الجينات المحددة بواسطة مجسات BAC المسماة باللون الأحمر و anti-Ki67 باللون الأخضر. لا توجد فروق ذات دلالة إحصائية بين مواقع الجينات في الخلايا المتكاثرة مقابل الخلايا الهرمة ، بعد تحضير هالة الحمض النووي. ومع ذلك ، هناك عدد أكبر بكثير من مواقع catenin alpha 1 CTNNA1 داخل هالة الحمض النووي من مواقع cyclin D1 CNDD1 ، حيث يوجد عدد قليل جدا. يعرض الشكل 5 مستحضرات هالة الحمض النووي مع التيلوميرات باللون الأخضر. يتم ترك الخلفية عالية عمدا لتمكين تصور إشارات التيلومير داخل هالة الحمض النووي. في هذه المجموعة من الخلايا الهادئة للبيانات ، أي ، تم تضمين الخلايا التي تم تجويعها في المصل لمدة 7 أيام ومن المثير للاهتمام أن هناك عددا أكبر بكثير من التيلوميرات غير المرتبطة والموجودة داخل هالات الحمض النووي في الخلايا الهادئة مقارنة بالخلايا المتكاثرة والشيخوخة. في الشكل 5 أ ، يمكن ملاحظة نسبة التيلوميرات في هالة الحمض النووي ، خاصة بالنسبة للصورة "التجربة 2". يتوافق هذا مع الشكل 5 ب حيث يبلغ متوسط النسبة المئوية للتيلوميرات في هالة الحمض النووي حوالي 17٪ في الخلايا الهادئة. هناك بعض الأدلة على أنه لا يمكن رؤية جميع التيلوميرات في الخلايا الهرمة لأن بعضها قد يكون قصيرا جدا.
لقد نجحت طريقة هالة الحمض النووي هذه بالنسبة لنا في التحقيق في تغيرات تفاعل الجينوم داخل النوى في الخلايا المريضة15. يوضح الشكل 6 الاختلافات في ارتباط الكروموسوم في الخلايا الليفية الضابطة الأولية وفي الخلايا المريضة ذات متلازمة هتشينسون جيلفورد بروجيريا النموذجية (طفرة لامين أ) ومتلازمة هتشينسون جيلفورد بروجيريا غير النمطية ، معبرا عن شكل متماثل مختلف ل SUN1 ولا توجد طفرة لامينأ 19. يظهر الكروموسومان 1 و 13 اختلافات ذات دلالة إحصائية في ارتباطهما داخل النوى المتبقية عند مقارنتهما بهالات الحمض النووي الضابطة. يربط الشكل 6 ب موضع منطقة الكروموسوم بأكملها بالنواة المتبقية وهالة الحمض النووي (DNA). تشير القيم 1 أو أقل إلى أن الكروموسوم يقع داخل النواة المتبقية والقيم التي تزيد عن 1 توضح الكروموسومات أو أجزاء من الكروموسومات داخل هالة الحمض النووي.
بشكل عام ، يسلط هذا الضوء على فائدة HALO-FISH في التحقيق في التفاعلات الجينومية للكروموسومات الكاملة والجينات والتيلوميرات المحددة في ظل مجموعة متنوعة من الظروف التي تؤثر على دورة الخلية (الانتشار والسكون والشيخوخة) أو داخل خلايا المرض مثل البروجيريا وخطوط الخلايا السرطانية. في الواقع ، تشير الاختلافات في التفاعلات بين هذه الحالات إلى أن الهيكل النووي له دور مهم في تنظيم العمليات الرئيسية داخل النواة.

الشكل 1: نواة HDF المستخرجة تعرض النواة المتبقية وهالة الحمض النووي ونظرة عامة على طريقة التحليل. (أ) نواة HDF محضرة عن طريق فحص هالة الحمض النووي ومضللة ب DAPI. تظهر النواة المتبقية ذات الألوان الزاهية الحمض النووي (DNA) مثبتا على الهيكل النووي وهذا محاط بالحمض النووي غير المرتبط الذي يشكل هالة من الحمض النووي. التكبير = × 100 ؛ شريط مقياس 10 ميكرومتر. (ب) تلتقط القناة الزرقاء النواة الملطخة ب DAPI والحمض النووي المحيط بها. يتم اختيار النواة المتبقية وإزالتها باستخدام ImageJ. يصور السهم المسافة من المركز النووي إلى الحافة النووية المتبقية (NE). (ج) تظهر القناة الحمراء إشارة المسبار. (د) الصورة المشار إليها ب "نتيجة" هي نتيجة تركيب القناة الحمراء على صورة القناة الزرقاء؛ وهذا يسمح بالمسافة من المركز النووي إلى أبعد حافة منطقة كروموسوم (CTE). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
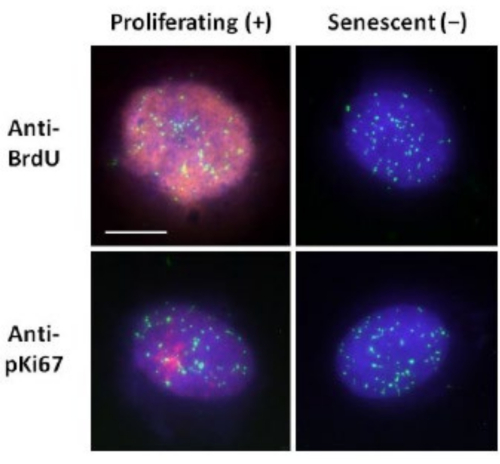
الشكل 2: تحضير هالة الحمض النووي باستخدام تيلومير PNA FISH على HDFs المتكاثرة والهرمة. Telomere PNA FISH على HDFs تخضع لفحص هالة الحمض النووي. يتم تصور إشارات التيلومير باللون الأخضر (FITC) ، وتم تلطيخ الحمض النووي المتبقي والهالة باستخدام DAPI (الأزرق) وتم الكشف عن النوى المتكاثرة باستخدام الأجسام المضادة ل BrdU أو anti-pKi67 عبر التألق المناعي غير المباشر باللون الأحمر (TRITC). التكبير = × 100 ؛ شريط مقياس 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
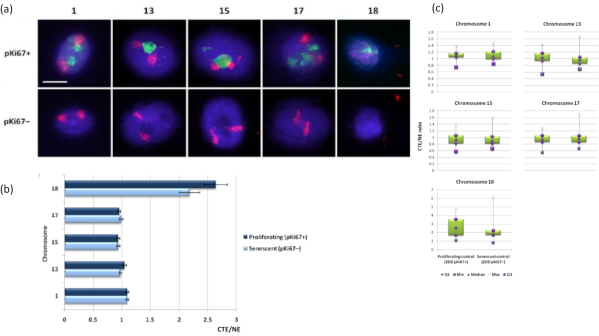
الشكل 3: تفاعلات وتحليل الكروموسومات بين الهيكل النووي والهيكل النووي باستخدام مقايسة هالة الحمض النووي. (أ) أجري 2D-FISH مع مجسات خاصة بالكروموسومات 1 و 13 و 15 و 17 و 18 على HDFs المعرضة لتحضير هالة الحمض النووي. تم طلاء الكروموسومات الكاملة باللون الأحمر (Cy3) وتم فحص النوى باستخدام pKi67 لتحديد ما إذا كانت تتكاثر أو تشيخ. تم تحديد الخلايا المتكاثرة (pKi67 +) باللون الأخضر (FITC) ، بينما ظلت الخلايا الهرمة غير ملوثة (pKi67-) أي لم يتم اكتشاف أي إشارة خضراء. التكبير = × 100 ؛ شريط مقياس 10 ميكرومتر. (ب) تثبيت الكروموسوم بواسطة الهيكل النووي في مركبات HDF المتكاثرة والهرمة التي خضعت ل HALO-FISH. تظهر القياسات نسبة أبعد حافة إقليم كروموسوم (CTE) إلى الحافة النووية (NE) للكروموسومات 1 و 13 و 15 و 17 و 18 في الخلايا المتكاثرة (pKi67 +) والخلايا الهرمة (pKi67-). تمثل أشرطة الخطأ ± SEM. (ج) تمثيل مخطط صندوقي معدل لحافة إقليم الكروموسوم (CTE) إلى الحافة النووية (NE) لكل منها لكروموسومات معينة في نوى pKi67+ و pKi67. Q1 = الربع الأدنى ؛ الحد الأدنى = أدنى قيمة مسجلة؛ ميد = الوسيط ؛ الحد الأقصى = الحد الأقصى للقيمة المسجلة ؛ Q3 = الربع العلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
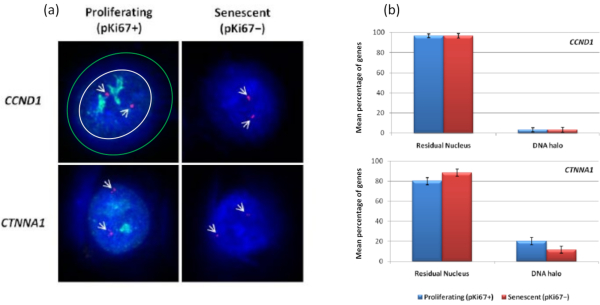
الشكل 4: التفاعلات الخاصة بالجينات في HDFs باستخدام HALO-FISH. (أ) تم تحري النوى المستخرجة بهالة الحمض النووي باستخدام مجسات جينية محددة (CCND1 و CTNNA1) لتحري رسوها إلى NM على الخلايا المتكاثرة والشيخوخة. تظهر الإشارات الجينية باللون الأحمر (Cy3) ويصور anti-pKi67 الخلايا المتكاثرة ويتم تصوير الإشارة باللون الأخضر (FITC). بالنسبة لصورة CCND1 المتكاثرة ، يتم وضع النواة المتبقية داخل الدائرة البيضاء ، والمسافة بين الدائرة البيضاء والخضراء تصور هالة الحمض النووي. التكبير = × 100 ؛ شريط مقياس 10 ميكرومتر. (ب) تقارن الإشارات الخاصة بالجينات ل CCND1 و CTNNA1 بين النواة المتبقية وهالة الحمض النووي ، وكذلك بين الخلايا المتكاثرة والخلايا الهرمة. تمثل أشرطة الخطأ ± التسويق عبر محرك البحث. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
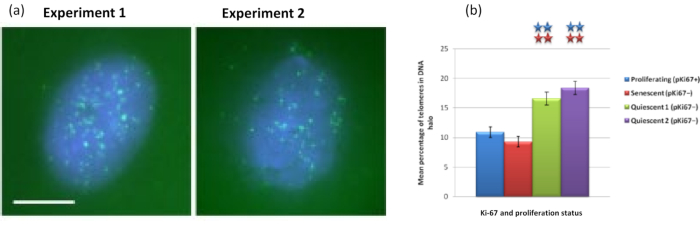
الشكل 5: مقايسة هالة الحمض النووي على HDFs الهادئة التي تم فحصها باستخدام تيلومير PNA-FISH. (أ) تم تحفيز هدوء HDFs عن طريق المزرعة في وسط مصل منخفض لمدة 7 أيام. تم إجراء اختبار هالة الحمض النووي ، ومكن PNA-FISH من تصور التيلوميرات بواسطة إشارة FITC (الخضراء) وتم تلطيخ النواة المتبقية وهالة الحمض النووي المحيطة ب DAPI (أزرق). كما تم تلطيخ الخلايا بالأجسام المضادة ل pKi67 لضمان عدم تكاثر النوى. وقد تكرر ذلك في مناسبتين منفصلتين. التكبير = × 100 ؛ شريط مقياس 10 ميكرومتر. (ب) مقارنة متوسط النسبة المئوية للتيلوميرات الموضعية داخل هالة الحمض النووي في خلايا HDF المتكاثرة والهرمة والهادئة. تمثل أشرطة الخطأ ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
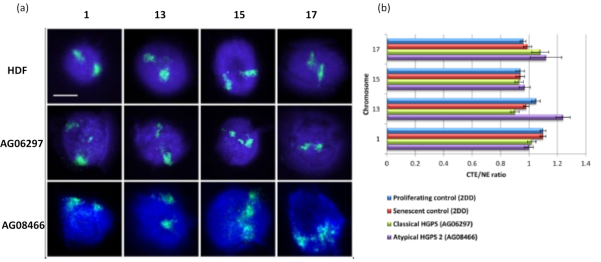
الشكل 6: فحص تثبيت الكروموسوم الكامل للهيكل النووي في خلايا HGPS باستخدام HALO-FISH26. (أ) خضعت نوى التحكم HDF (2DD) و HGPS الكلاسيكية (AG06297) والنوع غير النمطي 2 HGPS (AG08466) لإعداد هالة الحمض النووي ثم 2D-FISH باستخدام دهانات كروموسومية كاملة للكروموسوم 1 و 13 و 15 و 17. تم تصوير الكروموسومات الكاملة باللون الأخضر (FITC) وتم تلطيخ الحمض النووي ب DAPI (الأزرق). التكبير = × 100 ؛ مقياس الرسم 10 ميكرومتر. (ب) تم تحديد موضع الكروموسومات داخل النوى المستخرجة عن طريق قياس نسبة حافة إقليم الكروموسوم المتوسطة (CTE) إلى الحافة النووية (NE). توضح النسبة فوق 1 أن أبعد CTE يقع خارج NE المقابل داخل هالة الحمض النووي ، بينما تشير النسبة الأقل من 1 إلى أن أبعد CTE يقع داخل NE داخل النواة المتبقية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المكونات | الحجم (ميكرولتر) |
| 5XDOP-PCRbuffer | 10 |
| dNTPmix (بدون TTP) (2 مللي متر) | 5 |
| dTTP (2mM) | 2 |
| البيوتين-16-dUTPorDigoxigenin-11-dUTP | 10 |
| DOPprimer (20 ميكرومتر) | 5 |
| TaqDNAPolymerase (1U / μL) | 1 |
| PCRgradewater | 12 |
| قالب | 5 |
الجدول 1: جدول يوضح مكونات وأحجام DOP-PCR لتفاعل 1x
| درج | دورات | درجة الحرارة (درجة مئوية) | الوقت |
| التمسخ الأولي | 1 | 95 | 3 دقائق |
| تمسخ | 34 | 98 | 20 ثانية |
| التلدين التمهيدي | 62 | 1 دقيقة | |
| امتداد | 72 | 30 ثانية | |
| التمديد النهائي | 1 | 72 | 5 دقائق |
| تبريد | 4 | مسك |
الجدول 2: جدول يوضح دورة DOP-PCR ودرجة الحرارة وملف تعريف الوقت.
| مكون | الحجم (ميكرولتر) |
| 10x NT عازلة (0.5M Tris-HCl pH 8،50 mM MgCl2 ، 0.5 مجم / مل BSA) | 5 |
| 0.1 مليون بيتا ميركابتوإيثانول | 5 |
| 10X مخزون النوكليوتيدات (0.5 مللي متر dATP ، 0.5 مللي متر dCTP ، 0.5 مللي متر dGTP ، 0.5 مللي متر dTTP ، 0.5 مجم / مل بيوتين -16-dUTP) | 5 |
| دناس I (1 نانوغرام / مل) | 2 |
| DNApolymerase I | 5U لكل ميكروغرام من الحمض النووي |
| قالب الحمض النووي (1 ميكروغرام) | 1 |
| المياه المعالجة ب DEPC | إلى 50 ميكرولتر |
الجدول 3: جدول يوضح مكونات وأحجام الترجمة الدقيقة لمسبار واحد.
Discussion
تعد طريقة هالة الحمض النووي طريقة ممتازة للاختيار عند تحليل التفاعلات بين الهيكل النووي والجينوم ، ومع ذلك ، هناك بعض الخطوات الحاسمة التي يجب الالتزام بها أيضا. واحدة من أهم المعلمات هي تحسين كثافة بذر الخلية. إذا أصبحت الخلايا أكثر من التقارب ، فسوف تتداخل هالات الحمض النووي مع الخلايا المجاورة مما يجعل من المستحيل إجراء التحليل. يجب دائما جعل CSK ومخازن الاستخراج طازجة في يوم الاستخدام مع إضافة spermine و spermidine و digitonin إلى المخزن المؤقت للاستخراج في نهاية عملية التحضير للحفاظ على نشاطها البيولوجي. في حالة إجراء Halo-FISH ، من المهم للغاية استخدام درجة حرارة التمسخ الصحيحة لهالات الحمض النووي لتمكين المسبار أو الطلاء من التهجين لاحقا.
تم استخدام المجهر الإلكتروني لتصور المصفوفة النووية ، مع تحديد الهياكل الخيطية20. ومع ذلك ، فإن المجهر الإلكتروني محدود حيث لا يمكن بسهولة استنتاج ارتباطات المصفوفة مع الكروماتين. في الواقع ، تعد طريقة DNA Halo أكثر تنوعا مقارنة بالمجهر الإلكتروني حيث يمكن فحص جينات وكروموسومات وحالات خلايا معينة. علاوة على ذلك ، تتم دراسة التحليل البروتيني لبروتينات المصفوفة النووية21,22. هذه الطريقة جيدة لمقارنة مكونات المصفوفة النووية ، خاصة عند مقارنة الخلايا المريضة ، ومع ذلك ، فهي لا توفر التوزيع المكاني والمرفقات التي أبرزتها تقنية DNA Halo القياسية.
مقايسات هالة الحمض النووي لها حدود. أولا ، عند استخراج المصفوفة ، لا يمكن إجراء ذلك إلا على خلايا ثابتة ، لذا لا يمكن التصوير الحي. على الرغم من أن طريقة DNA Halo سريعة نسبيا وسهلة الأداء ، إلا أن العملية الإجمالية قد تستغرق وقتا طويلا عندما يتم أخذ زراعة الخلايا وتوليد المسبار و Halo-FISH والتحليل في الاعتبار.
من شأن التقاط صور لهالات الحمض النووي و HALO-FISH باستخدام الفحص المجهري فائق الدقة أن يحسن بشكل كبير من دقة المجسات والأجسام المضادة الخاصة بالحمض النووي. بالإضافة إلى ذلك ، نظرا لأنه يمكن حل الفلوروكرومات بسهولة أكبر طيفيا ، فقد يكون من الممكن استخدام عدد من مجسات الحمض النووي في تجربة واحدة ، مما يوفر المزيد من المعلومات. تم استخدام التحسينات في تقنيات البيولوجيا الجزيئية مثل التقاط تشكل الكروموسوم (3C) لتحديد تفاعلات مواقع الجينات وتحليل التنظيم المكاني على الكروماتين في الخلية. يمكن الجمع بين فحوصات DNA Halo و 3C ، وهو مصطلح يعرف باسم M3C23 ، مما يدل مرة أخرى على قابلية التكيف لتقنية DNA Halo.
البيانات الأصلية المقدمة هنا هي لتوضيح إمكانيات استجواب سلوك الجينوم وكيفية تقديم تلك البيانات. من خلال هذه البيانات ، أثبتنا أنه من الممكن تحديد اختلافات كبيرة في ارتباط الجينوم باستخدام (1) مجسات طلاء الكروموسوم ، في هذه الدراسة التي تكشف أن الكروموسوم 18 هو أقل كروموسوم مرتبط من بين تلك التي تم تحليلها (الشكل 3) ؛ (2) مواضع الجينات ذات الاختلافات الكبيرة بين موقعين جينيين و (الشكل 4) (3) التيلوميرات ، والتي تكون أقل ارتباطا بقوة في الخلايا الهادئة مقارنة بالخلايا المتكاثرة والشيخوخة (الشكل 5). نحن قادرون على التمييز بين الخلايا المتكاثرة وغير المتكاثرة من خلال وجود مستضد Ki67 لعلامة الانتشار وهو بروتين غير قابل للذوبان لذلك يبقى مع النوى المتبقية أو باستخدام دمج النيوكليوتيدات لتسليط الضوء على الخلايا التي مرت بالطور S خلال فترة زمنية محددة (الشكل 2). لقد مكنتنا هذه التقنية أيضا من تحليل سلوك الجينوم في الخلايا التي تتعرض للخطر في هياكلها النووية ، أي خلايا اعتلال الصفيحة ، وهنا وفي Bikkul et al. ، 2018 ، نكشف أن الجينوم يمكن أن يكون أقل ارتباطا بإحكام عند مقارنته بالخلايا الضابطة ويمكن استعادته عند التعامل مع أدوية معينة تعمل على تحسين تأثير طفرة lamin A في خلايا HGPS الكلاسيكية15. ومع ذلك ، نعرض بيانات جديدة هنا لخلايا HGPS AGO8466 غير النمطية ، التي تفتقر إلى طفرة lamin A ولكنها تحتوي على شكل غير عادي من بروتين LINC المركب SUN1 19 الذي يكون الكروموسوم13 أقل ارتباطا به (الشكل 6).
HALO-FISH هي طريقة فريدة من نوعها من خلال تمكين دراسة التفاعلات الجينومية مع الهيكل النووي بالاشتراك مع التألق المناعي غير المباشر لحل البروتينات التي لم تتم إزالتها من إجراء الاستخراج. لقد ثبت أن الهيكل النووي يتم تعديله في أمراض مختلفة مثل بعض أنواع السرطان19 وأهمية بعض البروتينات المرتبطة بالهيكل النووي كمؤشرات حيوية تشخيصية24,25. وبالتالي ، فإن هذه التقنية لها دور مهم في فحص تأثير الهيكل النووي على تنظيم / عدم تنظيم الكروماتين في المرض15،24،25،27 ولا تقتصر على الخلايا البشرية ، مع مجسات اللوحة الكروموسومية من الحيوانات الأخرى ، يمكن استخدام نفس بروتوكول الحمض النووي - الهالة 28.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نود أن نشكر البروفيسور مايكل بيتنر على الهدية الكريمة لمجسات طلاء ذراع الكروموسوم. تم دعم LG من قبل مشروع EURO-Laminopathies الممول من الاتحاد الأوروبي وصندوق أبحاث Brunel Progeria.
Materials
| Name | Company | Catalog Number | Comments |
| 10X PBS | Thermo Fisher Scientific | 10388739 | Used to create DNA halos |
| 5-bromo-2′-deoxy-uridine | Sigma-Aldrich | B5002-100MG | Labelled nucleotide |
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100MG | Labelled nucleotide |
| Agar Technical | Thermo Fisher Scientific | 15562141 | DNA isolation of BAC clones |
| Agarose | Sigma-Aldrich | A939-50G | Check product size of DOP-PCR and nick translation |
| Atypical type 2 HGPS fibroblasts (AG08466) | Coriell Institute | AG08466 | Cell line |
| Bacto tryptone | Thermo Fisher Scientific | 16269751 | DNA isolation of BAC clones |
| Biotin-16-dUTP | Roche Diagnostics | 11093711103 | Labelled nucleotides |
| Chloramphenicol | Sigma-Aldrich | C0378-25G | DNA isolation of BAC clones |
| Classical Hutchinson-Gilford progeria syndrome (HGPS) fibroblasts (AG06297) | Coriell Institute | AG0297 | Cell line |
| Coplin jar | Thermo Fisher Scientific | 12608596 | Holds 5 slides or 8 slides back to back |
| Cot-1 DNA | Thermo Fisher Scientific | 15279011 | Block nonspecific hybridization in HALO FISH |
| DEPC-treated water | Sigma-Aldrich | 693520-1L | DNA isolation of BAC clones |
| Dextran sulphate | Sigma-Aldrich | S4030 | Hybridisation mixture |
| Digitonin | Sigma-Aldrich | D141 | Component of extraction buffer |
| Digoxigenin-11-dUTP | Sigma-Aldrich | 11093088910 | Labelled nucleotides |
| Donkey anti-mouse Cy3 | Jackson Laboratory | 715-165-150 | Secondary antibody |
| EDTA | Sigma-Aldrich | E6758 | Component of extraction buffer |
| Ethanol | Component of extraction buffer | ||
| Ethanol | Sigma-Aldrich | 443611 | Probe precipitation and HALO FISH |
| Fetal bovine system | Thermo Fisher Scientific | 26140079 | Cell culture serum |
| Formamide | Thermo Fisher Scientific | 10523525 | 2D FISH of DNA halos |
| Glass wool | Sigma-Aldrich | 18421 | Spin column |
| Herring sperm | Sigma-Aldrich | D7290 | Probe precipitation |
| HXP™ Lamp (metal halide microscope lamp) | OSRAM | HXP-R120W45C VIS | Image capture of DNA halos |
| Hydrochloric acid | Thermo Fisher Scientific | 10313680 | Cleaning microscope slides |
| Isopropanol | Sigma-Aldrich | I9516-25ML | DNA isolation of BAC clones |
| KAPA HiFi PCR Kit | KAPA Biosystems | KK2103 | PCR Kit |
| Leica DM4000 fluorescent microscope with DFC365 FX camera and LAS AF (Version: 4.5.0) image acquisition software. | Leica Microsystems | Image capture of DNA halos | |
| Luria-Bertani agar | Thermo Fisher Scientific | 13274843 | DNA isolation of BAC clones |
| Magnesium chloride | Sigma-Aldrich | M8266 | Component of CSK buffer |
| Methanol | Thermo Fisher Scientific | 10284580 | Cleaning and sterilizing microscope slides |
| Mouse anti-BrdU antibody | BD Pharmingen | B2531-100UL | BrdU visualisation |
| Newborn calf serum | Thermo Fisher Scientific | 16010159 | Cell culture serum and blocking reagent |
| Nick translation kit | Invitrogen | ||
| PCR grade water | Sigma-Aldrich | 693520-1L | PCR and DNA isolation of BAC clones |
| PCR Primers | Sigma-Aldrich | ||
| PIPES | Sigma-Aldrich | P1851 | Component of CSK and extraction buffers |
| Potassium acetate | Sigma-Aldrich | P1190-100G | DNA isolation of BAC clones |
| QuadriPERM® 4 X 12 | SARSTEDT | 94.6077.307 | Square cell culture dish, polysterene with four compartments. This has hydrophobic surface, is sterile, non-pyrogenic/endotoxin-fee and non-cytotoxic. |
| Rabbit Anti-Ki67 antibody | Sigma-Aldrich | ZRB1007-25UL | Proliferation marker |
| Rnase A | Sigma-Aldrich | R6513 | DNA isolation of BAC clones |
| Rubber cement | Halford's | 101836 | 2D FISH of DNA halos |
| Sephadex G-50 | Sigma-Aldrich | S6022-25G | Spin column |
| Sodium acetate | Sigma-Aldrich | S2889 | Probe precipitation |
| Sodium chloride | Sigma-Aldrich | S5886 | Component of CSK, extraction and SSC buffers |
| Sodium citrate | Sigma-Aldrich | C8532 | Component of SSC buffer |
| Sodium dodecyl sulphate | L3771-100G | DNA isolation of BAC clones | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | DNA isolation of BAC clones |
| Spermidine | Sigma-Aldrich | S2626 | Component of extraction buffer |
| Spermine | Sigma-Aldrich | S4264 | Component of extraction buffer |
| Streptavidin-Cy3 | Amersham Life Sciences Ltd, Scientific Laboratory Supplies | pa43001 | Probe antibody |
| Sucrose | Sigma-Aldrich | S0389 | Component of CSK buffer |
| Sucrose | Sigma-Aldrich | S0389 | CSK buffer+A66:D68 |
| SuperFrost™ microscope slides | Thermo Fisher Scientific | 12372098 | Microscope slides: 1 mm thickness, 76 mm length, 26 mm width. Uncoated. |
| Swine anti-rabbit TRITC | Dako | ||
| TELO-PNA FISH KIT | Agilent Dako | K532511-8 | Delineation of telomeres |
| Tris-HCl | Sigma-Aldrich | T3253-100G | Column buffer |
| Triton™ X-100 | Sigma-Aldrich | T9284 | Component of CSK buffer |
| Tryptone | Thermo Fisher Scientific | 10158962 | DNA isolation of BAC clones |
| Tween-20 | Sigma-Aldrich | P9416- 100ML | Detergent |
| Vectashield mountant containing DAPI | Vector Laboratories | H-1200 | 2D FISH of DNA halos |
| Whole human chromosome probes | Calbiochem | 2D FISH of DNA halos | |
| Yeast extract | Thermo Fisher Scientific | 10108202 | DNA isolation of BAC clones |
References
- Berezney, R., Coffey, D. S. Identification of a nuclear protein matrix. Biochemical Biophysical Research Communications. 60 (4), 1410-1417 (1974).
- Haaf, T., Ward, D. C. High resolution ordering of YAC contigs using extended chromatin and chromosomes. Human Molecular Genetics. 3 (4), 629-633 (1994).
- Parra, I., Windle, B. High resolution visual mapping of stretched DNA by fluorescent hybridization. Nature Genetics. 5 (1), 17-21 (1993).
- Senger, G., et al. Released chromatin: linearized DNA for high resolution fluorescence in situ hybridization. Human Molecular Genetics. 3 (8), 1275-1280 (1994).
- Florijn, R. J., et al. High-resolution DNA Fiber-FISH for genomic DNA mapping and colour bar-coding of large genes. Human Molecular Genetics. 4 (5), 831-836 (1995).
- Elcock, L. S., Bridger, J. M. Fluorescence in situ hybridization on DNA halo preparations and extended chromatin fibres. Methods Molecular Biology. 659, 21-31 (2010).
- Heiskanen, M., et al. Visual mapping by fiber-FISH. Genomics. 30 (1), 31-36 (1995).
- Bensimon, A., et al. Alignment and sensitive detection of DNA by a moving interface. Science. 265 (5181), 2096-2098 (1994).
- Michalet, X., et al. Dynamic molecular combing: stretching the whole human genome for high-resolution studies. Science. 277 (5331), 1518-1523 (1997).
- Wilson, R. H., Coverley, D. Relationship between DNA replication and the nuclear matrix. Genes Cells. 18 (1), 17-31 (2013).
- Wilson, R. H. C., Coverley, D. Transformation-induced changes in the DNA-nuclear matrix interface, revealed by high-throughput analysis of DNA halos. Science Reports. 7 (1), 6475(2017).
- Iarovaia, O. V., Akopov, S. B., Nikolaev, L. G., Sverdlov, E. D., Razin, S. V. Induction of transcription within chromosomal DNA loops flanked by MAR elements causes an association of loop DNA with the nuclear matrix. Nucleic Acids Research. 33 (13), 4157-4163 (2005).
- Tandara, M., et al. Sperm DNA integrity testing: big halo is a good predictor of embryo quality and pregnancy after conventional IVF. Andrology. 2 (5), 678-686 (2014).
- Repping, S., et al. The use of spermHALO-FISH to determine DAZ gene copy number. Mol Human Reproduction. 9 (4), 183-188 (2003).
- Bikkul, M. U., et al. Farnesyltransferase inhibitor and rapamycin correct aberrant genome organisation and decrease DNA damage respectively, in Hutchinson-Gilford progeria syndrome fibroblasts. Biogerontology. 19 (6), 579-602 (2018).
- Telenius, H., et al. Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer. Genomics. 13 (3), 718-725 (1992).
- Bridger, J. M., et al. Association of pKi-67 with satellite DNA of the human genome in early G1 cells. Chromosome Research. 6, 13-24 (1998).
- Sales Gil, R., Vagnarelli, P. Ki-67: More Hidden behind a 'Classic Proliferation Marker'. Trends in Biochemical Sciences. 43 (10), 747-748 (2018).
- Bikkul, M. U., et al. Telomere elongation through hTERT immortalization leads to chromosome repositioning in control cells and genomic instability in Hutchinson-Gilford progeria syndrome fibroblasts, expressing a novel SUN1 isoform. Genes Chromosomes Cancer. 58 (6), 341-356 (2019).
- Jackson, D. A., Cook, P. R. Visualization of a filamentous nucleoskeleton with a 23 nm axial repeat. EMBO Journal. 7, 3667-3677 (1988).
- Albrethsen, J., et al. Unravelling the nuclear matrix proteome. Journal of Proteomics. 72, 71-81 (2009).
- Mika, S., Rost, B. NMPdb: Database of nuclear matrix proteins. Nucleic Acids Research. 33, 160-163 (2005).
- Gavrilov, A. A., et al. of the nuclear matrix-bound chromatin hubs by a new M3C experimental procedure. Nucleic Acids Research. 38, 8051-8060 (2010).
- Sjakste, N., et al. Role of the nuclear matrix proteins in malignant transformation and cancer diagnosis. Experimental Oncology. 26 (3), 170-178 (2004).
- Leman, E. S., Getzenberg, R. H. Nuclear structure as a source of cancer specific biomarkers. Journal of Cellular Biochemistry. 104 (6), 1988-1993 (2008).
- Volpi, E. V., Bridger, J. M. FISH glossary: an overview of the fluorescence in situ hybridization technique. Biotechniques. 45 (4), 385-386 (2008).
- Bridger, J. M., Foster, H. A. Senescence and the Genome. Human Interphase Chromosomes. , Springer. New York. Ed. Ivan Iourov (2021).
- Foster, H. A., Griffin, D. K., Bridger, J. M. Interphase chromosome positioning in in vitro porcine cells and ex vivo porcine tissues. BMC Cell Biology. 13 (1), 30(2012).
Erratum
Formal Correction: Erratum: Fluorescence In Situ Hybridization on DNA Halo Preparations to Reveal Whole Chromosomes, Telomeres and Gene Loci
Posted by JoVE Editors on 6/05/2023. Citeable Link.
An erratum was issued for: Fluorescence In Situ Hybridization on DNA Halo Preparations to Reveal Whole Chromosomes, Telomeres and Gene Loci. The Authors section was updated from:
Lauren S. Godwin1
Joanna M. Bridger1
Helen A. Foster2
1Laboratory of Nuclear and Genomic Health, Centre for Genome Engineering and Maintenance, Division of Biosciences, Department of Life Sciences, College of Health, Medicine and Life Sciences, Brunel University London
2Biosciences, Department of Clinical, Pharmaceutical and Biological Science, School of Life and Medical Sciences, University of Hertfordshire
to:
Lauren S. Godwin1
Emily Roberts2
Joanna M. Bridger1
Helen A. Foster2
1Laboratory of Nuclear and Genomic Health, Centre for Genome Engineering and Maintenance, Division of Biosciences, Department of Life Sciences, College of Health, Medicine and Life Sciences, Brunel University London
2Biosciences, Department of Clinical, Pharmaceutical and Biological Science, School of Life and Medical Sciences, University of Hertfordshire
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved