Method Article
DNA晕片制备物的荧光原位杂交揭示整个染色体、端粒和基因位点
摘要
将DNA晕制备与荧光原位杂交相结合,可以对基因组与核骨架的相互作用进行高分辨率分析。附着的基因组导致位于残余提取的细胞核内的杂交荧光信号,而非附着的基因组位于残余细胞核周围的DNA晕中。
摘要
基因组与细胞核内的几个结构相关联,以调节其活性并将其锚定在特定位置。这些结构统称为核骨架,包括核薄片、核仁和核体。尽管存在许多荧光原位杂交(FISH)变体来研究基因组及其组织,但这些变体通常受到分辨率的限制,并且无法提供有关基因组与核结构关联的信息。DNA晕法使用高盐浓度和非离子去垢剂来产生DNA环,这些DNA环通过基因组内的附着区域保持锚定在细胞核内的结构上。在这里,可溶性核蛋白,如组蛋白、脂质和与核基质不紧密结合的DNA,被提取出来。这导致在残余细胞核周围形成一个未连接的DNA晕,该残余细胞核本身含有与内部核结构和抗提取蛋白密切相关的DNA。这些延伸的DNA链可以提高分辨率,并促进物理映射。与FISH结合使用,该方法具有研究基因组与基因组锚定的所有结构的相互作用的额外优势。这种被称为HALO-FISH的技术用途广泛,DNA晕可以与核酸探针偶联,以揭示基因位点,整个染色体,α卫星,端粒甚至RNA。该技术提供了对正常细胞和疾病进展(如癌症)中核组织和功能的洞察。
引言
"核矩阵"最早由别列兹尼和科菲在1974年描述1.在对大鼠肝核进行高盐摩尔萃取和核酸酶处理后,他们鉴定出蛋白质结构框架。DNA晕程序随后从该方法改编而来,涉及去除可溶性蛋白质,以便仅保留核基质(NM)和NM相关蛋白质和染色体。DNA附着区位于DNA环的底部,称为基质附着区(MAR)或支架附着区(SAR),它们分别耐高盐浓度和离子洗涤剂锂-3,5-二碘水杨酸酯(LIS)的提取。在DNA晕中,与MAR / SAR相关的DNA结合在残余细胞核内,而DNA环从这些位点延伸并形成DNA晕。我们现在知道,基因组通过薄片相关结构域(LAD)锚定到核层,通过核仁相关区(NAD),并可能通过其他核结构(如特定核体)锚定。
DNA晕环法可用于DNA,基因和染色体区域的物理定位,因为扩展的DNA和染色质提供了更高的分辨率,因为染色质被剥离了组蛋白并且DNA被拉伸2,3,4,5,6。但是,在此应用中使用DNA晕时存在一些限制。例如,探针可能无法接近与DNA晕的残余核紧密相关的DNA,从而将其排除在分析和物理映射之外6。其他技术,如fiber-FISH2,4,5,7和分子梳理8也支持物理映射,并具有相对快速和易于执行的优点。两者都优先用于DNA晕上的基因DNA图谱。这些方法通过使用溶剂或盐从细胞核中提取染色质纤维,然而,分子梳理往往具有更好的重现性8,9。
越来越多的证据表明,核骨架在支持关键核过程方面发挥作用,例如DNA的附着位点,染色质重塑,DNA转录,DNA修复和DNA复制11,12。因此,开发了DNA晕技术来研究这些细胞活动期间核骨架和基因组之间的相互作用,并已在研究中常规使用和报道。该技术还被用于研究基因组和核骨架与疾病进展相关的相互作用,并鉴定出与恶性肿瘤相关的核结构变化11。
DNA晕技术也被用于研究发育和分化过程中基因组和核骨架之间的关系12。许多研究使用了DNA晕轮技术的变体,称为被子植物13 或SpermHalo-FISH,如果与FISH14结合。精子染色质与称为鱼精蛋白的蛋白质紧密结合,该技术的开发是为了改善对精子DNA的访问。被子植物已被用于研究精子DNA的完整性并确定是否存在DNA损伤。DNA损伤较少的精子与较大的DNA晕环大小相关,而片段化和受损DNA水平增加的精子要么有小的光晕,要么根本没有。因此,被子植物可用作胚胎质量和IVF13成功怀孕的潜在预后标志物。这个例子强调了这种技术的潜在临床应用。在我们的工作中,我们使用HALO-FISH来评估基因组行为的变化以及特定药物治疗对过早衰老疾病哈钦森 - 吉尔福德早衰综合症(HGPS)的影响15。
总之,这些以及其他研究突出了DNA晕技术可用于研究和该技术的实用性的过程/应用的广度。
研究方案
1. 玻片制备、灭菌和细胞培养
- 准备 500 mL 10% HCl (v/v) 并倒入大烧杯中。
- 将显微镜单独放入酸中,并在室温下在设置为2 x g 的摇床上孵育1小时。
注意:盐酸具有腐蚀性和刺激性。它可能会导致严重的皮肤灼伤和眼睛损伤以及皮肤、眼睛和呼吸系统的刺激。确保穿戴适当的个人防护用品,包括丁腈手套、护目镜和实验室外套。 - 从烧杯中倒出酸,在自来水中洗涤载玻片十次,然后在去离子水中再倒十次。
- 用甲醇冲洗载玻片两次,并保持在甲醇中,直到通过燃烧灭菌。
注意:甲醇是一种高度易燃的液体,吞咽、皮肤接触或吸入有毒。此外,甲醇可能对器官造成损害,具有腐蚀性和刺激性。遵守工作场所接触限值,并确保穿戴适当的个人防护用品,包括丁基橡胶手套、护目镜和实验室外套。在可能的情况下,将处理在局部排气通风 (LEV) 通风柜中。 - 使用金属钳或长镊子,从装有甲醇的烧杯中取出显微镜载玻片。在本生燃烧器上燃烧以消毒,然后转移到位于本生燃烧器附近的矩形细胞培养容器中,该容器包含四个载玻片隔间。
注意:燃烧允许在使用前立即对显微镜载玻片进行灭菌;但是,这种方法确实存在相关危害。由于甲醇是高度易燃的,因此装有载玻片的烧杯必须远离本生燃烧器。应使用长钳或镊子紧紧抓住载玻片。烧杯中的甲醇水平应刚好覆盖载玻片,以尽量减少甲醇的使用量,并使只有镊子/钳子的末端与甲醇接触。始终确保甲醇在使用后已从镊子或钳子中蒸发,并且在放回装有载玻片和甲醇的烧杯之前已冷却。烧杯应用一块铝箔覆盖,以便在甲醇着火时缺氧。切勿火焰在空气循环的II类层流罩内滑动。 - 或者,执行步骤1.1至1.4,但在与甲醇孵育后不要燃烧载玻片,而是将载玻片放在无绒纸巾上风干。干燥后,用铝箔包裹并放入灭菌器烤箱或高压灭菌器中。
- 在适当的培养基中用血清在5%CO2 中在37°C下培养细胞至少48小时,直到达到60-70%汇合。该协议是在人类真皮成纤维细胞(HDF)的早期传代和经典的哈钦森 - 吉尔福德早衰综合征(HGPS)成纤维细胞(AG06297)和非典型2型HGPS成纤维细胞(AG08466)上进行的。收获每种细胞类型并使用血细胞计数器计数以确定细胞密度。每张载玻片在 10 mL 培养基中接种 1 x 105 个细胞。
注意:细胞密度很重要,因为如果细胞变得过于融合,来自不同细胞核的DNA环可能会收敛。根据所使用的细胞类型,可能需要优化接种密度,因为转化的细胞可能增殖得更快,而后期传代的细胞培养可能需要更长的时间才能达到所需的汇合度。 - 如果需要在G0 中阻止细胞以使其静止,则每张载玻片接种1 x 105 个细胞(在10mL培养基中),并放置生长24小时。用无血清培养基洗涤细胞两次,并在含有较低浓度血清0.5%的标准培养基(新生小牛血清,NCS;或胎牛血清,FBS)中孵育7天。
- 如果DNA晕测定需要细胞的增殖状态,则通过在复制过程中将5-溴-2'-脱氧尿苷(BrdU)掺入DNA中来确定已通过S相的细胞。
- 正常接种细胞并生长24小时。取出培养基,用含有BrdU和5-氟-2'-脱氧尿苷(3μg/μL)的培养基替换。再过24小时后,除去培养基,用培养基(10%NCS)洗涤细胞一次,然后用新鲜培养基(10%NCS)重新进料。再孵育24小时,然后准备用于DNA晕测定的载玻片。
2. 探头准备
- 染色体整体和手臂绘画探针
- 使用 Telenius 等人的方法通过简并寡核苷酸引发聚合酶链反应 (DOP-PCR) 扩增流动分选或显微解剖的染色体进行染色体探针16。使用DOP-PCR用生物素-16-dUTP或地高辛-11-dUTP标记染色体探针,如 表1所示。请查看制造商的扩增曲线说明,但是,用于本实验的条件如 表2所示。
- 通过将 8 μL 标记的 PCR 产物、7 μL Cot-1 DNA、3 μL 鲱鱼精子、1/20体积 的 3 M 乙酸钠 (pH 5.4) 和 2 体积的 100% 乙醇一起制备手臂或整个染色体探针。将探针溶液在-80°C孵育至少30分钟。
注意:此方法可用于创建单染色体探针,如果每个感兴趣的染色体使用不同的标记(即生物素-16-UTP和地高辛-11-dUTP),则可用于创建单个染色体探针或多个染色体探针。
注意:乙醇是一种高度易燃的液体和蒸气,可能会引起严重的眼睛刺激。远离热源、热表面和点火源。遵守工作场所接触限值,并确保穿戴适当的个人防护用品,包括丁基橡胶手套、护目镜和实验室外套。尽可能将手柄放在 LEV 通风柜中。 - 在4°C下以13,700× g 离心探针溶液15分钟,然后用70%乙醇洗涤。重复离心过程并丢弃上清液,注意不要干扰或丢失DNA沉淀。让DNA沉淀干燥。
- 向 DNA 沉淀中加入 12 μL 杂交缓冲液(50% 甲酰胺、10% 葡聚糖硫酸盐、10% 20x 盐水柠檬酸钠(SSC;3 M NaCl、0.3 M 柠檬酸三钠;pH 7.0)、1% (v/v) 聚氧乙烯山梨醇单月桂酸酯 (吐温-20))。在37°C下放置至少2小时,使DNA沉淀溶解到杂交缓冲液中。
注意:甲酰胺具有致癌性和致畸性,因此可能对未出生的孩子造成严重伤害。如果女性怀孕或怀疑自己怀孕,则应避免使用甲酰胺。甲酰胺应在 LEV 通风橱中使用。遵守工作场所接触限值,并确保穿戴适当的个人防护用品,包括丁基橡胶手套、护目镜和实验室外套。
- 从细菌人工染色体 (BAC) 中分离 DNA
- 将BAC克隆中的一小部分甘油原液划线到Luria-Bertani(LB)琼脂平板(1%(W / V)NaCl;1%(w / v)胰蛋白胨,0.5%(w / v)酵母提取物,1.5%(w / v)琼脂技术,12.5μg/ mL(w / v)氯霉素)。在37°C孵育过夜。
- 从培养皿中选择一个菌落并接种 10 mL LB 肉汤(1% (w/v) NaCl、1% (w/v) 杆菌胰胨、0.5% (w/v) 酵母提取物、12.5 μg/mL (w/v) 氯霉素)。将溶液在37°C的振荡培养箱中过夜。
注意:氯霉素被怀疑会导致癌症。小心处理并减少暴露。 - 在室温下以1,700× g 离心培养10分钟。
- 弃去上清液,向沉淀中加入 300 μL P1 溶液(15 mM Tris (pH 8)、10 mM EDTA、100 μg/mL RNase A)。剧烈涡旋并将细胞转移到 2 mL 微量离心管中。
- 向细胞中滴加 300 μL P2 溶液(0.2 M NaOH,1% (w/v) 十二烷基硫酸钠 (SDS)。将封闭的微量离心管倒置5次,并在室温下放置最多5分钟。
注意:氢氧化钠具有腐蚀性,可能导致严重的皮肤灼伤和眼睛损伤。它可能对金属有腐蚀性。小心处理并减少暴露。遵守工作场所接触限制,并确保穿戴适当的个人防护用品,包括丁腈橡胶手套、护目镜和实验室外套。尽可能将手柄放在 LEV 通风柜中。
注意:十二烷基硫酸钠是一种易燃固体,吞咽有害,可能引起皮肤和呼吸道刺激。它还可能导致严重的眼睛损伤。确保穿戴适当的个人防护用品,包括丁腈橡胶手套、护目镜和实验室外套。尽可能将手柄放在 LEV 通风柜中。 - 向细胞中缓慢加入 300 μL P3(3 M 乙酸钾)并轻轻混合。将微量离心管放在冰上10分钟。
- 在4°C下以8,100× g 离心10分钟,并将上清液转移到含有800μL冰冷异丙醇的管中。将试管倒置几次,并在-20°C孵育过夜。
注意:异丙醇是一种高度易燃的液体和蒸气,可能会引起严重的眼睛刺激、嗜睡或头晕。远离热源、热表面和点火源。遵守工作场所接触限制,并确保穿戴适当的个人防护用品,包括丁腈橡胶手套、护目镜和实验室外套。在可能的情况下,将处理放在 LEV)通风柜中。 - 在4°C下以8,100× g 离心15分钟。 取出上清液并转移到另一个管中。加入 500 μL 冰冷的 70% 乙醇。倒置管几次,并在4°C下以8,100× g 离心5分钟。
- 除去上清液并在室温下风干沉淀。一旦沉淀干燥,重新悬浮在40μL焦碳酸二乙酯处理的水(DEPC处理)中,并在4°C下放置过夜。完全重悬后,取出 5 μL 溶液并加载到 1% 琼脂糖凝胶上以检查 DNA 的存在。
- 通过缺口翻译制备BAC的单基因探针
- 使用市售的昵称翻译标签套件。或者,使用以下协议。成分和体积见 表3 。
- 将 表3 中的成分一起加入微量离心管中,最后加入DNA聚合酶I,轻轻混合并短暂离心几秒钟。将溶液在15°C孵育2小时。
- 要验证片段大小,请将 5 μL 溶液上样到 2% 琼脂糖凝胶上。DNA片段大小范围应在200-600 bp之间。如果DNA片段尺寸较大,则继续在15°C下孵育溶液15分钟,并在2%琼脂糖凝胶上运行产物。
- 通过添加 10 mM EDTA、0.1% SDS(2.5 μL 的 0.5 M EDTA、pH 8.0 的 100 μL 和 100 μL 中的 10% SDS)来停止缺口翻译反应。将溶液在65°C下加热5分钟。
- 为了去除未掺入的核苷酸,将BAC探针应用于离心柱。可以购买商业离心柱,也可以使用注射器创建,如下所示:
- 将 30 g Sephadex G-50 加入 500 mL 色谱柱缓冲液(10 mM Tris-HCl (pH8)、1 mM EDTA、0.1% SDS)。高压灭菌混合物。此外,制作 500 mL 柱缓冲液(不含 Sephadex G-50)并高压灭菌。
- 通过将高压灭菌的玻璃棉添加到 1 mL 注射器的底部来制作离心柱。在柱缓冲液中用Sephadex G-50填充1 mL注射器。将 1 mL 注射器放入 15 mL 离心管中,该离心管底部有一个没有盖子的微量离心管。以1,600 x g 离心5分钟。
- 取出注射器并丢弃底部的微量离心管。将新鲜的微量离心管重新添加到 15 mL 离心管中。将柱缓冲液(不含Sephadex G-50)添加到1 mL注射器中,然后重新插入15 mL离心管中。以1,600 x g 离心5分钟。再次重复此步骤两次。
- 取出注射器并插入包含新清洁微量离心管的 15 mL 离心管中。将探针涂在注射器上,并将探针收集在微量离心管中。
- 要沉淀 DNA 探针,向 DNA 溶液中加入 5 μL 鲱鱼精子 DNA (10 mg/mL)、10 μL 乙酸钠和 2.25 体积的 100% 乙醇。轻轻混合溶液并在-80°C孵育至少1小时。在4°C下以13,700× g 离心15分钟。
- 弃去上清液,用200μL冰冷的70%乙醇在4°C下洗涤沉淀15分钟。 除去上清液并风干。干燥后,将沉淀在室温下在20μLDEPC处理的水中重悬数小时或在4°C下过夜。 探头现在可以使用了,也可以储存在-20°C。
- 对于每张载玻片,将 5 μL 探针 DNA 与 5 μL Cot-1 DNA 混合,并使用 Speed Vac 真空浓缩器干燥。沉淀干燥后,重新悬浮在 12 μL 杂交混合物中。
3. DNA晕制备
- 从培养箱中取出含有载玻片和附着细胞的方形培养皿。丢弃培养基,用铅笔标记载玻片,并放入含有 50 mL 冰冷细胞骨架 (CSK) 缓冲液的 Coplin 罐中:100 mM NaCl、3 mM MgCl2、0.3 M 蔗糖、10 mM 1,4-哌嗪二烷磺酸 (PIPES; pH 7.8),0.5% (v/v) Triton X-100 在去离子水中组成。在冰上或4°C孵育15分钟。
注意:Triton X-100 会引起皮肤刺激和严重的眼睛损伤。使用适当的个人防护设备进行处理,包括丁腈手套、护目镜和实验室外套。 - 弃去CSK缓冲液,并在50 mL的1x DNA卤素缓冲液(DHB;140 mM NaCl,27 mM KCl,110 mM NaHPO 4,15 mM KH2PO 4;pH7.4)中快速冲洗载玻片三次,即将载玻片浸入含有DHB的Coplin罐中并取出。
- 将载玻片转移到含有 50 mL 提取缓冲液的 Coplin 罐中:2 M NaCl、10 mM PIPES (pH 6.8)、10 mM 乙二胺四乙酸 (EDTA)、0.1% (w/v) 洋地黄皂苷、0.05 mM (v/v) 精胺、0.125 mM (v/v) 亚精胺。在室温下孵育4分钟。
注意:洋地黄皂苷如果吞咽或与皮肤接触是有毒的,如果吸入是致命的。确保洋地黄皂苷在LEV通风柜中处理,并穿上实验室外套,丁腈手套(双层手套),安全眼镜和口罩。精胺和亚精胺都可能导致严重的皮肤灼伤和眼睛损伤,而EDTA会引起严重的眼睛刺激,因此请小心处理每种化学物质。
注意:通过将粉末溶解在60-70°C的水中来单独制备洋地黄皂苷。 冷却后,将溶解的洋地黄皂苷加入提取缓冲液中。最后将精胺、亚精胺和洋地黄皂苷加入提取缓冲液中以保持生物活性。 - 在 50 mL 的 10x DHB(1.4 M NaCl、270 mM KCl、1.1 M NaHPO 4、150 mM KH2PO4;PH7.4),5x,2x和1x DHB,每个1分钟。
- 浸渍滑块(直入和直出)通过 10%、30%、70% 和 95% (v/v) 乙醇的 50 mL 顺序乙醇系列。
- 风干载玻片并储存在-80°C,直到进行二维荧光原位杂交(2D FISH)。
4. 二维荧光原位杂交
- 制作 20x SSC:3 M 氯化钠、0.3 M 柠檬酸三钠、pH 7.0。该缓冲液可以高压灭菌,在室温下储存,并根据需要进行稀释。
- 制作 70% (v/v) 甲酰胺,2x SSC pH 7.0,并在水浴中加热至 70 °C。
- 将载玻片孵育,每次5分钟,通过70%、90%和100%乙醇的顺序50mL乙醇系列。
- 在加热板上风干载玻片,在70°C烤箱中烘烤5分钟。
- 通过在70°C下放入70%甲酰胺,2x SSC溶液2分钟来变性载玻片。
注意:温度和时序对于步骤 4.5 至关重要。如果温度是,DNA不会变性,探针也不会杂交,并且不会从DNA晕FISH获得信号。 - 将变性载玻片放入50mL冰冷的70%乙醇中5分钟,并在室温下通过90%,95%和100%的乙醇系列,每次5分钟。
- 在加热板上风干
- 根据制造商的说明处理直接标记的全人类染色体探针。在这些实验中,我们使用了人类全染色体涂料1,13,15,17和18。此外,在该实验中,使用了 CCND1 和 CTNNA1 基因探针。
注意:整个染色体探针和BAC基因特异性探针都用生物素-11-dUTP标记,并通过与花青3(Cy3)偶联的链霉亲和素进行检测。对于由(DOP-PCR)和由缺口翻译标记的BAC DNA制成的染色体绘画探针,从协议中开始,这些将被称为DNA探针,并按如下方式处理。 - 变性DNA探针(全染色体油漆或基因特异性探针)在75°C下在热块或水浴中10分钟。
- 在37°C下在热块或水浴中加热DNA探针30分钟,然后将10μL移液到适当的载玻片上。
注意:此步骤对于阻断重复的染色体序列很重要。如果不执行,非特异性信号可能会在DNA晕FISH中产生。 - 覆盖探头,带有 21 mm x 21 mm 盖玻片,并使用橡胶水泥密封。
- 在加湿的杂交室中将载玻片在37°C下孵育至少18小时。
注意:加湿杂交室可以由夹心盒制成,夹心盒包含几层湿润的组织,以及由切割的 10 mL 塑料移液器制成的凸起平台,用于将载玻片放在上面。它被铝箔覆盖,以尽量减少暴露在光线下。 - 用镊子小心地取出橡胶水泥。
- 将载玻片在 50 mL 50% (v/v) 甲酰胺、2x SSC、pH 7.0 溶液中孵育,该溶液已预热至 45 °C 进行三次 5 分钟孵育。
注意:让盖玻片在50%(v / v)甲酰胺,2x SSC,pH 7.0溶液中的第一次孵育中从载玻片上脱落。这可以防止因"拖"盖玻片而对DNA Halo制备物造成损坏。载玻片可以通过镊子夹住在缓冲液中搅拌,以帮助分离盖玻片。 - 接下来,将载玻片放入 50 mL 的 0.1x SSC、pH 7.0 溶液中,该溶液已预热至 60 °C,但置于 45 °C 水浴中。孵育5分钟,并用5分钟孵育再更换缓冲液两次。
- 将载玻片放入含有50mL 4x SSC,pH 7.0溶液的Coplin罐中,并在三次更换缓冲液的情况下孵育15分钟。
- 将 100 μL 4% BSA、4x SSC 溶液涂在每张载玻片上,并用一块石蜡膜覆盖。在室温下孵育10分钟。这可以防止抗体的非特异性结合。
- 为了检测标记的探针(生物素-16-dUTP),在室温下与100μL的1:200(在1%BSA,4x SSC中制成)链霉亲和素-Cy3孵育1小时。
注意:在实验前,按照制造商的说明稀释抗体和测试稀释度,以确保产生良好的信号 - 将载玻片放入室温下含有 50 mL 4x SSC(0.5% 吐温-20)pH 7.0 溶液的 Coplin 罐中,并用三次更换的缓冲液孵育 15 分钟。如果不需要免疫荧光,则可以在此阶段安装载玻片,如步骤4.21所示。
- 如果需要制成DNA晕的细胞的增殖状态,请在FISH步骤后,在安装或染色之前用抗pKi67抗体染色以掺入BrdU。
- 在50mL的1x磷酸盐缓冲盐水(PBS)中洗涤载玻片3次,每次5分钟,然后在室温下用PBS中的4%NCS封闭1小时。
- 将 200 μL 必要的一抗(兔抗人 pKi67;小鼠抗 BrdU)涂在载玻片上,用石蜡膜条覆盖并在室温下孵育 1 小时。
- 在 1x PBS 中洗涤载玻片 3 次 5 分钟,并在室温下在 200 μL 荧光染料偶联二抗(pKi67:猪抗兔 TRITC;BrdU:驴反鼠Cy3)。用PBS再洗3次5分钟。所有稀释均使用PBS中的1%(v / v)NCS在制造商建议的稀释范围内进行。
- 将载玻片安装在含有 DAPI 的 20 μL 封片剂中,并用 22 mm x 50 mm 盖玻片覆盖。
5. 端粒PNA鱼
- 要检测端粒,请使用端粒 PNA 鱼试剂盒 - FITC;按照制造商的说明执行该过程。除非另有说明,否则该程序应在室温下执行。
- 将载玻片浸入三缓冲盐水(TBS,pH 7.5)中2分钟,然后放入3.7%甲醛(TBS;v / v)中正好2分钟。
注意:TBS溶液含有10-30%氨丁三醇和10-30%2-氨基-2-(羟甲基)丙烷-1,3-二醇盐酸盐。这可能会引起严重的眼睛和皮肤刺激,因此请戴上防护手套和护目镜/面部防护装置。在通风良好的地方使用。 - 用TBS在Coplin罐中清洗载玻片两次,每次5分钟。
- 将载玻片浸入预处理溶液中10分钟,然后用TBS洗涤两次,每次洗涤5分钟。
- 接下来,将载玻片通过由 50 mL 的 70%、85% 和 95% (v/v) 乙醇组成的冰冷乙醇系列,每浓度 2 分钟。然后让载玻片风干。
- 根据荧光标签颜色的选择,将 10 μL 端粒 PNA 探针/FITC(或 Cy3)涂在每张载玻片上,并用盖玻片覆盖。在80°C的预热烤箱中孵育5分钟,然后在黑暗中放置约1小时。
注意:端粒PNA探针/ FITC含有6-100%的甲酰胺,会引起严重的眼睛刺激并且具有致畸性,因此可能对未出生的孩子造成严重伤害。如果女性怀孕或怀疑自己怀孕,则应避免使用甲酰胺。甲酰胺应在 LEV 通风橱中使用,并应佩戴适当的眼睛或面部防护装置。 - 要去除盖玻片,请将载玻片浸入"漂洗溶液"中1分钟,然后在65°C下放入"洗涤溶液"中5分钟。
注意:洗涤液含有1-5%的聚氧乙烯辛基苯基醚和1-5%的氯化钠。这是腐蚀性的,会造成严重的眼睛损伤。确保在处理洗涤液时佩戴护目镜或面部防护装置。 - 将载玻片通过 50 mL 冰冷的乙醇系列(70%、85% 和 95% (v/v))孵育每浓度 2 分钟,然后风干。干燥后,使用含有DAPI的封片剂进行滑盖,并用盖玻片覆盖。
6. 图像捕获和分析
- 要可视化DNA晕和染色体区域,请使用落射荧光显微镜(例如,徕卡DM4000显微镜)使用HC PL FLUOTAR 100X / 1.30油物镜和DFC365FX相机捕获图像。
- 捕获灰度图像并为捕获的每个通道定义颜色,以实现图像的伪着色。本实验中使用了商业软件(例如,LAS AF 版本 4.5.0 软件)。各个颜色通道导出为 TIFF。
- 使用 Java 图像处理程序斐济图像J 分析图像。 按文件 并 打开上传图像。
- 加载单独的图像通道或通过单击 图像 |颜色 |拆分通道。选择图像通道,然后单击 图像 |调整 ,然后选择 亮度和对比度。相应地更改并重复其他通道。
- 通过选择描述细胞核的DAPI染色通道来创建残余细胞核的掩码。点击 图片 |调整 ,然后选择 阈值。将出现一个对话框,可以在其中更改阈值,选中 深色背景 框。更改直到残余细胞核清除,然后按 应用 并关闭对话框。
注意:这将基于像素强度创建二进制蒙版,其中白色像素显示感兴趣区域,黑色像素显示背景。在探测通道上重复相同的过程。 - 使用手绘选择勾勒出残余核的外围,然后单击 编辑 并 清除外部。将探针通道覆盖在残余细胞核上。这可以通过按 图像|颜色 |合并频道。
- 要在 ImageJ 中设置测量刻度,请在比例尺上或两个已知距离的点之间画一条线。转到 分析 ,然后按 设置比例。在对话框中添加距离长度,然后单击 确定。要测量距离,请在要测量的点之间绘制一条线,然后单击 分析|"测量。这会将距离值传输到数据窗口。
- 测量最亮的DAPI强度,因为它与细胞核的中心重合。由此测量从核中心到最远染色体区域边缘(CTE)的距离。测量核中心到核边缘 (NE) 的距离。
- 确保将结果描述为 CTE/NE 比率。在这里,从核中心到每个最远的染色体区域边缘(CTE)的距离除以从核中心到每个核边缘(NE)的距离。这应该在至少 50 个细胞核上进行。这可以描述为条形图或箱形图。
- 要分析端粒,每个数据集至少分析30个细胞核。可以使用斐济ImageJ或手动分析图像,以计算残余细胞核和DNA晕内的端粒数量。BrdU或pKi67能够分化增殖(BrdU / piK67 +)和衰老/静止(BrdU / pKi67-)细胞核。数据可以用条形图表示,误差条对应于平均值的标准误差(SEM)。
- 使用学生 t 检验(未配对)将结果与 p>0.05 进行统计比较。
结果
这种DNA晕制备方法帮助我们努力确定年轻细胞和老年细胞内基因组行为的差异,以及来自具有异常核骨架蛋白的过早衰老疾病的细胞的差异15。 图1 显示了DNA晕的示例,其中可以看到残余细胞核的边缘,残留核内的DNA以及卷绕到周围区域产生DNA晕的未附着DNA。它还描述了如何获得残余核以及NE和CTE测量的分析。当细胞处于S期时,可以通过掺入标记的核苷酸(例如BrdU)或使用诊断增殖标记物抗pKi67(显示核仁和G1细胞中的异染色质区域)来区分增殖和非增殖细胞17,18。在高血清中生长而未达到汇合的原代细胞,对增殖标志物呈阴性,被认为是衰老的。在低血清中生长或已经融合的原代细胞,即对增殖标志物呈阴性的接触抑制被认为是静止的,并且在正确的营养和情况下能够重新进入增殖细胞周期。能够区分Ki67阳性和阴性细胞使我们能够确定增殖,静止和衰老的人真皮成纤维细胞之间的差异。 图2 显示了增殖的人真皮成纤维细胞的DNA晕,这些细胞在DNA复制过程中BrdU被掺入其中,这种机制不会发生在非增殖细胞中,随后用抗BrdU抗体染色。用增殖标记物抗pKi67抗体染色也见于 图2。这是一种强大的抗原,在 FISH 方案中存活下来,因此可以染色以进行 FISH 后和预安装。因此,增殖细胞在左列中对BrdU和抗pKi67(红色)呈阳性(红色),非增殖细胞,实际上图 2 中的衰老细胞显示在右列中。绿色信号是用端粒PNA FISH/FITC试剂盒显示的单个端粒。将免疫荧光与DNA晕相结合,可以在不同的细胞状态下进行分析,如图 2 所示,用于研究增殖,静止和衰老细胞。根据所选择的抗体,可以检查其他条件,例如分化,通过照射造成的DNA损伤等。
染色体区域也可以使用FISH在DNA晕中可视化。由于制备允许将DNA从细胞核中卷绕出来,染色体区域形状可能会受到干扰,在DNA晕中发现或小或大的染色体量,这取决于残余细胞核及其结构内基因组的锚定。 图3 揭示了一组DNA晕,其中单个染色体已经通过特定的全臂染色体绘画探针(红色)揭示了染色体1,13,17和18。抗pKi67(绿色)已用于标记增殖细胞及其在同一培养物中的缺失,在同一载玻片上,表示衰老细胞。从图像和以CTE / NE形式呈现的数据中可以非常明显地看到,小基因贫瘠的18号染色体是一条几乎没有附着物的染色体,并且离残余细胞核的中心比其他染色体更远。然而,对于1号染色体也是如此。使用增殖标记抗pKi67,还可以在同一培养物中和同一载玻片上比较与衰老细胞的增殖,并且该分析表明,在与残留核结构的附着方面,这两种非常不同的细胞状态中的染色体彼此没有显着差异。
有趣的是,基因在增殖细胞和衰老细胞之间也显示出统计学上的显着差异,这些差异留在残留细胞核内或位于DNA晕中。 图4 用红色标记的BAC探针和绿色的抗Ki67描绘的基因位点来证明这一点。在DNA晕制备后,增殖细胞与衰老细胞中的基因位置之间没有显着差异。然而,DNA晕中的连环蛋白α1 CTNNA1 位点明显多于细胞周期蛋白D1 CNDD1 位点,后者很少。 图5 显示了端粒为绿色的DNA晕制备物。背景故意保持较高,以使端粒信号能够在DNA晕中可视化。在这组数据中,静态细胞,即血清饥饿7天的细胞已被包括在内,有趣的是,与增殖和衰老细胞相比,静止细胞中未附着且位于DNA晕内的端粒明显更多。在 图5a 中,可以观察到DNA晕中端粒的比例,特别是对于图像"实验2"。这与 图5b 相对应,其中静止细胞中DNA晕中端粒的平均百分比约为17%。有证据表明,并非所有衰老细胞中的端粒都可以被视为其中一些可能非常短。
这种DNA晕的方法已经成功地让我们研究了患病细胞核内的基因组相互作用改变15。 图6 显示了一级对照成纤维细胞和具有典型(层粘连蛋白A突变)和非典型哈钦森-吉尔福德早衰综合征的患病细胞中染色体附着的差异,表达不同的SUN1亚型并且没有层粘连蛋白A突变19。与对照 DNA 晕相比,染色体 1 和 13 在残余细胞核内的附着显示出统计学上的显着差异。 图6b 将整个染色体区域的位置与残余细胞核和DNA晕相关联。值为 1 或更小表示染色体位于残余细胞核内,大于 1 的值表示 DNA 晕内的染色体或染色体部分。
总体而言,这突出了HALO-FISH在影响细胞周期(增殖,静止和衰老)或疾病细胞(例如早衰和癌细胞系)的各种条件下研究整个染色体,特定基因和端粒的基因组相互作用中的实用性。事实上,这些状态之间相互作用的差异意味着核骨架在调节细胞核内的关键过程中起着重要作用。

图1: HDF提取的细胞核显示残余细胞核和DNA晕以及分析方法概述。(a) 通过 DNA 晕测定制备并用 DAPI 复染的 HDF 细胞核。鲜艳染色的残余细胞核显示DNA锚定在核骨架上,并且被形成DNA晕的非附着DNA包围。放大倍率 = x 100;比例尺 10 μm。 (b) 蓝色通道捕获 DAPI 染色的细胞核和周围的 DNA。使用ImageJ选择并去除残余细胞核。箭头表示从核中心到残余核边缘 (NE) 的距离。(c) 红色通道显示探头信号。(d) 标有"结果"的图像是将红色通道叠加在蓝色通道图像上的结果;这允许从核中心到最远的染色体区域边缘(CTE)的距离。 请点击此处查看此图的大图。
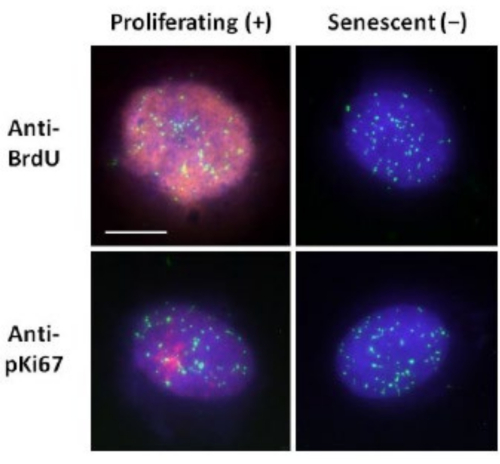
图 2: 使用端粒 PNA FISH 在增殖和衰老 HDF 上进行 DNA 晕制备。端粒PNA FISH在HDF上进行DNA晕测定。端粒信号以绿色(FITC)可视化,残留和晕部DNA使用DAPI(蓝色)复染,并使用抗BrdU或抗pKi67抗体通过红色间接免疫荧光(TRITC)检测增殖细胞核。放大倍率 = x 100;比例尺 10 μm。 请点击此处查看此图的大图。
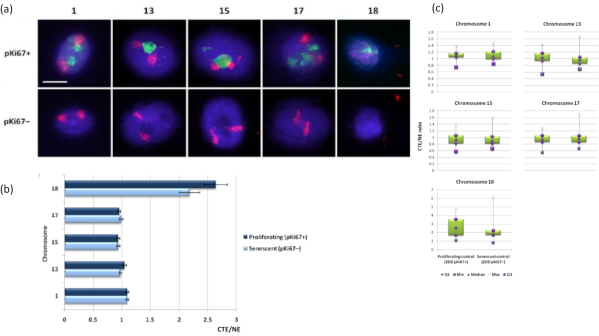
图 3: 核骨架-染色体相互作用和使用 DNA 晕测定的分析。(a) 对经受DNA晕合成的HDF进行带有1、13、15、17和18号染色体特异性探针的2D-FISH。整个染色体被涂成红色(Cy3),并用pKi67探测细胞核以确定它们是增殖还是衰老。增殖细胞(pKi67+)以绿色(FITC)描绘,而衰老细胞保持未染色(pKi67-),即未检测到绿色信号。放大倍率 = x 100;比例尺 10 μm。 (b) 核骨架在经过卤素的增殖和衰老 HDF 中的染色体锚定。测量显示增殖 (pKi67+) 和衰老 (pKi67-) 细胞中染色体 1、13、15、17 和 18 的最远染色体区域边缘 (CTE) 与各自核边缘 (NE) 的比率。误差条表示± SEM。 (c)修改了pKi67+和pKi67-细胞核中染色体区域边缘(CTE)到特定染色体各自核边缘(NE)的箱线图表示。Q1 = 下四分位数;最小值 = 记录的最低值;Med = 中位数;最大值 = 记录的最大值;Q3 = 上四分位数。 请点击此处查看此图的大图。
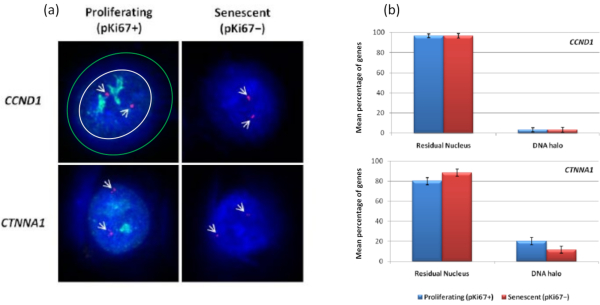
图 4: 使用 HALO-FISH 的 HDF 中的基因特异性相互作用。(a)用基因特异性探针(CCND1 和 CTNNA1)探测DNA晕提取的细胞核,以研究它们在增殖和衰老细胞上对NM的锚定。基因信号以红色(Cy3)显示,抗pKi67描绘增殖细胞,信号以绿色(FITC)显示。对于增殖的CCND1图像,残余细胞核被封闭在白色圆圈内,白色和绿色圆圈之间的空间描绘了DNA晕。放大倍率 = x 100;比例尺 10 μm。 (b) CCND1 和 CTNNA1 的基因特异性信号在残余细胞核和DNA晕之间以及增殖细胞和衰老细胞之间进行比较。误差线表示 SEM ±。 请点击此处查看此图的大图。
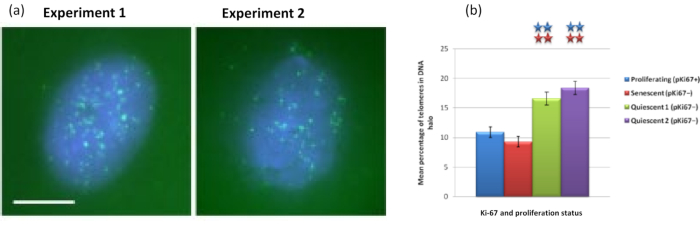
图 5: 用端粒 PNA-FISH 探测的静态 HDF 上的 DNA 晕测定。(a)HDFs的静止是通过在低血清培养基中培养7天诱导的。进行DNA晕测定,PNA-FISH能够通过FITC信号(绿色)可视化端粒,并用DAPI(蓝色)对残留细胞核和周围的DNA晕进行复染。细胞也用抗pKi67抗体染色,以确保细胞核不增殖。这在两个不同的场合重复出现。放大倍率 = x 100;比例尺 10 μm。 (b) 增殖、衰老和静止 HDF 细胞中位于 DNA 晕内的端粒平均百分比的比较。误差线表示 SEM ±。 请点击此处查看此图的大图。
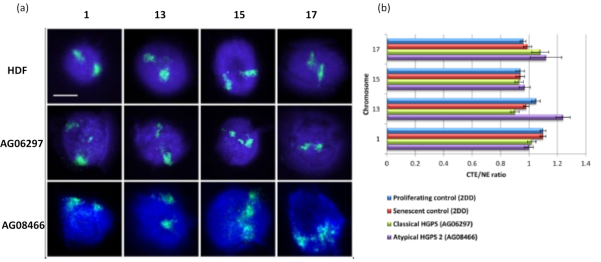
图 6:使用 HALO-FISH26 检查 HGPS 细胞中核骨架的整个染色体锚定。(a)对照HDF(2DD),经典HGPS(AG06297)和非典型2型HGPS(AG08466)细胞核进行DNA晕制备,然后使用全染色体涂料对1号,13号,15号和17号染色体进行2D-FISH。整个染色体以绿色(FITC)表示,DNA用DAPI(蓝色)复染。放大倍率 = x 100;比例尺 10 μm。 (b) 通过测量平均染色体区域边缘 (CTE) 与核边缘 (NE) 的比率来确定提取的细胞核内染色体的位置。高于 1 的比率表明最远的 CTE 位于 DNA 晕内的相应 NE 之外,而低于 1 的比率表示最远的 CTE 位于残余细胞核内的 NE 内。请点击此处查看此图的大图。
| 成分 | 体积(微升) |
| 5XDOP-PCR缓冲 | 10 |
| dNTPmix(withoutdTTP)(2mM) | 5 |
| dTTP(2mM) | 2 |
| 生物素-16-dUT或地高辛-11-dUTP | 10 |
| 引子(20μM) | 5 |
| TaqDNA钎聚酶(1U/μL) | 1 |
| PCR级水 | 12 |
| 模板 | 5 |
表1:显示1x反应的DOP-PCR组分和体积的表格
| 步 | 周期 | 温度(摄氏度) | 时间 |
| 初始变性 | 1 | 95 | 3 分钟 |
| 变性 | 34 | 98 | 20 秒 |
| 引物退火 | 62 | 1 分钟 | |
| 外延 | 72 | 30 秒 | |
| 最终延期 | 1 | 72 | 5 分钟 |
| 冷却 | 4 | 拿 |
表2:显示DOP-PCR循环、温度和时间曲线的表格。
| 成分 | 体积(微升) |
| 10x NT 缓冲液(0.5M 盐酸三溶液 pH 8.50 mM 氯化镁 2,0.5 毫克/毫升 BSA) | 5 |
| 0.1 M β-巯基乙醇 | 5 |
| 10X 核苷酸储备液(0.5 mM dATP、0.5 mM dCTP、0.5 mM dGTP、0.5 mM dTTP、0.5 mg/ml 生物素-16-dUTP) | 5 |
| 脱氧核糖核酸酶 I (1 纳克/毫升) | 2 |
| 脱氧核糖核酸聚合酶 I | 每微克脱氧核糖核酸 5U |
| 脱氧核糖核酸模板(1微克) | 1 |
| DEPC处理过的水 | 至 50 μL |
表 3:显示一个探头的昵称转换组件和体积的表格。
讨论
在分析核骨架和基因组之间的相互作用时,DNA晕法是一种极好的选择方法,但是,也必须遵守一些关键步骤。最重要的参数之一是细胞接种密度的优化。如果细胞过度汇合,那么DNA晕将与邻近细胞重叠,从而无法进行分析。CSK和提取缓冲液在使用当天必须始终保持新鲜,在制备过程结束时将精胺、亚精胺和洋地黄皂苷添加到提取缓冲液中,以保持其生物活性。如果进行Halo-FISH,则使用DNA晕的正确变性温度以使探针或油漆随后杂交非常重要。
电子显微镜已被用于可视化核基质,并鉴定丝状结构20。然而,电子显微镜检查是有限的,因为基质与染色质的关联不容易推断出来。事实上,与电子显微镜相比,DNA Halo方法更通用,因为可以检查特定的基因,染色体和细胞状态。此外,正在研究核基质蛋白的蛋白质组学分析21,22。这种方法适用于比较核基质成分,特别是在比较患病细胞时,但是,它不提供标准DNA晕轮技术突出显示的空间分布和附着。
DNA晕测定确实有局限性。首先,由于基质被提取,这只能在固定细胞上进行,因此无法进行实时成像。尽管DNA Halo方法相对快速且易于执行,但当将细胞培养,探针生成,Halo-FISH和分析全部考虑在内时,整个过程可能会非常耗时。
使用超分辨率显微镜捕获DNA晕和卤素鱼的图像将大大提高DNA特异性探针和抗体的分辨率。此外,由于荧光染料可以更容易地进行光谱分离,因此可以在单个实验中使用多个DNA探针,从而提供更多信息。分子生物学技术的改进,如染色体构象捕获(3C)已被用于确定基因位点的相互作用并分析细胞中染色质的空间组织。DNA晕测定和3C可以组合使用,称为M3C23,再次证明了DNA晕技术的适应性。
这里提供的原始数据是为了证明基因组行为询问的可能性以及如何呈现这些数据。有了这些数据,我们已经证明,使用(1)染色体绘画探针可以确定基因组附着的显着差异,在这项研究中,揭示了18号染色体是所分析染色体中附着最少的染色体(图3);(2)两个基因位点与(图4)(3)端粒之间有显着差异的基因位点,与增殖和衰老细胞相比,端粒在静止细胞中的附着力较低(图5)。我们能够通过增殖标记Ki67抗原的存在来区分增殖和非增殖细胞,Ki67抗原是一种不溶性蛋白质,因此保留在残留的细胞核中,或者使用核苷酸的掺入来突出显示在特定时间段内通过S期的细胞(图2)。这项技术还使我们能够分析在其核骨头(即椎板病细胞)中受到损害的细胞中的基因组行为,在这里和Bikkul等人,2018年,我们发现与对照细胞相比,基因组可以不那么紧密地附着,并且在使用特定药物治疗时可以恢复,这些药物可以改善经典HGPS细胞中层粘连蛋白A突变的作用15.然而,我们在这里显示了非典型HGPS AGO8466细胞的新数据,缺乏层粘连蛋白A突变,但含有不寻常形式的LINC复合蛋白SUN119,染色体13 的附着力较低(图6)。
HALO-FISH 是一种独特的方法,它能够研究与核骨架的基因组相互作用,结合间接免疫荧光来解析未从提取过程中去除的蛋白质。已经证明,核骨架在各种疾病中被修饰,例如某些癌症类型19和某些核骨架相关蛋白作为诊断生物标志物的重要性24,25。因此,该技术在检查细胞骨架对疾病15,24,25,27中染色质组织/组织失理的影响方面具有重要作用,并且不仅限于人类细胞,使用来自其他动物的染色体绘画探针,可以采用相同的DNA-halo协议28。
披露声明
作者没有什么可透露的。
致谢
我们要感谢Michael Bittner教授对染色体手臂绘画探针的善意礼物。LG得到了欧盟资助的EURO-Laminopathies项目和布鲁内尔早衰研究基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10X PBS | Thermo Fisher Scientific | 10388739 | Used to create DNA halos |
| 5-bromo-2′-deoxy-uridine | Sigma-Aldrich | B5002-100MG | Labelled nucleotide |
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100MG | Labelled nucleotide |
| Agar Technical | Thermo Fisher Scientific | 15562141 | DNA isolation of BAC clones |
| Agarose | Sigma-Aldrich | A939-50G | Check product size of DOP-PCR and nick translation |
| Atypical type 2 HGPS fibroblasts (AG08466) | Coriell Institute | AG08466 | Cell line |
| Bacto tryptone | Thermo Fisher Scientific | 16269751 | DNA isolation of BAC clones |
| Biotin-16-dUTP | Roche Diagnostics | 11093711103 | Labelled nucleotides |
| Chloramphenicol | Sigma-Aldrich | C0378-25G | DNA isolation of BAC clones |
| Classical Hutchinson-Gilford progeria syndrome (HGPS) fibroblasts (AG06297) | Coriell Institute | AG0297 | Cell line |
| Coplin jar | Thermo Fisher Scientific | 12608596 | Holds 5 slides or 8 slides back to back |
| Cot-1 DNA | Thermo Fisher Scientific | 15279011 | Block nonspecific hybridization in HALO FISH |
| DEPC-treated water | Sigma-Aldrich | 693520-1L | DNA isolation of BAC clones |
| Dextran sulphate | Sigma-Aldrich | S4030 | Hybridisation mixture |
| Digitonin | Sigma-Aldrich | D141 | Component of extraction buffer |
| Digoxigenin-11-dUTP | Sigma-Aldrich | 11093088910 | Labelled nucleotides |
| Donkey anti-mouse Cy3 | Jackson Laboratory | 715-165-150 | Secondary antibody |
| EDTA | Sigma-Aldrich | E6758 | Component of extraction buffer |
| Ethanol | Component of extraction buffer | ||
| Ethanol | Sigma-Aldrich | 443611 | Probe precipitation and HALO FISH |
| Fetal bovine system | Thermo Fisher Scientific | 26140079 | Cell culture serum |
| Formamide | Thermo Fisher Scientific | 10523525 | 2D FISH of DNA halos |
| Glass wool | Sigma-Aldrich | 18421 | Spin column |
| Herring sperm | Sigma-Aldrich | D7290 | Probe precipitation |
| HXP™ Lamp (metal halide microscope lamp) | OSRAM | HXP-R120W45C VIS | Image capture of DNA halos |
| Hydrochloric acid | Thermo Fisher Scientific | 10313680 | Cleaning microscope slides |
| Isopropanol | Sigma-Aldrich | I9516-25ML | DNA isolation of BAC clones |
| KAPA HiFi PCR Kit | KAPA Biosystems | KK2103 | PCR Kit |
| Leica DM4000 fluorescent microscope with DFC365 FX camera and LAS AF (Version: 4.5.0) image acquisition software. | Leica Microsystems | Image capture of DNA halos | |
| Luria-Bertani agar | Thermo Fisher Scientific | 13274843 | DNA isolation of BAC clones |
| Magnesium chloride | Sigma-Aldrich | M8266 | Component of CSK buffer |
| Methanol | Thermo Fisher Scientific | 10284580 | Cleaning and sterilizing microscope slides |
| Mouse anti-BrdU antibody | BD Pharmingen | B2531-100UL | BrdU visualisation |
| Newborn calf serum | Thermo Fisher Scientific | 16010159 | Cell culture serum and blocking reagent |
| Nick translation kit | Invitrogen | ||
| PCR grade water | Sigma-Aldrich | 693520-1L | PCR and DNA isolation of BAC clones |
| PCR Primers | Sigma-Aldrich | ||
| PIPES | Sigma-Aldrich | P1851 | Component of CSK and extraction buffers |
| Potassium acetate | Sigma-Aldrich | P1190-100G | DNA isolation of BAC clones |
| QuadriPERM® 4 X 12 | SARSTEDT | 94.6077.307 | Square cell culture dish, polysterene with four compartments. This has hydrophobic surface, is sterile, non-pyrogenic/endotoxin-fee and non-cytotoxic. |
| Rabbit Anti-Ki67 antibody | Sigma-Aldrich | ZRB1007-25UL | Proliferation marker |
| Rnase A | Sigma-Aldrich | R6513 | DNA isolation of BAC clones |
| Rubber cement | Halford's | 101836 | 2D FISH of DNA halos |
| Sephadex G-50 | Sigma-Aldrich | S6022-25G | Spin column |
| Sodium acetate | Sigma-Aldrich | S2889 | Probe precipitation |
| Sodium chloride | Sigma-Aldrich | S5886 | Component of CSK, extraction and SSC buffers |
| Sodium citrate | Sigma-Aldrich | C8532 | Component of SSC buffer |
| Sodium dodecyl sulphate | L3771-100G | DNA isolation of BAC clones | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | DNA isolation of BAC clones |
| Spermidine | Sigma-Aldrich | S2626 | Component of extraction buffer |
| Spermine | Sigma-Aldrich | S4264 | Component of extraction buffer |
| Streptavidin-Cy3 | Amersham Life Sciences Ltd, Scientific Laboratory Supplies | pa43001 | Probe antibody |
| Sucrose | Sigma-Aldrich | S0389 | Component of CSK buffer |
| Sucrose | Sigma-Aldrich | S0389 | CSK buffer+A66:D68 |
| SuperFrost™ microscope slides | Thermo Fisher Scientific | 12372098 | Microscope slides: 1 mm thickness, 76 mm length, 26 mm width. Uncoated. |
| Swine anti-rabbit TRITC | Dako | ||
| TELO-PNA FISH KIT | Agilent Dako | K532511-8 | Delineation of telomeres |
| Tris-HCl | Sigma-Aldrich | T3253-100G | Column buffer |
| Triton™ X-100 | Sigma-Aldrich | T9284 | Component of CSK buffer |
| Tryptone | Thermo Fisher Scientific | 10158962 | DNA isolation of BAC clones |
| Tween-20 | Sigma-Aldrich | P9416- 100ML | Detergent |
| Vectashield mountant containing DAPI | Vector Laboratories | H-1200 | 2D FISH of DNA halos |
| Whole human chromosome probes | Calbiochem | 2D FISH of DNA halos | |
| Yeast extract | Thermo Fisher Scientific | 10108202 | DNA isolation of BAC clones |
参考文献
- Berezney, R., Coffey, D. S. Identification of a nuclear protein matrix. Biochemical Biophysical Research Communications. 60 (4), 1410-1417 (1974).
- Haaf, T., Ward, D. C. High resolution ordering of YAC contigs using extended chromatin and chromosomes. Human Molecular Genetics. 3 (4), 629-633 (1994).
- Parra, I., Windle, B. High resolution visual mapping of stretched DNA by fluorescent hybridization. Nature Genetics. 5 (1), 17-21 (1993).
- Senger, G., et al. Released chromatin: linearized DNA for high resolution fluorescence in situ hybridization. Human Molecular Genetics. 3 (8), 1275-1280 (1994).
- Florijn, R. J., et al. High-resolution DNA Fiber-FISH for genomic DNA mapping and colour bar-coding of large genes. Human Molecular Genetics. 4 (5), 831-836 (1995).
- Elcock, L. S., Bridger, J. M. Fluorescence in situ hybridization on DNA halo preparations and extended chromatin fibres. Methods Molecular Biology. 659, 21-31 (2010).
- Heiskanen, M., et al. Visual mapping by fiber-FISH. Genomics. 30 (1), 31-36 (1995).
- Bensimon, A., et al. Alignment and sensitive detection of DNA by a moving interface. Science. 265 (5181), 2096-2098 (1994).
- Michalet, X., et al. Dynamic molecular combing: stretching the whole human genome for high-resolution studies. Science. 277 (5331), 1518-1523 (1997).
- Wilson, R. H., Coverley, D. Relationship between DNA replication and the nuclear matrix. Genes Cells. 18 (1), 17-31 (2013).
- Wilson, R. H. C., Coverley, D. Transformation-induced changes in the DNA-nuclear matrix interface, revealed by high-throughput analysis of DNA halos. Science Reports. 7 (1), 6475 (2017).
- Iarovaia, O. V., Akopov, S. B., Nikolaev, L. G., Sverdlov, E. D., Razin, S. V. Induction of transcription within chromosomal DNA loops flanked by MAR elements causes an association of loop DNA with the nuclear matrix. Nucleic Acids Research. 33 (13), 4157-4163 (2005).
- Tandara, M., et al. Sperm DNA integrity testing: big halo is a good predictor of embryo quality and pregnancy after conventional IVF. Andrology. 2 (5), 678-686 (2014).
- Repping, S., et al. The use of spermHALO-FISH to determine DAZ gene copy number. Mol Human Reproduction. 9 (4), 183-188 (2003).
- Bikkul, M. U., et al. Farnesyltransferase inhibitor and rapamycin correct aberrant genome organisation and decrease DNA damage respectively, in Hutchinson-Gilford progeria syndrome fibroblasts. Biogerontology. 19 (6), 579-602 (2018).
- Telenius, H., et al. Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer. Genomics. 13 (3), 718-725 (1992).
- Bridger, J. M., et al. Association of pKi-67 with satellite DNA of the human genome in early G1 cells. Chromosome Research. 6, 13-24 (1998).
- Sales Gil, R., Vagnarelli, P. Ki-67: More Hidden behind a 'Classic Proliferation Marker'. Trends in Biochemical Sciences. 43 (10), 747-748 (2018).
- Bikkul, M. U., et al. Telomere elongation through hTERT immortalization leads to chromosome repositioning in control cells and genomic instability in Hutchinson-Gilford progeria syndrome fibroblasts, expressing a novel SUN1 isoform. Genes Chromosomes Cancer. 58 (6), 341-356 (2019).
- Jackson, D. A., Cook, P. R. Visualization of a filamentous nucleoskeleton with a 23 nm axial repeat. EMBO Journal. 7, 3667-3677 (1988).
- Albrethsen, J., et al. Unravelling the nuclear matrix proteome. Journal of Proteomics. 72, 71-81 (2009).
- Mika, S., Rost, B. NMPdb: Database of nuclear matrix proteins. Nucleic Acids Research. 33, 160-163 (2005).
- Gavrilov, A. A., et al. of the nuclear matrix-bound chromatin hubs by a new M3C experimental procedure. Nucleic Acids Research. 38, 8051-8060 (2010).
- Sjakste, N., et al. Role of the nuclear matrix proteins in malignant transformation and cancer diagnosis. Experimental Oncology. 26 (3), 170-178 (2004).
- Leman, E. S., Getzenberg, R. H. Nuclear structure as a source of cancer specific biomarkers. Journal of Cellular Biochemistry. 104 (6), 1988-1993 (2008).
- Volpi, E. V., Bridger, J. M. FISH glossary: an overview of the fluorescence in situ hybridization technique. Biotechniques. 45 (4), 385-386 (2008).
- Bridger, J. M., Foster, H. A. Senescence and the Genome. Human Interphase Chromosomes. , (2021).
- Foster, H. A., Griffin, D. K., Bridger, J. M. Interphase chromosome positioning in in vitro porcine cells and ex vivo porcine tissues. BMC Cell Biology. 13 (1), 30 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。