Method Article
הכלאה פלואורסצנטית באתרה על תכשירי הילה של DNA לחשיפת כרומוזומים שלמים, טלומרים ומיקומי גנים
In This Article
Summary
שילוב של תכשירי הילה של DNA עם הכלאה פלואורסצנטית באתרו מאפשר ניתוח ברזולוציה גבוהה של אינטראקציות גנומיות עם השלד הנוקלאו-שלד. גנום מחובר מוביל לאותות פלואורסצנטיים היברידיים הממוקמים בתוך הגרעינים השיוריים שחולצו, בעוד שהגנום שאינו מחובר נמצא בהילת הדנ"א המקיפה את הגרעינים השיוריים.
Abstract
הגנום משויך למספר מבנים בתוך גרעיני התא, על מנת לווסת את פעילותו ולעגן אותה במקומות ספציפיים. מבנים אלה ידועים באופן קולקטיבי בשם גרעין השלד וכוללים את הלמינה הגרעינית, הגרעינים וגופים גרעיניים. למרות שקיימות גרסאות רבות של הכלאה פלואורסצנטית באתרו (FISH) כדי לחקור את הגנום ואת ארגונו, אלה מוגבלות לעתים קרובות על ידי רזולוציה ומספקות מידע לא מספיק על הקשר של הגנום עם מבנים גרעיניים. שיטת הילת הדנ"א משתמשת בריכוזי מלח גבוהים ודטרגנטים לא יוניים כדי ליצור לולאות דנ"א שנשארות מעוגנות למבנים בתוך גרעינים דרך אזורי התקשרות בתוך הגנום. כאן מופקים חלבונים גרעיניים מסיסים, כגון היסטונים, ליפידים ודנ"א שאינם קשורים היטב למטריצה הגרעינית. זה מוביל להיווצרות הילה של דנ"א לא מחובר סביב גרעין שיורי אשר עצמו מכיל DNA הקשור קשר הדוק עם מבנים גרעיניים פנימיים וחלבונים עמידים מיצוי. גדילי דנ"א מורחבים אלה מאפשרים רזולוציה מוגברת ויכולים להקל על מיפוי פיזי. בשילוב עם FISH, לשיטה זו יש יתרון נוסף של חקר אינטראקציות גנומיות עם כל המבנים שהגנום מעוגן בהם. טכניקה זו, המכונה HALO-FISH, היא רב-תכליתית ביותר לפיה ניתן לשלב הילות DNA עם בדיקות חומצות גרעין כדי לחשוף לוקי גנים, כרומוזומים שלמים, לוויין אלפא, טלומרים ואפילו RNA. טכניקה זו מספקת תובנה לגבי ארגון גרעיני ותפקוד בתאים נורמליים ובהתקדמות מחלות כגון עם סרטן.
Introduction
"המטריצה הגרעינית" תוארה לראשונה על ידי ברזני וקופי בשנת 19741. לאחר ביצוע מיצויים עם טוחנות מלח גבוהות וטיפול בנוקלאז על גרעיני כבד חולדה, הם זיהו מסגרת מבנית חלבונית. הליך הילת הדנ"א הותאם לאחר מכן משיטה זו וכולל הסרה של חלבונים מסיסים כך שרק המטריצה הגרעינית (NM) והחלבונים והכרומוזומים הקשורים לננומטר ימשיכו להתקיים. אזורי חיבור DNA ממוקמים בבסיס לולאות DNA ונקראים אזורים מחוברים מטריצה (MARs) או אזורי חיבור פיגומים (SARs), אשר עמידים למיצוי עם ריכוזי מלח גבוהים ודטרגנט יוני ליתיום-3,5-diiodosalicylate (LIS) בהתאמה. בהילות דנ"א, דנ"א הקשור ל-MARs/SARs קשור בתוך הגרעין השיורי, בעוד שלולאות הדנ"א מתרחקות מאתרים אלה ויוצרות את הילת הדנ"א. כיום אנו יודעים שהגנום מעוגן באמצעות תחומים הקשורים ללמינה (LADs) ללמינה הגרעינית ודרך אזורים הקשורים לגרעין (NADs) ואולי דרך מבנים גרעיניים אחרים כגון גופים גרעיניים ספציפיים.
שיטת הילת הדנ"א יכולה לשמש למיפוי פיזי של דנ"א, גנים ואזורים כרומוזומליים מכיוון שהדנ"א והכרומטין המורחבים מספקים רזולוציה גדולה יותר מכיוון שהכרומטין מופשט מהיסטונים והדנ"א נמתחהחוצה 2,3,4,5,6. עם זאת, ישנן כמה מגבלות בעת שימוש הילות DNA עבור יישום זה. לדוגמה, דנ"א הקשור באופן הדוק לגרעינים שיוריים של הילות דנ"א יכול להיות בלתי נגיש לגשושיות ובכך למנוע ממנו ניתוח ומיפוי פיזי6. טכניקות אחרות כגון fiber-FISH 2,4,5,7 וסירוק מולקולרי 8 מאפשרות גם הן מיפוי פיזי ויש להן יתרון בכך שהן מהירות וקלות יחסית לביצוע. שניהם משמשים באופן מועדף למיפוי DNA של גנים על פני הילות DNA. שיטות אלה לחלץ סיבי כרומטין באמצעות שימוש מיצוי ממס או מלח מן הגרעין, עם זאת, סירוק מולקולרי נוטה להיות רבייה טובה יותר 8,9.
ישנן ראיות הולכות וגדלות לכך שלשלד הנוקלאוסקלטון יש תפקיד בתמיכה בתהליכים גרעיניים מרכזיים, כגון אתרי התקשרות לדנ"א, עיצוב מחדש של כרומטין, שעתוק DNA, תיקון DNA ושכפול DNA11,12. ככזו, טכניקת הילת הדנ"א פותחה כדי לחקור את יחסי הגומלין בין השלד והגנום במהלך פעילויות תאיות אלה ושימשה באופן שגרתי ודווחה במחקר. טכניקה זו שימשה גם לחקר אינטראקציות בין הגנום לבין השלד הנוקלאוסקלטוני ביחס להתקדמות המחלה, כאשר זוהו שינויים הקשורים לממאירות במבנה הגרעין11.
טכניקת הילת הדנ"א שימשה גם לחקר הקשר בין הגנום לשלד במהלך ההתפתחות וההתמיינות12. מספר מחקרים השתמשו בווריאציה של טכניקת הילת הדנ"א הידועה בשם הלוספרם13 או SpermHalo-FISH בשילוב עם FISH14. כרומטין הזרע קשור קשר הדוק לחלבונים המכונים פרוטמינים וטכניקה זו פותחה כדי לשפר את הגישה לדנ"א של הזרע. הלוספרם שימש כדי לחקור את שלמות הדנ"א של זרעונים ולקבוע אם קיים נזק לדנ"א. זרעונים עם פחות נזק לדנ"א קשורים לגודל הילת דנ"א גדול יותר, בעוד שלזרעונים עם רמות מוגברות של דנ"א מקוטע ופגום היו הילות קטנות או כלל לא. לפיכך, הלוספרם יכול לשמש כסמן פרוגנוסטי פוטנציאלי של איכות העובר והריון מוצלח עם הפריה חוץ גופית13. דוגמה זו מדגישה את היישומים הקליניים הפוטנציאליים של טכניקה זו. בעבודתנו השתמשנו ב- HALO-FISH כדי להעריך שינויים בהתנהגות הגנום ואת ההשפעה של טיפולים תרופתיים ספציפיים במחלת ההזדקנות המוקדמת תסמונת האצ'ינסון-גילפורד פרוגריה (HGPS)15.
יחד, מחקרים אלה ואחרים, מדגישים את רוחב התהליכים/יישומים שניתן להשתמש בהם בטכניקת הילת הדנ"א כדי לחקור את הטכניקה ואת תועלתה.
Protocol
1. הכנת שקופיות, עיקור ותרבית תאים
- מכינים 500 מ"ל של 10% HCl (v/v) ויוצקים לתוך גדולה.
- יש להחליק את המיקרוסקופ בנפרד לתוך החומצה ולדגור במשך שעה אחת בטמפרטורת החדר על שייקר שנקבע על 2 x גרם.
אזהרה: HCl הוא חומר מאכל ומגרה. הוא עלול לגרום לכוויות חמורות בעור ולנזק לעיניים ולגירוי של העור, העיניים ומערכת הנשימה. יש להקפיד על לבישת הגנה אישית מתאימה הכוללת כפפות ניטריל, מגן עיניים ומעיל מעבדה. - מרוקנים חומצה מהכוס ומחליקים עשר פעמים במי ברז ואז עשר פעמים נוספות במים נטולי יונים.
- יש לשטוף את המגלשות במתנול פעמיים ולשמור במתנול עד לעיקור על ידי שריפה.
אזהרה: מתנול הוא נוזל דליק מאוד ורעיל בבליעה, במגע עם העור או בשאיפה. בנוסף, מתנול עלול לגרום נזק לאיברים, הוא קורוזיבי ומגרה. יש להקפיד על מגבלות החשיפה במקום העבודה ולוודא כי נלבשת הגנה אישית מתאימה, כולל כפפות גומי בוטיל, הגנה על העיניים ומעיל מעבדה. במידת האפשר, יש לטפל בארון אדים של אוורור פליטה מקומי (LEV). - בעזרת מלקחיים מתכתיים או מלקחיים ארוכים, הסירו מהכוס מגלשת מיקרוסקופ המכילה מתנול. מבעירים מעל מבער בונזן לעיקור, ומעבירים לכלי תרבית תאים מלבני המכיל ארבעה תאים למגלשות, הממוקם בסמוך למבער הבונזן.
זהירות: בעירה מאפשרת עיקור מיידי של שקופיות מיקרוסקופ לפני השימוש; עם זאת, לשיטה זו יש סיכונים נלווים. מכיוון שמתנול דליק מאוד, חשוב שהכוס המכילה את המגלשות תמוקם הרחק ממבער הבונזן. יש להשתמש במלקחיים ארוכים או במלקחיים האוחזים בחוזקה במגלשות. רמת המתנול בכד צריכה פשוט לכסות את המגלשות, הן כדי למזער את כמות המתנול בשימוש והן כך שרק קצות המלקחיים/מלקחיים יהיו במגע עם המתנול. יש לוודא תמיד שהמתנול התאדה מהמלקחיים או המלקחיים לאחר השימוש ושאלו התקררו לפני הכנסתם חזרה לכד המכיל את המגלשות והמתנול. הכד צריך להיות מכוסה על ידי חתיכת נייר אלומיניום כדי להרעיב את החמצן אם מתנול עולה באש. לעולם אין להבה מחליקה בתוך מכסה מנוע זרימה למינרי Class II שבו האוויר מוזרם. - לחלופין, בצעו את שלבים 1.1 עד 1.4, אך במקום להבעיר את המגלשות לאחר הדגירה עם מתנול, הניחו את המגלשות על רקמה נטולת סיבים לייבוש באוויר. לאחר הייבוש, עוטפים ברדיד אלומיניום ומניחים בתנור סטריליזטור או אוטוקלאב.
- לגדל תאים בתווך המתאים עם סרום לפחות 48 שעות ב 37 ° C ב 5% CO2 עד 60-70% מפגש הוא הגיע. פרוטוקול זה בוצע על מעבר מוקדם של פיברובלסטים עוריים אנושיים (HDFs) ועל פיברובלסטים קלאסיים של תסמונת האצ'ינסון-גילפורד פרוגריה (HGPS) (AG06297) ופיברובלסטים לא טיפוסיים מסוג 2 HGPS (AG08466). קצור כל סוג תא וספירה באמצעות המוציטומטר כדי לקבוע את צפיפות התא. זרע 1 x 105 תאים ב 10 מ"ל בינוני לכל שקופית.
הערה: צפיפות התא חשובה מכיוון שלולאות דנ"א מגרעינים שונים עשויות להתכנס אם התאים הופכים לנפגשים מדי. ייתכן שיהיה צורך למטב את צפיפות הזריעה בהתאם לסוג התא המשמש תאים מותמרים עשויים להתרבות מהר יותר, בעוד תרביות תאים במעבר מאוחר יותר עשויות להימשך זמן רב יותר כדי להגיע למפגש הרצוי. - אם תאים צריכים להיעצר ב G0 כדי להיות שקט, ואז זרע 1 x 105 תאים (ב 10 מ"ל בינוני) לכל שקופית ולהשאיר לגדול במשך 24 שעות. יש לשטוף תאים פעמיים עם מדיום ללא סרום ולדגור בתווך סטנדרטי המכיל ריכוז נמוך יותר של סרום ב -0.5% (סרום עגל יילוד, NCS; או סרום בקר עוברי, FBS) במשך 7 ימים.
- אם מצב ההתרבות של התאים נדרש עבור בדיקת הילה של DNA, אז לקבוע תאים שעברו שלב S על ידי שילוב של 5-bromo-2'-deoxy-uridine (BrdU) לתוך ה- DNA במהלך השכפול.
- זרעו תאים כרגיל וגדלו במשך 24 שעות. הסר את מדיום התרבית והחלף במדיום המכיל BrdU ו- 5-fluoro-2'-deoxyuridine (3 מיקרוגרם / μL). לאחר 24 שעות נוספות, להסיר את המדיום, לשטוף את התאים פעם אחת עם בינוני (10% NCS) ולאחר מכן להאכיל מחדש עם מדיום טרי (10% NCS). דגרו במשך 24 שעות נוספות ולאחר מכן הכינו את השקופיות לבדיקת הילת הדנ"א.
2. הכנת בדיקה
- גשושיות כרימוזום שלמות וצביעות זרוע
- צור בדיקות כרומוזומים מהגברה של כרומוזומים ממוינים או מיקרו-חתוכים על ידי תגובת שרשרת פולימראז מנוונת של אוליגונוקלאוטיד (DOP-PCR) באמצעות השיטה של Telenius et al.16. השתמש ב- DOP-PCR כדי לתייג בדיקות כרומוזומים עם Biotin-16-dUTP או Digoxigenin-11-dUTP כפי שמוצג בטבלה 1. אנא בדוק את הוראות היצרן עבור פרופיל הגברה, עם זאת, התנאים המשמשים לניסוי זה מוצגים בטבלה 2.
- הכן בדיקת זרוע או כרומוזום שלם על ידי הוספת 8 μL של מוצר PCR מסומן, 7 μL של Cot-1 DNA, 3 μL של זרע הרינג, 1/20נפח של 3 M נתרן אצטט (pH 5.4) ו 2 כרכים של 100% אתנול. לדגור על פתרון הבדיקה במשך מינימום של 30 דקות ב -80 ° C.
הערה: שיטה זו יכולה לשמש ליצירת בדיקות כרומוזום יחיד, או בדיקות כרומוזומים מרובות אם תוויות שונות (כלומר, Biotin-16-UTP ו- Digoxigenin-11-dUTP) משמשות עבור כל כרומוזום מעניין.
אזהרה: אתנול הוא נוזל ואדים דליקים מאוד ועלול לגרום לגירוי חמור בעיניים. יש להרחיק מחום, משטחים חמים ומקורות הצתה. יש להקפיד על מגבלות החשיפה במקום העבודה ולוודא כי נלבשת הגנה אישית מתאימה, כולל כפפות גומי בוטיל, הגנה על העיניים ומעיל מעבדה. במידת האפשר ידית בארון אדים LEV. - תמיסת בדיקה צנטריפוגה ב 13,700 x גרם במשך 15 דקות ב 4 ° C ולאחר מכן לשטוף עם 70% אתנול. חזור על הליך הצנטריפוגה והשלך את הסופרנטנט, תוך הקפדה שלא להפריע או לאבד את גלולת ה- DNA. הניחו לגלולת הדנ"א להתייבש.
- הוסף 12 μL של חיץ הכלאה (50% פורממיד, 10% דקסטרן סולפט, 10% 20x מלוחים נתרן ציטראט (SSC; 3 M NaCl, 0.3 M tri-sodium ציטראט; pH 7.0), 1% (v/v) פוליאוקסאתילן סורבינל מונולאורט (Tween-20)) לגלולת ה- DNA. השאירו בטמפרטורה של 37°C למשך שעתיים לפחות עד שגלולת הדנ"א תתמוסס לתוך מאגר ההכלאה.
אזהרה: פורממיד הוא חומר מסרטן וטרטוגני ולכן עלול לגרום נזק חמור לילד שטרם נולד. אם אישה בהריון או חושדת שהיא בהריון עליהם להימנע מעבודה עם פורממיד. יש להשתמש בפורמיד במנדף LEV. יש להקפיד על מגבלות החשיפה במקום העבודה ולוודא כי נלבשת הגנה אישית מתאימה, כולל כפפות גומי בוטיל, הגנה על העיניים ומעיל מעבדה.
- בידוד DNA מכרומוזומים מלאכותיים חיידקיים (BACs)
- פזרו חלק קטן ממלאי הגליצרול משיבוט BAC על צלחת אגר Luria-Bertani (LB) (1% (W/V) NaCl; 1% (w/v) טריפטון, 0.5% (w/v) תמצית שמרים, 1.5% (w/v) אגר טכני, 12.5 מיקרוגרם/מ"ל (w/v) כלוראמפניקול). לדגור לילה ב 37 °C (77 °F).
- בחר מושבה אחת מהצלחת וחסן 10 מ"ל של ציר LB (1% (w/v) NaCl, 1% (w/v) bactotryptone, 0.5% (w/v) תמצית שמרים, 12.5 מיקרוגרם / מ"ל (w/v) chloramphenicol). השאירו את התמיסה באינקובטור רועד למשך הלילה ב 37 מעלות צלזיוס.
זהירות: כלוראמפניקול חשוד בגרימת סרטן. טפל בזהירות וצמצם את החשיפה. - תרבית צנטריפוגות במהירות 1,700 x גרם למשך 10 דקות בטמפרטורת החדר.
- יש להשליך סופרנאטנט ולהוסיף 300 μL של תמיסת P1 (15 mM Tris (pH 8), 10 mM EDTA, 100 μg/mL RNase A) לכדור. מערבולת במרץ ולהעביר תאים לצינור מיקרוצנטריפוגה 2 מ"ל.
- הוסף 300 μL של תמיסת P2 (0.2 M NaOH, 1% (w/v) נתרן דודציל סולפט (SDS) טיפה לתאים. הפכו את צינור המיקרוצנטריפוגה הסגור 5 פעמים והשאירו בטמפרטורת החדר למשך 5 דקות לכל היותר.
אזהרה: נתרן הידרוקסידי הוא חומר מאכל ועלול לגרום לכוויות חמורות בעור ולנזק לעיניים. זה עשוי להיות קורוזיבי למתכות. טפל בזהירות וצמצם את החשיפה. יש להקפיד על מגבלות החשיפה במקום העבודה ולוודא כי נלבשת הגנה אישית מתאימה, כולל כפפות גומי ניטריל, הגנה על העיניים ומעיל מעבדה. במידת האפשר ידית בארון אדים LEV.
אזהרה: סודיום דודציל סולפט הוא מוצק דליק, מזיק בבליעה ועלול לגרום לגירוי בעור ובדרכי הנשימה. זה עלול גם לגרום נזק חמור לעיניים. יש להקפיד על לבישת הגנה אישית מתאימה הכוללת כפפות גומי ניטריל, הגנה על העיניים ומעיל מעבדה. במידת האפשר ידית בארון אדים LEV. - הוסיפו 300 מיקרוליטר של P3 (3 M אשלגן אצטט) לאט לתאים וערבבו בעדינות. מניחים את צינור המיקרוצנטריפוגה על קרח למשך 10 דקות.
- צנטריפוגה ב 8,100 x גרם למשך 10 דקות ב 4 ° C ולהעביר את supernatant לצינור המכיל 800 μL של איזופרופנול קר כקרח. הפוך את הצינור מספר פעמים ודגר ב -20 ° C במשך הלילה.
אזהרה: איזופרופנול הוא נוזל ואדים דליקים מאוד ועלול לגרום לגירוי חמור בעיניים, נמנום או סחרחורת. יש להרחיק מחום, משטחים חמים ומקורות הצתה. הקפידו על מגבלות החשיפה במקום העבודה והקפידו על לבישת הגנה אישית מתאימה, כולל כפפות גומי ניטריל, הגנה על העיניים ומעיל מעבדה. במידת האפשר ידית בארון נדף LEV). - צנטריפוגה ב 8,100 x גרם במשך 15 דקות ב 4 ° C. מוציאים את הסופרנאטנט ומעבירים לצינור אחר. הוסף 500 μL של אתנול קר כקרח 70%. הפוך צינור מספר פעמים וצנטריפוגה ב 8,100 x גרם במשך 5 דקות ב 4 ° C.
- מוציאים את הסופרנאטנט ומייבשים את הגלולה באוויר בטמפרטורת החדר. לאחר שהגלולה יבשה, יש להשהות מחדש ב-40 מיקרוליטר מים המטופלים בדיאתיל פירוקרבונט (מטופלים ב-DEPC) ולהשאיר בטמפרטורה של 4°C למשך הלילה. לאחר השעיה מלאה להסיר 5 μL של פתרון ולטעון על ג'ל agarose 1% כדי לבדוק נוכחות של DNA.
- הכנת בדיקה של גן יחיד של BACs באמצעות תרגום ניק
- השתמשו בערכות תיוג לתרגום ניקים הזמינות באופן מסחרי. לחלופין, השתמש בפרוטוקול הבא. ראו טבלה 3 למרכיבים וכרכים.
- מוסיפים את המרכיבים מטבלה 3 יחד בצינור מיקרוצנטריפוגה ומוסיפים את הדנ"א פולימראז שאני מחזיק מעמד, מערבבים בעדינות וצנטריפוגה לזמן קצר למשך מספר שניות. לדגור את התמיסה ב 15 ° C במשך 2 שעות.
- כדי לוודא את גודל השברים, יש להעמיס 5 μL של התמיסה על ג'ל אגרוז 2%. טווח גודל מקטע ה- DNA צריך להיות בין 200-600 bp. אם גדלי מקטעי הדנ"א גדולים יותר, המשיכו לדגור על התמיסה במשך 15 דקות נוספות ב-15°C והריצו מוצרים על ג'ל אגרוז 2%.
- עצור את תגובת תרגום הניק על ידי הוספת 10 mM EDTA, 0.1% SDS (2.5 μL של 0.5 M EDTA, pH 8.0 ב 100 μL ו 1 μL של 10% SDS ב 100 μL). מחממים את התמיסה ב-65°C למשך 5 דקות.
- כדי להסיר נוקלאוטידים לא משולבים, החל בדיקת BAC על עמודת ספין. ניתן לרכוש עמודי ספין מסחריים, או ליצור אותם באמצעות מזרק כדלקמן:
- הוסף 30 גרם של Sephadex G-50 עד 500 מ"ל של מאגר עמודות (10 mM Tris-HCl (pH8), 1 mM EDTA, 0.1% SDS). Autoclave את התערובת. כמו כן, לעשות 500 מ"ל של חיץ עמודה (ללא Sephadex G-50) ו autoclave.
- צור עמודי סיבוב על ידי הוספת צמר זכוכית autoclaved לתחתית מזרק 1 מ"ל. מלא את מזרק 1 מ"ל עם Sephadex G-50 במאגר עמודה. מניחים מזרק 1 מ"ל לתוך צינור צנטריפוגה 15 מ"ל בעל צינור מיקרוצנטריפוגה ללא מכסה בתחתית. צנטריפוגה בגודל 1,600 x גרם למשך 5 דקות.
- הסר מזרק ולהשליך את צינור microcentrifuge בתחתית. הוסף צינור מיקרוצנטריפוגה טרי בחזרה לצינור הצנטריפוגה של 15 מ"ל. הוסף מאגר עמודות (ללא Sephadex G-50) למזרק 1 מ"ל והכנס מחדש לצינור צנטריפוגה 15 מ"ל. צנטריפוגה בגודל 1,600 x גרם למשך 5 דקות. חזור על שלב זה שוב פעמיים.
- מוציאים את המזרק ומכניסים לצינור צנטריפוגה בנפח 15 מ"ל המכיל צינור מיקרוצנטריפוגה חדש ונקי. החל בדיקה על מזרק לאסוף בדיקה בצינור microcentrifuge.
- כדי לזרז את בדיקת ה- DNA להוסיף 5 μL של DNA זרע הרינג (10 מ"ג / מ"ל), 10 μL של נתרן אצטט ו 2.25 נפח של 100% אתנול לתמיסת ה- DNA. מערבבים בעדינות את התמיסה ודגרים בטמפרטורה של -80°C למשך שעה אחת לפחות. צנטריפוגה ב 13,700 x גרם במשך 15 דקות ב 4 ° C.
- השליכו את הסופרנאטנט ושטפו את הגלולה עם 200 מיקרוליטר אתנול 70% קר כקרח למשך 15 דקות ב-4°C. מוציאים את הסופרנאטנט ומייבשים באוויר. לאחר הייבוש, יש להשהות מחדש את הגלולה ב-20 מיקרוליטר מים שטופלו ב-DEPC בטמפרטורת החדר למשך מספר שעות או למשך הלילה בטמפרטורה של 4°C (4°C). הגשושית מוכנה כעת לשימוש או עשויה להיות מאוחסנת ב -20 מעלות צלזיוס.
- עבור כל שקופית, יש לערבב 5 μL DNA בדיקה עם 5 μL Cot-1 DNA ולייבש באמצעות רכז ואקום Speed Vac. לאחר שהגלולה התייבשה, יש להשהות מחדש ב-12 מיקרוליטר של תערובת הכלאה.
3. הכנת הילת DNA
- מוציאים את צלחת התרבית המרובעת המכילה את המגלשות והתאים המחוברים מהאינקובטור. יש להשליך מדיום, לתייג שקופיות בעזרת עיפרון ולהניח בצנצנת קופלין המכילה 50 מ"ל של שלד ציטוקלטון קר כקרח (CSK): 100 mM NaCl, 3 mM MgCl2, 0.3 M סוכרוז, 10 mM 1, 4-piperazinediethanesulfonic חומצה (PIPES; pH 7.8), 0.5% (v/v) Triton X-100 מורכב במים deionized. יש לדגור במשך 15 דקות על קרח או בטמפרטורה של 4 מעלות צלזיוס.
אזהרה: Triton X-100 עלול לגרום לגירוי בעור ולנזק חמור לעיניים. יש לטפל באמצעות ציוד מגן אישי מתאים כולל כפפות ניטריל, משקפי מגן ומעיל מעבדה. - יש להשליך את מאגר CSK ולשטוף במהירות שקופיות ב-50 מ"ל של מאגר הילת DNA 1x (DHB; 140 mM NaCl, 27 mM KCl, 110 mM NaHPO 4, 15 mM KH2PO 4; pH7.4) שלוש פעמים, כלומר, לטבול את החלק בצנצנת Coplin המכילה DHB ולהסיר.
- העברת שקופיות לצנצנת Coplin המכילה 50 מ"ל של מאגר מיצוי: 2 M NaCl, 10 mM PIPES (pH 6.8), 10 mM ethylenediaminetetraacetic acid (EDTA), 0.1% (w/v) digitonin, 0.05 mM (v/v) זרע, 0.125 mM (v/v) זרע. דוגרים במשך 4 דקות בטמפרטורת החדר.
אזהרה: דיגיטונין רעיל בבליעה או במגע עם העור והוא קטלני אם נשאף. יש לוודא שהדיגיטונין מטופל בארון אדים מסוג LEV וללבוש מעיל מעבדה, כפפות ניטריל (כפפות כפולות), משקפי בטיחות ומסכה. גם זרע וגם זרע עלולים לגרום לכוויות עור חמורות ולנזק לעיניים, בעוד EDTA גורם לגירוי חמור בעיניים, לכן יש לטפל בכל כימיקל בזהירות.
הערה: הכינו דיגיטונין בנפרד על ידי המסת האבקה במים בטמפרטורה של 60-70°C. הוסף דיגיטונין מומס למאגר החילוץ לאחר הקירור. הוסף זרע, זרע ודיגיטונין אחרון למאגר המיצוי כדי לשמר את הפעילות הביולוגית. - דגירה רצופה של שקופיות ב-50 מ"ל של 10x DHB (1.4 מ' NaCl, 270 מ"מ KCl, 1.1 מ' NaHPO 4, 150 מ"מ KH2PO4; PH7.4), 5x, 2x ו-1x DHB למשך דקה אחת כל אחד.
- טבילה מחליקה (ישר פנימה וישרה) דרך סדרת אתנול רציף של 50 מ"ל של אתנול 10%, 30%, 70% ו-95% (v/v).
- יש לייבש את המגלשות באוויר ולאחסן בטמפרטורה של -80°C עד לביצוע הכלאה דו-ממדית של פלואורסצנטיות באתרה (2D FISH).
4. הכלאה פלואורסצנטית דו-ממדית באתרה
- הכינו 20x SSC: 3 M NaCl, 0.3 M tri-sodium citrate, pH 7.0. חיץ זה יכול להיות autoclaved, מאוחסן בטמפרטורת החדר, ומדולל לפי הצורך.
- הכינו 70% (v/v) פורממיד, 2x SSC pH 7.0 וחממו ל-70°C באמבט מים.
- דגירה על שקופיות, במשך 5 דקות כל אחת, דרך סדרה רציפה של אתנול 50 מ"ל של 70, 90 ו-100% אתנול.
- מייבשים באוויר מגלשות על צלחת חימום ואופים בתנור של 70 מעלות במשך 5 דקות.
- ניתן להחליק על ידי הכנסת תמיסת 70% פורממיד, 2x SSC למשך 2 דקות ב-70°C.
הערה: הטמפרטורה והתזמון קריטיים לשלב 4.5. אם הטמפרטורה היא הדנ"א לא יתפרק והגשושיות לא יעברו הכלאה, ולא יתקבל אות מהילה של DNA FISH. - הניחו את המגלשה המפורקת ב-50 מ"ל אתנול 70% קר כקרח למשך 5 דקות ועברו דרך סדרת אתנול של 90%, 95% ו-100% בטמפרטורת החדר למשך 5 דקות כל אחת.
- ייבוש באוויר על צלחת חימום
- טפל ישירות בבדיקות כרומוזום אנושיות כוללות המסומנות ישירות בהתאם להוראות היצרן. עבור ניסויים אלה השתמשנו בצבעי כרומוזום שלמים אנושיים 1, 13, 15, 17 ו-18. בנוסף, בניסוי זה נעשה שימוש בבדיקות גנים CCND1 ו- CTNNA1 .
הערה: הן בדיקות הכרומוזומים השלמות והן בדיקות ספציפיות לגן BAC סומנו בביוטין-11-dUTP וזוהו על ידי סטרפטאבידין מצומד לציאנין 3 (Cy3). עבור בדיקות צביעת הכרומוזומים שנעשו על ידי (DOP-PCR) ו- BAC DNA המסומנות על ידי תרגום ניק, אלה יכונו בדיקות DNA מנקודה זו ואילך בפרוטוקול ויטופלו כדלקמן. - בדיקת DNA Denature (צבע כרומוזום שלם או בדיקה ספציפית לגן) ב 75 ° C במשך 10 דקות בלוק חם או אמבט מים.
- יש לחמם את בדיקות הדנ"א בטמפרטורה של 37°C למשך 30 דקות בבלוק חם או באמבט מים לפני שפיץ 10 μL על המגלשה המתאימה.
הערה: שלב זה חשוב כדי לחסום רצפים כרומוזומליים חוזרים. אם לא מבוצעים, אותות לא ספציפיים עשויים להיווצר ב- DNA, Halo FISH. - כיסוי בדיקה עם כיסוי 21 מ"מ x 21 מ"מ להחליק ולאטום באמצעות מלט גומי.
- דגירה על שקופיות למשך 18 שעות לפחות בטמפרטורה של 37°C בתא הכלאה לח.
הערה: תאי הכלאה לחים יכולים להיות עשויים מקופסאות סנדוויץ' המכילות מספר שכבות של רקמה לחה ומפלטפורמה מוגבהת הבנויה מפיפטות פלסטיק חתוכות של 10 מ"ל כדי להניח עליהן את המגלשות. זה מכוסה ברדיד אלומיניום כדי למזער את החשיפה לאור. - מוציאים את מלט הגומי בזהירות בעזרת מלקחיים.
- דגירה על שקופיות בתמיסת פורממיד 50% 50% (v/v), 2x SSC, pH 7.0 שחוממה מראש ל-45°C למשך שלוש דגירות של 5 דקות.
הערה: אפשר לתלוש הכיסוי ליפול מהשקופית בדגירה הראשונה בתמיסת 50% (v/v) פורממיד, 2x SSC, pH 7.0. זה מונע נזק להכנת הילת הדנ"א שיכול להיגרם על ידי "גרירת" הכיסוי משם. ניתן לסעיר את המגלשות בחיץ באמצעות אחיזה באמצעות מלקחיים כדי לסייע בניתוק הכיסוי. - לאחר מכן, מקם שקופיות ב 50 מ"ל של 0.1x SSC, pH 7.0 פתרון שחומם מראש ל 60 ° C אבל ממוקם באמבט מים 45 ° C. דוגרים במשך 5 דקות ומחליפים את החיץ פעמיים נוספות בדגירות של 5 דקות.
- מניחים את המגלשות בצנצנת קופלין המכילה 50 מ"ל של 4x SSC, תמיסת pH 7.0 בטמפרטורת החדר ודגרים במשך 15 דקות עם שלושה שינויים של חיץ.
- החל 100 μL של 4% BSA, 4x SSC פתרון על כל שקופית וכיסוי עם חתיכת סרט פרפין. יש לדגור בטמפרטורת החדר למשך 10 דקות. זה מונע קשירה לא ספציפית של הנוגדן.
- כדי לזהות את הבדיקה המסומנת (ביוטין-16-dUTP), יש לדגור עם 100 μL של סטרפטווידין-Cy3 בקנ"מ 1:200 (מיוצר ב-1% BSA, 4x SSC) למשך שעה אחת בטמפרטורת החדר.
הערה: עקוב אחר הוראות היצרן עם דילול נוגדנים ודילול הבדיקה לפני הניסוי כדי להבטיח הפקת אות טוב - מניחים את המגלשות בצנצנת קופלין המכילה 50 מ"ל של תמיסת 4x SSC (0.5% Tween-20) pH 7.0 בטמפרטורת החדר ודגרים במשך 15 דקות עם שלושה החלפות חיץ. ניתן להתקין שקופיות בשלב זה כפי שמוצג בשלב 4.21 אם אין צורך באימונופלואורסנציה.
- אם נדרש מצב התרבות של תאים שהפכו להילות DNA, יש להכתים בנוגדנים נגד pKi67 לאחר שלבי FISH, לפני הרכבה או כתם עבור BrdU משולב.
- לשטוף שקופיות 3 פעמים במשך 5 דקות כל אחד ב 50 מ"ל של 1x פוספט buffered מלוחים (PBS), ואחריו חסימה עם 4% NCS ב PBS במשך 1 שעה בטמפרטורת החדר.
- החל 200 μL של הנוגדן הראשוני הדרוש (ארנב אנטי אנושי pKi67; עכבר נגד BrdU) על השקופית, כיסוי עם רצועה של סרט פרפין לדגור בטמפרטורת החדר במשך 1 שעות.
- יש לשטוף את המגלשות 3 פעמים במשך 5 דקות ב-1x PBS ולדגור בטמפרטורת החדר למשך שעה אחת ב-200 מיקרוליטר של נוגדן משני מצומד פלואורוכרום (pKi67: חזיר נגד ארנב TRITC; BrdU: חמור נגד עכבר Cy3). בצע 3 שטיפות נוספות של 5 דקות עם PBS. כל הדילולים יבוצעו באמצעות 1% (v/v) NCS ב- PBS בטווח הדילולים המוצעים של היצרנים.
- הרכבה מחליקה ב 20 μL של mountant המכיל DAPI וכיסוי עם כיסוי 22 מ"מ x 50 מ"מ.
5. דגי Telomere PNA
- כדי לזהות טלומרים, השתמש בערכת PNA FISH של הטלומרים - FITC; בצע את ההליך עם הוראות היצרן. יש לבצע את ההליך בטמפרטורת החדר, אלא אם צוין אחרת.
- יש לטבול את המגלשות במי מלח חוצצים בתריס (TBS, pH 7.5) למשך 2 דקות ולאחר מכן להכניס 3.7% פורמלדהיד (ב-TBS; v/v) למשך 2 דקות בדיוק.
זהירות: תמיסת TBS מכילה 10-30% טרומטמול ו-10-30% 2-אמינו-2-(הידרוקסימתיל) פרופאן-1,3-דיול הידרוכלוריד. הדבר עלול לגרום לגירוי חמור בעיניים ובעור, לכן יש ללבוש כפפות מגן ומשקפי מגן / הגנה על הפנים. יש להשתמש באזור מאוורר היטב. - שטפו שקופיות בצנצנת קופלין פעמיים עם TBS במשך 5 דקות כל אחת.
- יש לטבול את המגלשות בתמיסה טרום-טיפולית למשך 10 דקות ולאחר מכן לשטוף פעמיים עם כפות למשך 5 דקות לכל כביסה.
- לאחר מכן, קח את השקופיות דרך סדרת אתנול קר כקרח הכולל 50 מ"ל של 70%, 85% ו 95% (v/v) אתנול במשך 2 דקות לכל ריכוז. לאחר מכן הניחו למגלשות להתייבש באוויר.
- יש למרוח 10 μL של Telomere PNA Probe/FITC (או Cy3) בהתאם לבחירת צבע התג הפלואורסצנטי, על כל שקופית וכיסוי כיסוי עם כיסוי כיסוי. יש לדגור בתנור שחומם מראש, להגדיר על 80 מעלות צלזיוס במשך 5 דקות ולאחר מכן מניחים בחושך במשך כשעה.
אזהרה: Telomere PNA Probe/FITC מכיל 6-100% פורממיד, הגורם לגירוי חמור בעיניים והוא טרטוגני ולכן עלול לגרום נזק חמור לילד שטרם נולד. אם אישה בהריון או חושדת שהיא בהריון עליהם להימנע מעבודה עם פורממיד. יש להשתמש בפורמיד במכסה אדים LEV וללבוש הגנה מתאימה לעיניים או לפנים. - כדי להסיר את הכיסויים, יש לטבול את השקופיות ב'תמיסת שטיפה' למשך דקה אחת ולאחר מכן להכניס ל'תמיסת כביסה' למשך 5 דקות בטמפרטורה של 65°C.
זהירות: תמיסת שטיפה מכילה 1-5% פוליאוקסאתילן אוקטיל פניל אתר ו-1-5% נתרן כלורי. זהו חומר מאכל ועלול לגרום לנזק חמור לעיניים. יש להרכיב משקפי מגן או הגנה על הפנים בעת הטיפול בתמיסת הכביסה. - הדגירה מחליקה דרך 50 מ"ל של סדרת אתנול קר כקרח (70%, 85% ו-95% (v/v)) למשך 2 דקות לכל ריכוז ולאחר מכן מייבשת באוויר. לאחר ההרכבה היבשה, החלק עם תושבת המכילה DAPI וכיסוי עם כיסוי.
6. לכידת תמונה וניתוח
- כדי להמחיש הילות DNA וטריטוריות כרומוזומים, השתמש במיקרוסקופ אפיפלואורסצנטי (לדוגמה, מיקרוסקופ Leica DM4000) לכידת תמונות באמצעות מטרת שמן HC PL FLUOTAR 100X/1.30 ומצלמת DFC365FX.
- לכדו תמונות בקנה מידה אפור והגדירו צבע לכל ערוץ שצולם כדי לאפשר פסאודו-צביעה של תמונות. בניסוי זה נעשה שימוש בתוכנה מסחרית (לדוגמה, תוכנת LAS AF גרסה 4.5.0). ערוצי הצבע הבודדים יוצאו כערוצי TIFF.
- נתח תמונות באמצעות תוכנית עיבוד התמונה Java Fiji ImageJ. העלה תמונה על ידי לחיצה על קובץ ופתח.
- טען ערוצי תמונה נפרדים או פצל תמונה ללא הפרדות צבע לערוצים נפרדים בגווני אפור על-ידי לחיצה על תמונה | צבע | ערוצים מפוצלים. בחר ערוץ תמונה ולחץ על תמונה | כוונן ולאחר מכן בחר בהירות וניגודיות. שנו בהתאם וחזרו על הפעולה עם ערוצים אחרים.
- צור מסיכה של הגרעין השיורי על-ידי בחירת התעלה המוכתמת ב- DAPI המתארת את הגרעין. לחץ על תמונה | התאם ולאחר מכן בחר סף. תופיע תיבת דו-שיח שבה ניתן לשנות סף, סמן את התיבה רקע כהה . שנה עד שהגרעין השיורי יהיה ברור ולחץ על החל וסגור את תיבת הדו-שיח.
הערה: פעולה זו יוצרת מסיכה בינארית המבוססת על עוצמת הפיקסלים, כאשר פיקסלים לבנים מציגים אזורי עניין ופיקסלים שחורים מציגים רקע. חזור על אותו הליך בערוץ הבדיקה. - השתמש בבחירה החופשית כדי לשרטט את הפריפריה של הגרעין השיורי ולאחר מכן לחץ על ערוך ונקה בחוץ. שכבו את תעלת הגשושית על הגרעין השיורי. ניתן לעשות זאת על ידי לחיצה על תמונה| צבע | מיזוג ערוצים.
- לקביעת קנה המידה ב- ImageJ, ציירו קו בסרגל קנה המידה או בין נקודות של שני מרחקים ידועים. עבור אל נתח ולחץ על הגדר קנה מידה. בתיבת הדו-שיח, הוסף את אורך המרחק ולחץ על אישור. כדי למדוד מרחקים, צייר קו בין הנקודות הנמדדות ולחץ על נתח | למדוד. פעולה זו תעביר את ערכי המרחק לחלון נתונים.
- מדוד את עוצמת DAPI הבהירה ביותר מכיוון שהיא חופפת למרכז הגרעין. ממדידה זו המרחק ממרכז הגרעין לקצה שטח הכרומוזומים הרחוק ביותר (CTE). למדוד את המרחק של המרכז הגרעיני לקצה הגרעיני (NE).
- ודא שהתוצאות מוצגות כיחס CTE/NE. כאן המרחק מהמרכז הגרעיני לכל קצה טריטוריית הכרומוזומים הרחוקה ביותר (CTE) מחולק במרחק מהמרכז הגרעיני לכל קצה גרעיני בהתאמה (NE). זה צריך להתבצע על מינימום של 50 גרעינים. זה עשוי להיות מתואר כתרשים עמודות או תיבה.
- לניתוח הטלומרים, נתח לפחות 30 גרעינים לכל מערך נתונים. ניתן לנתח תמונות באמצעות Fiji ImageJ או באופן ידני כדי לספור את מספר הטלומרים בתוך הגרעין השיורי ובתוך הילת הדנ"א. BrdU או pKi67 אפשרו הבחנה בין גרעינים מתרבים (BrdU/piK67+) וגרעינים מזדקנים/שקטים (BrdU/pKi67-). הנתונים עשויים להיות מתוארים בתרשימי עמודות עם קווי שגיאה המתאימים לשגיאת תקן של הממוצע (SEM).
- השתמש במבחן t של תלמיד (לא מזווג) כדי להשוות סטטיסטית את התוצאות עם p> 0.05 נחשב מובהק.
תוצאות
שיטה זו של הכנת הילת דנ"א סייעה לנו במאמצינו לקבוע הבדלים בהתנהגות הגנום בתאים צעירים ומבוגרים, אך גם בתאים שמקורם במחלות הזדקנות מוקדמת עם חלבוני גרעין ושלד חריגים15. איור 1 מציג דוגמאות של הילות דנ"א שבהן אפשר לראות את הקצה של גרעין שיורי, את הדנ"א שנשאר בתוך הגרעין השיורי ואת הדנ"א הלא מחובר שזרם החוצה לאזור שמסביב ויצר הילת דנ"א. הוא גם מתאר את הניתוח המראה כיצד הגרעין השיורי מתקבל ואת מדידות NE ו- CTE. ניתן להבדיל בין תאים מתרבים לתאים שאינם מתרבים על ידי שילוב נוקלאוטיד מסומן כגון BrdU כאשר התאים נמצאים בשלב S או שימוש בסמן ההתרבות האבחנתי anti-pKi67, החושף גרעינים, ואזורים של הטרוכרומטין בתאי G117,18. תאים ראשוניים הגדלים בסרום גבוה ללא השגת מפגש, שהם שליליים לסמני ההתפשטות, מניחים שהם מזדקנים. תאים ראשוניים שגדלו בסרום נמוך או הפכו לקבועים, כלומר מעוכבי מגע שהם שליליים לסמני ההתפשטות, נחשבים שקטים ויוכלו להיכנס מחדש למחזור התא המתפשט בהינתן החומרים המזינים והמצב הנכון. היכולת להבדיל בין תאים חיוביים ושליליים של Ki67 אפשרה לנו לקבוע הבדלים בין פיברובלסטים עוריים אנושיים מתרבים, שקטים ומזדקנים. איור 2 מציג הילות דנ"א של פיברובלסטים עוריים אנושיים מתרבים שנוצרו מתאים שבהם BrdU שולב בהם במהלך שכפול דנ"א, מנגנון שאינו מתרחש בתאים שאינם מתרבים, ולאחר מכן מוכתם בנוגדן נגד BrdU. כתמים עם הסמן המתפשט נוגדן anti-pKi67 נראים גם באיור 2. זהו אנטיגן חזק ושורד את פרוטוקול FISH ולכן ניתן להכתים אותו לאחר FISH והרכבה מראש. לפיכך, תאים מתרבים הם חיוביים (באדום) עבור BrdU ואנטי-pKi67 (אדום) בעמודה השמאלית ותאים שאינם מתרבים, ואכן תאים מזדקנים באיור 2 מוצגים בעמודה הימנית. האותות הירוקים הם טלומרים בודדים המתגלים באמצעות ערכת PNA FISH/FITC של טלומרים. שילוב של אימונופלואורסנציה עם הילות דנ"א מאפשר ניתוח במהלך מצבי תאים שונים, כפי שניתן לראות באיור 2 בעת חקירת תאים מתרבים, שקטים ומזדקנים. בהתאם לנוגדן שנבחר ניתן לבדוק מצבים נוספים, כגון התמיינות, נזק לדנ"א באמצעות הקרנה וכו'.
ניתן גם לדמיין טריטוריות כרומוזומים בתוך הילות DNA באמצעות FISH. בשל ההכנה המאפשרת את הוצאת הדנ"א אל מחוץ לגרעינים, צורת טריטוריית הכרומוזומים עלולה להיות מופרעת, כאשר כמויות קטנות או גדולות יותר של הכרומוזום נמצאות בהילת הדנ"א, בהתאם לעיגון הגנום בתוך הגרעין השיורי והמבנים שלו. איור 3 חושף פאנל של הילות דנ"א שבו כרומוזומים בודדים התגלו עם גשושיות ספציפיות לצביעת כרומוזומי זרוע שלמה (באדום) עבור כרומוזומים 1, 13, 17 ו-18. Anti-pKi67 (ירוק) שימש לסימון תאים מתרבים והיעדרם באותה תרבית, על אותה שקופית, המציינת תאים מזדקנים. ברור מאוד מהתמונות ומהנתונים המוצגים כ-CTE/NE שכרומוזום 18 הקטן והעני בגן הוא כרומוזום שיש לו מעט חיבורים והוא גולש רחוק יותר אל תוך הילת הדנ"א הרחק מהגרעינים השיוריים, והוא רחוק משמעותית ממרכז הגרעינים השיוריים מאשר הכרומוזומים האחרים. עם זאת, זה נכון גם לגבי כרומוזום 1. באמצעות סמן ההתרבות anti-pKi67 ניתן גם להשוות את ההתרבות עם תאים מזדקנים, באותה תרבית, ובאותה שקופית, וניתוח זה גילה כי הכרומוזומים בתוך שני מצבי תאים שונים מאוד אלה אינם שונים באופן משמעותי זה מזה, ביחס להיצמדות למבנים הגרעיניים השיוריים.
באופן מעניין, גנים גם מראים הבדלים מובהקים סטטיסטית בין תאים מתרבים ומזדקנים ביחס להישארות בתוך גרעין שיורי או הימצאות בהילת הדנ"א. איור 4 מדגים זאת באמצעות מיקומי גנים המסומנים על-ידי גשושיות BAC המסומנות באדום ואנטי-Ki67 בירוק. אין הבדלים משמעותיים בין מיקומי הגנים בתאים המתרבים לעומת התאים המזדקנים, לאחר הכנת הילת DNA. עם זאת, יש הרבה יותר אתרי קטנין אלפא 1 CTNNA1 בתוך הילת הדנ"א מאשר ציקלין D1 CNDD1 loci, שם יש מעט מאוד. איור 5 מציג תכשירי הילת דנ"א עם טלומרים בירוק. הרקע נשאר גבוה בכוונה כדי לאפשר לאותות הטלומרים להיות חזותיים בתוך הילת הדנ"א. בקבוצה זו של תאים שקטים של נתונים, כלומר תאים שהורעבו בסרום במשך 7 ימים, נכללו ובאופן מעניין יש הרבה יותר טלומרים שאינם מחוברים וממוקמים בתוך הילות הדנ"א בתאים שקטים מאשר בתאים מתרבים ומזדקנים. באיור 5a ניתן לראות את שיעור הטלומרים בהילת הדנ"א, במיוחד עבור התמונה 'ניסוי 2'. זה תואם לאיור 5b , שבו אחוז הטלומרים הממוצע בהילת דנ"א הוא בערך 17% בתאים שקטים. יש כמה ראיות לכך שלא ניתן לראות את כל הטלומרים בתאים מזדקנים כחלקם, אולי קצרים מאוד.
שיטה זו של הילת דנ"א הצליחה עבורנו לחקור שינויים באינטראקציה גנומית בתוך גרעינים בתאים חולים15. איור 6 מדגים הבדלים בהתקשרות כרומוזומים בפיברובלסטים של בקרה ראשונית ובתאים חולים עם מוטציה טיפוסית (מוטציית למין A) ולא טיפוסית של האצ'ינסון-גילפורד פרוג'ריה, המבטאים איזופורם SUN1 שונה וללא מוטציה של למין A19. כרומוזומים 1 ו-13 מראים הבדלים מובהקים סטטיסטית בהתקשרותם בתוך הגרעינים השיוריים בהשוואה להילי דנ"א ביקורתיים. איור 6b מתאם את המיקום של כל שטח הכרומוזומים לגרעין השיורי ולהילה של הדנ"א. ערכים של 1 או פחות מצביעים על כך שהכרומוזום ממוקם בתוך הגרעין השיורי וערכים מעל 1 מדגימים כרומוזומים או חלקים של כרומוזומים בתוך הילת הדנ"א.
בסך הכל, זה מדגיש את התועלת של HALO-FISH בחקירת אינטראקציות גנומיות של כרומוזומים שלמים, גנים ספציפיים וטלומרים במגוון תנאים המשפיעים על מחזור התא (התפשטות, שקט והזדקנות) או בתוך תאי מחלה כגון פרוגריה ושורות תאים סרטניים. ואכן, ההבדלים באינטראקציות בין מצבים אלה מרמזים שלשלד יש תפקיד חשוב בוויסות תהליכי מפתח בגרעין.

איור 1: גרעין מחולץ HDF המציג את הגרעין השיורי ואת הילת הדנ"א וסקירה כללית של שיטת הניתוח. (א) גרעין HDF שהוכן באמצעות בדיקת הילה של DNA ומוכתם ב-DAPI. הגרעין השיורי המוכתם בבהירות מראה דנ"א המעוגן לגרעין השלד וזה מוקף בדנ"א שאינו מחובר אשר יוצר הילה של דנ"א. הגדלה = x 100; סרגל קנה מידה 10 מיקרומטר. (b) התעלה הכחולה לוכדת את הגרעין המוכתם ב-DAPI ואת הדנ"א שמסביב. הגרעין השיורי נבחר ומוסר באמצעות ImageJ. החץ מתאר את המרחק מהמרכז הגרעיני לקצה הגרעיני השיורי (NE). (ג) הערוץ האדום מראה את אות הגשוש. (ד) התמונה המסומנת 'תוצאה' היא תוצאה של הצבת הערוץ האדום על תמונת הערוץ הכחול; זה מאפשר את המרחק מהמרכז הגרעיני לקצה שטח הכרומוזומים הרחוק ביותר (CTE). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
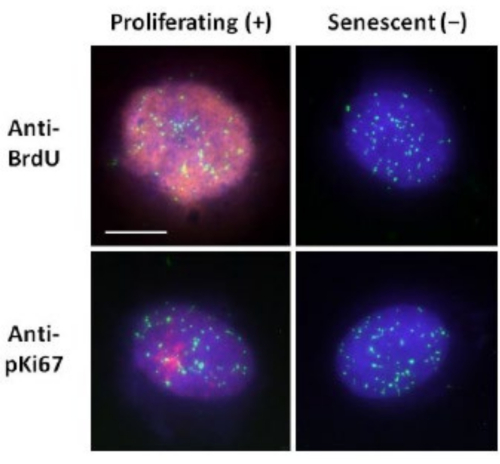
איור 2: הכנת הילת דנ"א עם דגי PNA של טלומרים על HDF מתרבים ומזדקנים. Telomere PNA FISH על HDFs הנתונים לבדיקת הילת DNA. אותות הטלומרים מוצגים בירוק (FITC), שאריות דנ"א והילה הוכתמו באמצעות DAPI (כחול) וגרעינים מתרבים זוהו באמצעות נוגדנים נגד BrdU או נגד pKi67 באמצעות אימונופלואורסנציה עקיפה באדום (TRITC). הגדלה = x 100; סרגל קנה מידה 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
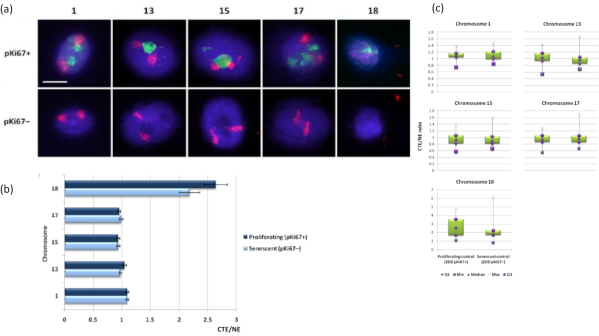
איור 3: אינטראקציות וניתוח של נוקלאושלד-כרומוזום באמצעות בדיקת הילה של דנ"א. (א) 2D-FISH עם בדיקות ספציפיות לכרומוזומים 1, 13, 15, 17 ו-18 בוצע על HDFs הנתונים להכנת הילת DNA. כרומוזומים שלמים נצבעו באדום (Cy3) וגרעינים נבדקו עם pKi67 כדי לקבוע אם הם מתרבים או מזדקנים. תאים מתרבים (pKi67+) סומנו בירוק (FITC), ואילו תאים מזדקנים נותרו ללא כתמים (pKi67-), כלומר לא זוהה אות ירוק. הגדלה = x 100; סרגל קנה מידה 10 מיקרומטר. (ב) עיגון כרומוזומים על ידי השלד הנוקלאוסקלטוני ב-HDF מתרבים ומזדקנים שעברו HALO-FISH. מדידות מראות את היחס בין קצה טריטוריית הכרומוזומים הרחוק ביותר (CTE) לקצה הגרעיני המתאים (NE) עבור כרומוזומים 1, 13, 15, 17 ו-18 בתאים מתרבים (pKi67+) ובתאים מזדקנים (pKi67-). קווי שגיאה מייצגים ± SEM. (ג) ייצוג תרשים תיבה שונה של קצה טריטוריית הכרומוזומים (CTE) לקצה הגרעיני המתאים (NE) של כרומוזומים ספציפיים בגרעיני pKi67+ ו-pKi67. Q1 = רביעון תחתון; מינימום = הערך הנמוך ביותר שנרשם; Med = חציון; מקסימום = הערך המרבי שנרשם; Q3 = רביעון עליון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
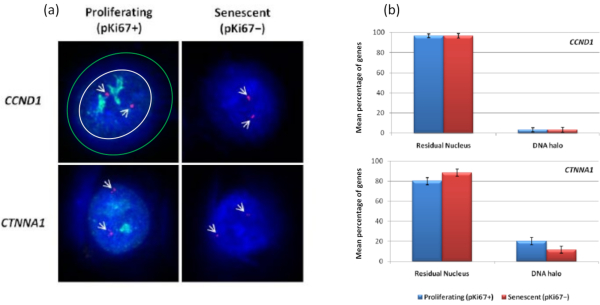
איור 4: אינטראקציות ספציפיות לגן ב-HDF באמצעות HALO-FISH. (א) גרעיני הילה של דנ"א שחולצו נבדקו באמצעות בדיקות ספציפיות לגנים (CCND1 ו-CTNNA1) כדי לחקור את העיגון שלהם ל-NM על תאים מתרבים ומזדקנים. אותות הגן מוצגים באדום (Cy3) ואנטי-pKi67 מתאר תאים מתרבים והאות מוצג בירוק (FITC). עבור תמונת CCND1 המתפשטת, הגרעין השיורי סגור בתוך העיגול הלבן, והרווח בין העיגול הלבן והעיגול הירוק מתאר את הילת הדנ"א. הגדלה = x 100; סרגל קנה מידה 10 מיקרומטר. (ב) אותות ספציפיים לגנים עבור CCND1 ו-CTNNA1 מושווים בין הגרעין השיורי להילת הדנ"א, וגם, בין תאים מתרבים ומזדקנים. קווי שגיאה מייצגים ± SEM. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
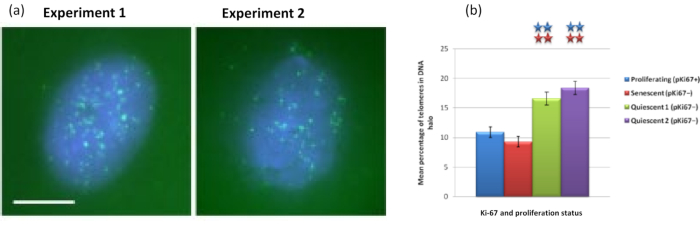
איור 5: בדיקת הילת דנ"א על HDFs שקטים שנבדקו עם דגי PNA-SPOT של טלומרים. (א) שקט של HDFs נגרם על ידי תרבית בתווך סרום נמוך במשך 7 ימים. בדיקת הילת הדנ"א בוצעה, ו- PNA-FISH איפשר הדמיה של טלומרים על ידי אות FITC (ירוק) והגרעין השיורי והילה הדנ"א שמסביב הוכתמו ב- DAPI (כחול). התאים הוכתמו גם בנוגדן נגד pKi67 כדי להבטיח שהגרעינים לא יתרבו. זה חזר על עצמו בשתי הזדמנויות שונות. הגדלה = x 100; סרגל קנה מידה 10 מיקרומטר. (b) השוואה של האחוז הממוצע של טלומרים הממוקמים בתוך הילת הדנ"א בתאי HDF מתרבים, מזדקנים ושקטים. קווי שגיאה מייצגים ± SEM. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
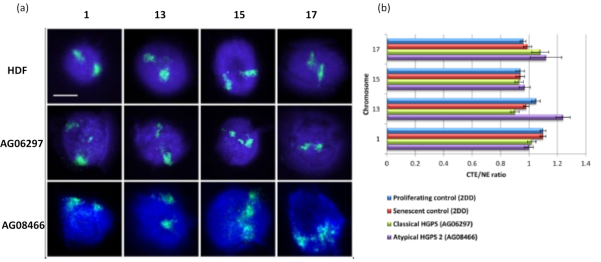
איור 6: בחינת עיגון כרומוזום שלם לשלד הגרעין בתאי HGPS באמצעות HALO-FISH26. (א) גרעיני בקרה HDF (2DD), HGPS קלאסי (AG06297) ו-HGPS לא טיפוסי מסוג 2 (AG08466) עברו הכנה להילת DNA ולאחר מכן 2D-FISH באמצעות צבעי כרומוזום שלמים עבור כרומוזום 1, 13, 15 ו-17. כרומוזומים שלמים מתוארים בירוק (FITC) והדנ"א הוכתם ב-DAPI (כחול). הגדלה = x 100; סרגל קנה מידה 10 מיקרומטר. (ב) מיקום הכרומוזומים בתוך גרעינים שחולצו נקבע על ידי מדידת היחס בין קצה שטח הכרומוזומים הממוצע (CTE) לקצה הגרעיני (NE). יחס מעל 1 מדגים שה-CTE הרחוק ביותר נמצא מחוץ ל-NE המתאים בתוך הילת הדנ"א, בעוד שיחס מתחת ל-1 מסמל שה-CTE הרחוק ביותר נמצא בתוך ה-NE בתוך הגרעין השיורי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| - הרכבים | נפח(μL) |
| 5XDOP-PCRbuffer | 10 |
| dNTPmix(ללא dTTP)(2mM) | 5 |
| dTTP (2mM) | 2 |
| ביוטין-16-dUTPorדיגוקסיגנין-11-dUTP | 10 |
| DOPפריימר(20μM) | 5 |
| TaqDNAPolymerase(1U/μL) | 1 |
| PCRgradewater | 12 |
| תבנית | 5 |
טבלה 1: טבלה המציגה את הרכיבים ואמצעי האחסון של DOP-PCR עבור תגובה 1x
| צעד | מחזורים | Temp (תואר Centigrade) | זמן |
| דנטורציה ראשונית | 1 | 95 | 3 דקות |
| דנטורציה | 34 | 98 | 20 שניות |
| חישול פריימר | 62 | 1 דקות | |
| סיומת | 72 | 30 שניות | |
| הארכה סופית | 1 | 72 | 5 דקות |
| קירור | 4 | אחז |
טבלה 2: טבלה המציגה את מחזור DOP-PCR, הטמפרטורה ופרופיל הזמן.
| מרכיב | נפח(μL) |
| 10x מאגר NT (0.5M Tris-HCl pH 8,50 mM MgCl2, 0.5 מ"ג/מ"ל BSA) | 5 |
| 0.1 מטר בטא-מרקפטואתנול | 5 |
| 10X מלאי נוקלאוטידים (0.5 mM dATP, 0.5 mM dCTP, 0.5 mM dGTP, 0.5 mM dTTP, 0.5 מ"ג/מ"ל ביוטין-16-dUTP) | 5 |
| Dnase I (1 נ"ג/מ"ל) | 2 |
| DNAפולימראז I | 5U למק"ג DNA |
| DNAtemplate (1 מיקרוגרם) | 1 |
| מים שטופלו ב-DEPC | עד 50 מיקרוליטר |
טבלה 3: טבלה המציגה את רכיבי התרגום ואמצעי האחסון של nick עבור בדיקה אחת.
Discussion
שיטת הילת הדנ"א היא שיטת בחירה מצוינת בעת ניתוח אינטראקציות בין השלד הגרעין והגנום, עם זאת, ישנם כמה שלבים קריטיים שיש להקפיד עליהם. אחד הפרמטרים החשובים ביותר הוא אופטימיזציה של צפיפות הזריעה התא. אם התאים הופכים למפגש יתר, הילות הדנ"א יחפפו לתאים שכנים ולא יאפשרו לבצע את הניתוח. יש תמיד להפוך את מאגרי ה- CSK והמיצוי לטריים ביום השימוש עם הוספת זרע, זרע ודיגיטונין למאגר המיצוי בסוף תהליך ההכנה כדי לשמור על פעילותם הביולוגית. אם מבצעים Halo-FISH, חשוב מאוד להשתמש בטמפרטורת הדנטורציה הנכונה של הילות הדנ"א כדי לאפשר לגשושית או לצבע לבצע הכלאה לאחר מכן.
מיקרוסקופ אלקטרונים שימש כדי לדמיין את המטריצה הגרעינית, עם מבנים נימיים מזוהים20. עם זאת, מיקרוסקופ אלקטרונים מוגבל מכיוון שלא ניתן להסיק בקלות אסוציאציות מטריצה עם כרומטין. ואכן, שיטת הילה של DNA היא מגוונת יותר בהשוואה למיקרוסקופ אלקטרונים מכיוון שניתן לבחון גנים, כרומוזומים ומצבי תאים ספציפיים. יתר על כן, אנליזה פרוטאומית של חלבוני מטריצה גרעינית נחקרת21,22. שיטה זו טובה להשוואת רכיבי מטריצה גרעינית, במיוחד כאשר משווים תאים חולים, אולם היא אינה מספקת את הפיזור המרחבי ואת ההתקשרות המודגשת על ידי טכניקת הילת הדנ"א הסטנדרטית.
למבחני DNA Halo יש מגבלות. ראשית, כאשר המטריצה מחולצת, זה יכול להתבצע רק על תאים קבועים ולכן הדמיה חיה אינה אפשרית. למרות ששיטת Halo של הדנ"א מהירה יחסית וקלה לביצוע, התהליך הכולל עשוי לקחת בחשבון זמן רב כאשר נלקחים בחשבון תרבית תאים, יצירת גשושיות, Halo-FISH וניתוח.
לכידת תמונות של הילות DNA ו- HALO-FISH באמצעות מיקרוסקופיה ברזולוציית על תשפר מאוד את הרזולוציה של בדיקות ונוגדנים ספציפיים ל- DNA. בנוסף, מכיוון שניתן לפתור באופן ספקטרלי פלואורוכרומים בקלות רבה יותר, ייתכן שניתן יהיה להשתמש במספר בדיקות דנ"א בניסוי יחיד, ולספק מידע רב עוד יותר. שיפורים בטכניקות ביולוגיה מולקולרית כגון לכידת קונפורמציה של כרומוזומים (3C) שימשו כדי לקבוע אינטראקציות של אתרי גנים ולנתח את הארגון המרחבי על הכרומטין בתא. ניתן לשלב מבחני DNA Halo ו-3C, מונח המכונה M3C23, המדגים שוב את יכולת ההסתגלות של טכניקת ה-DNA Halo.
הנתונים המקוריים המוצגים כאן נועדו להדגים את האפשרויות לחקירת התנהגות גנומית וכיצד להציג נתונים אלה. בעזרת נתונים אלה הוכחנו כי ניתן לקבוע הבדלים משמעותיים בהתקשרות הגנום באמצעות (1) בדיקות צביעת כרומוזומים, במחקר זה התגלה כי כרומוזום 18 הוא הכרומוזום הכי פחות מחובר מבין אלה שנותחו (איור 3); (2) אתרי גנים עם הבדלים משמעותיים בין שני אתרי גנים ו(איור 4) (3) טלומרים, שמחוברים פחות חזק בתאים שקטים בהשוואה לתאים מתרבים ומזדקנים (איור 5). אנו מסוגלים להבדיל בין תאים מתרבים לתאים שאינם מתרבים באמצעות נוכחות של סמן ההתפשטות Ki67 antigen, שהוא חלבון בלתי מסיס ולכן נשאר עם הגרעינים השיוריים, או באמצעות שילוב של נוקלאוטידים כדי להדגיש תאים שעברו שלב S בתוך פרק זמן מסוים (איור 2). טכניקה זו גם אפשרה לנו לנתח את התנהגות הגנום בתאים שנפגעים בגרעין השלד שלהם, כלומר תאי למינופתיה וכאן וב- Bikkul et al., 2018 אנו מגלים כי הגנום יכול להיות מחובר פחות חזק בהשוואה לתאי ביקורת וניתן לשחזר אותו כאשר מטפלים בתרופות ספציפיות המשפרות את השפעת מוטציית למין A בתאי HGPS קלאסיים15. אולם אנו מראים כאן נתונים חדשים עבור תאי HGPS AGO8466 לא טיפוסיים, חסרי מוטציית למין A אך מכילים צורה יוצאת דופן של חלבון קומפלקס LINC SUN1 19 שכרומוזום13 מחובר אליו פחות חזק (איור 6).
HALO-FISH היא שיטה ייחודית המאפשרת לחקור אינטראקציות גנומיות עם השלד הגרעיני בשילוב עם אימונופלואורסנציה עקיפה לפתרון חלבונים שלא הוסרו מהליך המיצוי. הוכח כי השלד הנוקלאוסקלטוני משתנה במחלות שונות כגון סוגי סרטן מסוימים19 וחשיבותם של כמה חלבונים הקשורים לשלד גרעיני כסמנים ביולוגיים אבחוניים24,25. לפיכך, לטכניקה זו יש תפקיד חשוב בבחינת השפעת השלד הנוקלאוסקלטוני על ארגון/חוסר ארגון הכרומטין במחלה 15,24,25,27 ואינה מוגבלת לתאים אנושיים, עם בדיקות צביעה כרומוזומליות מבעלי חיים אחרים, ניתן להשתמש באותו פרוטוקול DNA-הילה 28.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לפרופ' מיכאל ביטנר על המתנה הנדיבה של גשושיות צביעת זרועות כרומוזומים. LG נתמכה על ידי פרויקט EURO-Laminopathies במימון האיחוד האירופי וקרן המחקר Brunel Progria.
Materials
| Name | Company | Catalog Number | Comments |
| 10X PBS | Thermo Fisher Scientific | 10388739 | Used to create DNA halos |
| 5-bromo-2′-deoxy-uridine | Sigma-Aldrich | B5002-100MG | Labelled nucleotide |
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100MG | Labelled nucleotide |
| Agar Technical | Thermo Fisher Scientific | 15562141 | DNA isolation of BAC clones |
| Agarose | Sigma-Aldrich | A939-50G | Check product size of DOP-PCR and nick translation |
| Atypical type 2 HGPS fibroblasts (AG08466) | Coriell Institute | AG08466 | Cell line |
| Bacto tryptone | Thermo Fisher Scientific | 16269751 | DNA isolation of BAC clones |
| Biotin-16-dUTP | Roche Diagnostics | 11093711103 | Labelled nucleotides |
| Chloramphenicol | Sigma-Aldrich | C0378-25G | DNA isolation of BAC clones |
| Classical Hutchinson-Gilford progeria syndrome (HGPS) fibroblasts (AG06297) | Coriell Institute | AG0297 | Cell line |
| Coplin jar | Thermo Fisher Scientific | 12608596 | Holds 5 slides or 8 slides back to back |
| Cot-1 DNA | Thermo Fisher Scientific | 15279011 | Block nonspecific hybridization in HALO FISH |
| DEPC-treated water | Sigma-Aldrich | 693520-1L | DNA isolation of BAC clones |
| Dextran sulphate | Sigma-Aldrich | S4030 | Hybridisation mixture |
| Digitonin | Sigma-Aldrich | D141 | Component of extraction buffer |
| Digoxigenin-11-dUTP | Sigma-Aldrich | 11093088910 | Labelled nucleotides |
| Donkey anti-mouse Cy3 | Jackson Laboratory | 715-165-150 | Secondary antibody |
| EDTA | Sigma-Aldrich | E6758 | Component of extraction buffer |
| Ethanol | Component of extraction buffer | ||
| Ethanol | Sigma-Aldrich | 443611 | Probe precipitation and HALO FISH |
| Fetal bovine system | Thermo Fisher Scientific | 26140079 | Cell culture serum |
| Formamide | Thermo Fisher Scientific | 10523525 | 2D FISH of DNA halos |
| Glass wool | Sigma-Aldrich | 18421 | Spin column |
| Herring sperm | Sigma-Aldrich | D7290 | Probe precipitation |
| HXP™ Lamp (metal halide microscope lamp) | OSRAM | HXP-R120W45C VIS | Image capture of DNA halos |
| Hydrochloric acid | Thermo Fisher Scientific | 10313680 | Cleaning microscope slides |
| Isopropanol | Sigma-Aldrich | I9516-25ML | DNA isolation of BAC clones |
| KAPA HiFi PCR Kit | KAPA Biosystems | KK2103 | PCR Kit |
| Leica DM4000 fluorescent microscope with DFC365 FX camera and LAS AF (Version: 4.5.0) image acquisition software. | Leica Microsystems | Image capture of DNA halos | |
| Luria-Bertani agar | Thermo Fisher Scientific | 13274843 | DNA isolation of BAC clones |
| Magnesium chloride | Sigma-Aldrich | M8266 | Component of CSK buffer |
| Methanol | Thermo Fisher Scientific | 10284580 | Cleaning and sterilizing microscope slides |
| Mouse anti-BrdU antibody | BD Pharmingen | B2531-100UL | BrdU visualisation |
| Newborn calf serum | Thermo Fisher Scientific | 16010159 | Cell culture serum and blocking reagent |
| Nick translation kit | Invitrogen | ||
| PCR grade water | Sigma-Aldrich | 693520-1L | PCR and DNA isolation of BAC clones |
| PCR Primers | Sigma-Aldrich | ||
| PIPES | Sigma-Aldrich | P1851 | Component of CSK and extraction buffers |
| Potassium acetate | Sigma-Aldrich | P1190-100G | DNA isolation of BAC clones |
| QuadriPERM® 4 X 12 | SARSTEDT | 94.6077.307 | Square cell culture dish, polysterene with four compartments. This has hydrophobic surface, is sterile, non-pyrogenic/endotoxin-fee and non-cytotoxic. |
| Rabbit Anti-Ki67 antibody | Sigma-Aldrich | ZRB1007-25UL | Proliferation marker |
| Rnase A | Sigma-Aldrich | R6513 | DNA isolation of BAC clones |
| Rubber cement | Halford's | 101836 | 2D FISH of DNA halos |
| Sephadex G-50 | Sigma-Aldrich | S6022-25G | Spin column |
| Sodium acetate | Sigma-Aldrich | S2889 | Probe precipitation |
| Sodium chloride | Sigma-Aldrich | S5886 | Component of CSK, extraction and SSC buffers |
| Sodium citrate | Sigma-Aldrich | C8532 | Component of SSC buffer |
| Sodium dodecyl sulphate | L3771-100G | DNA isolation of BAC clones | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | DNA isolation of BAC clones |
| Spermidine | Sigma-Aldrich | S2626 | Component of extraction buffer |
| Spermine | Sigma-Aldrich | S4264 | Component of extraction buffer |
| Streptavidin-Cy3 | Amersham Life Sciences Ltd, Scientific Laboratory Supplies | pa43001 | Probe antibody |
| Sucrose | Sigma-Aldrich | S0389 | Component of CSK buffer |
| Sucrose | Sigma-Aldrich | S0389 | CSK buffer+A66:D68 |
| SuperFrost™ microscope slides | Thermo Fisher Scientific | 12372098 | Microscope slides: 1 mm thickness, 76 mm length, 26 mm width. Uncoated. |
| Swine anti-rabbit TRITC | Dako | ||
| TELO-PNA FISH KIT | Agilent Dako | K532511-8 | Delineation of telomeres |
| Tris-HCl | Sigma-Aldrich | T3253-100G | Column buffer |
| Triton™ X-100 | Sigma-Aldrich | T9284 | Component of CSK buffer |
| Tryptone | Thermo Fisher Scientific | 10158962 | DNA isolation of BAC clones |
| Tween-20 | Sigma-Aldrich | P9416- 100ML | Detergent |
| Vectashield mountant containing DAPI | Vector Laboratories | H-1200 | 2D FISH of DNA halos |
| Whole human chromosome probes | Calbiochem | 2D FISH of DNA halos | |
| Yeast extract | Thermo Fisher Scientific | 10108202 | DNA isolation of BAC clones |
References
- Berezney, R., Coffey, D. S. Identification of a nuclear protein matrix. Biochemical Biophysical Research Communications. 60 (4), 1410-1417 (1974).
- Haaf, T., Ward, D. C. High resolution ordering of YAC contigs using extended chromatin and chromosomes. Human Molecular Genetics. 3 (4), 629-633 (1994).
- Parra, I., Windle, B. High resolution visual mapping of stretched DNA by fluorescent hybridization. Nature Genetics. 5 (1), 17-21 (1993).
- Senger, G., et al. Released chromatin: linearized DNA for high resolution fluorescence in situ hybridization. Human Molecular Genetics. 3 (8), 1275-1280 (1994).
- Florijn, R. J., et al. High-resolution DNA Fiber-FISH for genomic DNA mapping and colour bar-coding of large genes. Human Molecular Genetics. 4 (5), 831-836 (1995).
- Elcock, L. S., Bridger, J. M. Fluorescence in situ hybridization on DNA halo preparations and extended chromatin fibres. Methods Molecular Biology. 659, 21-31 (2010).
- Heiskanen, M., et al. Visual mapping by fiber-FISH. Genomics. 30 (1), 31-36 (1995).
- Bensimon, A., et al. Alignment and sensitive detection of DNA by a moving interface. Science. 265 (5181), 2096-2098 (1994).
- Michalet, X., et al. Dynamic molecular combing: stretching the whole human genome for high-resolution studies. Science. 277 (5331), 1518-1523 (1997).
- Wilson, R. H., Coverley, D. Relationship between DNA replication and the nuclear matrix. Genes Cells. 18 (1), 17-31 (2013).
- Wilson, R. H. C., Coverley, D. Transformation-induced changes in the DNA-nuclear matrix interface, revealed by high-throughput analysis of DNA halos. Science Reports. 7 (1), 6475 (2017).
- Iarovaia, O. V., Akopov, S. B., Nikolaev, L. G., Sverdlov, E. D., Razin, S. V. Induction of transcription within chromosomal DNA loops flanked by MAR elements causes an association of loop DNA with the nuclear matrix. Nucleic Acids Research. 33 (13), 4157-4163 (2005).
- Tandara, M., et al. Sperm DNA integrity testing: big halo is a good predictor of embryo quality and pregnancy after conventional IVF. Andrology. 2 (5), 678-686 (2014).
- Repping, S., et al. The use of spermHALO-FISH to determine DAZ gene copy number. Mol Human Reproduction. 9 (4), 183-188 (2003).
- Bikkul, M. U., et al. Farnesyltransferase inhibitor and rapamycin correct aberrant genome organisation and decrease DNA damage respectively, in Hutchinson-Gilford progeria syndrome fibroblasts. Biogerontology. 19 (6), 579-602 (2018).
- Telenius, H., et al. Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer. Genomics. 13 (3), 718-725 (1992).
- Bridger, J. M., et al. Association of pKi-67 with satellite DNA of the human genome in early G1 cells. Chromosome Research. 6, 13-24 (1998).
- Sales Gil, R., Vagnarelli, P. Ki-67: More Hidden behind a 'Classic Proliferation Marker'. Trends in Biochemical Sciences. 43 (10), 747-748 (2018).
- Bikkul, M. U., et al. Telomere elongation through hTERT immortalization leads to chromosome repositioning in control cells and genomic instability in Hutchinson-Gilford progeria syndrome fibroblasts, expressing a novel SUN1 isoform. Genes Chromosomes Cancer. 58 (6), 341-356 (2019).
- Jackson, D. A., Cook, P. R. Visualization of a filamentous nucleoskeleton with a 23 nm axial repeat. EMBO Journal. 7, 3667-3677 (1988).
- Albrethsen, J., et al. Unravelling the nuclear matrix proteome. Journal of Proteomics. 72, 71-81 (2009).
- Mika, S., Rost, B. NMPdb: Database of nuclear matrix proteins. Nucleic Acids Research. 33, 160-163 (2005).
- Gavrilov, A. A., et al. of the nuclear matrix-bound chromatin hubs by a new M3C experimental procedure. Nucleic Acids Research. 38, 8051-8060 (2010).
- Sjakste, N., et al. Role of the nuclear matrix proteins in malignant transformation and cancer diagnosis. Experimental Oncology. 26 (3), 170-178 (2004).
- Leman, E. S., Getzenberg, R. H. Nuclear structure as a source of cancer specific biomarkers. Journal of Cellular Biochemistry. 104 (6), 1988-1993 (2008).
- Volpi, E. V., Bridger, J. M. FISH glossary: an overview of the fluorescence in situ hybridization technique. Biotechniques. 45 (4), 385-386 (2008).
- Bridger, J. M., Foster, H. A. Senescence and the Genome. Human Interphase Chromosomes. , (2021).
- Foster, H. A., Griffin, D. K., Bridger, J. M. Interphase chromosome positioning in in vitro porcine cells and ex vivo porcine tissues. BMC Cell Biology. 13 (1), 30 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved