A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توصيف رواية الإنسان Organotypic تقنية ثقافة الشبكية
In This Article
Summary
تهدف هذه الدراسة إلى تطوير نموذج جديد لثقافة الشبكية العضوية البشرية (HORC) يمنع المساس بسلامة الشبكية أثناء المناولة العرضية. ويتحقق ذلك عن طريق زراعة شبكية العين مع الزجاجية الزائدة وظهارة الصباغ الشبكية الكامنة (RPE-choroid) والشد.
Abstract
استخدمت نماذج سابقة لثقافة الشبكية العضوية البشرية (HORC) شبكية العين المنفصلة. ومع ذلك ، من دون الدعم الهيكلي الذي يمنحه ظهارة صبغ الشبكية المشيمية (RPE -choroid) والشد ، يمكن بسهولة اختراق سلامة الشبكية الهشة. وكان الهدف من هذه الدراسة لتطوير نموذج HORC الرواية التي تحتوي على شبكية العين، RPE-المشيمية والشدة للحفاظ على سلامة الشبكية عند زراعة النباتات الشبكية.
بعد قطع محيط على طول الحويزل لإزالة القزحية والعدسة ، تم إجراء أربعة شقوق عميقة لتسطيح فنجان العين. على النقيض من بروتوكولات HORC السابقة ، تم استخدام التريفين لقطع ليس فقط من خلال شبكية العين ولكن أيضا RPE - المشيمية والشد. وقد تم استزراع النباتات ثلاثية الطبقات الناتجة عن ذلك لمدة 72 ساعة. تم استخدام تلطيخ الهيماتوكسيلين واليوسين (H &؛ E) لتقييم الهياكل التشريحية وتميزت النباتات السابقة الشبكية كذلك بالكيمياء المناعية (IHC) لخلايا المبرمج وسلامة خلايا مولر والتهاب الشبكية. لتأكيد إمكانية تحريض المرض ، تعرضت النباتات السابقة لارتفاع الجلوكوز (HG) والسيتوكينات المؤيدة للالتهابات (Cyt) ، لمحاكاة اعتلال الشبكية السكري (DR). تم استخدام فحص حبة Luminex المغناطيسي لقياس السيتوكينات ذات الصلة DR التي تم إطلاقها في وسيط الثقافة.
كشفت تلطيخ H &؛ E لاميلا الشبكية متميزة ونوى مدمجة في النباتات الشبكية مع الكامنة RPE-المشيمية والشديد، في حين أظهرت شبكية العين دون الهياكل الأساسية انخفاض سمك وفقدان النوى الشديدة. أشارت نتائج IHC إلى عدم وجود موت الخلايا المبرمج والتهاب الشبكية بالإضافة إلى الحفاظ على سلامة خلايا مولر. أظهرت فحوصات Luminex زيادة كبيرة في إفراز السيتوكينات المؤيدة للالتهابات المرتبطة ب DR في النباتات الشبكية المكشوفة ل HG + Cyt نسبة إلى مستويات خط الأساس عند 24 ساعة.
نجحنا في تطوير وتميز بروتوكول HORC جديد تم فيه الحفاظ على سلامة الشبكية دون موت الخلايا المبرمج أو التهاب الشبكية. وعلاوة على ذلك، فإن إفراز المؤشرات الحيوية المؤيدة للالتهابات المرتبطة ب DR عند تعريض النباتات الشبكية ل HG + Cyt يشير إلى أن هذا النموذج يمكن استخدامه لدراسات أمراض الشبكية القابلة للترجمة سريريا.
Introduction
شبكية العين هي بنية عين متخصصة للغاية مسؤولة عن تحويل الطاقة الضوئية الواردة إلى إشارات كهربائية ، والتي يتم معالجتها بعد ذلك من قبل الدماغ للإدراك البصري. شبكية العين البشرية يحتوي على مجموعة ديناميكية من أنواع الخلايا، نظمت للغاية في هيكل lamellar فريدة من نوعها تتكون من طبقتين متشابك وثلاث طبقات نواة1 (الشكل 1). يستمر التوازن الشبكي من خلال الاتصالات المعقدة بين الخلايا العصبية الشبكية والأوعية الدموية والأعصاب والأنسجة الضامة وRPE1. بسبب تشريح الشبكية المتطورة وعلم وظائف الأعضاء، وآليات العديد من أمراض الشبكية لا تزال غير مفهومة بشكل جيد2،3،4،5. لدراسة أمراض الشبكية بشكل أفضل ، تم تطوير نماذج HORC6و7و8و9. بالمقارنة مع الدراسات الحيوانية والثقافات المختبرية ، فإن نماذج HORC مفيدة لأنها تحتفظ بالبيئة الخلوية الديناميكية والتفاعلات العصبية الوعائية المعقدة في الموقع ، مما يوفر نموذجا جيدا للترجمة السريرية.
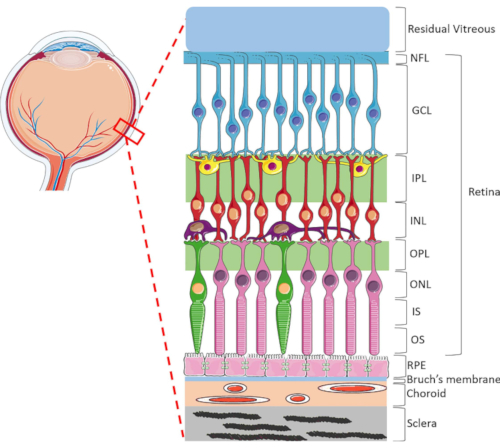
الشكل 1: هياكل العين الخلفية للعين البشرية. من الخلف إلى الخلف ، تكون طبقات الشبكية: طبقة الألياف العصبية (NFL) ، وطبقة خلايا العقدة (GCL) ، وطبقة شكل شبكي داخلي (IPL) ، وطبقة نووية داخلية (INL) ، وطبقة شكل شبكي خارجية (OPL) ، وطبقة نووية خارجية (ONL) ، والجزء الداخلي من المستقبل الضوئي (IS) ، وطبقة خارجية مستقبلات ضوئية (OS). وتشمل الخلايا داخل شبكية العين خلايا العقدة (الأزرق)، وخلايا الأماكرين (الصفراء)، والخلايا ثنائية القطب (الحمراء)، والخلايا الأفقية (الأرجواني)، وقضبان مستقبلات ضوئية (الوردي) ومخروط مستقبلات ضوئية (الأخضر). يقع الزجاجي الأمامي إلى شبكية العين. وRPE، غشاء بروش،choroid والشدة وتقع الخلفي إلى شبكية العين. لاحظ أن الصورة المعروضة هي مجرد تمثيل تخطيطي للشبكية وأن نسبة اتصال الخلايا/الشبكية داخل كل طبقة قد لا تكون مؤشرا على الإعداد في الجسم الحي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
وقد تضمنت بروتوكولات HORC التي تم توصيفها سابقا6و7و8و9 فصل الشبكية عن RPE-choroid وsclera باستخدام التريفين الجراحي. ومع ذلك ، من دون الدعم الذي تقدمه هذه الهياكل الأساسية ، تصبح شبكية العين الشفافة واهية ، ويصعب التعامل معها ، ويمكن لأدوات مثل ملقط تعطيل سلامتها بسهولة. وعلاوة على ذلك، عزل شبكية العين في الثقافة دون RPE وقد ثبت أن يسبب موت الخلايا العقدية وانحطاط مستقبلات ضوئية10،11،12. وبالتالي، فإن بروتوكول HORC البديل الذي يقلل من فقدان سلامة الشبكية ويحااكي بشكل أفضل البيئة في الجسم الحي سيكون مفيدا. وهذا مهم بشكل خاص عند دراسة آليات أمراض الشبكية، حيث أن الإصابة الجسدية أثناء المناولة الإكسبلانت يمكن أن تدخل القطع الأثرية. لذلك ، كان الهدف من هذه الدراسة هو تطوير نموذج HORC جديد يتضمن RPE-choroid و sclera من أجل حماية سلامة الشبكية أثناء المناولة والثقافة.
من أجل تحقيق هذا الهدف، تم استخراج النباتات الشبكية "تقع" بين الزجاجي المتبقية وRPE-المشيمية الكامنة والصلابة. في النباتات الساندوتشات ، ويزن الزجاجي أسفل شبكية العين لمنع انفصال الشبكية وقابلة للطي ، في حين أن الصلبة الليفية الصعبة تعمل سقالة للدعم الهيكلي ونقطة اتصال للملقط. وعلاوة على ذلك، أظهرت النماذج الحيوانية أن الإبقاء على RPE في الثقافة يمكن أن يمنع انحطاط الشبكية وانتشار الدبقية، استجابة من خلايا مولر لإشارات الخطر مثل نقص الأكسيجة والالتهاب10،11،12.
لتوصيف النموذج، كانت ملطخة explants شبكية الساقين مع Hematoxylin وEosin (H & E) لتقييم الهياكل التشريحية والكيمياء المناعية (IHC) تم تنفيذها، وضع العلامات على النباتات السابقة مع محطة deoxynucleotidyl transferase dUTP وضع العلامات النهائية (TUNEL، علامة الخلية المبرمج)، البروتين الحمضي الرجفان الدبقية (GFAP، التهاب الشبكية وعلامة تنشيط الخلية مولر)، وفيمينتين، علامة على سلامة الخلية مولر. لتحديد ما إذا كان يمكن حث هذا النموذج لتطوير علامات المرض الجزيئي، تعرضت النباتات السابقة لارتفاع الجلوكوز (HG) مع السيتوكينات المؤيدة للالتهابات (Cyt) ، interleukin-1β (IL-1β) وعوامل نخر الورم α (TNF-α) ، وهي بيئة زراعة ثبت أنها تحاكي اعتلال الشبكية السكري (DR) في كل من نماذج الأمراض الخلوية والحيوانية13و14و15. استخدمت المقايسات Luminex في نموذج DR لقياس السيتوكينات الصادرة في الوسط الثقافي.
Protocol
تم الحصول على أكواب العين من المتبرع البشري من بنك العيون الوطني النيوزيلندي بعد استئصال القرنية لزرعها وكما وافقت عليها لجنة أخلاقيات الصحة والإعاقة الشمالية B (NTX/06/19/CPD/AM07).
ملاحظة: يجب أن يتم وضع الثقافة في خزانة السلامة الحيوية من الفئة الثانية لضمان ظروف زراعة الأنسجة العقيمة. يجب زراعة الأنسجة في غضون 24 ساعة بعد الوفاة لتجنب فقدان كبير في سلامة الشبكية.

الشكل 2: صور توضح الإجراء لجمع النباتات الشبكية ساندويتش. لإعداد explant، استخدم مقص تشريح مع طرف حاد واحد ونهاية واحدة حادة، مع نهاية حادة تواجه داخل الكرة الأرضية للحد من تلف الأنسجة أثناء شق. استخدم ملقط مع نهايات حادة لتجنب خدش الأنسجة داخل العين أثناء التعامل. باستخدام مقص الجراحية، مع نهاية حادة تواجه الداخل، وقطع على طول الحويزل لإزالة القزحيةوالعدسة (A-C). يمكن أن يكون موجودا في ONH إذا كان يبحث مباشرة في فتح eyecup (D). باستخدام ملقط مع نصائح حادة، عقد تصلب لتحقيق الاستقرار في العالم (ه). تقسيم الكرة الأرضية عموديا إلى نصفين عن طريق إجراء شقين عميقين نحو ONH ولكن لا تقطع من خلال ONH. كرر هذا على طول خط الطول الأفقي (G). تطبيق ملقط حاد في تصلب وفتح الكرة الأرضية بلطف إلى شكل البرسيم(H-K). استخدام ملقط لمعالجة بعناية الزجاجية لتنعيم شبكية العين مطوية، كما القاطرات الزجاجية على شبكية العين، ولكن لا تلمس شبكية العين مباشرة (أنا). إزالة الزجاجية إذا كان يسبب انفصال الشبكية أو للطي (لا يظهر في الشكل 2 كما لا يتم التقاطها بشكل جيد على الزجاجية شفافة على الصور). تحديد المناطق التي تكون فيها الشبكية مسطحة واستخراج النباتات الشبكية باستخدام التريفين الجراحي (L). تطبيق ملقط في تصلب, نقل بعناية explants الشبكية في المتوسط ثقافة معدة مسبقا (M, N). يجب أن تغرق explant شطيرة كاملة إلى الجزء السفلي من البئر بسبب وزنه، وبالتالي يتم submersed كل explant في المتوسط (O). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. استخراج النباتات الشبكية شطيرة من فنجان العين
- إزالة القزحية والعدسة.
- ضع كأس العين داخل طبق بيتري ، مع القزحية والعدسة التي تواجه صعودا ورأس العصب البصري (ONH) الاتصال طبق بيتري(الشكل 2A).
- عقد كوب العين ثابت في طي النسيان باستخدام ملقط (الشكل 2B).
- فصل القزحية والعدسة عن طريق جعل تخفيضات صغيرة محيطيا على طول الحافة الخارجية للأطراف(الشكل 2A).
- إزالة القزحية والعدسة بعناية. تجنب إزعاج الشبكية أثناء التلاعب (الشكل 2C).
ملاحظة: لن تقع العدسة في كوب العين كما هو مرفق، عبر ألياف الزونولي، إلى الجسم السيلاري.
- تسطيح كوب العين.
- مع كوب العين لا يزال يجلس تستقيم، وتحديد ONH. هذا هو أسهل مع مصدر الضوء الأبيض الساطع (الشكل 2D).
- Incise في أربعة أرباع نحو ONH (الشكل 2E). يمكن تدوير طبق بيتري لتسهيل التعامل معه. لا تقطع على ONH.
- انتشار وتسطيح كوب العين بعناية (الشكل 2E).
- تطبيق ملقط على تصلب بدلا من شبكية العين لتجنب تعطيل سلامة الشبكية.
ملاحظة: انفصال الشبكية الطرفية وقابلية للطي أمر لا مفر منه، كما وزن الزجاجي تفيض سوف تسحب على شبكية العين. في هذه المناطق، قم بإزالة الزجاجي لمنع المزيد من طي الشبكية. تذكر أن تترك الزجاجي المتبقية لتحقيق الاستقرار في شبكية العين على رأس RPE-المشيمية والشد.
- جمع شطيرة شبكية العين explants.
- ضع تريفين جراحي على شبكية العين في منطقة بدون طيات شبكية العين(الشكل 2F).
- اضغط بقوة لاختراق الصلبة ، والتي ينبغي أن تولد صوت تكسير.
- تويست التريفين بنسبة 180 درجة لضمان تم اختراق الصلبة تماما بحيث يتم فصل الان explant الشبكية من الأنسجة المتبقية.
- تطبيق ملقط في تصلب ونقل explant الشبكية شطيرة إلى وسط الثقافة (الشكل 2G-I).
- الحصول على 2-3 شطيرة الشبكية explants من شبكية العين الطرفية من كل ربع.
ملاحظة: يمكن في بعض الأحيان أن تكون محصورة في افتتاح تريفين في explant الشبكية ساندويتش. باستخدام ملقط، ندف بلطف من قسم صغير من قاعدة الصلبة. يحدث هذا في كثير من الأحيان عندما يكون النصل حاد ويمكن أن يسبب فقدان الشبكية (الشكل 3A-C). - استخدام التريفين الجديد بعد الاستغناء عن 1-2 النباتات الشبكية كما يصبح النصل حادة بسهولة (الشكل 3C
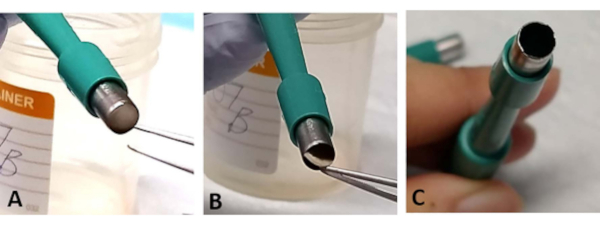
الشكل 3: استكشاف الأخطاء وإصلاحها. أثناء عملية الاستخراج ، قد يكون محصورا في explant الشبكية عند فتح التريفين الجراحي (A). ندف بلطف من الأنسجة من قاعدة تصلب دون لمس شبكية العين (ب). هذا يمكن أن يحدث في كثير من الأحيان إذا تم استخدام التريفين الجراحي لاستخراج أكثر من اثنين من النباتات الشبكية، كما يمكن أن تصبح بسهولة شفرة حادة (C). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- ثقافة النباتات الشبكية.
- إعداد وسيط الثقافة التي تحتوي على خليط المغذيات المتوسط النسر المعدلة Dulbecco F-12 (DMEM-F12) و1x المضادات الحيوية وخليط مضادات الميكوديتكس (AA، 100x الأسهم).
- قبل استخراج explant، ضع 500 ميكرولتر من المتوسط في آبار لوحة 24 بئرا والاعتدال في الحاضنة. وهذا أمر مهم كما إضافة المتوسطة بعد ذلك يمكن إزاحة شبكية العين.
- زراعة النباتات الشبكية ساندويتش في 37 درجة مئوية لمدة تصل إلى 72 ساعة في حاضنةCO2 5٪ رطبة في المتوسطة المعدة في الخطوة 1.4.2.
- للحث على تغييرات تشبه DR، النباتات الشبكية الثقافة في المتوسطة التي تحتوي على DMEM-F12 مع مزيج من 32.5 mM HG مع Cyt، TNF-α (10 نانوغرام / مل) وIL-1β (10 نانوغرام / مل).
2. البارافين تضمين من النباتات الشبكية شطيرة
- إصلاح النباتات الشبكية شطيرة.
- تزج explants الشبكية شطيرة في 10٪ الفورمالين لمدة 24 ساعة على الأقل.
- إزالة محلول الفورمالين ونقل explants الشبكية ساندويتش بلطف في منصات الأنسجة والأشرطة.
- نقع النباتات الشبكية شطيرة في الإيثانول 70٪ لمدة 24 ساعة على الأقل.
- البارافين تضمين الشبكية explants في كتل.
- قطع أنسجة الشبكية المضمنة البارافين إلى أقسام سميكة 5 ميكرومتر باستخدام microtome وجبل على الشرائح الزجاجية. يخزن في درجة حرارة الغرفة حتى التصوير.
- إزالة الأقسام.
- تزج المقاطع في 70٪ xylene لمدة 5 دقائق.
- تزج المقاطع في 100٪ xylene لمدة 5 دقائق.
- إعادة ترطيب المقاطع في الإيثانول 70٪ لمدة 5 دقائق.
- إعادة ترطيب المقاطع في الإيثانول 100٪ لمدة 5 دقائق.
- اغسل الأقسام تحت مياه الصنبور الجارية لمدة 10 دقائق.
3. التوصيف باستخدام H &؛ E ، IHC و م المقايسة Luminex المغناطيسي
- H &؛ E تلطيخ البروتوكول
- إزالةparaffinize المقاطع باستخدام الخطوة 2.2.
- هيدرات المقاطع في مياه الصنبور لمدة 5 دقائق.
- وصمة عار المقاطع في حل جيل 2 هيماتوكسيلين لمدة 5 دقائق.
- غسل المقاطع جيدا تحت مياه الصنبور الجارية لإزالة وصمة عار الزائدة.
- التفريق عن طريق غمس المقاطع مرتين في الكحول الحمضي 1٪.
- اغسل الأقسام بسرعة تحت مياه الصنبور الجارية.
- وصمة عار المقاطع الزرقاء عن طريق غمس ست مرات في كربونات الليثيوم 1٪ (10 ملغم / مل).
- غسل المقاطع جيدا تحت مياه الصنبور الجارية لمدة 5 دقائق لإزالة البقع الزرقاء الزائدة.
- تراجع المقاطع في 1٪ eosin 10 مرات.
- غسل المقاطع بسرعة تحت مياه الصنبور لإزالة وصمة عار الزائدة.
- يجفف المقاطع عن طريق غمسها 10 مرات في الإيثانول بنسبة 100٪. افعل هذا مرتين.
- تراجع المقاطع في 70٪ xylene 10 مرات.
- تراجع المقاطع في 100٪ xylene 10 مرات.
- جبل مع coverlip باستخدام ثنائي بوتيل فيثالات البوليسترين xylene (DPX) تصاعد المتوسطة.
- التقاط الصور باستخدام المجهر الخفيف.
- بروتوكول وضع العلامات IHC '
- إزالةparaffinize المقاطع باستخدام الخطوة 2.2.
- ضع الشرائح في محلول يحتوي على 10 mM الصوديوم سيترات العازلة مع 0.05٪ توين 20 في درجة الحموضة 6.0 وتشغيل استرجاع مستضد في طنجرة ضغط الآلي في 121 درجة مئوية لمدة 2 دقيقة.
- اغسل الأقسام الموجودة في محلول ملحي عازل للفوسفات لمدة 5 دقائق. افعل هذا 3 مرات.
- كتلة المقاطع مع برنامج تلفزيوني يحتوي على 0.1٪ تريتون X-100 و 10٪ مصل الماعز العادي لمدة 1 ساعة في درجة حرارة الغرفة.
- احتضان أقسام بين عشية وضحاها في 4 درجة مئوية مع الأجسام المضادة الأولية المقترنة الأجسام المضادة الثانوية (جدول المواد).
- اغسل المقاطع في PBS لمدة 5 دقائق. افعل هذا 3 مرات.
- وصمة عار النوى باستخدام 4′,6-diamidino-2-phenylindole (DAPI) لمدة 2 دقيقة.
- اغسل و ماونت المقاطع باستخدام كاشف مضاد للتلاشي.
- يغطي الختم مع طلاء الأظافر.
- التقاط الصور باستخدام مجهر المسح بالليزر confocal.
- فحص لومينيكس المغناطيسي
- نقل 75 ميكرولتر من الوسائط من كل بئر إلى لوحة 96-جيدا-u-أسفل في 24 و 72 ساعة.
- تحليل الخلايا الفائقة لIL-18، IL-6، IL-8 والأوعية الدموية عامل النمو البطانية (VEGF) بعد 24 و 72 ساعة باستخدام م المقايسة لومينيكس السيتوكين. اتبع تعليمات الشركة المصنعة لإجراء الفحص16.
النتائج
تم الحفاظ على سلامة الشبكية في هذا النموذج HORC. تم الحفاظ على سلامة الشبكية في النباتات الشبكية ساندويتش المستزرعة ولكن فقدت في شبكية العين المستزرعة دون هياكل مجاورة. وقد أجريت H &؛ E لفحص السلامة الهيكلية للشرائح الشبكية شطيرة مقطعة بعد 72 ساعة في الثقافة. وأظه?...
Discussion
HORC هو حاليا النموذج الأكثر قابلية للترجمة سريريا في أبحاث الشبكية قبل السريرية. بالمقارنة مع نماذج زراعة الخلايا المختبرية ، يمكن أن يمثل HORC بشكل أفضل تشريح شبكية العين البشرية في الموقع ، من خلال الاحتفاظ بأنواع خلايا الشبكية الديناميكية واتصالاتها بالخلايا العصبية ، الأوعية الدموية و?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ويود المؤلفون أن يشكروا المتبرعين السخيين لأنسجة العيون والفريق من بنك العيون الوطني النيوزيلندي على دعمهم. وقد دعم هذا العمل ماليا بمنح مشاريع من صندوق موريس وفيليس بايكل ومؤسسة أوكلاند للبحوث الطبية (1117015). وتدعم مؤسسة بوكانان الخيرية إدارة المعهد. تقدم منحة CK من قبل جمعية نيوزيلندا لصندوق التعليم والبحوث لعلماء العيون (CC36812) ويتم تقديم منحة HHL من قبل مؤسسة بوكانان الخيرية.
Materials
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved