Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Caractérisation d’une nouvelle technique de culture rétinienne organotypique humaine
Dans cet article
Résumé
Cette étude vise à développer un nouveau modèle de culture rétinienne organotypique humaine (HORC) qui empêche de compromettre l’intégrité rétinienne lors de la manipulation des explants. Ceci est réalisé en cultivant la rétine avec le vitré sous-jacent et le pigment rétinien sous-jacent épithélium-choroïde (RPE-choroïde) et la sclérotique.
Résumé
Des modèles antérieurs de culture rétinienne organotypique humaine (HORC) ont utilisé des rétines détachées; cependant, sans le soutien structurel conféré par l’épithélium-choroïde pigmentaire rétinien (RPE-choroïde) et la sclérotique, l’intégrité de la rétine fragile peut facilement être compromise. L’objectif de cette étude était de développer un nouveau modèle HORC qui contient la rétine, la choroïde RPE et la sclérotique pour maintenir l’intégrité rétinienne lors de la culture d’explants rétiniens.
Après avoir coupé circonférentiellement le long du limbe pour enlever l’iris et le cristallin, quatre incisions profondes ont été pratiquées pour aplatir l’œillet. Contrairement aux protocoles HORC précédents, une tréphine a été utilisée pour couper non seulement la rétine, mais aussi la choroïde RPE et la sclérotique. Les explants à triple couche qui en ont résulté ont été cultivées pendant 72 h. La coloration à l’hématoxyline et à l’éosine (H & E) a été utilisée pour évaluer les structures anatomiques et les explants rétiniens ont été caractérisés par immunohistochimie (IHC) pour l’apoptose, l’intégrité cellulaire de Müller et l’inflammation de la rétine. Pour confirmer la possibilité d’induction de la maladie, les explants ont été exposés à un taux élevé de glucose (HG) et à des cytokines pro-inflammatoires (Cyt), pour imiter la rétinopathie diabétique (DR). Le test de billes magnétiques Luminex a été utilisé pour mesurer les cytokines liées à la RD libérées dans le milieu de culture.
La coloration H & E a révélé des lamelles rétiniennes distinctes et des noyaux compacts dans les explantes rétiniennes avec la choroïde RPE sous-jacente et la sclérotique, tandis que les rétines sans les structures sous-jacentes présentaient une épaisseur réduite et une perte de noyaux sévère. Les résultats de l’IHC ont indiqué l’absence d’apoptose et d’inflammation de la rétine ainsi que la préservation de l’intégrité des cellules de Müller. Les tests Luminex ont montré une augmentation significative de la sécrétion de cytokines pro-inflammatoires associées à la RD dans les explants rétiniens exposés à HG + Cyt par rapport aux niveaux de base à 24 h.
Nous avons développé et caractérisé avec succès un nouveau protocole HORC dans lequel l’intégrité de la rétine a été préservée sans apoptose ni inflammation de la rétine. De plus, la sécrétion induite de biomarqueurs pro-inflammatoires associés à la RD lors de l’exposition des explants rétiniens à HG + Cyt suggère que ce modèle pourrait être utilisé pour des études cliniquement traduisibles sur les maladies rétiniennes.
Introduction
La rétine est une structure oculaire hautement spécialisée responsable de la transformation de l’énergie lumineuse entrante en signaux électriques, qui sont ensuite traités par le cerveau pour la perception visuelle. La rétine humaine contient une gamme dynamique de types cellulaires, très organisés dans une structure lamellaire unique composée de deux couches synaptiques et de trois couches nucléiques1 (Figure 1). L’homéostasie rétinienne est soutenue par les connexions complexes entre les cellules neurorétiniennes, les vaisseaux sanguins, les nerfs, les tissus conjonctifs etl’EPR 1. En raison de l’anatomie et de la physiologie rétiniennes sophistiquées, les mécanismes de nombreuses maladies de la rétine restent encore mal compris2,3,4,5. Pour mieux étudier les maladies de la rétine, des modèles HORC ont étédéveloppés6,7,8,9. Comparés aux études animales et aux cultures in vitro, les modèles HORC sont avantageux car ils conservent l’environnement cellulaire dynamique et les interactions neurovasculaires complexes in situ, fournissant un bon modèle pour la traduction clinique.
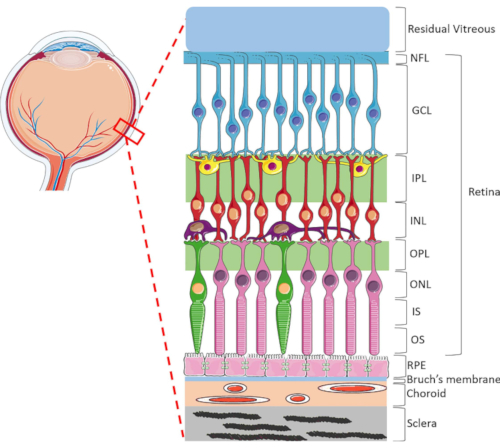
Figure 1: Structures oculaires postérieures de l’œil humain. Antérieures à postérieures, les couches rétiniennes sont : la couche de fibres nerveuses (NFL), la couche de cellules ganglionnaires (GCL), la couche plexiforme interne (IPL), la couche nucléaire interne (INL), la couche plexiforme externe (OPL), la couche nucléaire externe (ONL), le segment interne du photorécepteur (IS) et la couche externe du photorécepteur (OS). Les cellules de la rétine comprennent les cellules ganglionnaires (bleues), les cellules amacrines (jaunes), les cellules bipolaires (rouges), les cellules horizontales (violettes), les photorécepteurs de bâtonnets (roses) et les photorécepteurs coniques (verts). Le vitré est situé avant la rétine. L’EPR, la membrane de Bruch, la choroïde et la sclérotique sont situées postérieurement à la rétine. Notez que l’image montrée n’est qu’une représentation schématique de la rétine et que le rapport cellules/connectivité rétinienne au sein de chaque couche peut ne pas indiquer le contexte in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les protocoles HORCprécédemmentcaractérisés 6,7,8,9ont impliqué la séparation de la rétine de la choroïde RPE sous-jacente et de la sclérotique à l’aide d’une tréphine chirurgicale. Cependant, sans le soutien fourni par ces structures sous-jacentes, la rétine translucide devient fragile, difficile à manipuler et des outils tels que des pinces peuvent facilement perturber son intégrité. De plus, il a été démontré que l’isolement de la rétine en culture sans l’EPR provoque l’apoptose des cellules ganglionnaires et la dégénérescence des photorécepteurs10,11,12. Ainsi, un protocole HORC alternatif qui minimise la perte d’intégrité rétinienne et imite mieux l’environnement in vivo serait utile. Ceci est particulièrement important lors de l’étude des mécanismes de la maladie rétinienne, car les blessures physiques lors de la manipulation des explants pourraient introduire des artefacts. Par conséquent, l’objectif de cette étude était de développer un nouveau modèle HORC qui inclut la choroïde RPE et la sclérotique afin de protéger l’intégrité de la rétine pendant la manipulation et la culture des explants.
Afin d’atteindre cet objectif, des explantes rétiniennes « prises en sandwich » entre le vitré résiduel et la choroïde RPE sous-jacente et la sclérotique ont été extraites. Dans les explants sandwich, le vitré alourd la rétine pour empêcher le décollement et le repliement de la rétine, tandis que la sclérotique fibreuse et résistante agit à la fois comme un échafaudage pour le soutien structurel et un point de contact pour les forceps. De plus, des modèles animaux ont montré que la rétention de l’EPR en culture peut prévenir la dégénérescence rétinienne et la prolifération gliale, une réponse des cellules de Müller à des signaux de danger tels que l’hypoxie et l’inflammation10,11,12.
Pour caractériser le modèle, des explants rétiniens sandwich ont été colorés avec de l’hématoxyline et de l’éosine (H & E) pour évaluer les structures anatomiques et une immunohistochimie (IHC) a été réalisée, en tissant les explants avec un marquage terminal de l’extrémité de l’extrémité de la dUTP doxynucléotidyl transférase dUTP (TUNEL, un marqueur cellulaire apoptotique), une protéine acide fibrillaire gliale (GFAP, une inflammation de la rétine et marqueur d’activation cellulaire de Müller) et la vimentine, un marqueur de l’intégrité cellulaire de Müller. Pour déterminer si ce modèle peut être induit à développer des signes moléculaires de maladie, les explantes ont été exposées à un taux élevé de glucose (HG) avec des cytokines pro-inflammatoires (Cyt), de l’interleukine-1β (IL-1β) et un facteur de nécrose tumorale-α (TNF-α), un environnement de culture qui a été montré pour imiter la rétinopathie diabétique (DR) dans les modèles de maladies cellulaires et animales13,14,15. Les tests Luminex ont été utilisés dans le modèle DR pour mesurer les cytokines libérées dans le milieu de culture.
Protocole
Les cils de donneurs humains ont été obtenus auprès de la Banque nationale des yeux de Nouvelle-Zélande à la suite d’une excision cornéenne en vue d’une transplantation et approuvés par le Comité d’éthique de la santé et du handicap du Nord B (NTX/06/19/CPD/AM07).
REMARQUE: La culture doit être effectuée dans une armoire de biosécurité de classe II pour assurer des conditions de culture de tissus stériles. Les tissus doivent être cultivés dans les 24 heures post-mortem pour éviter une perte importante de l’intégrité de la rétine.

Figure 2: Images montrant la procédure de collecte des explants rétiniens sandwich. Pour la préparation des explantations, utilisez des ciseaux disséqués avec une pointe pointue et une extrémité émoussée, avec l’extrémité émoussée face à l’intérieur du globe pour réduire les lésions tissulaires pendant l’incision. Utilisez également des pinces à extrémités émoussées pour éviter de rayer les tissus intraoculaires pendant la manipulation. À l’aide de ciseaux chirurgicaux, avec l’extrémité émoussée tournée vers l’intérieur, coupez le long du limbe pour enlever l’iris et le cristallin(A-C). L’ONH peut être localisé si vous regardez directement dans l’œillet ouvert (D). À l’aide de pinces à pointes émoussées, tenez la sclérotique pour stabiliser le globe (E). Divisez le globe verticalement en deux moitiés en faisant deux incisions profondes vers l’ONH mais ne coupez pas à travers l’ONH. Répétez cette opération le long du méridien horizontal (G). Appliquez des pinces émoussées à la sclérotique et ouvrez doucement le globe en forme de trèfle(H-K). Utilisez des pinces pour manipuler soigneusement le vitré afin de lisser la rétine repliée, car le vitré tire sur la rétine, mais ne touchez pas directement la rétine (I). Retirez le vitré s’il provoque un décollement ou un repliement de la rétine (ce qui n’est pas illustré à la figure 2 car le vitré transparent n’est pas bien capturé sur les photos). Localisez les zones où la rétine est plate et extrayez les explants rétiniens à l’aide d’une tréphine chirurgicale (L). En appliquant une pince à la sclérotique, transférer soigneusement les explants rétiniens dans le milieu de culture pré-préparé (M,N). L’explante sandwich entière doit couler au fond du puits en raison de son poids, donc chaque explante est submersée dans le milieu (O). Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Extraction des explants rétiniens sandwich de l’œillet
- Retirez l’iris et la lentille.
- Placez la coupe oculaire à l’intérieur d’une boîte de Pétri, avec l’iris et la lentille tournés vers le haut et la tête du nerf optique (ONH) en contact avec la boîte de Pétri(Figure 2A).
- Maintenez la coupe oculaire stable au niveau du limbe à l’aide d’une pince(Figure 2B).
- Détachez l’iris et le cristallin en effectuant de petites coupures circonférentielles le long du bord externe du limbe (Figure 2A).
- Retirez soigneusement l’iris et la lentille. Évitez de déranger la rétine lors de la manipulation (Figure 2C).
REMARQUE: La lentille ne tombera pas dans la coupe oculaire car elle est attachée, via des fibres de zonule, au corps ciliaire.
- Aplatissez la coupe oculaire.
- Avec la coupe oculaire toujours assise debout, identifiez l’ONH. Ceci est plus facile avec une source de lumière blanche brillante (Figure 2D).
- Inciser aux quatre quadrants vers l’ONH (Figure 2E). La boîte de Petri peut être tournée pour une manipulation plus facile. Ne coupez PAS l’ONH.
- Étaler et aplatir soigneusement la coupe oculaire (Figure 2E).
- Appliquez la pince sur la sclérotique au lieu de la rétine pour éviter de perturber l’intégrité de la rétine.
REMARQUE: Le décollement et le repliement périphériques de la rétine sont inévitables, car le poids du vitré débordant tirera sur la rétine. Dans ces zones, retirez le vitré pour éviter d’autres plis rétiniens. N’oubliez pas de laisser le vitré résiduel pour stabiliser la rétine au-dessus de la choroïde RPE et de la sclérotique.
- Recueillez les explants rétiniens sandwich.
- Placer une tréphine chirurgicale sur la rétine dans une région sans plis rétiniens (Figure 2F).
- Appuyez fort pour pénétrer dans la sclérotique, ce qui devrait générer un son de craquement.
- Tournez la tréphine de 180° pour vous assurer que la sclérotique a été complètement pénétrée de sorte que l’explante rétinienne soit maintenant séparée du tissu restant.
- Appliquez la pince au niveau de la sclérotique et transférez l’explant rétinien sandwich dans le milieu de culture (Figure 2G-I).
- Obtenir 2-3 explants rétiniens sandwich de la rétine périphérique de chaque quadrant.
REMARQUE: L’explante rétinienne sandwich peut parfois être piégée dans l’ouverture de la tréphine. À l’aide de pinces, coupez doucement une petite section de la base de la sclérotique. Cela se produit plus souvent lorsque la lame est émoussée et peut entraîner une perte de la rétine (Figure 3A-C). - Utilisez une nouvelle tréphine après avoir coupé 1 à 2 explants rétiniens lorsque la lame devient facilement émoussée (Figure 3C
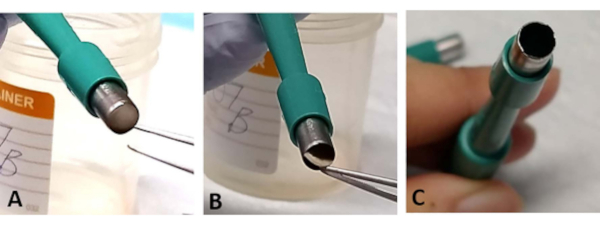
Figure 3: Dépannage. Au cours du processus d’extraction, l’explante rétinienne peut être piégée à l’ouverture de la tréphine chirurgicale (A). Extraire doucement le tissu de la base de la sclérotique sans toucher la rétine (B). Cela peut se produire plus souvent si la tréphine chirurgicale est utilisée pour extraire plus de deux explants rétiniens, car la lame peut facilement devenir émoussée (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Culture des explants rétiniens.
- Préparer le milieu de culture contenant le mélange nutritif F-12 (DMEM-F12) de Dulbecco Modified Eagle Medium et un mélange 1x d’antibiotiques et d’antimycotiques (AA, 100x stock).
- Avant l’extraction des explants, placer 500 μL de milieu dans les puits d’une plaque de 24 puits et équilibrer dans l’incubateur. Ceci est important car l’ajout du milieu par la suite peut déloger la rétine.
- Culture des explants rétiniens sandwich à 37 °C jusqu’à 72 h dans un incubateur humidifié à 5 % de CO2 dans un milieu préparé à l’étape 1.4.2.
- Pour induire des changements de type DR, culture d’explants rétiniens dans un milieu contenant du DMEM-F12 avec une combinaison de 32,5 mM HG avec Cyt, TNF-α (10 ng/ mL) et IL-1β (10 ng / mL).
2. Incorporation de paraffine des explants rétiniens sandwich
- Fixez les explants rétiniens sandwich.
- Immerger les explants rétiniens sandwich dans 10% de forger pendant au moins 24 h.
- Retirez la solution de forma et transférez doucement les explants rétiniens sandwich dans des tampons tissulaires et des cassettes.
- Faire tremper les explants rétiniens sandwich dans de l’éthanol à 70% pendant au moins 24 h.
- Explantations rétiniennes incorporées à la paraffine en blocs.
- Coupez les tissus rétiniens incorporés à la paraffine en sections de 5 μm d’épaisseur à l’aide d’un microtome et montez-les sur des lames de verre. Conserver à température ambiante jusqu’à l’imagerie.
- Déparaffiniser les sections.
- Immerger les sections dans 70% de xylène pendant 5 min.
- Immerger les sections dans du xylène à 100% pendant 5 min.
- Réhydraté les sections dans de l’éthanol à 70% pendant 5 min.
- Réhydraté les sections dans de l’éthanol à 100% pendant 5 min.
- Lavez les sections sous l’eau courante du robinet pendant 10 min.
3. Caractérisation à l’aide de H&E, IHC et d’un test Magnétique Luminex
- Protocole de coloration H&E
- Déparaffinez les sections à l’aide de l’étape 2.2.
- Hydrater les sections dans l’eau du robinet pendant 5 min.
- Tacher les sections dans la solution d’hématoxyline 2 de Gill pendant 5 min.
- Lavez soigneusement les sections sous l’eau courante du robinet pour éliminer l’excès de tache.
- Différencier en trempant les sections deux fois dans de l’alcool acide à 1%.
- Lavez rapidement les sections à l’eau courante du robinet.
- Colorez les sections en bleu en trempant six fois dans du carbonate de lithium à 1 % (10 mg/mL).
- Lavez soigneusement les sections sous l’eau courante du robinet pendant 5 minutes pour éliminer l’excès de tache bleue.
- Trempez les sections dans 1% d’éosine 10 fois.
- Lavez rapidement les sections sous l’eau du robinet pour éliminer l’excès de tache.
- Déshydratez les sections en les trempant 10 fois dans de l’éthanol à 100%. Faites-le deux fois.
- Trempez les sections dans 70% de xylène 10 fois.
- Trempez les sections dans du xylène 100% 10 fois.
- Montage avec un couvercle à l’aide d’un milieu de montage en polystyrène xylène (DPX) de phtalate de dibutyle.
- Prenez des images à l’aide d’un microscope optique.
- Protocole d’étiquetage IHC'
- Déparaffinez les sections à l’aide de l’étape 2.2.
- Placer les lames dans une solution contenant 10 mM de tampon de citrate de sodium avec 0,05 % de Tween 20 à pH 6,0 et exécuter une récupération d’antigène dans un autocuiseur automatisé à 121 °C pendant 2 min.
- Laver les sections dans une solution saline tamponnée au phosphate (PBS) pendant 5 min. Faites-le 3 fois.
- Bloquez les sections avec du PBS contenant 0,1% de Triton X-100 et 10% de sérum de chèvre normal pendant 1 h à température ambiante.
- Incuber des sections pendant la nuit à 4 °C avec des anticorps primaires conjugués à des anticorps secondaires (Table des matériaux).
- Laver les sections dans PBS pendant 5 min. Faites-le 3 fois.
- Colorez les noyaux à l’aide de 4′,6-diamidino-2-phénylindole (DAPI) pendant 2 min.
- Lavez et montez les sections à l’aide d’un réactif anti-décoloration.
- Scellez les couvercles avec du vernis à ongles.
- Prenez des images à l’aide d’un microscope à balayage laser confocal.
- Essai magnétique Luminex
- Transférer 75 μL de média de chaque puits vers une plaque de fond de 96 puits en U à 24 et 72 h.
- Analyser le surnageant cellulaire pour l’IL-18, l’IL-6, l’IL-8 et le facteur de croissance de l’endothélium vasculaire (VEGF) après 24 et 72 h à l’aide du test de cytokines Luminex. Suivez les instructions du fabricant pour effectuer le test16.
Résultats
L’intégrité rétinienne a été préservée dans ce modèle HORC. L’intégrité rétinienne a été préservée dans les explants rétiniens sandwich cultivés, mais a été perdue dans la rétine cultivée sans structures adjacentes. H&E a été mené pour examiner l’intégrité structurelle des explants rétiniens sandwich sectionnés après 72 h en culture. Les explantes rétiniennes sandwich ont montré une intégrité préservée et une structure de lamelles ...
Discussion
HORC est actuellement le modèle le plus traduisible cliniquement dans la recherche rétinienne préclinique. Par rapport aux modèles de culture cellulaire in vitro, HORC peut mieux représenter l’anatomie de la rétine humaine in situ, en conservant les types de cellules rétiniennes dynamiques et leurs connexions avec les neurones, les vascularisations et l’environnement extracellulaire19. Par rapport aux modèles animaux, les HORC sont plus avantageux dans l’étude de la physiopathologie...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier les généreux donneurs de tissus oculaires et l’équipe de la New Zealand National Eye Bank pour leur soutien. Ce travail a été soutenu financièrement par des subventions de projet du Maurice and Phyllis Paykel Trust et de l’Auckland Medical Research Foundation (1117015). La direction d’IDR est soutenue par la Buchanan Charitable Foundation. La bourse de CK est fournie par le New Zealand Association of Optometrists Education and Research Fund (CC36812) et la bourse de HHL est fournie par la Buchanan Charitable Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
Références
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon