A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אפיון טכניקה חדשנית של תרבות רשתית אורגניוטיפית אנושית
In This Article
Summary
מחקר זה נועד לפתח מודל תרבות רשתית אורגניוטיפית אנושית חדשנית (HORC) המונעת פגיעה בשלמות הרשתית במהלך טיפול בהסבר. זה מושגת על ידי פולחן הרשתית עם הזגוזית יתר על המידה ואת אפיתל הפיגמנט ברשתית הבסיסית-choroid (RPE-choroid) ו sclera.
Abstract
דגמי תרבות הרשתית האורגנוטיפית האנושית הקודמת (HORC) השתמשו ברשתיות מנותקות; עם זאת, ללא התמיכה המבנית המוענקת על ידי אפיתל פיגמנט רשתית-choroid (RPE-choroid) ו sclera, השלמות של הרשתית שבירה יכול בקלות להיות בסכנה. מטרת המחקר הזה הייתה לפתח מודל HORC חדשני המכיל את הרשתית, RPE-choroid ו sclera כדי לשמור על שלמות הרשתית בעת פולחן explants רשתית.
לאחר חיתוך היקפי לאורך הלימבוס כדי להסיר קשתית ועדשה, ארבעה חתכים עמוקים נעשו כדי לשטח את העין. בניגוד לפרוטוקולים קודמים של HORC, נעשה שימוש בטרפין כדי לחתוך לא רק את הרשתית אלא גם את RPE-choroid ו sclera. המהדורות המשולשות שהתקבלו היו בתרבית במשך 72 שעות. ההמטוקסילין והכתמת אאוזין (H&E) שימשו להערכת מבנים אנטומיים ו explants ברשתית התאפיינו עוד יותר על ידי אימונוהיסטוכימיה (IHC) עבור אפופטוזיס, שלמות התא מולר ודלקת ברשתית. כדי לאשר את האפשרות של אינדוקציה המחלה, explants נחשפו גלוקוז גבוה (HG) וציטוקינים פרו דלקתיים (Cyt), כדי לחקות רטינופתיה סוכרתית (DR). חרוזים מגנטיים Luminex שימש למדידת ציטוקינים הקשורים DR שוחרר לתוך המדיום התרבותי.
כתמי H&E חשפו לאמלי רשתית ברורה וגרפיעים קומפקטיים בגרשי רשתית עם RPE-choroid ו sclera הבסיסיים, בעוד רשתיות ללא המבנים הבסיסיים הציגו עובי מופחת ואובדן גרעינים חמור. תוצאות IHC הצביעו על היעדר אפופטוזיס ודלקת ברשתית, כמו גם על שלמות תאי מולר שנשמרה. בדיקות Luminex הראו הפרשה מוגברת באופן משמעותי של ציטוקינים פרו דלקתיים הקשורים DR ב explants ברשתית שנחשפו HG + Cyt ביחס לרמות הבסיס ב 24 שעות.
פיתחנו ואיפיינו בהצלחה פרוטוקול HORC חדשני שבו שלמות הרשתית נשמרה ללא אפופטוזיס או דלקת ברשתית. יתר על כן, הפרשה המושרה של סמנים ביולוגיים פרו דלקתיים הקשורים DR בעת חשיפת explants רשתית HG + Cyt מציע כי מודל זה יכול לשמש למחקרי מחלות רשתית לתרגום קליני.
Introduction
הרשתית היא מבנה עיני מיוחד מאוד האחראי על הפיכת אנרגיית אור נכנסת לאותות חשמליים, אשר מעובדים לאחר מכן על ידי המוח לתפיסה חזותית. הרשתית האנושית מכילה מגוון דינמי של סוגי תאים, מאורגן מאוד במבנה lamellar ייחודי המורכב משתישכבות סינפטיות ושלוש גרעינים 1 (איור 1). הומאוסטזיס ברשתית מתקיים על ידי הקשרים המורכבים בין תאים עצביים, כלי דם, עצבים, רקמות חיבור ו RPE1. בשל האנטומיה והפיזיולוגיה המתוחכמות של הרשתית, מנגנונים של מחלות רשתית רבות עדיין נשארים מובנים היטב2,3,4,5. כדי לחקור טוב יותר מחלות רשתית, מודלים HORC פותחו6,7,8,9. בהשוואה למחקרים בבעלי חיים ותרבויות במבחנה, מודלים HORC הם יתרון כי הם שומרים על הסביבה התאית הדינמית ואינטראקציות נוירווסקולריות מורכבות במקום, מתן מודל טוב לתרגום קליני.
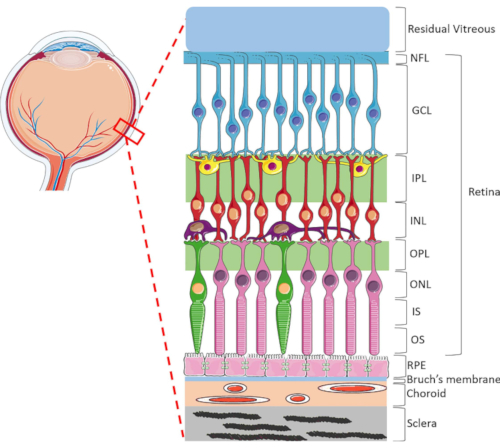
איור 1: מבנים עיניים אחוריים של העין האנושית. שכבות הרשתית הקדמיות הקדמיות הן: שכבת סיבי עצב (NFL), שכבת תא גנגליון (GCL), שכבת plexiform פנימית (IPL), שכבה גרעינית פנימית (INL), שכבת plexiform חיצונית (OPL), שכבה גרעינית חיצונית (ONL), קטע פנימי של קולטן פוטו (IS) ושכבה חיצונית פוטורצפטור (OS). תאים בתוך הרשתית כוללים תאי גנגליון (כחול), תאי אמקרין (צהוב), תאים דו קוטביים (אדום), תאים אופקיים (סגול), קולטני מוט (ורוד) ופוטרצפטורים חרוט (ירוק). הזגית ממוקמת כמטרית לרשית. RPE, הממברנה של ברוך, choroid ו sclera ממוקמים אחוריים הרשתית. שים לב שהתמונה המוצגת היא רק ייצוג סכמטי של הרשתית והיחס בין התאים/קישוריות הרשתית בתוך כל שכבה עשוי שלא להעיד על ההגדרה in vivo. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בעבר אפיינו פרוטוקולי HORC6,7,8,9 מעורבים בהפרדת הרשתית מן RPE-choroid הבסיסי ו sclera באמצעות טרפין כירורגי. עם זאת, ללא התמיכה שמספקים מבנים בסיסיים אלה, הרשתית השקוף הופכת דקיקה, קשה לטיפול וכלים כגון מלקחיים יכולים בקלות לשבש את שלמותה. יתר על כן, בידוד רשתית בתרבות ללא RPE הוכח לגרום אפופטוזיס תא גנגליון ניוון פוטורצפטור10,11,12. לכן, פרוטוקול HORC חלופי שממזער את אובדן שלמות הרשתית ומחקה טוב יותר את סביבת in vivo יהיה שימושי. זה חשוב במיוחד כאשר לומדים מנגנוני מחלת הרשתית, כמו פגיעה גופנית במהלך טיפול explant יכול להציג חפצים. לכן, מטרת המחקר הזה הייתה לפתח מודל HORC חדשני הכולל את RPE-choroid ו sclera על מנת להגן על שלמות הרשתית במהלך טיפול explant ותרבות.
על מנת להשיג מטרה זו, explants רשתית "סנדוויץ'" בין הזגוזית שיורית ואת הבסיסי RPE-choroid ו sclera חולצו. בגולשי הכריך, הזגוכית מכבידה על הרשתית כדי למנוע ניתוק רשתית וקיפול, ואילו הסקלרה הקשוחה והסיבית משמשת גם כפיגומים לתמיכה מבנית וגם כנקודת מגע למלקחיים. יתר על כן, מודלים בעלי חיים הראו כי שמירה על RPE בתרבות יכול למנוע ניוון רשתית והתפשטות גליה, תגובה של תאי מולר לאותות סכנה כגון היפוקסיה ודלקת10,11,12.
כדי לאפיין את המודל, בוצעו explants רשתית כריך עם תיוג קצה ניק dematoxylin ו- Eosin (H&E) כדי להעריך מבנים אנטומיים וחיסון חיסוני (IHC), תיוג explants עם מסוף deoxynucleotidyl transferase dUTP ניק סוף תיוג (TUNEL, סמן תא אפופוטוטי), חלבון חומצי סיביה (GFAP, דלקת רשתית וסמן הפעלת תא מולר), ו vimentin, סמן של שלמות התא מולר. כדי לקבוע אם מודל זה יכול להיות מושרה לפתח סימני מחלה מולקולרית, explants נחשפו גלוקוז גבוה (HG) עם ציטוקינים פרו דלקתיים (Cyt), אינטרלוקין-1β (IL-1β) וגורם נמק הגידול α (TNF-α), סביבת פולחן שהוכח לחקות רטינופתיה סוכרתית (DR) במודלים של מחלות תאים ובעלי חיים13,14,15. מבדקי Luminex שימשו במודל DR למדידת ציטוקינים ששוחררו למדיום התרבותי.
Protocol
כוסות עיניים של תורמים אנושיים התקבלו מבנק העיניים הלאומי של ניו זילנד לאחר כריתת קרנית להשתלה וכפי שאושר על ידי ועדת האתיקה לבריאות ונכות צפון B (NTX/06/19/CPD/AM07).
הערה: התרבות צריכה להיעשות בארון בטיחות ביולוגית Class II כדי להבטיח תנאי תרבית רקמות סטריליים. הרקמות חייבות להיות בתרבית בתוך 24 שעות לאחר המוות כדי למנוע אובדן שלמות רשתית משמעותי.

איור 2: תמונות המציגות את הליך איסוף רשתית הכריכים. להכנת explant, השתמש במספריים לנתח עם קצה חד אחד וקצה קהה אחד, עם הקצה הקהה מול החלק הפנימי של כדור הארץ כדי להפחית את הנזק לרקמות במהלך החתירה. גם להשתמש במלקחיים עם קצוות קהים כדי למנוע גירוד הרקמות התוך עיניות במהלך הטיפול. באמצעות מספריים כירורגיים, עם הקצה הקהה פונה פנימה, לחתוך לאורך הלימבוס כדי להסיר את הקשתית ואת העדשה (A-C). ניתן לאתר את ה- ONH אם מסתכלים ישר לתוך העין הפתוחה(D). באמצעות מלקחיים עם קצות קהים, להחזיק את הסקלרה כדי לייצב את כדור הארץ (E). חלק את כדור הארץ אנכית לשני חצאים על ידי ביצוע שני חתכים עמוקים לכיוון ONH אבל לא לחתוך דרך ONH. חזור על זה לאורך מרידיאן האופקי (G). החל מלקחיים קהים על הסקלרה ופתח בעדינות את כדור הארץ לצורת תלתן (H-K). השתמש במלקחיים כדי לתפעל בזהירות את הזגג כדי להחליק את הרשתית המקופלת, כמו הזגג מושך על הרשתית, אבל לא לגעת הרשתית ישירות(אני). הסר את הזגג אם הוא גורם לניתוק רשתית או קיפול (לא מוצג באיור 2 מכיוון שהמצח זג זג;לא נלכד היטב בתמונות). אתר אזורים שבהם הרשתית שטוחה ולחלץ explants רשתית באמצעות טרפין כירורגי (L). החלת מלקחיים על sclera, בזהירות להעביר את explants הרשתית לתוך מדיום התרבות מוכן מראש (M,N). כל מסלק הכריך צריך לשקוע לתחתית הבאר בשל משקלו, ולכן כל explant שקוע במדיום(O). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
1. מיצוי של סנדוויץ ' רשתית explants מן העין
- הסר את הקשתית והעדשה.
- מניחים את העין בתוך צלחת פטרי, עם הקשתית והעדשה הפונה כלפי מעלה וראש עצב הראייה (ONH) יוצר קשר עם צלחת הפטרי(איור 2A).
- החזק את העין יציבה בלימבוס באמצעות מלקחיים(איור 2B).
- נתק את הקשתית והעדשה על-ידי ביצוע חתכים קטנים בהיקף לאורך הקצה החיצוני של הלימבוס(איור 2A).
- הסר את הקשתית ואת העדשה בזהירות. הימנעו מלהפריע ל רשתית במהלך מניפולציה (איור 2C).
הערה: העדשה לא תיפול לתוך העין כפי שהוא מחובר, באמצעות סיבי zonule, לגוף ciliary.
- תשטח את העין.
- עם העין עדיין יושב זקוף, לזהות את ONH. זה קל יותר עם מקור אור לבן בהיר(איור 2D).
- יש להסית בארבעת הרביעים לכיוון ה-ONH (איור 2E). ניתן לסובב את צלחת הפטרי לטיפול קל יותר. אל תחתוך את ה- ONH.
- מורחים ומשטחים את העין בזהירות(איור 2E).
- החל את המלקחיים על sclera במקום הרשתית כדי למנוע שיבוש שלמות הרשתית.
הערה: ניתוק רשתית היקפית וקיפול הוא בלתי נמנע, כמו המשקל של הזגזלת עולה על גדותיו ימשוך על הרשתית. באזורים אלה, להסיר את הזע על הגחלת כדי למנוע קיפול רשתית נוסף. זכור להשאיר זג זג כדי לייצב את הרשתית על גבי RPE-choroid ו sclera.
- לאסוף explants רשתית כריך.
- הניחו טרפין כירורגי על הרשתית באזור ללא קפלי רשתית(איור 2F).
- לחץ חזק כדי לחדור את sclera, אשר אמור ליצור צליל פיצוח.
- סובבו את הטרפין ב-180° כדי להבטיח שהסקלרה תיחדר במלואה, כך שזרוע הרשתית יופרד כעת מהרקמה הנותרת.
- החל את המלקחיים בסקלרה והעביר את רשתית הכריך למדיום התרבותי(איור 2G-I).
- להשיג 2-3 סנדוויץ 'explal explants מהרשתית ההיקפית של כל רבע.
הערה: לעתים ניתן ללכוד את מגרש רשתית הכריכים בפתיחת הטרפין. בעזרת מלקחיים, מתגרה בעדינות בחלק קטן מבסיס הסקלרה. מצב זה מתרחש לעתים קרובות יותר כאשר הלהב קהה ועלולה לגרום לאובדן הרשתית(איור 3A-C). - השתמש בטרפין חדש לאחר חיתוך 1-2 explants רשתית כמו הלהב הופך בוטה בקלות (איור 3C
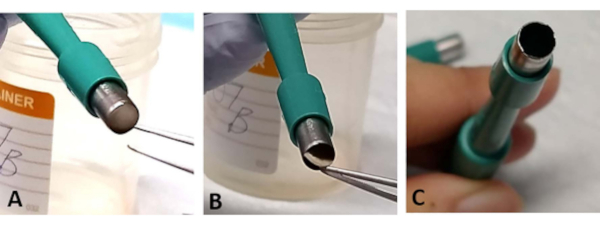
איור 3: פתרון בעיות. במהלך תהליך החילוץ, המסלק ברשתית עשוי להיות לכוד בפתיחת הטרפין הכירורגי (A). להקניט בעדינות את הרקמה מבסיס הסקלרה מבלי לגעת ברשתית (B). זה יכול לקרות לעתים קרובות יותר אם טרפין כירורגי משמש לחילוץ יותר משני explants רשתית, כמו הלהב יכול בקלות להיות בוטה (C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תרבות, מגרשי הרשתית.
- הכן את המדיום התרבותי המכיל את תערובת החומרים המזינים הבינוניים של Dulbecco F-12 (DMEM-F12) ותערובת אנטיביוטיקה ואנטי-מיקוטיקה פי 1 (AA, מלאי 100x).
- לפני מיצוי explant, למקם 500 μL של בינוני בבארות של צלחת 24-well וישקול באינקובטור. זה חשוב כמו הוספת המדיום לאחר מכן יכול להפיץ את הרשתית.
- תרבות רשתית הכריך explants ב 37 °C (72 שעות) בחממה 5% CO2 לח בינוני מוכן בשלב 1.4.2.
- כדי לגרום לשינויים דמויי DR, רשתית תרבות explants בינוני המכיל DMEM-F12 עם שילוב של 32.5 מ"מ HG עם Cyt, TNF-α (10 ng/ mL) ו IL-1β (10 ננוגרם / מ"ל).
2. הטמעת פרפין של תוחמי רשתית הכריך
- תקן את מגרשי רשתית הכריכים.
- לטבול את explants רשתית כריך ב 10% פורמלין לפחות 24 שעות.
- מוציאים את תמיסת הפורמלין ומעבירים בעדינות את רשתית הכריך לרפידות רקמות וקלטות.
- משרים את רשתית הכריך ב-70% אתנול לפחות 24 שעות.
- מסלקי רשתית הטמעת פרפין לתוך בלוקים.
- חותכים רקמות רשתית מוטבעות פרפין לחלקים בעובי 5 מיקרומטר באמצעות מיקרוטום ומורכבים על מגלשות זכוכית. יש לאחסן בטמפרטורת החדר עד להדמיה.
- תפענח מקטעים.
- לטבול את החלקים ב 70% קסילן במשך 5 דקות.
- לטבול את המקטעים ב 100% קסילן במשך 5 דקות.
- Rehydrate את החלקים ב 70% אתנול במשך 5 דקות.
- Rehydrate את החלקים ב 100% אתנול במשך 5 דקות.
- לשטוף את החלקים תחת מי ברז זורמים במשך 10 דקות.
3. אפיון באמצעות H&E, IHC ובוחן לומינקס מגנטי
- פרוטוקול הכתמת H&E
- להפוך את המקטעים לפיגומים באמצעות שלב 2.2.
- לחות את החלקים במי ברז במשך 5 דקות.
- כתים את החלקים בפתרון המטוקסילין 2 של גיל במשך 5 דקות.
- לשטוף את החלקים ביסודיות תחת מי ברז זורמים כדי להסיר כתם עודף.
- להבדיל על ידי טבילת החלקים פעמיים ב 1% אלכוהול חומצה.
- לשטוף את החלקים במהירות תחת מי ברז זורמים.
- מכתים את החלקים בכחול על ידי טבילה שש פעמים ב-1% ליתיום קרבונט (10 מ"ג/מ"ל).
- לשטוף את החלקים ביסודיות תחת מי ברז זורמים במשך 5 דקות כדי להסיר כתם כחול עודף.
- טובלים את המקטעים ב-1% אאוזין 10 פעמים.
- לשטוף את החלקים במהירות תחת מי ברז כדי להסיר כתם עודף.
- לייבש את החלקים על ידי טבילת אותם 10 פעמים ב 100% אתנול. תעשה את זה פעמיים.
- טובלים את החלקים ב-70% קסילן 10 פעמים.
- טובלים את המקטעים ב-100% קסילן 10 פעמים.
- הר עם כיסוי באמצעות דיבוטילפתלט פוליסטירן קסילן (DPX) הרכבה בינונית.
- צמו תמונות באמצעות מיקרוסקופ אור.
- פרוטוקול תיוג IHC'
- להפוך את המקטעים לפיגומים באמצעות שלב 2.2.
- מניחים את השקופיות לתוך פתרון המכיל 10 mM נתרן סיטראט חוצץ עם 0.05% Tween 20 ב pH 6.0 ולהפעיל אחזור אנטיגן בסיר לחץ אוטומטי ב 121 °C (2 דקות).
- לשטוף חלקים מלוחים חוצץ פוספט (PBS) במשך 5 דקות. תעשה את זה 3 פעמים.
- חסמו את המקטעים עם PBS המכיל 0.1% טריטון X-100 ו 10% סרום עזים רגיל במשך שעה אחת בטמפרטורת החדר.
- מקטעי דגירה בלילה ב 4 °C (55 °F) עם נוגדנים ראשוניים מצומדים נוגדנים משניים (טבלה של חומרים).
- לשטוף קטעים PBS במשך 5 דקות. תעשה את זה 3 פעמים.
- גרעיני כתמים באמצעות 4′,6-דיאמידינו-2-פנילינדול (DAPI) למשך 2 דקות.
- יש לשטוף ולהרכיב מקטעים באמצעות ריאגנט נגד עמעום.
- חותם מכסה עם לק.
- צלם תמונות באמצעות מיקרוסקופ סריקת לייזר קונפוקלי.
- מאמץ מגנטי של לומינקס
- העבר 75 μL של מדיה מכל באר ללוח 96-טוב u-התחתון ב 24 ו 72 שעות.
- נתחו את חומר-העל של התא עבור IL-18, IL-6, IL-8 ומקדם גדילה אנדותל וסקולרי (VEGF) לאחר 24 ו-72 שעות באמצעות לבדיקת ציטוקינים של Luminex. בצע את הוראות היצרן כדי לבצע את ה- assay16.
תוצאות
שלמות הרשתית נשמרה במודל HORC זה. שלמות הרשתית נשמרה ברשתית הכריכים התרבותית אך אבדה ברשתית בתרבית ללא מבנים סמוכים. H&E נערך כדי לבחון את השלמות המבנית של explants רשתית כריך חתך לאחר 72 שעות בתרבות. מגרשי רשתית הכריכים הראו שלמות משומרת ומבנה lamellae מובחן מ- GCL ל- ONL עם גרע...
Discussion
HORC הוא כיום המודל הניתן לתרגום קליני ביותר במחקר רשתית פרה-קלינית. בהשוואה למודלים של תרבית תאי הפריה, HORC יכול לייצג טוב יותר את האנטומיה של הרשתית האנושית במקום, באמצעות שמירה על סוגי תאי הרשתית הדינמיים והקשרים שלהם עם נוירונים, כלי דם והסביבה החוץ תאית19. בהשוואה למודלים של ?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לתורמים הנדיבים של רקמות עיניים ולצוות מבנק העיניים הלאומי של ניו זילנד על תמיכתם. עבודה זו נתמכה כלכלית על ידי מענקי פרויקטים מקרן מוריס ופיליס פיקל וקרן המחקר הרפואי של אוקלנד (1117015). הדירקטוריון של IDR נתמך על ידי קרן הצדקה ביוקנן. המלגה של CK ניתנת על ידי האגודה הניו זילנדית לחינוך ומחקר של האופטומטריסטים (CC36812) והמלגה של HHL ניתנת על ידי קרן הצדקה ביוקנן.
Materials
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
References
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved