Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterización de una nueva técnica de cultivo de retina organotípica humana
En este artículo
Resumen
Este estudio tiene como objetivo desarrollar un nuevo modelo de cultivo de retina organotípico humano (HORC) que evite comprometer la integridad de la retina durante el manejo del explante. Esto se logra cultivando la retina con el vítreo resbanante y el epitelio-coroides pigmentario retiniano subyacente (RPE-coroides) y esclerótica.
Resumen
Los modelos previos de cultivo organotípico de retina (HORC) humano han utilizado retinas desprendidas; sin embargo, sin el soporte estructural conferido por el epitelio-coroide pigmentario de la retina (EPR-coroides) y la esclerótica, la integridad de la retina frágil puede verse fácilmente comprometida. El objetivo de este estudio fue desarrollar un nuevo modelo HORC que contenga la retina, la CORoides RPE y la esclerótica para mantener la integridad de la retina al cultivar explantes retinianas.
Después de cortar circunferencialmente a lo largo del limbo para eliminar el iris y el cristalino, se hicieron cuatro incisiones profundas para aplanar el ocular. A diferencia de los protocolos HORC anteriores, se utilizó una trefina para cortar no solo la retina, sino también la COROIDES y la esclerótica. Los explantes de triple capa resultantes se cultivaron durante 72 h. La tinción de hematoxilina y eosina (H&E) se utilizó para evaluar las estructuras anatómicas y los explantes retinianas se caracterizaron además por inmunohistoquímica (IHC) para la apoptosis, la integridad de las células de Müller y la inflamación de la retina. Para confirmar la posibilidad de inducción de la enfermedad, los explantes fueron expuestos a glucosa alta (HG) y citoquinas proinflamatorias (Cyt), para imitar la retinopatía diabética (RD). El ensayo de perla magnética de Luminex se utilizó para medir las citoquinas relacionadas con DR liberadas en el medio de cultivo.
La tinción de H&E reveló distintas láminas retinianas y núcleos compactos en explantes retinianas con la coroides y la esclerótica subyacentes, mientras que las retinas sin las estructuras subyacentes exhibieron un grosor reducido y una pérdida severa de núcleos. Los resultados de la IHC indicaron la ausencia de apoptosis e inflamación de la retina, así como la preservación de la integridad de las células de Müller. Los ensayos de Luminex mostraron un aumento significativo de la secreción de citoquinas proinflamatorias asociadas a DR en explantes retinianas expuestos a HG + Cyt en relación con los niveles basales a las 24 h.
Desarrollamos y caracterizamos con éxito un nuevo protocolo HORC en el que se preservó la integridad de la retina sin apoptosis ni inflamación de la retina. Además, la secreción inducida de biomarcadores proinflamatorios asociados a la RD al exponer los explantes de retina a HG + Cyt sugiere que este modelo podría usarse para estudios de enfermedad de la retina clínicamente traducibles.
Introducción
La retina es una estructura ocular altamente especializada responsable de transformar la energía de la luz entrante en señales eléctricas, que luego son procesadas por el cerebro para la percepción visual. La retina humana contiene un rango dinámico de tipos de células, altamente organizadas en una estructura lamelar única que consiste en dos capas sinápticas y tres núcleos1 (Figura 1). La homeostasis retiniana se sustenta en las intrincadas conexiones entre las células neurorretinianas, los vasos sanguíneos, los nervios, los tejidos conectivos y el RPE1. Debido a la sofisticada anatomía y fisiología de la retina, los mecanismos de muchas enfermedades de la retina siguen siendo poco conocidos2,3,4,5. Para estudiar mejor las enfermedades de la retina, se han desarrollado modelos HORC6,7,8,9. En comparación con los estudios en animales y los cultivos in vitro, los modelos HORC son ventajosos porque conservan el entorno celular dinámico y las interacciones neurovasculares complejas in situ, proporcionando un buen modelo para la traducción clínica.
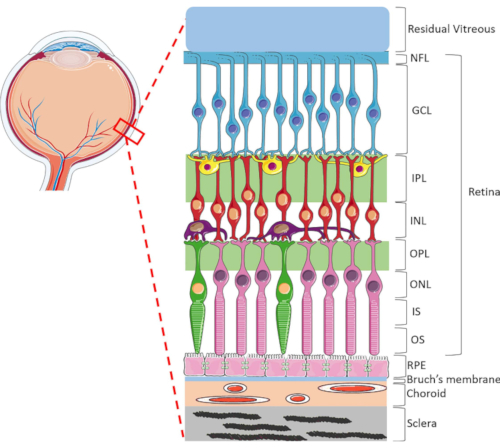
Figura 1: Estructuras oculares posteriores del ojo humano. De anterior a posterior, las capas de la retina son: capa de fibra nerviosa (NFL), capa de células ganglionares (GCL), capa plexiforme interna (IPL), capa nuclear interna (INL), capa plexiforme externa (OPL), capa nuclear externa (ONL), segmento interno del fotorreceptor (IS) y capa externa (SO) del fotorreceptor. Las células dentro de la retina incluyen células ganglionares (azul), células amacrinas (amarillas), células bipolares (rojas), células horizontales (púrpura), fotorreceptores de bastón (rosa) y fotorreceptores de cono (verde). El vítreo se localiza antes de la retina. El RPE, la membrana de Bruch, la coroides y la esclerótica se encuentran posteriores a la retina. Tenga en cuenta que la imagen que se muestra es solo una representación esquemática de la retina y la relación entre las células y la conectividad retiniana dentro de cada capa puede no ser indicativa de la configuración in vivo. Haga clic aquí para ver una versión más grande de esta figura.
Los protocolos HORC previamente caracterizados6,7,8,9 han implicado separar la retina de la RPE-coroides subyacente y la esclerótica mediante una trefina quirúrgica. Sin embargo, sin el apoyo proporcionado por estas estructuras subyacentes, la retina translúcida se vuelve endeble, difícil de manejar y herramientas como los fórceps pueden interrumpir fácilmente su integridad. Además, se ha demostrado que el aislamiento de retina en cultivo sin el RPE causa apoptosis de células ganglionares y degeneración fotorreceptora10,11,12. Por lo tanto, sería útil un protocolo HORC alternativo que minimice la pérdida de integridad de la retina e imite mejor el entorno in vivo. Esto es particularmente importante cuando se estudian los mecanismos de la enfermedad de la retina, ya que la lesión física durante el manejo del explante podría introducir artefactos. Por lo tanto, el objetivo de este estudio fue desarrollar un nuevo modelo HORC que incluya la RPE-coroides y la esclerótica para proteger la integridad de la retina durante el manejo y cultivo del explante.
Para lograr este objetivo, se extrajeron explantes de retina "intercalados" entre el vítreo residual y la coroides y esclerótica subyacentes. En los explantes sándwich, el vítreo pesa sobre la retina para evitar el desprendimiento y plegamiento de la retina, mientras que la esclerótica fibrosa y resistente actúa como un andamio para el soporte estructural y un punto de contacto para los pórceps. Por otra parte, modelos animales han demostrado que retener el RPE en cultivo puede prevenir la degeneración retiniana y la proliferación glial, una respuesta de las células de Müller a señales de peligro como la hipoxia y la inflamación10,11,12.
Para caracterizar el modelo, se tiñeron explantes retinianas sándwich con hematoxilina y eosina (H&E) para evaluar las estructuras anatómicas y se realizó inmunohistoquímica (IHC), marcando explantes con desoxinucleotidil transferasa terminal dUTP nick end labeling (TUNEL, un marcador de células apoptóticas), proteína ácida fibrilar glial (GFAP, una inflamación retiniana y marcador de activación celular de Müller) y vimentina, un marcador de integridad celular de Müller. Para determinar si este modelo puede ser inducido a desarrollar signos moleculares de enfermedad, los explantes fueron expuestos a glucosa alta (HG) con citoquinas proinflamatorias (Cyt), interleucina-1β (IL-1β) y factor de necrosis tumoral-α (TNF-α), un ambiente de cultivo que se ha demostrado que imita la retinopatía diabética (DR) tanto en modelos de enfermedades celulares como animales13,14,15. Los ensayos de Luminex se utilizaron en el modelo DR para medir las citoquinas liberadas en el medio de cultivo.
Protocolo
Las copas de ojos de donantes humanos se obtuvieron del Banco Nacional de Ojos de Nueva Zelanda después de la escisión corneal para trasplante y según lo aprobado por el Comité de Ética de Salud y Discapacidad de Northern B (NTX/06/19/CPD/AM07).
NOTA: El cultivo debe realizarse en un gabinete de bioseguridad de Clase II para garantizar condiciones de cultivo de tejidos estériles. Los tejidos deben cultivarse dentro de las 24 h post mortem para evitar una pérdida significativa de la integridad de la retina.

Figura 2: Imágenes que muestran el procedimiento para la recolección de los explantes retinianas sándwich. Para la preparación del explante, use tijeras de disección con una punta afilada y un extremo romo, con el extremo romo mirando hacia el interior del globo para reducir el daño tisular durante la incisión. También use forrcepciones con extremos romos para evitar rascarse los tejidos intraoculares durante la manipulación. Usando tijeras quirúrgicas, con el extremo romo mirando hacia el interior, corte a lo largo del limbo para eliminar el iris y la lente(A-C). El ONH se puede localizar si se mira directamente en el ocular abierto (D). Usando fórceps con puntas romas, sostenga la esclerótica para estabilizar el globo (E). Divida el globo verticalmente en dos mitades haciendo dos incisiones profundas hacia el ONH, pero no corte a través del ONH. Repita esto a lo largo del meridiano horizontal (G). Aplique fórceps romos en la esclerótica y abra suavemente el globo terráqueo en forma de trébol(H-K). Use fórceps para manipular cuidadosamente el vítreo para alisar la retina plegada, ya que el vítreo tira de la retina, pero no toque la retina directamente (I). Retire el vítreo si está causando desprendimiento de retina o plegamiento (no se muestra en la Figura 2 ya que el vítreo transparente no está bien capturado en las fotos). Localice las áreas donde la retina es plana y extraiga los explantes de retina utilizando una trefina quirúrgica (L). Aplicando fórceps en la esclerótica, transfiera cuidadosamente los explantes de retina al medio de cultivo pre-preparado (M,N). Todo el explante sándwich debe hundirse hasta el fondo del pozo debido a su peso, por lo tanto, cada explante se sumerge en el medio (O). Haga clic aquí para ver una versión más grande de esta figura.
1. Extracción de los explantes retinianas sándwich del ocular
- Retire el iris y la lente.
- Coloque la copa del ojo dentro de una placa de Petri, con el iris y la lente hacia arriba y la cabeza del nervio óptico (ONH) en contacto con la placa de Petri (Figura 2A).
- Mantenga la copa del ojo firme en el limbo usando fórceps(Figura 2B).
- Separe el iris y la lente haciendo pequeños cortes circunferenciales a lo largo del borde externo del limbo(Figura 2A).
- Retire el iris y la lente con cuidado. Evite perturbar la retina durante la manipulación(Figura 2C).
NOTA: La lente no caerá en la copa del ojo, ya que está unida, a través de fibras dezonula, al cuerpo ciliar.
- Aplana la copa del ojo.
- Con la copa del ojo todavía sentada en posición vertical, identifique la ONH. Esto es más fácil con una fuente de luz blanca brillante(Figura 2D).
- Incise en los cuatro cuadrantes hacia la ONH (Figura 2E). La placa de Petri se puede girar para facilitar su manejo. NO corte el ONH.
- Extienda y aplane la copa del ojo con cuidado (Figura 2E).
- Aplique los pórceps en la esclerótica en lugar de la retina para evitar interrumpir la integridad de la retina.
NOTA: El desprendimiento y plegamiento de retina periférica es inevitable, ya que el peso del vítreo desbordado tirará de la retina. En estas áreas, retire el vítreo para evitar un mayor plegamiento de la retina. Recuerde dejar el vítreo residual para estabilizar la retina en la parte superior de la RPE-coroides y la esclerótica.
- Recolectar explantes de retina sándwich.
- Coloque una trefina quirúrgica en la retina en una región sin pliegues retinianas (Figura 2F).
- Presione con fuerza para penetrar la esclerótica, lo que debería generar un sonido de agrietamiento.
- Gire la trefina en 180 ° para asegurarse de que la esclerótica haya sido penetrada completamente de tal manera que el explante de retina ahora esté separado del tejido restante.
- Aplicar los fórceps en la esclerótica y transferir el explante retiniana sándwich al medio de cultivo (Figura 2G-I).
- Obtener 2-3 explantes retinianas sándwich de la retina periférica de cada cuadrante.
NOTA: El explante de retina sándwich a veces puede quedar atrapado en la abertura de la trefina. Usando forrceps, desentraña suavemente una pequeña sección de la base de la esclerótica. Esto ocurre con más frecuencia cuando la cuchilla es roma y puede causar pérdida de la retina(Figura 3A-C). - Use una nueva trefina después de cortar 1-2 explantes de retina a medida que la cuchilla se vuelve roma fácilmente (Figura 3C
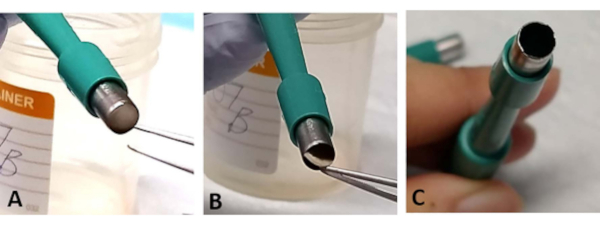
Figura 3: Solución de problemas. Durante el proceso de extracción, el explante de retina puede quedar atrapado en la abertura de la trefina quirúrgica (A). Desentrañar suavemente el tejido de la base de la esclerótica sin tocar la retina (B). Esto puede suceder con más frecuencia si la trefina quirúrgica se utiliza para extraer más de dos explantes de retina, ya que la cuchilla puede volverse fácilmente roma (C). Haga clic aquí para ver una versión más grande de esta figura.
- Cultivo de los explantes de retina.
- Preparar el medio de cultivo que contenga la mezcla de nutrientes F-12 (DMEM-F12) de Dulbecco y una mezcla de antibióticos y antimicóticos 1x (AA, stock de 100x).
- Antes de la extracción del explante, coloque 500 μL de medio en los pozos de una placa de 24 pozos y equilibre en la incubadora. Esto es importante ya que agregar el medio después puede desalojar la retina.
- Culta los explantes retinianas sándwich a 37 °C durante un tiempo de hasta 72 h en una incubadora humidificada al 5% de CO2 en medio preparado en el paso 1.4.2.
- Para inducir cambios similares a la DR, culta explantes retinianas en medio que contenga DMEM-F12 con una combinación de 32,5 mM HG con Cyt, TNF-α (10 ng/mL) e IL-1β (10 ng/mL).
2. Incrustación de parafina de los explantes retinianas sándwich
- Arreglar los explantes retinianas sándwich.
- Sumergir los explantes retinianas sándwich en formalina al 10% durante al menos 24 h.
- Retire la solución de formalina y transfiera los explantes de retina sándwich suavemente a almohadillas de tejido y casetes.
- Remoje los explantes retinianas sándwich en etanol al 70% durante al menos 24 h.
- La retina incrustada en parafina se explanta en bloques.
- Corte los tejidos retinianas incrustados en parafina en secciones de 5 μm de espesor con un microtomo y colópelos en portaobjetos de vidrio. Conservar a temperatura ambiente hasta la toma de imágenes.
- Desparafinar secciones.
- Sumergir las secciones en 70% de xileno durante 5 min.
- Sumergir las secciones en 100% xileno durante 5 min.
- Rehidratar las secciones en etanol al 70% durante 5 min.
- Rehidratar las secciones en etanol al 100% durante 5 min.
- Lave las secciones con agua corriente del grifo durante 10 min.
3. Caracterización mediante H&E, IHC y un ensayo magnético de Luminex
- Protocolo de tinción de H&E
- Desparafinar las secciones mediante el paso 2.2.
- Hidratar las secciones en agua del grifo durante 5 min.
- Manche las secciones en la solución de 2 hematoxilina de Gill durante 5 min.
- Lave bien las secciones con agua corriente del grifo para eliminar el exceso de manchas.
- Diferenciar sumergiendo las secciones dos veces en alcohol ácido al 1%.
- Lave las secciones rápidamente con agua corriente del grifo.
- Se tiñe las secciones de azul sumergiéndo las seis veces en carbonato de litio al 1% (10 mg/ml).
- Lave bien las secciones con agua corriente del grifo durante 5 minutos para eliminar el exceso de manchas azules.
- Sumerja las secciones en 1% de eosina 10 veces.
- Lave las secciones rápidamente bajo el agua del grifo para eliminar el exceso de manchas.
- Deshidrata las secciones sumergiéndolas 10 veces en etanol al 100%. Haga esto dos veces.
- Sumerja las secciones en 70% de xileno 10 veces.
- Sumerja las secciones en 100% xileno 10 veces.
- Montaje con un recubre utilizando el medio de montaje de dibutilftalato poliestireno xileno (DPX).
- Tome imágenes con un microscopio de luz.
- Protocolo de etiquetado IHC'
- Desparafinar las secciones mediante el paso 2.2.
- Coloque los portaobjetos en una solución que contenga un tampón de citrato de sodio de 10 mM con Tween 20 al 0,05% a pH 6,0 y ejecute una recuperación de antígenos en una olla a presión automatizada a 121 °C durante 2 min.
- Lavar las secciones en solución salina tamponada con fosfato (PBS) durante 5 min. Haga esto 3 veces.
- Bloquee las secciones con PBS que contengan 0.1% tritón X-100 y 10% de suero normal de cabra durante 1 h a temperatura ambiente.
- Incubar secciones durante la noche a 4 °C con anticuerpos primarios conjugados con anticuerpos secundarios (Tabla de Materiales).
- Lavar las secciones en PBS durante 5 min. Haga esto 3 veces.
- Teñir núcleos usando 4′,6-diamidino-2-fenilindol (DAPI) durante 2 min.
- Lave y monte las secciones con un reactivo antidesvanección.
- Selle las fundas con esmalte de uñas.
- Tome imágenes con un microscopio de barrido láser confocal.
- Ensayo magnético de Luminex
- Transfiera 75 μL de medios de cada pozo a una placa de fondo de 96 pozos a las 24 y 72 h.
- Analizar el sobrenadante celular para IL-18, IL-6, IL-8 y factor de crecimiento endotelial vascular (VEGF) después de 24 y 72 h utilizando el ensayo de citoquinas Luminex. Siga las instrucciones del fabricante para realizar el ensayo16.
Resultados
La integridad de la retina se conservó en este modelo HORC. La integridad retiniana se conservó en los explantes retinianas sándwich cultivados, pero se perdió en la retina cultivada sin estructuras adyacentes. H&E se llevó a cabo para examinar la integridad estructural de los explantes retiniana sándwich seccionados después de 72 h en cultivo. Los explantes retinianas sándwich mostraron integridad preservada y una estructura de láminas distinta de GCL a ONL con ...
Discusión
HORC es actualmente el modelo clínicamente más traducible en la investigación preclínica de la retina. En comparación con los modelos de cultivo celular in vitro, HORC puede representar mejor la anatomía de la retina humana in situ, a través de la retención de los tipos dinámicos de células retinianas y sus conexiones con las neuronas, las vasculaturas y el entorno extracelular19. En comparación con los modelos animales, los HORC son más ventajosos en el estudio de la fisiopatología y...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a los generosos donantes de tejidos oculares y al equipo del Banco Nacional de Ojos de Nueva Zelanda por su apoyo. Este trabajo fue apoyado financieramente por subvenciones para proyectos del Maurice and Phyllis Paykel Trust y la Auckland Medical Research Foundation (1117015). La dirección de IDR cuenta con el apoyo de la Buchanan Charitable Foundation. La beca de CK es proporcionada por el Fondo de Educación e Investigación de la Asociación de Optometristas de Nueva Zelanda (CC36812) y la beca de HHL es proporcionada por la Fundación Caritativa Buchanan.
Materiales
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
Referencias
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados