È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Caratterizzazione di una nuova tecnica di coltura retinica organotipica umana
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio mira a sviluppare un nuovo modello di coltura retinica organotipica umana (HORC) che impedisce di compromettere l'integrità retinica durante la manipolazione dell'espianto. Ciò si ottiene coltivando la retina con il vitreo sovrastante e il pigmento retinico sottostante epitelio-coroide (RPE-coroide) e sclera.
Abstract
Precedenti modelli di coltura retinica organotipica umana (HORC) hanno utilizzato retine staccate; tuttavia, senza il supporto strutturale conferito dall'epitelio-coroide pigmentato retinico (RPE-coroide) e dalla sclera, l'integrità della retina fragile può essere facilmente compromessa. Lo scopo di questo studio era quello di sviluppare un nuovo modello HORC che contiene la retina, la coroide RPE e la sclera per mantenere l'integrità retinica durante la coltura di espianti retinici.
Dopo aver tagliato circonferenzialmente lungo il limbus per rimuovere l'iride e la lente, sono state fatte quattro incisioni profonde per appiattire la oculare. In contrasto con i precedenti protocolli HORC, una trefina è stata utilizzata per tagliare non solo la retina, ma anche la coroide RPE e la sclera. Gli espianti a triplo strato risultanti sono stati coltivati per 72 ore. La colorazione di ematossilina ed eosina (H & E) è stata utilizzata per valutare le strutture anatomiche e gli espianti retinici sono stati ulteriormente caratterizzati dall'immunoistochimica (IHC) per l'apoptosi, l'integrità delle cellule di Müller e l'infiammazione della retina. Per confermare la possibilità di induzione della malattia, gli espianti sono stati esposti a glucosio alto (HG) e citochine pro-infiammatorie (Cyt), per imitare la retinopatia diabetica (DR). Il test delle perle magnetiche Luminex è stato utilizzato per misurare le citochine correlate al DR rilasciate nel terreno di coltura.
La colorazione H&E ha rivelato lamelle retiniche distinte e nuclei compatti negli espianti retinici con la coroide RPE e la sclera sottostanti, mentre le retine senza le strutture sottostanti hanno mostrato uno spessore ridotto e una grave perdita di nuclei. I risultati dell'IHC hanno indicato l'assenza di apoptosi e infiammazione retinica, nonché l'integrità delle cellule di Müller preservata. I saggi Luminex hanno mostrato un aumento significativo della secrezione di citochine pro-infiammatorie associate a DR in espianti retinici esposti a HG + Cyt rispetto ai livelli basali a 24 ore.
Abbiamo sviluppato e caratterizzato con successo un nuovo protocollo HORC in cui l'integrità retinica è stata preservata senza apoptosi o infiammazione retinica. Inoltre, la secrezione indotta di biomarcatori pro-infiammatori associati a DR quando espone espianti retinici a HG + Cyt suggerisce che questo modello potrebbe essere utilizzato per studi clinicamente traducibili sulle malattie retiniche.
Introduzione
La retina è una struttura oculare altamente specializzata responsabile della trasformazione dell'energia luminosa in entrata in segnali elettrici, che vengono poi elaborati dal cervello per la percezione visiva. La retina umana contiene una gamma dinamica di tipi cellulari, altamente organizzati in un'unica struttura lamellare costituita da due strati sinaptici e tre nuclei1 (Figura 1). L'omeostasi retinica è sostenuta dalle intricate connessioni tra cellule neuroretiniche, vasi sanguigni, nervi, tessuti connettivi e RPE1. A causa della sofisticata anatomia e fisiologia retinica, i meccanismi di molte malattie della retina rimangono ancora poco compresi2,3,4,5. Per studiare meglio le malattie della retina, sono stati sviluppati modelli HORC6,7,8,9. Rispetto agli studi sugli animali e alle colture in vitro, i modelli HORC sono vantaggiosi perché mantengono l'ambiente cellulare dinamico e le complesse interazioni neurovascolari in situ, fornendo un buon modello per la traduzione clinica.
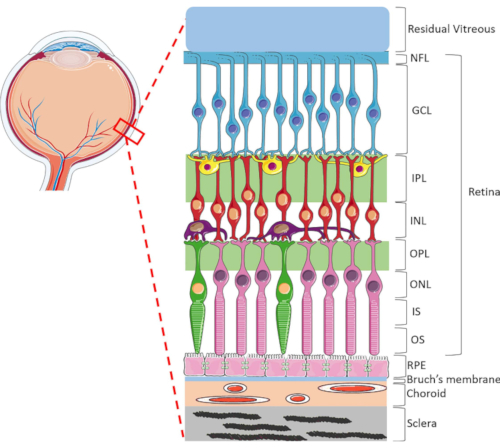
Figura 1: Strutture oculari posteriori dell'occhio umano. Da anteriore a posteriore, gli strati retinici sono: strato di fibre nervose (NFL), strato di cellule gangliari (GCL), strato plessiforme interno (IPL), strato nucleare interno (INL), strato plessiforme esterno (OPL), strato nucleare esterno (ONL), segmento interno del fotorecettore (IS) e strato esterno del fotorecettore (OS). Le cellule all'interno della retina includono cellule gangliari (blu), cellule amacrine (giallo), cellule bipolari (rosse), cellule orizzontali (viola), fotorecettori a bastoncello (rosa) e fotorecettori a cono (verde). Il vitreo si trova anteriormente alla retina. L'RPE, la membrana di Bruch, la coroide e la sclera si trovano posteriormente alla retina. Si noti che l'immagine mostrata è solo una rappresentazione schematica della retina e il rapporto tra cellule e connettività retinica all'interno di ciascuno strato potrebbe non essere indicativo dell'impostazione in vivo. Fare clic qui per visualizzare una versione più grande di questa figura.
I protocolli HORC precedentemente caratterizzati6,7,8,9 hanno comportato la separazione della retina dalla coroide RPE sottostante e dalla sclera utilizzando una trefina chirurgica. Tuttavia, senza il supporto fornito da queste strutture sottostanti, la retina traslucida diventa fragile, difficile da maneggiare e strumenti come la pince possono facilmente interrompere la sua integrità. Inoltre, l'isolamento della retina in coltura senza RPE ha dimostrato di causare apoptosi delle cellule gangliari e degenerazione dei fotorecettori10,11,12. Pertanto, sarebbe utile un protocollo HORC alternativo che riduca al minimo la perdita di integrità retinica e imiti meglio l'ambiente in vivo. Ciò è particolarmente importante quando si studiano i meccanismi della malattia retinica, poiché le lesioni fisiche durante la manipolazione dell'espianto potrebbero introdurre artefatti. Pertanto, lo scopo di questo studio era quello di sviluppare un nuovo modello HORC che includa la coroide RPE e la sclera al fine di proteggere l'integrità retinica durante la manipolazione e la coltura dell'espianto.
Per raggiungere questo obiettivo sono stati estratti espianti retinici "inseriti" tra il vitreo residuo e la sottostante RPE-coroide e sclera. Negli espianti sandwich, il vitreo appesantisce la retina per evitare il distacco e il ripiegamento della retina, mentre la sclera dura e fibrosa funge sia da impalcatura per il supporto strutturale che da punto di contatto per la pinna. Inoltre, modelli animali hanno dimostrato che il mantenimento dell'RPE in coltura può prevenire la degenerazione retinica e la proliferazione gliale, una risposta delle cellule di Müller a segnali di pericolo come ipossia e infiammazione10,11,12.
Per caratterizzare il modello, gli espianti retinici sandwich sono stati colorati con ematossilina ed eosina (H & E) per valutare le strutture anatomiche ed è stata eseguita l'immunoistochimica (IHC), etichettando gli espianti con deossinucleotidiltransferasi terminale dUTP nick end labeling (TUNEL, un marcatore cellulare apoptotico), proteina acida fibrillare gliale (GFAP, un'infiammazione retinica e marcatore di attivazione delle cellule di Müller) e vimentina, un marcatore dell'integrità cellulare di Müller. Per determinare se questo modello può essere indotto a sviluppare segni molecolari di malattia, gli espianti sono stati esposti ad alto livello di glucosio (HG) con citochine pro-infiammatorie (Cyt), interleuchina-1β (IL-1β) e fattore di necrosi tumorale-α (TNF-α), un ambiente di coltura che ha dimostrato di imitare la retinopatia diabetica (DR) in entrambi i modelli di malattia cellulare e animale13,14,15. I saggi Luminex sono stati utilizzati nel modello DR per misurare le citochine rilasciate nel terreno di coltura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
I colliri per donatori umani sono stati ottenuti dalla New Zealand National Eye Bank dopo l'escissione corneale per il trapianto e come approvato dal Northern B Health and Disability Ethics Committee (NTX/06/19/CPD/AM07).
NOTA: La coltura deve essere effettuata in un armadio di biosicurezza di Classe II per garantire condizioni di coltura tissutale sterile. I tessuti devono essere coltivati entro 24 ore post-mortem per evitare una significativa perdita di integrità retinica.

Figura 2: Immagini che mostrano la procedura per la raccolta degli espianti retinici sandwich. Per la preparazione dell'impianto, utilizzare forbici per sezionare con una punta affilata e un'estremità smussata, con l'estremità smussata rivolta verso l'interno del globo per ridurre il danno tissutale durante l'incisione. Utilizzare anche pinna con estremità smussate per evitare di graffiare i tessuti intraoculari durante la manipolazione. Utilizzando le forbici chirurgiche, con l'estremità smussata rivolta verso l'interno, tagliare lungo il limbus per rimuovere l'iride e la lente (A-C). L'ONH può essere localizzato se si guarda direttamente nella oculare aperta (D). Usando una pinz-pinz con punte smussate, tenere la sclera per stabilizzare il globo (E). Dividi il globo verticalmente in due metà facendo due incisioni profonde verso l'ONH ma non tagliare l'ONH. Ripeti questo lungo il meridiano orizzontale (G). Applicare una pinna smussata sulla sclera e aprire delicatamente il globo a forma di trifoglio (H-K). Utilizzare una pinica per manipolare attentamente il vitreo per levigare la retina piegata, poiché il vitreo tira sulla retina, ma non toccare direttamente la retina (I). Rimuovere il vitreo se sta causando il distacco o la piegatura della retina (non mostrato nella Figura 2 poiché il vitreo trasparente non è ben catturato nelle foto). Individuare le aree in cui la retina è piatta ed estrarre gli espianti retinici utilizzando una trefina chirurgica (L). Applicando una pinna alla sclera, trasferire con cura gli espianti retinici nel terreno di coltura pre-preparato (M,N). L'intero espianto sandwich dovrebbe affondare sul fondo del pozzo a causa del suo peso, quindi ogni espianto viene immerso nel mezzo (O). Fare clic qui per visualizzare una versione più grande di questa figura.
1. Estrazione degli espianti retinici sandwich dalla oculare
- Rimuovere l'iride e la lente.
- Posizionare il oculare all'interno di una capsula di Petri, con l'iride e la lente rivolte verso l'alto e la testa del nervo ottico (ONH) che contatta la capsula di Petri (Figura 2A).
- Tenere la coppa dell'occhio ferma al limbus usando una pinna (Figura 2B).
- Staccare l'iride e la lente effettuando piccoli tagli circonferenzialmente lungo il bordo esterno del limbus (Figura 2A).
- Rimuovere l'iride e la lente con attenzione. Evitare di disturbare la retina durante la manipolazione (Figura 2C).
NOTA: La lente non cadrà nella coppa dell'occhio in quanto è attaccata, tramite fibre zonule, al corpo ciliare.
- Appiattire la coppa oculare.
- Con la coppa dell'occhio ancora seduta in posizione verticale, identifica l'ONH. Questo è più facile con una sorgente di luce bianca brillante (Figura 2D).
- Incise in piedi ai quattro quadranti verso l'ONH (Figura 2E). La capsula di Petri può essere ruotata per una più facile manipolazione. NON tagliare l'ONH.
- Stendere e appiattire accuratamente il bulbo oculare (Figura 2E).
- Applicare la pinna sulla sclera invece che sulla retina per evitare di interrompere l'integrità retinica.
NOTA: Il distacco e il ripiegamento della retina periferica sono inevitabili, poiché il peso del vitreo traboccante attirerà la retina. In queste aree, rimuovere il vitreo per evitare ulteriori ripiegamento della retina. Ricordarsi di lasciare il vitreo residuo per stabilizzare la retina sopra la coroide RPE e la sclera.
- Raccogli gli espianti retinici sandwich.
- Posizionare una trefina chirurgica sulla retina in una regione senza pieghe retiniche (Figura 2F).
- Premere forte per penetrare la sclera, che dovrebbe generare un suono di cracking.
- Ruotare la trefina di 180° per assicurarsi che la sclera sia stata penetrata completamente in modo tale che l'espianto retinico sia ora separato dal tessuto rimanente.
- Applicare la pinna alla sclera e trasferire l'espianto retinico sandwich sul terreno di coltura (Figura 2G-I).
- Ottenere 2-3 espianti retinici sandwich dalla retina periferica di ciascun quadrante.
NOTA: L'espianto retinico sandwich a volte può essere intrappolato nell'apertura della trefina. Usando la pinpetta, stuzzicare delicatamente una piccola sezione della base della sclera. Ciò si verifica più spesso quando la lama è smussata e può causare la perdita della retina (Figura 3A-C). - Utilizzare una nuova trefina dopo aver tagliato 1-2 espianti retinici poiché la lama diventa facilmente smussata (Figura 3C
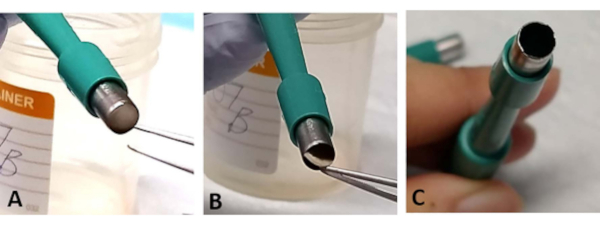
Figura 3: Risoluzione dei problemi. Durante il processo di estrazione, l'espianto retinico può essere intrappolato all'apertura della trefina chirurgica (A). Stuzzicare delicatamente il tessuto dalla base della sclera senza toccare la retina (B). Questo può accadere più spesso se la trefina chirurgica viene utilizzata per estrarre più di due piante retiniche, poiché la lama può facilmente diventare smussata (C). Fare clic qui per visualizzare una versione più grande di questa figura.
- Cultura degli espianti retinici.
- Preparare il terreno di coltura contenente la miscela di nutrienti Modified Eagle Medium F-12 (DMEM-F12) di Dulbecco e una miscela 1x di antibiotici e antimicotici (AA, 100x stock).
- Prima dell'estrazione dell'espianto, posizionare 500 μL di terreno nei pozzetti di una piastra a 24 pozzetti ed equilibrare nell'incubatore. Questo è importante in quanto l'aggiunta del mezzo in seguito può rimuovere la retina.
- Coltura degli espianti retinici sandwich a 37 °C per un massimo di 72 ore in un incubatore umidificato al 5% di CO2 in mezzo preparato nella fase 1.4.2.
- Per indurre cambiamenti simili a DR, la coltura di espianti retinici in mezzo contenente DMEM-F12 con una combinazione di 32,5 mM HG con Cyt, TNF-α (10 ng / mL) e IL-1β (10 ng / mL).
2. Incorporazione di paraffina degli espianti retinici sandwich
- Fissare gli espianti retinici sandwich.
- Immergere gli espianti retinici sandwich in formalina al 10% per almeno 24 ore.
- Rimuovere la soluzione di formalina e trasferire delicatamente gli espianti retinici sandwich in cuscinetti e cassette di tessuto.
- Immergere gli espianti retinici sandwich in etanolo al 70% per almeno 24 ore.
- Paraffina-incorporare espianti retinici in blocchi.
- Tagliare i tessuti retinici incorporati nella paraffina in sezioni spesse 5 μm usando un microtomo e montarlo su vetrini. Conservare a temperatura ambiente fino all'imaging.
- Deparaffinizzare le sezioni.
- Immergere le sezioni in 70% xilene per 5 min.
- Immergere le sezioni in 100% xilene per 5 min.
- Reidratare le sezioni in etanolo al 70% per 5 min.
- Reidratare le sezioni in etanolo al 100% per 5 min.
- Lavare le sezioni sotto l'acqua corrente del rubinetto per 10 minuti.
3. Caratterizzazione mediante H&E, IHC e un saggio magnetico Luminex
- Protocollo di colorazione H&E
- Deparaffinizzare le sezioni utilizzando il passaggio 2.2.
- Idratare le sezioni in acqua di rubinetto per 5 min.
- Macchiare le sezioni nella soluzione di 2 ematossilina di Gill per 5 minuti.
- Lavare accuratamente le sezioni sotto l'acqua corrente del rubinetto per rimuovere le macchie in eccesso.
- Differenziare immergendo le sezioni due volte in alcool acido all'1%.
- Lavare rapidamente le sezioni sotto l'acqua corrente del rubinetto.
- Colorare le sezioni di blu immergendo sei volte in carbonato di litio all'1% (10 mg / mL).
- Lavare accuratamente le sezioni sotto l'acqua corrente del rubinetto per 5 minuti per rimuovere la macchia blu in eccesso.
- Immergere le sezioni in 1% eosina 10 volte.
- Lavare rapidamente le sezioni sotto l'acqua del rubinetto per rimuovere le macchie in eccesso.
- Disidratare le sezioni immergendole 10 volte in etanolo al 100%. Fallo due volte.
- Immergere le sezioni in 70% di xilene 10 volte.
- Immergere le sezioni in 100% xilene 10 volte.
- Montare con un coperchio utilizzando il mezzo di montaggio in polistirene xilene dibutilftalato (DPX).
- Scatta immagini usando un microscopio ottico.
- Protocollo di etichettatura IHC»
- Deparaffinizzare le sezioni utilizzando il passaggio 2.2.
- Posizionare i vetrini in una soluzione contenente tampone di citrato di sodio da 10 mM con 0,05% Tween 20 a pH 6,0 ed eseguire un prelievo di antigene in una pentola a pressione automatizzata a 121 °C per 2 minuti.
- Lavare le sezioni in soluzione salina tamponata con fosfato (PBS) per 5 min. Fallo 3 volte.
- Bloccare le sezioni con PBS contenente lo 0,1% di Triton X-100 e il 10% di siero di capra normale per 1 ora a temperatura ambiente.
- Incubare sezioni durante la notte a 4 °C con anticorpi primari coniugati ad anticorpi secondari (Tabella dei materiali).
- Lavare le sezioni in PBS per 5 min. Fallo 3 volte.
- Nuclei di colorazione con 4′,6-diamidino-2-fenilindolo (DAPI) per 2 min.
- Lavare e montare le sezioni utilizzando un reagente anti-dissolvenza.
- Sigillare le coperture con lo smalto per unghie.
- Scatta immagini usando un microscopio a scansione laser confocale.
- Saggio magnetico Luminex
- Trasferire 75 μL di mezzi da ciascun pozzetti a una piastra a 96 pozzetti u-bottom a 24 e 72 ore.
- Analizzare il surnatante cellulare per IL-18, IL-6, IL-8 e il fattore di crescita endoteliale vascolare (VEGF) dopo 24 e 72 ore utilizzando il test delle citochine Luminex. Seguire le istruzioni del produttore per eseguire il test16.
Access restricted. Please log in or start a trial to view this content.
Risultati
L'integrità retinica è stata preservata in questo modello HORC. L'integrità retinica è stata preservata negli espianti retinici sandwich coltivati, ma è stata persa nella retina coltivata senza strutture adiacenti. H&E è stato condotto per esaminare l'integrità strutturale degli espianti retinici a sandwich sezionati dopo 72 ore di coltura. Gli espianti retinici sandwich hanno mostrato integrità preservata e una struttura lamellare distinta da GCL a ONL con nucle...
Access restricted. Please log in or start a trial to view this content.
Discussione
HORC è attualmente il modello clinicamente più traducibile nella ricerca preclinica retinica. Rispetto ai modelli di coltura cellulare in vitro, HORC può rappresentare meglio l'anatomia della retina umana in situ, attraverso il mantenimento dei tipi di cellule retiniche dinamiche e delle loro connessioni con neuroni, vascolari e ambiente extracellulare19. Rispetto ai modelli animali, gli HORC sono più vantaggiosi nello studio della fisiopatologia e nella progettazione di trattamenti farmaceuti...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare i generosi donatori di tessuti oculari e il team della New Zealand National Eye Bank per il loro sostegno. Questo lavoro è stato sostenuto finanziariamente da sovvenzioni di progetto del Maurice and Phyllis Paykel Trust e della Auckland Medical Research Foundation (1117015). La direzione di IDR è sostenuta dalla Buchanan Charitable Foundation. La borsa di studio di CK è fornita dal New Zealand Association of Optometrists Education and Research Fund (CC36812) e la borsa di studio di HHL è fornita dalla Buchanan Charitable Foundation.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
Riferimenti
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , Internet (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -H., Jiang, L. -Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156(2018).
- R&D Systems, I. , Available from: https://www.rndsystems.com/protocol-types/luminex (2020).
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon