Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Charakterisierung einer neuartigen humanen organotypischen Netzhautkulturtechnik
In diesem Artikel
Zusammenfassung
Diese Studie zielt darauf ab, ein neuartiges humanes organotypisches Netzhautkulturmodell (HORC) zu entwickeln, das eine Beeinträchtigung der Netzhautintegrität während der Behandlung mit Explanten verhindert. Dies wird erreicht, indem die Netzhaut mit dem darüber liegenden Glaskörper und dem darunter liegenden retinalen Pigmentepithel-Choroid (RPE-Choroid) und Sklera kultiviert wird.
Zusammenfassung
Frühere humane organotypische Netzhautkulturmodelle (HORC) haben abgelöste Netzhäute verwendet; Ohne die strukturelle Unterstützung durch retinales Pigmentepithel-Aderoid (RPE-Aderoid) und Sklera kann die Integrität der fragilen Netzhaut jedoch leicht beeinträchtigt werden. Ziel dieser Studie war es, ein neuartiges HORC-Modell zu entwickeln, das netzhaut-, RPE-Aderoid und Sklera enthält, um die Integrität der Netzhaut bei der Kultivierung von Netzhautentpflanzungen aufrechtzuerhalten.
Nach dem umlaufenden Schnitt entlang des Limbus, um Iris und Linse zu entfernen, wurden vier tiefe Schnitte gemacht, um die Augenmuschel abzuflachen. Im Gegensatz zu früheren HORC-Protokollen wurde ein Trephin verwendet, um nicht nur die Netzhaut, sondern auch die RPE-Aderhaut und Sklera zu durchschneiden. Die resultierenden dreischichtigen Explanten wurden 72 h lang kultiviert. Hämatoxylin- und Eosinfärbung (H & E) wurde zur Beurteilung anatomischer Strukturen verwendet und Retinaxplanten wurden weiter durch Immunhistochemie (IHC) für Apoptose, Müller-Zellintegrität und Netzhautentzündung charakterisiert. Um die Möglichkeit einer Krankheitsinduktion zu bestätigen, wurden Explanten hoher Glukose (HG) und entzündungsfördernden Zytokinen (Cyt) ausgesetzt, um die diabetische Retinopathie (DR) nachzuahmen. Der Luminex Magnetic Bead Assay wurde verwendet, um DR-verwandte Zytokine zu messen, die in das Kulturmedium freigesetzt wurden.
Die H & E-Färbung zeigte deutliche Netzhautlamellen und kompakte Kerne in netztinalen Explanten mit der darunter liegenden RPE-Aderhaut und Sklera, während Netzhäute ohne die zugrunde liegenden Strukturen eine reduzierte Dicke und einen starken Kernverlust aufwiesen. IHC-Ergebnisse deuteten auf das Fehlen von Apoptose und Netzhautentzündung sowie auf die Erhaltung der Integrität der Müller-Zellen hin. Die Luminex-Assays zeigten eine signifikant erhöhte Sekretion von DR-assoziierten entzündungsfördernden Zytokinen in Retinaxplanten, die HG + Cyt ausgesetzt waren, im Vergleich zu den Ausgangswerten nach 24 h.
Wir haben erfolgreich ein neuartiges HORC-Protokoll entwickelt und charakterisiert, bei dem die Integrität der Netzhaut ohne Apoptose oder Netzhautentzündung erhalten bleibt. Darüber hinaus legt die induzierte Sekretion von DR-assoziierten entzündungsfördernden Biomarkern bei der Exposition von Netzhautentregungen gegenüber HG + Cyt nahe, dass dieses Modell für klinisch übersetzbare Netzhauterkrankungsstudien verwendet werden könnte.
Einleitung
Die Netzhaut ist eine hochspezialisierte Augenstruktur, die dafür verantwortlich ist, einfallende Lichtenergie in elektrische Signale umzuwandeln, die dann vom Gehirn zur visuellen Wahrnehmung verarbeitet werden. Die menschliche Netzhaut enthält einen dynamischen Bereich von Zelltypen, hochorganisiert in einer einzigartigen lamellenförmigen Struktur, die aus zwei synaptischen und drei Kernschichtenbesteht 1 (Abbildung 1). Die retinale Homöostase wird durch die komplizierten Verbindungen zwischen neuroretinalen Zellen, Blutgefäßen, Nerven, Bindegewebe und dem RPE1 aufrechterhalten. Aufgrund der ausgefeilten Netzhautanatomie und Physiologie sind die Mechanismen vieler Netzhauterkrankungen immer noch wenig verstanden2,3,4,5. Um Netzhauterkrankungen besser untersuchen zu können, wurden HORC-Modelle entwickelt6,7,8,9. Im Vergleich zu Tierversuchen und In-vitro-Kulturen sind HORC-Modelle von Vorteil, da sie die dynamische zelluläre Umgebung und komplexe neurovaskuläre Interaktionen in situ beibehalten und ein gutes Modell für die klinische Translation bieten.
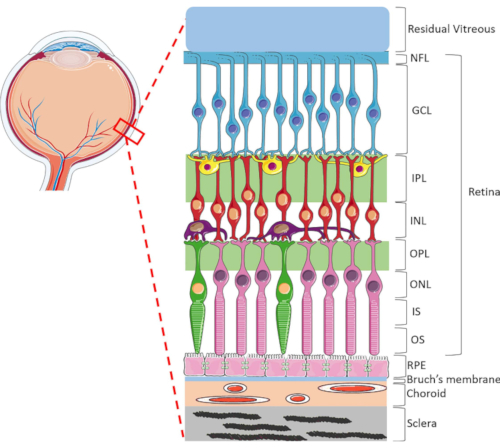
Abbildung 1: Hintere Augenstrukturen des menschlichen Auges. Anterior bis posterior sind die Netzhautschichten: Nervenfaserschicht (NFL), Ganglienzellschicht (GCL), innere plexiforme Schicht (IPL), innere Kernschicht (INL), äußere plexiforme Schicht (OPL), äußere Kernschicht (ONL), Photorezeptor-Innensegment (IS) und Photorezeptor-Außenschicht (OS). Zu den Zellen innerhalb der Netzhaut gehören Ganglienzellen (blau), amakrine Zellen (gelb), bipolare Zellen (rot), horizontale Zellen (violett), Stäbchenphotorezeptoren (rosa) und Zapfenphotorezeptoren (grün). Der Glaskörper befindet sich vor der Netzhaut. RpE, Bruch-Membran, Aderhaut und Sklera befinden sich hinter der Netzhaut. Beachten Sie, dass das gezeigte Bild nur eine schematische Darstellung der Netzhaut ist und das Verhältnis von Zellen / Netzhautkonnektivität innerhalb jeder Schicht möglicherweise nicht auf die In-vivo-Einstellung hinweist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Zuvor charakterisierte HORC-Protokolle6,7,8,9 beinhalteten die Trennung der Netzhaut von der darunter liegenden RPE-Aderhaut und Sklera mit einem chirurgischen Trephin. Ohne die Unterstützung durch diese zugrunde liegenden Strukturen wird die durchscheinende Netzhaut jedoch dünn, schwer zu handhaben und Werkzeuge wie eine Zette können ihre Integrität leicht stören. Darüber hinaus wurde gezeigt, dass die Isolierung der Netzhaut in Kultur ohne RPE Ganglienzellapoptose und Photorezeptordegeneration verursacht10,11,12. Daher wäre ein alternatives HORC-Protokoll nützlich, das den Verlust der Netzhautintegrität minimiert und die In-vivo-Umgebung besser nachahmt. Dies ist besonders wichtig bei der Untersuchung von Mechanismen von Netzhauterkrankungen, da körperliche Verletzungen während des Explant-Handlings Artefakte verursachen können. Ziel dieser Studie war es daher, ein neuartiges HORC-Modell zu entwickeln, das die RPE-Aderhaut und die Sklera umfasst, um die Integrität der Netzhaut während der Explant-Handhabung und -Kultur zu schützen.
Um dieses Ziel zu erreichen, wurden Netzhautexplanten extrahiert, die zwischen dem Restgetres und der darunter liegenden RPE-Aderhaut und Sklera "eingeklemmt" waren. Bei den Sandwich-Explantaten belastet der Glaskörper die Netzhaut, um netzhautablösung und -faltung zu verhindern, während die zähe, faserige Sklera sowohl als Gerüst für die strukturelle Unterstützung als auch als Kontaktpunkt für die Zierzette fungiert. Darüber hinaus haben Tiermodelle gezeigt, dass die Beibehaltung des RPE in Kultur Netzhautdegeneration und Gliavermehrung verhindern kann, eine Reaktion von Müller-Zellen auf Gefahrensignale wie Hypoxie und Entzündung10,11,12.
Zur Charakterisierung des Modells wurden Sandwich-Netzhaut-Explanten mit Hämatoxylin und Eosin (H & E) gefärbt, um anatomische Strukturen zu bewerten, und es wurde eine Immunhistochemie (IHC) durchgeführt, bei der Explanten mit terminaler Desoxynukleotidyltransferase dUTP-Nick-End-Markierung (TUNEL, ein apoptotischer Zellmarker), Gliafibrilläres saures Protein (GFAP, eine Netzhautentzündung und Müller-Zellaktivierungsmarker) und Vimentin, ein Marker für die Integrität von Müller-Zellen, markiert wurden. Um festzustellen, ob dieses Modell zur Entwicklung molekularer Krankheitszeichen veranlasst werden kann, wurden die Explanten hoher Glukose (HG) mit entzündungsfördernden Zytokinen (Cyt), Interleukin-1β (IL-1β) und Tumornekrosefaktor-α (TNF-α) ausgesetzt, einer Kultivierungsumgebung, die nachweislich diabetische Retinopathie (DR) in Zell- und Tierkrankheitsmodellen nachahmt13,14,15. Luminex-Assays wurden im DR-Modell verwendet, um Zytokine zu messen, die in das Kulturmedium freigesetzt wurden.
Protokoll
Menschliche Spenderaugenbecher wurden von der New Zealand National Eye Bank nach Hornhautexzision zur Transplantation erhalten und vom Northern B Health and Disability Ethics Committee (NTX/06/19/CPD/AM07) genehmigt.
HINWEIS: Die Kultur sollte in einer Biosicherheitswerkbank der Klasse II durchgeführt werden, um sterile Gewebekulturbedingungen zu gewährleisten. Das Gewebe muss innerhalb von 24 Stunden post mortem kultiviert werden, um einen signifikanten Verlust der Netzhautintegrität zu vermeiden.

Abbildung 2: Bilder, die das Verfahren zum Sammeln der Sandwich-Netzhaut-Explanten zeigen. Verwenden Sie für die Explantierungsvorbereitung eine Sezierenschne mit einer scharfen Spitze und einem stumpfen Ende, wobei das stumpfe Ende zur Innenseite des Globus zeigt, um Gewebeschäden während des Schnitts zu reduzieren. Verwenden Sie auch eine Zette mit stumpfen Enden, um zu vermeiden, dass das intraokulare Gewebe während der Handhabung zerkratzt wird. Schneiden Sie mit einer chirurgischen Schere, wobei das stumpfe Ende nach innen zeigt, entlang des Limbus, um die Iris und die Linse (A-C )zu entfernen. Der ONH kann lokalisiert werden, wenn man direkt in die geöffnete Augenmuschel schaut (D). Halten Sie mit einer Zette mit stumpfen Spitzen die Sklera, um den Globus zu stabilisieren (E). Teilen Sie den Globus vertikal in zwei Hälften, indem Sie zwei tiefe Einschnitte in Richtung ONH machen, aber schneiden Sie nicht durch den ONH. Wiederholen Sie dies entlang des horizontalen Meridians (G). Tragen Sie eine stumpfe Zette auf die Sklera auf und öffnen Sie die Kugel vorsichtig zu einer Kleeform (H-K). Verwenden Sie eine Zette, um den Glaskörper vorsichtig zu manipulieren, um die gefaltete Netzhaut zu glätten, da der Glaskörper auf die Netzhaut zieht, aber berühren Sie die Netzhaut nicht direkt (I). Entfernen Sie den Glaskörper, wenn er zu netzhautablösungen oder -falten führt (in Abbildung 2 nicht dargestellt, da der transparente Glaskörper auf Fotos nicht gut erfasst ist). Lokalisieren Sie Bereiche, in denen die Netzhaut flach ist, und extrahieren Sie Netzhautexplanten mit einem chirurgischen Trephin (L). Durch Anlegen einer Zette an der Sklera, vorsichtig die Netzhauterregungen in das vorbereitete Kulturmedium (M, N) übertragen. Die gesamte Sandwich-Explant sollte aufgrund ihres Gewichts auf den Boden des Brunnens sinken, daher wird jede Explant in das Medium getaunken (O). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Extraktion der Sandwich-Netzhaut-Explanten aus der Augenmuschel
- Entfernen Sie die Blende und das Objektiv.
- Legen Sie die Augenmuschel in eine Petrischale, wobei die Iris und die Linse nach oben zeigen und der Sehnervenkopf (ONH) die Petrischale kontaktiert(Abbildung 2A).
- Halten Sie die Augenmuschel mit einer Zette am Limbus ruhig (Abbildung 2B).
- Lösen Sie die Iris und die Linse, indem Sie kleine Schnitte umlaufend entlang des äußeren Randes des Limbus machen (Abbildung 2A).
- Entfernen Sie die Iris und die Linse vorsichtig. Vermeiden Sie es, die Netzhaut während der Manipulation zu stören (Abbildung 2C).
HINWEIS: Die Linse fällt nicht in die Augenmuschel, da sie über Zonulefasern am Ziliarkörper befestigt ist.
- Die Augenmuschel abflachen.
- Wenn die Augenmuschel noch aufrecht sitzt, identifizieren Sie die ONH. Dies ist mit einer hellen weißen Lichtquelle einfacher (Abbildung 2D).
- Einschneiden an den vier Quadranten zum ONH hin (Abbildung 2E). Die Petrischale kann zur einfacheren Handhabung gedreht werden. Schneiden Sie den ONH NICHT ab.
- Verteilen und abflachen Sie die Augenmuschel vorsichtig (Abbildung 2E).
- Tragen Sie die Zette auf die Sklera anstelle der Netzhaut auf, um eine Störung der Netzhautintegrität zu vermeiden.
HINWEIS: Periphere Netzhautablösung und -faltung ist unvermeidlich, da das Gewicht des überlaufenden Glaskörpers an der Netzhaut zieht. Entfernen Sie in diesen Bereichen den Glaskörper, um eine weitere Netzhautfaltung zu verhindern. Denken Sie daran, Restgetres zu belassen, um die Netzhaut auf der RPE-Aderhaut und Sklera zu stabilisieren.
- Sammeln Sie Sandwich-Netzhaut-Explanten.
- Legen Sie ein chirurgisches Trephin auf die Netzhaut in einer Region ohne Netzhautfalten (Abbildung 2F).
- Drücken Sie hart, um die Sklera zu durchdringen, die ein knackendes Geräusch erzeugen sollte.
- Drehen Sie das Trephin um 180°, um sicherzustellen, dass die Sklera vollständig durchdrungen ist, so dass die Netzhautentpflanzung nun vom verbleibenden Gewebe getrennt ist.
- Die Zwirzette an der Sklera auftragen und die Sandwich-Netzhaut-Explant aus dem Kulturmedium übertragen (Abbildung 2G-I).
- Erhalten Sie 2-3 Sandwich-Netzhaut-Explanten aus der peripheren Netzhaut jedes Quadranten.
HINWEIS: Die Sandwich-Netzhaut-Explant kann manchmal in der Öffnung des Trephins gefangen sein. Mit einer Zette vorsichtig einen kleinen Teil der Basis der Sklera herausstrecken. Dies tritt häufiger auf, wenn die Klinge stumpf ist und kann zu einem Verlust der Netzhaut führen (Abbildung 3A-C). - Verwenden Sie ein neues Trephin nach dem Ausschneiden von 1-2 Netzhauterbfleisch, da die Klinge leicht stumpf wird(Abbildung 3C
Abbildung 3:Problembehandlung. Während des Extraktionsprozesses kann die Netzhautentnahme an der Öffnung des chirurgischen Trephins eingeschlossen werden (A). Necken Sie das Gewebe vorsichtig von der Basis der Sklera heraus, ohne die Netzhaut zu berühren (B). Dies kann häufiger passieren, wenn das chirurgische Trephin zur Extraktion von mehr als zwei Netzhautexplanten verwendet wird, da die Klinge leicht stumpf werden kann (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Kultur die Netzhaut Explanten.
- Bereiten Sie das Kulturmedium vor, das Dulbeccos Modified Eagle Medium Nährstoffmischung F-12 (DMEM-F12) und eine 1x Antibiotika- und Antimykotika-Mischung (AA, 100x Brühe) enthält.
- Vor der Explantionsextraktion 500 μL Medium in die Vertiefungen einer 24-Well-Platte geben und im Inkubator ausgleichen. Dies ist wichtig, da das hinzufügen des Mediums danach die Netzhaut verdrängen kann.
- Die Sandwich-Netzhaut explantiert bei 37 °C für bis zu 72 h in einem befeuchteten 5%igen CO2-Inkubator in einem in Schritt 1.4.2 hergestellten Medium.
- Um DR-ähnliche Veränderungen zu induzieren, werden Retinaxplanten in Medium, das DMEM-F12 enthält, mit einer Kombination von 32,5 mM HG mit Cyt, TNF-α (10 ng/ml) und IL-1β (10 ng/ml) kultiviert.
2. Paraffin-Einbettung der Sandwich-Netzhaut-Explanten
- Fixieren Sie die Sandwich-Netzhaut-Explantierungen.
- Tauchen Sie die Sandwich-Netzhaut-Explanten mindestens 24 h in 10% Formalin ein.
- Entfernen Sie die Formalinlösung und übertragen Sie die Sandwich-Netzhaut-Explanten vorsichtig in Gewebepolster und Kassetten.
- Die Sandwich-Netzhaut-Explanten in 70% Ethanol für mindestens 24 h einweichen.
- Paraffin-eingebettete Netzhaut explantiert in Blöcke.
- Schneiden Sie paraffineingebettete Netzhautgewebe mit einem Mikrotom in 5 μm dicke Abschnitte und montieren Sie es auf Glasobjektträgern. Bis zur Bildgebung bei Raumtemperatur lagern.
- Abschnitte entparaffinisieren.
- Tauchen Sie die Abschnitte für 5 min in 70% Xylol.
- Tauchen Sie die Abschnitte für 5 min in 100% Xylol.
- Rehydrieren Sie die Abschnitte in 70% Ethanol für 5 min.
- Rehydrieren Sie die Abschnitte in 100% Ethanol für 5 min.
- Waschen Sie die Abschnitte unter fließendem Leitungswasser für 10 min.
3. Charakterisierung mit H&E, IHC und einem Magnetic Luminex Assay
- H&E Färbeprotokoll
- Entparaffinisieren Sie die Abschnitte mit Schritt 2.2.
- Die Abschnitte 5 min im Leitungswasser hydratisieren.
- Die Abschnitte in Gill's 2 Hämatoxylinlösung für 5 min einfärben.
- Waschen Sie die Abschnitte gründlich unter fließendem Leitungswasser, um überschüssige Flecken zu entfernen.
- Differenzieren Sie, indem Sie die Abschnitte zweimal in 1% sauren Alkohol tauchen.
- Waschen Sie die Abschnitte schnell unter fließendem Leitungswasser.
- Färben Sie die Abschnitte blau, indem Sie sechsmal in 1% Lithiumcarbonat (10 mg / ml) eintauchen.
- Waschen Sie die Abschnitte gründlich unter fließendem Leitungswasser für 5 Minuten, um überschüssige blaue Flecken zu entfernen.
- Tauchen Sie die Abschnitte 10 Mal in 1% Eosin.
- Waschen Sie die Abschnitte schnell unter Leitungswasser, um überschüssige Flecken zu entfernen.
- Dehydrieren Sie die Abschnitte, indem Sie sie 10-mal in 100% Ethanol tauchen. Tun Sie dies zweimal.
- Tauchen Sie die Abschnitte 10 Mal in 70% Xylol.
- Tauchen Sie die Abschnitte 10 mal in 100% Xylol.
- Montage mit einem Abdeckrlip aus Demmontagemedium Dibutylphthalat-Polystyrol-Xylol (DPX).
- Machen Sie Bilder mit einem Lichtmikroskop.
- IHC-Kennzeichnungsprotokoll"
- Entparaffinisieren Sie die Abschnitte mit Schritt 2.2.
- Die Dias in eine Lösung mit 10 mM Natriumcitratpuffer mit 0,05% Tween 20 bei pH 6,0 geben und 2 min lang einen Antigenabruf in einem Schnellkochtopf automatisiert bei 121 °C durchführen.
- Waschen Sie Abschnitte in phosphatgepufferter Kochsalzlösung (PBS) für 5 min. Tun Sie dies 3 mal.
- Blockieren Sie die Abschnitte mit PBS, das 0,1% Triton X-100 und 10% normales Ziegenserum enthält, für 1 h bei Raumtemperatur.
- Inkubieren Sie Abschnitte über Nacht bei 4 °C mit primären Antikörpern, die mit sekundären Antikörpern konjugiert sind (Materialtabelle).
- Abschnitte in PBS für 5 min waschen. Tun Sie dies 3 mal.
- Färben Sie Kerne mit 4′,6-Diamidino-2-phenylindol (DAPI) für 2 min.
- Waschen und montieren Sie Abschnitte mit einem Anti-Fade-Reagenz.
- Versiegeln Sie Abdecklippen mit Nagellack.
- Nehmen Sie Bilder mit einem konfokalen Laserscanning-Mikroskop auf.
- Magnetischer Luminex-Assay
- Übertragen Sie 75 μL Medien von jeder Vertiefung auf eine 96-Well-u-Bodenplatte nach 24 und 72 h.
- Analysieren Sie den Zellüberstand auf IL-18, IL-6, IL-8 und den vaskulären endothelialen Wachstumsfaktor (VEGF) nach 24 und 72 h mit dem Luminex-Zytokin-Assay. Befolgen Sie die Anweisungen des Herstellers, um den Assay16durchzuführen.
Ergebnisse
Die Integrität der Netzhaut wurde in diesem HORC-Modell erhalten. Die Integrität der Netzhaut blieb in den kultivierten Sandwich-Netzhaut-Explantierungen erhalten, ging aber in der Netzhaut verloren, die ohne benachbarte Strukturen kultiviert wurde. H & E wurde durchgeführt, um die strukturelle Integrität von schnitten Sandwich-Netzhaut-Explanten nach 72 h in Kultur zu untersuchen. Die Sandwich-Netzhaut-Explantierungen zeigten eine erhaltene Integrität und eine ausg...
Diskussion
HORC ist derzeit das klinisch am besten übersetzbare Modell in der präklinischen Netzhautforschung. Im Vergleich zu In-vitro-Zellkulturmodellen kann HORC die Anatomie der menschlichen Netzhaut in situ besser darstellen, indem die dynamischen Netzhautzelltypen und ihre Verbindungen mit Neuronen, Vaskulaturen und der extrazellulären Umgebung erhalten bleiben19. Im Vergleich zu Tiermodellen sind HORC vorteilhafter bei der Untersuchung der Pathophysiologie und der Gestaltung pharmazeutischer Behand...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Die Autoren danken den großzügigen Spendern von Augengewebe und dem Team der New Zealand National Eye Bank für ihre Unterstützung. Diese Arbeit wurde durch Projektzuschüsse des Maurice and Phyllis Paykel Trust und der Auckland Medical Research Foundation (1117015) finanziell unterstützt. Die Leitung von IDR wird von der Buchanan Charitable Foundation unterstützt. Das Stipendium von CK wird vom New Zealand Association of Optometrists Education and Research Fund (CC36812) und das Stipendium der HHL von der Buchanan Charitable Foundation bereitgestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
Referenzen
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten