Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yeni bir İnsan Organotipik Retina Kültürü Tekniğinin Karakterizasyonu
Bu Makalede
Özet
Bu çalışma, eksplant kullanımı sırasında retina bütünlüğünü tehlikeye atmayı önleyen yeni bir insan organotipik retina kültürü (HORC) modeli geliştirmeyi amaçlamaktadır. Bu, retinanın aşırı vitreus ve alttaki retina pigment epitel-koroid (RPE-choroid) ve sklera ile kültleşmesi ile elde edilir.
Özet
Önceki insan organotipik retina kültürü (HORC) modelleri müstakil retinalar kullanmıştır; bununla birlikte, retina pigment epitel-koroid (RPE-choroid) ve sklera tarafından verilen yapısal destek olmadan, kırılgan retinanın bütünlüğü kolayca tehlikeye atılabilir. Bu çalışmanın amacı retina eksplantlarını kültlürken retina bütünlüğünü korumak için retina, RPE-koroid ve sklera içeren yeni bir HORC modeli geliştirmekti.
İris ve lensi çıkarmak için limbüs boyunca çevresel olarak kesildikten sonra, göz kapağını düzleştirmek için dört derin kesi yapıldı. Önceki HORC protokollerinin aksine, sadece retinayı değil, RPE-koroid ve sklerayı da kesmek için bir trefin kullanıldı. Ortaya çıkan üç katmanlı eksplantlar 72 saat boyunca kültürlendi. Anatomik yapıları değerlendirmek için hematoksilin ve Eozin lekeleme (H&E) kullanıldı ve retina eksplantları apoptoz, Müller hücre bütünlüğü ve retina iltihabı için immünhistokimya (IHC) ile karakterize edildi. Hastalık indüksiyon olasılığını doğrulamak için eksplantlar diyabetik retinopatiyi (DR) taklit etmek için yüksek glikoz (HG) ve pro-enflamatuar sitokinlere (Cyt) maruz kaldı. Luminex manyetik boncuk tahlili, kültür ortamına salınan DR ile ilişkili sitokinleri ölçmek için kullanıldı.
H&E lekeleme, alttaki RPE-choroid ve sklera ile retina eksplantlarında belirgin retinal lamel ve kompakt çekirdekler ortaya çıkarırken, alttaki yapılar olmayan retinalarda daha az kalınlık ve ciddi çekirdek kaybı gözlendi. IHC sonuçları apoptoz ve retina iltihabının yanı sıra korunmuş Müller hücre bütünlüğünün olmadığını gösterdi. Luminex tahlilleri, HG + Cyt'e maruz kalan retina eksplantlarında DR ile ilişkili pro-enflamatuar sitokinlerin 24 saat taban çizgisi seviyelerine göre salgılarının önemli ölçüde arttığını göstermiştir.
Retina bütünlüğünün apoptoz veya retina iltihabı olmadan korunduğu yeni bir HORC protokolünü başarıyla geliştirdik ve karakterize ettik. Ayrıca, retina eksplantlarını HG + Cyt'e maruz açıklarken DR ile ilişkili pro-enflamatuar biyobelirteçlerin indüklenmiş salgılanması, bu modelin klinik olarak çevrilebilir retina hastalığı çalışmaları için kullanılabileceğini göstermektedir.
Giriş
Retina, gelen ışık enerjisini elektrik sinyallerine dönüştürmekten sorumlu son derece özel bir oküler yapıdır ve daha sonra beyin tarafından görsel algı için işlenir. İnsan retinası, iki sinaptik ve üç çekirdek katmanı1 'den(Şekil 1)oluşan benzersiz bir lameller yapıda son derece düzenlenmiş dinamik bir hücre tipi yelpazesi içerir. Retina homeostazı nöroretinal hücreler, kan damarları, sinirler, bağ dokuları ve RPE1arasındaki karmaşık bağlantılar tarafından sürdürülür. Sofistike retina anatomisi ve fizyolojisi nedeniyle, birçok retina hastalığının mekanizmaları hala iyi anlaşılmamıştır2,3,4,5. Retina hastalıklarını daha iyi incelemek için HORC modellerigeliştirilmiştir 6,7,8,9. Hayvan çalışmaları ve in vitro kültürlerle karşılaştırıldığında, HORC modelleri dinamik hücresel ortamı ve karmaşık nörovasküler etkileşimleri yerinde tuttukları için avantajlıdır ve klinik çeviri için iyi bir model sağlar.
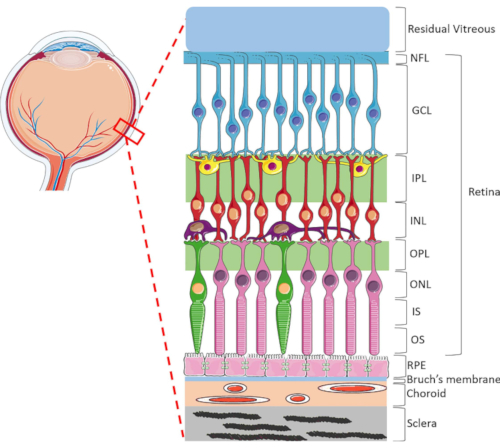
Şekil 1: İnsan gözünün arka oküler yapıları. Ön ve arka, retina katmanları şunlardır: sinir lifi tabakası (NFL), ganglion hücre tabakası (GCL), iç pleksiform tabaka (IPL), iç nükleer tabaka (INL), dış pleksiform tabaka (OPL), dış nükleer katman (ONL), fotoreceptör iç segmenti (IS) ve fotoreceptör dış katmanı (OS). Retina içindeki hücreler ganglion hücreleri (mavi), amakrin hücreler (sarı), bipolar hücreler (kırmızı), yatay hücreler (mor), çubuk fotoreceptörler (pembe) ve koni fotoreceptörlerini (yeşil) içerir. Vitreus retinanın ön kısmında bulunur. RPE, Bruch'un zarı, koroid ve sklera retinanın arka kısmında bulunur. Gösterilen görüntünün retinanın sadece şematik bir gösterimi olduğunu ve her katmandaki hücre/retina bağlantı oranının in vivo ayarının göstergesi olmayabileceğini unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha önce karakterize horc protokolleri6,7,8,9 cerrahi trefin kullanarak retina alttaki RPE-choroid ve sklera ayırmayı içermiştir. Bununla birlikte, bu alttaki yapıların sağladığı destek olmadan, yarı saydam retina zayıflar, kullanımı zorlaşır ve asalet gibi araçlar bütünlüğünü kolayca bozabilir. Ayrıca, RPE olmadan kültürde retina izole ederek ganglion hücre apoptoz ve fotoreceptör dejenerasyonu10,11,12neden olduğu gösterilmiştir. Bu nedenle, retina bütünlüğü kaybını en aza indiren ve in vivo ortamı daha iyi taklit eden alternatif bir HORC protokolü yararlı olacaktır. Bu özellikle retina hastalığı mekanizmalarını incelerken önemlidir, çünkü eksplant kullanımı sırasında fiziksel yaralanma eserlere neden olabilir. Bu nedenle, bu çalışmanın amacı, explant kullanımı ve kültürü sırasında retina bütünlüğünü korumak için RPE-koroid ve sklera içeren yeni bir HORC modeli geliştirmekti.
Bu amaca ulaşmak için, artık vitreus ile alttaki RPE-choroid ve sklera arasında "sandviçlenmiş" retina eksplantları çıkarıldı. Sandviç eksplantlarında, vitreus retina dekolmanını ve katlanmasını önlemek için retinayı tartarken, sert, lifli sklera hem yapısal destek için bir iskele hem de forseps için bir temas noktası görevi görür. Dahası, hayvan modelleri, RPE'yi kültürde tutmanın retina dejenerasyonu ve glial çoğalmasını önleyebileceğini göstermiştir, Müller hücrelerinin hipoksi ve iltihaplanma gibi tehlike sinyallerine bir yanıtı10,11,12.
Modeli karakterize etmek için, sandviç retina eksplantları anatomik yapıları değerlendirmek için Hematoksilin ve Eosin (H&E) ile boyandı ve immünhistokimya (IHC) yapıldı, eksplantların terminal deoksinükleotidil transferaz dUTP nick uç etiketlemesi (TUNEL, apoptotik hücre belirteci), glial fibril asidik protein (GFAP, retina iltihabı ve Müller hücre aktivasyon belirteci) ve Müller hücre bütünlüğünün bir belirteci olan vimentin ile etiketleme. Bu modelin moleküler hastalık belirtileri geliştirmek için indüklenip indüklenemeyeceği, eksplantlar, hem hücre hem de hayvan hastalıkları modellerinde diyabetik retinopatiyi (DR) taklit ettiği gösterilen kült bir ortam olan pro-enflamatuar sitokinler (Cyt), interlökin-1β (IL-1β) ve tümör nekroz faktör α (TNF-α) ile yüksek glikoz(HG)maruzkaldı. Luminex tahlilleri, DR modelinde kültür ortamına salınan sitokinleri ölçmek için kullanılmıştır.
Protokol
İnsan donör göz kapları, nakil için kornea eksizyonunu takiben ve Kuzey B Sağlık ve Engellilik Etik Komitesi (NTX/06/19/CPD/AM07) tarafından onaylandığı şekilde Yeni Zelanda Ulusal Göz Bankası'ndan elde edildi.
NOT: Steril doku kültürü koşullarını sağlamak için kültür sınıf II biyogüvenlik kabininde yapılmalıdır. Önemli retina bütünlüğü kaybını önlemek için dokular 24 saat içinde kültürlenmelidir.

Şekil 2: Sandviç retina eksplantlarının toplanması prosedürünü gösteren görüntüler. Eksplant hazırlama için, kesi sırasında doku hasarını azaltmak için künt ucu dünyanın içine bakacak şekilde keskin bir ucu ve bir künt ucu olan diseksiyon makası kullanın. Ayrıca, elleçleme sırasında göz içi dokularının çizilmesini önlemek için künt uçlu tokmaklar kullanın. Cerrahi makas kullanarak, künt ucu içe bakacak şekilde, iris ve lensi(A-C)çıkarmak için limbüs boyunca kesin. ONH, doğrudan açılan göz kapağına(D)bakıyorsa bulunabilir. Künt uçlu tostu kullanarak, dünyayı stabilize etmek için sklerayı tutun (E). ONH'ye doğru iki derin kesi yaparak küreyi dikey olarak ikiye bölün, ancak ONH'yi kesmeyin. Bunu yatay meridyen (G) boyunca tekrarlayın. Skleraya künt tokalar uygulayın ve küreyi hafifçe yonca şekline(H-K)açın. Vitreus retinaya çekiştirdiği için katlanmış retinayı yumuşatmak için vitreusu dikkatlice manipüle etmek için asalar kullanın, ancak doğrudan retinaya dokunmayın(I). Retina dekolmanı veya katlanmasına neden oluyorsa vitreus'i çıkarın (şeffaf vitreus fotoğraflarda iyi yakalanmadığı için Şekil 2'de gösterilmez). Retinanın düz olduğu bölgeleri bulun ve cerrahi trefin(L)kullanarak retina eksplantlarını çıkarın. Sklerada kümes apsesi uygulamak, retina eksplantlarını önceden hazırlanmış kültür ortamına(M,N)dikkatlice aktarın. Tüm sandviç eksplant ağırlığı nedeniyle kuyunun dibine batmalıdır, bu nedenle her eksplant orta (O)batırılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Sandviç retina eksplantlarının göz kapağından çıkarılması
- İris ve lensi çıkarın.
- Göz kabını bir Petri kabının içine, iris ve lens yukarı bakacak şekilde ve optik sinir kafası (ONH) Petri kabına temas edecek şekilde yerleştirin (Şekil 2A).
- Göz kabını asalar kullanarak limbusta sabit tutun (Şekil 2B).
- Limbüsün dış kenarı boyunca çevresel olarak küçük kesikler yaparak iris ve lensi ayırın (Şekil 2A).
- İris ve lensi dikkatlice çıkarın. Manipülasyon sırasında retinayı rahatsız etmekten kaçının (Şekil 2C).
NOT: Lens, zonule lifleri aracılığıyla siliary vücuda tutturulurken göz kabına düşmez.
- Göz kabını düzleştirin.
- Göz kabı hala dik dururken, ONH'yi tanımlayın. Parlak beyaz ışık kaynağı ile bu daha kolaydır(Şekil 2D).
- Dört kadranda ONH'ye doğru inzivaya al (Şekil 2E). Petri kabı daha kolay kullanım için döndürülebilir. ONH'yü KESMEYİn.
- Göz kabını dikkatlice yayın ve düzleştirin (Şekil 2E).
- Retina bütünlüğünü bozmamak için tokmakları retina yerine skleraya uygulayın.
NOT: Periferik retina dekolmanı ve katlanması kaçınılmazdır, çünkü taşan vitreus ağırlığı retinayı çeker. Bu bölgelerde, daha fazla retina katlanmasını önlemek için vitreus'i çıkarın. Retinayı RPE-koroid ve skleranın üzerine stabilize etmek için artık vitreus bırakmayı unutmayın.
- Sandviç retina eksplantları toplayın.
- Retina kıvrımları olmayan bir bölgede retinaya cerrahi bir trefin yerleştirin(Şekil 2F).
- Çatlama sesi üretmesi gereken skleraya nüfuz etmek için sert bastırın.
- Skleranın tam olarak nüfuz etmesini sağlamak için trephine'i 180 ° bükün, böyle şekilde retina eksplantı artık kalan dokudan ayrılır.
- Skleradaki tokmakları uygulayın ve sandviç retina eksplantını kültür ortamına aktarın (Şekil 2G-I).
- Her çeyreğin periferik retinasından 2-3 sandviç retina eksplant elde edin.
NOT: Sandviç retina eksplant bazen trefin açıklığında sıkışmış olabilir. Tokmalar kullanarak, sklera tabanının küçük bir bölümünü hafifçe alay edin. Bu, bıçak köreldiğinde daha sık ortaya çıkar ve retina kaybına neden olabilir(Şekil 3A-C). - Bıçak kolayca köreldikçe 1-2 retina eksplantını kestikten sonra yeni bir trefin kullanın(Şekil 3C
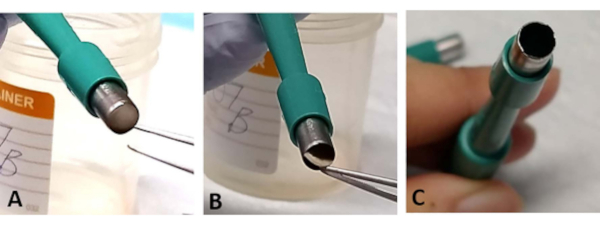
Şekil 3: Sorun giderme. Ekstraksiyon işlemi sırasında, retina eksplantı cerrahi trefin(A)açılışında sıkışmış olabilir. Retinaya (B)dokunmadan sklera tabanından dokuyu hafifçe dışarı atın. Bu, cerrahi trefin ikiden fazla retina eksplantını çıkarmak için kullanılırsa daha sık olabilir, çünkü bıçak kolayca körelebilir (C). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Retina eksplantlarını kültüre edin.
- Dulbecco'nun Modifiye Kartal Orta besin karışımı F-12 (DMEM-F12) ve 1x antibiyotik ve antimycotics karışımını (AA, 100x stok) içeren kültür ortamını hazırlayın.
- Eksplant ekstraksiyondan önce, 24 kuyulu bir plakanın kuyularına 500 μL orta yerleştirin ve inkübatöre dengeyi kesin. Bu, daha sonra ortamın eklenmesi retinayı yerinden çıkarabileceği için önemlidir.
- Sandviç retinasının 37 °C'de 72 saate kadar nemlendirilmiş %5 CO2 inkübatörde 1.4.2 adımda hazırlanan ortamda kültüre edilmesi.
- DR benzeri değişikliklere neden olmak için, DMEM-F12 içeren ortamda, Cyt, TNF-α (10 ng/mL) ve IL-1β (10 ng/mL) ile 32,5 mM HG kombinasyonu ile kültür retina eksplantları.
2. Sandviç retina eksplantlarının parafin gömülmesi
- Sandviç retina eksplantlarını düzeltin.
- Sandviç retina eksplantlarını en az 24 saat boyunca% 10 formalin içine daldırın.
- Formalin çözeltisini çıkarın ve sandviç retina eksplantlarını hafifçe doku pedlerine ve kasetlere aktarın.
- Sandviç retina eksplantlarını% 70 etanolde en az 24 saat bekletin.
- Parafin-embed retina dış gezegenleri bloklara.
- Parafin gömülü retina dokularını bir mikrotom kullanarak 5 μm kalınlığında bölümlere kesin ve cam slaytlara monte edin. Görüntülemeye kadar oda sıcaklığında saklayın.
- Bölümleri ayrıştır.
- Bölümleri 5 dakika boyunca% 70 ksilen içine daldırın.
- Bölümleri 5 dakika boyunca% 100 ksilen içine daldırın.
- Bölümleri 5 dakika boyunca% 70 etanolde yeniden sulanın.
- Bölümleri 5 dakika boyunca% 100 etanolde yeniden sulanın.
- Bölümleri akan musluk suyunun altında 10 dakika yıkayın.
3. H&E, IHC ve Manyetik Luminex test kullanılarak karakterizasyon
- H&E boyama protokolü
- 2.2 adımını kullanarak bölümlerin ayrıştırın.
- Musluk suyundaki bölümleri 5 dakika boyunca nemlendirin.
- Gill'in 2 hematoksilin çözeltislerindeki bölümleri 5 dakika boyunca lekelenin.
- Fazla lekeyi gidermek için bölümleri akan musluk suyunun altında iyice yıkayın.
- Bölümleri% 1 asit alkole iki kez batırarak ayırt edin.
- Bölümleri akan musluk suyunun altında hızlı bir şekilde yıkayın.
- %1 lityum karbonat (10 mg/mL) içine altı kez batırarak bölümleri maviye boyayın.
- Fazla mavi lekeyi gidermek için bölümleri akan musluk suyunun altında 5 dakika boyunca iyice yıkayın.
- Bölümleri 10 kez% 1 eosin batırın.
- Fazla lekeyi gidermek için bölümleri musluk suyunun altında hızlı bir şekilde yıkayın.
- Bölümleri% 100 etanol içine 10 kez batırarak susuz bırak. Bunu iki kez yap.
- Bölümleri% 70 ksilen 10 kez batırın.
- Bölümleri% 100 ksilen 10 kez batırın.
- Dibutylphthalate polistiren kstiren xylene (DPX) montaj ortamı kullanarak bir kapakla monte edin.
- Işık mikroskobu kullanarak görüntü alın.
- IHC etiketleme protokolü'
- 2.2 adımını kullanarak bölümlerin ayrıştırın.
- Slaytları pH 6.0'da %0,05 Tween 20 ile 10 mM sodyum sitrat tampon içeren bir çözeltiye yerleştirin ve 2 dakika boyunca 121 °C'de otomatikleştirilmiş bir düdüklü tencerede antijen alımını çalıştırın.
- Bölümleri fosfat tamponlu salin (PBS) içinde 5 dakika yıkayın. Bunu 3 kez yap.
- Oda sıcaklığında 1 saat boyunca %0,1 Triton X-100 ve %10 normal keçi serumu içeren PBS ile bölümleri tıkayın.
- Sekonder antikorlara konjuge primer antikorlarla (Malzeme Tablosu) bölümleri 4 °C'de bir gecede kuluçkaya yatırın.
- Pbs'deki bölümleri 5 dakika yıkayın. Bunu 3 kez yap.
- Leke çekirdeği kullanarak 4′,6-diamidino-2-fenylindole (DAPI) 2 dakika.
- Solmaya karşı bir reaktif kullanarak bölümleri yıkayın ve monte edin.
- Mühür kapakları oje ile.
- Konfokal lazer tarama mikroskobu kullanarak görüntü alın.
- Manyetik Luminex tahlil
- Her kuyudan 75 μL medyayı 24 ve 72 saat'te 96-well-u-bottom plakaya aktarın.
- Luminex sitokin testi kullanarak 24 ve 72 saat sonra IL-18, IL-6, IL-8 ve vasküler endotel büyüme faktörü (VEGF) için hücre süpernatantını analiz edin. Tahlil yapmak için üreticinin talimatlarını izleyin16.
Sonuçlar
Bu HORC modelinde retina bütünlüğü korunmuştur. Retina bütünlüğü kültürlü sandviç retina eksplantlarında korunmuş, ancak bitişik yapılar olmadan kültürlenmiş retinada kaybolmuştur. H&E, kültürde 72 saat sonra kesitli sandviç retina eksplantlarının yapısal bütünlüğünü incelemek için yapılmıştır. Sandviç retina eksplantları, INL ve ONL'de kompakt çekirdeklerle GCL'den ONL'ye korunmuş bütünlük ve belirgin bir lamel yapısı gös...
Tartışmalar
HORC şu anda klinik öncesi retina araştırmalarında klinik olarak en çevrilebilir modeldir. İn vitro hücre kültürü modelleriyle karşılaştırıldığında, HORC, dinamik retina hücre tiplerini ve nöronlar, vaskülürler ve hücre dışı ortamla bağlantılarını koruyarak insan retinasının anatomisini daha iyi temsil edebilir19. Hayvan modellerine kıyasla HORC, farklı retina hücre tiplerinin yanı sıra değişen fotoreceptör yoğunluğu ve oranları gibi türler arası varya...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, destekleri için göz dokularının cömert bağışçılarına ve Yeni Zelanda Ulusal Göz Bankası ekibine teşekkür ediyor. Bu çalışma Maurice ve Phyllis Paykel Trust ve Auckland Tıbbi Araştırma Vakfı'nın (1117015) proje hibeleriyle finansal olarak desteklendi. IDR'nin direktörlüğü Buchanan Hayır Kurumu tarafından desteklenmektedir. CK'nin bursu Yeni Zelanda Optometristler Eğitim ve Araştırma Fonu Derneği (CC36812) tarafından, HHL'nin bursu ise Buchanan Hayır Kurumu tarafından sağlanmaktadır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
Referanslar
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır