Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Характеристика новой техники органотипической культуры сетчатки человека
В этой статье
Резюме
Это исследование направлено на разработку новой модели органотипической культуры сетчатки человека (HORC), которая предотвращает компрометацию целостности сетчатки во время эксплантации. Это достигается путем культивирования сетчатки с шелужащимся стекловидным и нижележащим пигментом сетчатки эпителием-сосудистой оболочкой (RPE-сосудистой оболочкой) и склерами.
Аннотация
Предыдущие модели органотипической культуры сетчатки человека (HORC) использовали отслоивающиеся сетчатки; однако без структурной поддержки, приданной пигментным эпителием-сосудистой оболочкой сетчатки (RPE-сосудистой оболочкой) и склерой, целостность хрупкой сетчатки может быть легко нарушена. Целью этого исследования была разработка новой модели HORC, которая содержит сетчатку, RPE-хориозию и склеру для поддержания целостности сетчатки при культивировании эксплантов сетчатки.
После разрезания по окружности вдоль лимбуса для удаления радужной оболочки и хрусталика, были сделаны четыре глубоких разреза, чтобы сплющить глазник. В отличие от предыдущих протоколов HORC, трефин использовался для разрезания не только сетчатки, но и RPE-сосудистой оболочки и склеры. Полученную трехслойную эксплантировали в течение 72 ч. Окрашивание гематоксилином и эозином (H & E) использовалось для оценки анатомических структур, а экспланты сетчатки дополнительно характеризовались иммуногистохимией (IHC) для апоптоза, целостности клеток Мюллера и воспаления сетчатки. Чтобы подтвердить возможность индукции заболевания, экспланты подвергались воздействию высокого уровня глюкозы (HG) и провоспалительных цитокинов (Cyt), чтобы имитировать диабетическую ретинопатию (DR). Анализ магнитной бусины Luminex использовался для измерения связанных с DR цитокинов, высвобождаемых в культуральная среда.
Окрашивание H & E выявило отчетливые ламели сетчатки и компактные ядра в эксплантатах сетчатки с нижележащей RPE-сосудистой оболочкой и склерой, в то время как сетчатка без нижележащих структур продемонстрировала уменьшенную толщину и сильную потерю ядер. Результаты IHC показали отсутствие апоптоза и воспаления сетчатки, а также сохранение целостности клеток Мюллера. Анализы Luminex показали значительно повышенную секрецию DR-ассоциированных провоспалительных цитокинов в эксплантатах сетчатки, подвергшихся воздействию HG + Cyt, по сравнению с исходными уровнями через 24 ч.
Мы успешно разработали и охарактеризовали новый протокол HORC, в котором целостность сетчатки сохранялась без апоптоза или воспаления сетчатки. Более того, индуцированная секреция DR-ассоциированных провоспалительных биомаркеров при воздействии эксплантов сетчатки на HG + Cyt предполагает, что эта модель может быть использована для клинически транслируемых исследований заболеваний сетчатки.
Введение
Сетчатка является узкоспециализированной глазной структурой, ответственной за преобразование входящей световой энергии в электрические сигналы, которые затем обрабатываются мозгом для визуального восприятия. Сетчатка человека содержит динамический диапазон типов клеток, высокоорганизованных в уникальную ламеллярную структуру, состоящую из двух синаптических и трех ядер слоя1 (рисунок 1). Гомеостаз сетчатки поддерживается сложными связями между нейроретинальными клетками, кровеносными сосудами, нервами, соединительными тканями и RPE1. Из-за сложной анатомии и физиологии сетчатки механизмы многих заболеваний сетчатки до сих пор остаются плохо изученными2,3,4,5. Для лучшего изучения заболеваний сетчатки были разработаны модели HORC6,7,8,9. По сравнению с исследованиями на животных и культурами in vitro, модели HORC являются преимуществами, поскольку они сохраняют динамическую клеточную среду и сложные нейрососудистые взаимодействия in situ, обеспечивая хорошую модель для клинической трансляции.
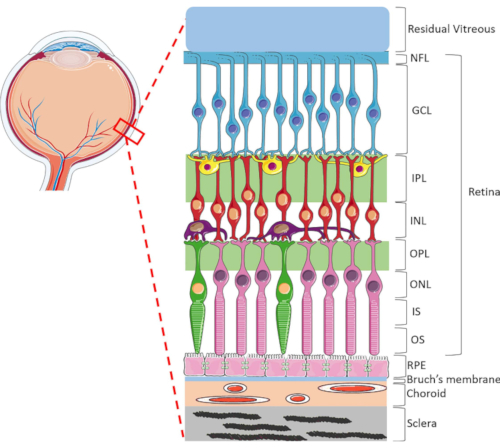
Рисунок 1:Задние глазные структуры человеческого глаза. Спереди к задней части слои сетчатки: слой нервных волокон (NFL), слой ганглиозных клеток (GCL), внутренний плексиформный слой (IPL), внутренний ядерный слой (INL), внешний плексиформный слой (OPL), внешний ядерный слой (ONL), внутренний сегмент фоторецептора (IS) и внешний слой фоторецептора (OS). Клетки внутри сетчатки включают ганглионные клетки (синий), амакриновые клетки (желтые), биполярные клетки (красные), горизонтальные клетки (фиолетовые), палочковые фоторецепторы (розовый) и колбочка фоторецепторов (зеленый). Стекловидное стекло расположено перед сетчаткой. RPE, мембрана Бруха, хориоида и склера расположены с задней частью сетчатки. Обратите внимание, что показанное изображение является только схематическим представлением сетчатки, и соотношение клеток / связности сетчатки в каждом слое может не указывать на настройку in vivo. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Ранее охарактеризованные протоколы HORC6,7,8,9 включали отделение сетчатки от лежащей в основе RPE-сосудистой оболочки и склеры с использованием хирургического трефина. Однако без поддержки, обеспечиваемой этими нижележащие структурами, полупрозрачная сетчатка становится хлипкой, трудной в обращении, а такие инструменты, как щипцы, могут легко нарушить ее целостность. Кроме того, было показано, что изоляция сетчатки в культуре без RPE вызывает апоптоз ганглиозных клеток и дегенерацию фоторецепторов10,11,12. Таким образом, альтернативный протокол HORC, который минимизирует потерю целостности сетчатки и лучше имитирует среду in vivo, был бы полезен. Это особенно важно при изучении механизмов заболевания сетчатки, так как физическая травма во время эксплантирования может привести к артефактам. Поэтому целью этого исследования была разработка новой модели HORC, которая включает в себя RPE-хориозию и склеру для защиты целостности сетчатки во время эксплантной обработки и культуры.
Для достижения этой цели экстрагировали экспланты сетчатки, «зажатые» между остаточным стекловидным стекловидным и лежащим в основе RPE-сосудистой оболочкой и склерой. В сэндвич-эксплантах стекловидное стекло утяжелит сетчатку, чтобы предотвратить отслоение и складчатку сетчатки, тогда как жесткая, волокнистая склера действует как каркас для структурной поддержки и точка контакта для щипцов. Более того, животные модели показали, что сохранение RPE в культуре может предотвратить дегенерацию сетчатки и глиальную пролиферацию, реакцию клеток Мюллера на сигналы опасности, такие как гипоксия и воспаление10,11,12.
Чтобы охарактеризовать модель, экспланты сэндвич-сетчатки окрашивали гематоксилином и эозином (H&E) для оценки анатомических структур и проводили иммуногистохимию (IHC), маркируя экспланты терминальной дезоксинуклеотидилтрансферазой dUTP nick end labeling (TUNEL, апоптотический клеточный маркер), глиальным фибриллярным кислым белком (GFAP, воспаление сетчатки и маркер активации клеток Мюллера) и виментином, маркером целостности клеток Мюллера. Чтобы определить, может ли эта модель быть индуцирована на развитие молекулярных признаков заболевания, экспланты подвергались воздействию высокого уровня глюкозы (HG) с провоспалительными цитокинами (Cyt), интерлейкином-1β (IL-1β) и фактором некроза опухоли α (TNF-α), культивируемой средой, которая, как было показано, имитирует диабетическую ретинопатию (DR) как в моделях клеточных, так и в животных моделях заболеваний13,14,15. Анализы Luminex использовались в модели DR для измерения цитокинов, высвобождаемых в культурную среду.
протокол
Глазные чашки доноров были получены из Национального банка глаз Новой Зеландии после иссечения роговицы для трансплантации и одобрены Комитетом по этике здравоохранения и инвалидности Северного В (NTX/06/19/CPD/AM07).
ПРИМЕЧАНИЕ: Культуру следует проводить в шкафу биобезопасности класса II для обеспечения стерильных условий культивированием тканей. Ткани должны быть культивированы в течение 24 ч после вскрытия, чтобы избежать значительной потери целостности сетчатки.

Рисунок 2:Изображения, показывающие процедуру сбора сэндвича эксплантов сетчатки. Для приготовления эксплантата используйте рассекающие ножницы с одним острым кончиком и одним тупым концом, с тупым концом, обращенным к внутренней части земного шара, чтобы уменьшить повреждение тканей во время разреза. Также используйте щипцы с тупыми концами, чтобы избежать расчесывания внутриглазных тканей во время обработки. С помощью хирургических ножниц, тупым концом, обращенным внутрь, разрезают вдоль лимбуса, чтобы удалить радужную оболочку и хрусталик(A-C). ONH может быть расположен, если смотреть прямо в открытый наглазник(D). Используя щипцы с тупыми кончиками, удерживайте склеру для стабилизации земного шара(E). Разделите глобус вертикально на две половины, сделав два глубоких разреза в сторону ONH, но не прорезайте ONH. Повторите это вдоль горизонтального меридиана(G). Нанесите тупые щипцы на склеру и осторожно откройте глобус до клеверной формы(H-K). Используйте щипцы, чтобы осторожно манипулировать стекловидным стеклом, чтобы сгладить сложенную сетчатку, так как стекловидное стекло тянет за сетчатку, но не прикасайтесь к сетчатке напрямую(I). Удалите стекловидное стекло, если оно вызывает отслоение сетчатки или сворачивание (не показано на рисунке 2, так как прозрачное стекловидное стекло плохо запечатлено на фотографиях). Найдите области, где сетчатка плоская, и извлеките экспланты сетчатки с помощью хирургического трефина(L). Прикладывая щипцы к склере, осторожно переносят экспланты сетчатки в заранее подготовленную культуральную среду(М,Н). Весь сэндвич эксплант должен опускаться на дно скважины из-за его веса, поэтому каждый эксплант погружается в среду(О). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Извлечение сэндвича из сетчатки из наглазницы
- Снимите радужную оболочку и линзу.
- Поместите глазную чашку внутрь чашки Петри, с радужной оболочкой и линзой, обращенной вверх, и головкой зрительного нерва (ONH), контактирующей с чашкой Петри(рисунок 2A).
- Держите глазную чашку устойчиво на лимбе с помощью щипцов(рисунок 2B).
- Отсоединять радужную оболочку и линзу, сделав небольшие разрезы по окружности вдоль внешнего края лимбуса(рисунок 2А).
- Осторожно снимите радужную оболочку и линзу. Избегайте нарушения сетчатки во время манипуляций(рисунок 2C).
ПРИМЕЧАНИЕ: Хрусталик не попадет в глазную чашку, так как он прикреплен через зонульные волокна к цилиарному телу.
- Расплющить глазную чашку.
- Когда глазная чашка все еще сидит вертикально, определите ONH. Это проще с ярким источником белого света(рисунок 2D).
- Наклониться в четырех квадрантах в сторону ONH(рисунок 2E). Чашку Петри можно вращать для упрощения обработки. НЕ вырезайте ONH.
- Аккуратно распределите и расплющите глазную чашку(рисунок 2E).
- Нанесите щипцы на склеру вместо сетчатки, чтобы избежать нарушения целостности сетчатки.
ПРИМЕЧАНИЕ: Периферическая отслойка и сворачивание сетчатки неизбежны, так как вес переполненного стекловидного тела будет тянуть за сетчатку. В этих областях удалите стекловидное стекло, чтобы предотвратить дальнейшее сворачивание сетчатки. Не забудьте оставить остаточное стекловидное стекло, чтобы стабилизировать сетчатку поверх RPE-сосудистой оболочки и склеры.
- Соберите бутербродные экспланты сетчатки.
- Поместите хирургический трефин на сетчатку в область без складок сетчатки(рисунок 2F).
- Надавливание сильно проникает в склеру, которая должна генерировать трескучий звук.
- Скручите трефин на 180°, чтобы убедиться, что склера была полностью проникла таким образом, что эксплант сетчатки теперь отделен от оставшейся ткани.
- Нанесите щипцы на склеру и перенесите сэндвич-эксплант сетчатки в культуральнуюсреду (рисунок 2G-I).
- Получить 2-3 сэндвич-эксплантата сетчатки из периферической сетчатки каждого квадранта.
ПРИМЕЧАНИЕ: Сэндвич-эксплант сетчатки иногда может быть захвачен в отверстии трефина. Используя щипцы, аккуратно выдразнить небольшой участок основания склеры. Это происходит чаще, когда лезвие тупое и может вызвать потерю сетчатки(рисунок 3A-C). - Используйте новый трефин после вырезания 1-2 эксплантов сетчатки, так как лезвие легко тупое(рисунок 3C
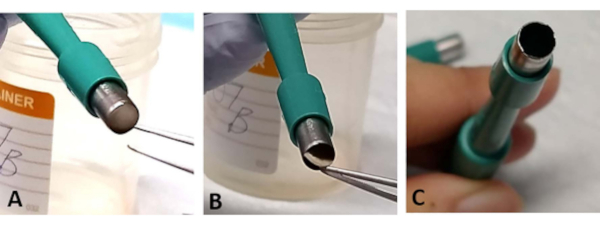
Рисунок 3:Устранение неполадок. Во время процесса экстракции эксплант сетчатки может быть захвачен при вскрытии хирургического трефина(А). Осторожно выдозните ткань от основания склеры, не касаясь сетчатки(B). Это может происходить чаще, если хирургический трефин используется для извлечения более двух эксплантов сетчатки, так как лезвие может легко стать тупым(C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Культивирует экспланты сетчатки.
- Подготовьте культурную среду, содержащую питательную смесь F-12 (DMEM-F12) от Dulbecco's Modified Eagle Medium и 1-кратную смесь антибиотиков и антимикотиков (AA, 100x бульон).
- Перед эксплантной добычей поместите 500 мкл среды в скважины 24-скважинной плиты и уравновесьте в инкубаторе. Это важно, так как добавление среды после этого может вытесдить сетчатку.
- Культивируйте сэндвич-эксплантатор сетчатки при 37 °C в течение 72 ч в увлажненный 5% CO2 инкубатор в среде, приготовленной на этапе 1.4.2.
- Для индуцирования DR-подобных изменений культивируют экспланты сетчатки в среде, содержащей DMEM-F12, с комбинацией 32,5 мМ HG с Cyt, TNF-α (10 нг/мл) и IL-1β (10 нг/мл).
2. Парафин-встраивание сэндвича эксплантов сетчатки
- Зафиксируйте бутерброд сетчаткой эксплантов.
- Погружайте бутербродные экспланты сетчатки в 10% формалин не менее 24 ч.
- Удалите раствор формалина и аккуратно переложите экспланты сетчатки сэндвича в тканевые прокладки и кассеты.
- Замочите бутербродные экспланты сетчатки в 70% этаноле в течение не менее 24 ч.
- Парафин-встраиваемые экспланты сетчатки в блоки.
- Разрежьте парафиновые ткани сетчатки на участки толщиной 5 мкм с помощью микротома и установите на стеклянные слайды. Хранить при комнатной температуре до тех пор, пока не будет установлено изображение.
- Депарафинизация разделов.
- Погружайте срезы в 70% ксилол на 5 мин.
- Погружайте срезы в 100% ксилол на 5 мин.
- Регидратировать срезы в 70% этаноле в течение 5 мин.
- Регидратировать срезы в 100% этаноле в течение 5 мин.
- Промыть секции под проточной водопроводной водой в течение 10 мин.
3. Характеристика с использованием H&E, IHC и магнитного анализа Luminex
- Протокол окрашивания H&E
- Депарафинизируйте разделы, используя шаг 2.2.
- Увлажняйте срезы в водопроводной воде в течение 5 мин.
- Окрашивают срезы в 2 гематоксилина Гилла в течение 5 мин.
- Тщательно вымойте секции под проточной водопроводной водой, чтобы удалить лишние пятна.
- Дифференцировать, обмакивая секции дважды в 1% кислый спирт.
- Быстро вымойте секции под проточной водопроводной водой.
- Окрашивают участки в синий цвет, окунув шесть раз в 1% карбонат лития (10 мг/мл).
- Тщательно вымойте участки под проточной водопроводной водой в течение 5 мин, чтобы удалить излишки синего пятна.
- Окуните срезы в 1% эозина 10 раз.
- Быстро вымойте участки под водопроводной водой, чтобы удалить лишние пятна.
- Обезвоживать срезы, окунув их 10 раз в 100% этанол. Сделайте это дважды.
- Окуните срезы в 70% ксилол 10 раз.
- Окуните срезы в 100% ксилол 10 раз.
- Монтаж с помощью обтекательного вала с использованием монтажной среды из дибутилфталата полистирола ксилола (DPX).
- Сделайте снимки с помощью светового микроскопа.
- Протокол маркировки IHC'
- Депарафинизируйте разделы, используя шаг 2.2.
- Поместите слайды в раствор, содержащий 10 мМ буфера цитрата натрия с 0,05% Tween 20 при рН 6,0 и запустите извлечение антигена в скороварке, автоматизированной при 121 °C в течение 2 мин.
- Промывайте участки фосфатно-буферным физиологическим раствором (PBS) в течение 5 мин. Сделайте это 3 раза.
- Блокируют участки с PBS, содержащими 0,1% Triton X-100 и 10% нормальной козьей сыворотки, в течение 1 ч при комнатной температуре.
- Инкубировать участки в течение ночи при 4 °C с первичными антителами, конъюгированными со вторичными антителами (Таблица материалов).
- Промывайте секции в PBS в течение 5 мин. Сделайте это 3 раза.
- Окрашивают ядра с помощью 4',6-диамидино-2-фенилиндола (DAPI) в течение 2 мин.
- Мойте и монтируйте секции с помощью антивядающего реагента.
- Запечатайте чехлы лаком для ногтей.
- Снимайте снимки с помощью конфокального лазерного сканирующего микроскопа.
- Магнитный анализ Luminex
- Перенос 75 мкл среды из каждой скважины в 96-скважинную u-дно плиту через 24 и 72 ч.
- Анализ клеточного супернатанта на IL-18, IL-6, IL-8 и фактор роста эндотелия сосудов (VEGF) через 24 и 72 ч с использованием цитокинового анализа Luminex. Следуйте инструкциям производителя для проведения анализа16.
Результаты
Целостность сетчатки была сохранена в этой модели HORC. Целостность сетчатки была сохранена в культивированных сэндвич-эксплантах сетчатки, но была потеряна в сетчатке, культивированной без смежных структур. H&E проводили для изучения структурной целостности ?...
Обсуждение
HORC в настоящее время является наиболее клинически переводимой моделью в доклинических исследованиях сетчатки. По сравнению с моделями культур клеток in vitro, HORC может лучше представлять анатомию сетчатки человека in situ, сохраняя динамические типы клеток сетчатки и их связи с нейронами, с?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить щедрых доноров тканей глаза и команду из Национального банка глаз Новой Зеландии за их поддержку. Эта работа была финансово поддержана грантами проекта от Фонда Мориса и Филлис Пайкель и Оклендского фонда медицинских исследований (1117015). Директорство IDR поддерживается Благотворительным фондом Бьюкенена. Стипендия CK предоставляется Новозеландским образовательным и исследовательским фондом Ассоциации оптометристов (CC36812), а стипендия HHL предоставляется Благотворительным фондом Бьюкенена.
Материалы
| Name | Company | Catalog Number | Comments |
| Disposable Biopsy Punches (5 mm) | Integra York PA Inc., USA | 21909-142 | Referred as surgical trephines in this article |
| Human Recombinant IL-1β | Peprotech, USA | 200-01B | Working concentration: 10 ng/mL |
| Human Recombinant TNF-a | Peprotech, USA | 300-01A | Working concentration: 10 ng/mL |
| DAPI (1 µg/mL) | Sigma Aldrich, Germany | #D9542 | Nuclear stain. Working dilution 1:1000 |
| DMEM/F-12, GlutaMAX supplement | Gibco, Thermofisher, Scientific Inc., USA | 10565018 | Dulbecco’s Modified Eagle Medium nutrient mixture F-12 containing a 1× antibiotics and antimycotics mixture (AA, 100× stock) |
| Fine Scissors - Sharp-Blunt | Fine Science Tools (F.S.T) | 14028-10 | Tips: Sharp-Blunt, Cutting Edge: 27mm, Length: 10cm, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight |
| Graefe Forceps | Fine Science Tools (F.S.T) | 11050-10 | Length:10cm, Tip shape: Straight, Tips: Serrated, Tip Width: 0.8mm, Tip Dimensions:0.8 x 0.7mm, Alloy/Materials: Stainless Steel |
| Mouse monoclonal GFAP-Cy3 | Sigma Aldrich, Germany | #C9205 | Primary antibody conjugated to Cy3. Working dilution 1:1000. |
| Mouse monoclonal Vimentin-Cy3 | Sigma Aldrich, Germany | #C9080 | Primary antibody conjugated to Cy3. Working dilution 1:50. |
| Rabbit polyclonal TUNEL (In Situ Cell Death Detection Kit, Fluorescein) | Sigma Aldrich, Germany | #11684795910 | Primary antibody conjugated to Fluorescein-dUTP. Working dilution 1:10 with enzyme-buffer solution. |
Ссылки
- Kolb, H., Fernandez, E., Nelson, R. Facts and Figures Concerning the Human Retina. Webvision-The Organization of the Retina and Visual System. , (2005).
- Gemenetzi, M., De Salvo, G., Lotery, A. Central serous chorioretinopathy: an update on pathogenesis and treatment. Eye. 24 (12), 1743-1756 (2010).
- Buschini, E., Piras, A., Nuzzi, R., Vercelli, A. Age related macular degeneration and drusen: neuroinflammation in the retina. Progress in Neurobiology. 95 (1), 14-25 (2011).
- Chen, S. -. Y., et al. Current concepts regarding developmental mechanisms in diabetic retinopathy in Taiwan. Biomedicine. 6 (2), (2016).
- Kaaja, R., Loukovaara, S. Progression of retinopathy in type 1 diabetic women during pregnancy. Current Diabetes Reviews. 3 (2), 85-93 (2007).
- Azizzadeh Pormehr, L., et al. Human organotypic retinal flat-mount culture (HORFC) as a model for retinitis pigmentosa11. Journal of Cellular Biochemistry. 119 (8), 6775-6783 (2018).
- Fernandez-Bueno, I., et al. Time course modifications in organotypic culture of human neuroretina. Experimental Eye Research. 104, 26-38 (2012).
- Niyadurupola, N., Sidaway, P., Osborne, A., Broadway, D. C., Sanderson, J. The development of human organotypic retinal cultures (HORCs) to study retinal neurodegeneration. British Journal of Ophthalmology. 95 (5), 720-726 (2011).
- Osborne, A., Hopes, M., Wright, P., Broadway, D. C., Sanderson, J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration. Experimental Eye Research. 143, 28-38 (2016).
- Caffe, A., Visser, H., Jansen, H., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Kaempf, S., Walter, P., Salz, A. K., Thumann, G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium. Journal of Neuroscience Methods. 173 (1), 47-58 (2008).
- Liu, L., Cheng, S. -. H., Jiang, L. -. Z., Hansmann, G., Layer, P. G. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro. Experimental Eye Research. 46 (5), 801-812 (1988).
- Kuo, C., Green, C. R., Rupenthal, I. D., Mugisho, O. O. Connexin43 hemichannel block protects against retinal pigment epithelial cell barrier breakdown. Acta Diabetologica. 57 (1), 13-22 (2020).
- Mugisho, O. O., et al. The inflammasome pathway is amplified and perpetuated in an autocrine manner through connexin43 hemichannel mediated ATP release. Biochimica et Biophysica Acta (BBA)-General Subjects. 1862 (3), 385-393 (2018).
- Mugisho, O. O., et al. Intravitreal pro-inflammatory cytokines in non-obese diabetic mice: Modelling signs of diabetic retinopathy. PLoS ONE. 13 (8), 0202156 (2018).
- . R&D Systems, I Available from: https://www.rndsystems.com/protocol-types/luminex (2020)
- Nakazawa, T., et al. Attenuated glial reactions and photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein and vimentin. Investigative Ophthalmology, Visual Science. 48 (6), 2760-2768 (2007).
- Okada, M., Matsumura, M., Ogino, N., Honda, Y. Müller cells in detached human retina express glial fibrillary acidic protein and vimentin. Graefe's Archive for Clinical and Experimental Ophthalmology. 228 (5), 467-474 (1990).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical & Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Koleva-Georgieva, D. N., Sivkova, N. P., Terzieva, D. Serum inflammatory cytokines IL-1beta, IL-6, TNF-alpha and VEGF have influence on the development of diabetic retinopathy. Folia Medica (Plovdiv). 53 (2), 44-50 (2011).
- Lee, J. -. H., et al. Cytokine profile of peripheral blood in type 2 diabetes mellitus patients with diabetic retinopathy. Annals of Clinical & Laboratory Science. 38 (4), 361-367 (2008).
- Chorostowska-Wynimko, J., et al. In vitro angiomodulatory activity of sera from type 2 diabetic patients with background retinopathy. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society. 56, 65-70 (2005).
- Khalifa, R. A., Khalef, N., Moemen, L. A., Labib, H. M. The role interleukin 12 (IL-12), interferon-inducible protein 10 (IP-10) and Interleukin 18 (IL-18) in the angiogenic activity of diabetic retinopathy. Research Journal of Medicine and Medical Sciences. 4, 510-514 (2009).
- Zhou, J., Wang, S., Xia, X. Role of intravitreal inflammatory cytokines and angiogenic factors in proliferative diabetic retinopathy. Current Eye Research. 37 (5), 416-420 (2012).
- Song, Z., et al. Increased intravitreous interleukin-18 correlated to vascular endothelial growth factor in patients with active proliferative diabetic retinopathy. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (8), 1229-1234 (2014).
- Louie, H. H., Shome, A., Kuo, C. Y. J., Rupenthal, I. D., Green, C. R., Mugisho, O. O. Connexin43 hemichannel block inhibits NLRP3 inflammasome activation in a human retinal explant model of diabetic retinopathy. Experimental Eye Research. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены