A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام أجهزة المساعدة البطينية عن طريق الجلد في احتشاء عضلة القلب الحاد المعقد بصدمة القلب
In This Article
Summary
يتم استخدام أجهزة المساعدة البطينية عن طريق الجلد بشكل متزايد في المرضى الذين يعانون من احتشاء عضلة القلب الحاد والصدمات القلبية. هنا، نناقش آلية العمل والآثار الديناميكية الدموية لهذه الأجهزة. كما نراجع الخوارزميات وأفضل الممارسات لزرع وإدارة فطم هذه الأجهزة المعقدة.
Abstract
وتعرف الصدمة القلبية بأنها انخفاض ضغط الدم المستمر، مصحوبة بأدلة على نهاية الجهاز نقص التروية. تستخدم أجهزة المساعدة البطينية عن طريق الجلد (PVADs) لعلاج صدمة القلب في محاولة لتحسين الديناميكا الدموية. Impella حاليا PVAD الأكثر شيوعا ويضخ الدم بنشاط من البطين الأيسر في الشريان الأورطي. PVADs تفريغ البطين الأيسر، وزيادة الناتج القلبي وتحسين التروية التاجية. عادة ما يتم وضع PVADs في مختبر قسطرة القلب تحت التوجيه بالمنظار عبر الشريان الفخذي عندما يكون ذلك ممكنا. في حالات الإصابة بمرض الشريان المحيطي الحاد، يمكن زرع PVADs من خلال إمكانية وصول بديلة. في هذه المقالة، ونحن تلخيص آلية عمل PVAD والبيانات التي تدعم استخدامها في علاج صدمة القلب.
Introduction
تعرف الصدمة القلبية المنشأ بأنها انخفاض ضغط الدم المستمر (ضغط الدم الانقباضي <90 مم زئبق لمدة 30 دقيقة >، أو الحاجة إلى فاسوبريسورس أو inotropes), نهاية الجهاز نقص التروية (إخراج البول <30 مل / ساعة, الأطراف باردة أو اللاكتات > 2 مليمول / لتر), احتقان رئوي (ضغط إسفين الشعيرات الدموية الرئوية (PCWP) ≥ 15 ملم زئبق) وانخفاض أداء القلب (مؤشر القلب <2.2 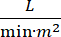 )1, 2 بسبب اضطراب القلب الأولي. احتشاء عضلة القلب الحاد (AMI) هو السبب الأكثر شيوعا ل CS3. CS يحدث في 5-10٪ من AMI وتاريخا ارتبطت مع وفيات كبيرة3،4. تستخدم أجهزة دعم الدورة الدموية الميكانيكية (MCS) مثل مضخة البالون داخل الأبهر (IABP) وأجهزة المساعدة البطينية عن طريق الجلد (PVAD) وأوكسجين الغشاء خارج الجسم (ECMO) وأجهزة الأذين الأيسر عن طريق الجلد إلى الأجهزة الأبهرية في المرضى الذين يعانون من CS5. وقد أظهرت الاستخدام الروتيني لل IABP أي تحسن في النتائج السريرية أو البقاء على قيد الحياة في AMI-CS1. نظرا لضعف النتائج المرتبطة ب AMI-CS ، والصعوبات في إجراء التجارب في AMI-CS ، والنتائج السلبية لاستخدام IABP في AMI-CS ، يتطلع الأطباء بشكل متزايد إلى أشكال أخرى من MCS.
)1, 2 بسبب اضطراب القلب الأولي. احتشاء عضلة القلب الحاد (AMI) هو السبب الأكثر شيوعا ل CS3. CS يحدث في 5-10٪ من AMI وتاريخا ارتبطت مع وفيات كبيرة3،4. تستخدم أجهزة دعم الدورة الدموية الميكانيكية (MCS) مثل مضخة البالون داخل الأبهر (IABP) وأجهزة المساعدة البطينية عن طريق الجلد (PVAD) وأوكسجين الغشاء خارج الجسم (ECMO) وأجهزة الأذين الأيسر عن طريق الجلد إلى الأجهزة الأبهرية في المرضى الذين يعانون من CS5. وقد أظهرت الاستخدام الروتيني لل IABP أي تحسن في النتائج السريرية أو البقاء على قيد الحياة في AMI-CS1. نظرا لضعف النتائج المرتبطة ب AMI-CS ، والصعوبات في إجراء التجارب في AMI-CS ، والنتائج السلبية لاستخدام IABP في AMI-CS ، يتطلع الأطباء بشكل متزايد إلى أشكال أخرى من MCS.
تستخدم PVADs بشكل متزايد في المرضى الذين يعانون من AMI-CS6. في هذه المقالة، وسوف نركز مناقشتنا في المقام الأول على IMPELLA CP، وهو PVAD الأكثر شيوعا المستخدمة حاليا6. يستخدم هذا الجهاز مضخة تدفق محوري أرخميدس المسمار الذي يدفع بنشاط وباستمرار الدم من البطين الأيسر (LV) إلى الشريان الأورطي الصاعد (الشكل 1). يتم وضع الجهاز في معظم الأحيان في مختبر قسطرة القلب تحت التوجيه بالمنظار عبر الشريان الفخذي. بدلا من ذلك، يمكن زرعه من خلال الوصول إلى المحور أو عبر المحيط عند الضرورة7،8.
Protocol
هذا البروتوكول هو معيار الرعاية في مؤسستنا.
1. إدراج PVAD (على سبيل المثال، Impella CP)
- الحصول على وصول الفخذ المشتركة على مدى النصف السفلي من رأس الفخذ تحت التوجيه بالمنظار والموجات فوق الصوتية باستخدام إبرة ثقب صغير9،10. ضع غمد الثقب الدقيق والحصول على صورة وعائية للشريان الفخذي لتأكيد موقع استئصال الشريان المناسب11.
- أدخل غمد 6 Fr في الشريان الفخذي.
- إذا كان هناك قلق لمرض عظم الفخذ، أدخل قسطرة ذيل الخنزير في الجزء السفلي من الشريان الأورطي البطني وقم بإجراء تصوير الأوعية الدموية للنظام iliofemoral لضمان عدم وجود مرض الشريان المحيطي الكبير (PAD) الذي قد يحول دون إدخال PVAD. إذا كان هناك مرض معتدل أو تكلس الشرايين الحرقفية النظر في استخدام أطول 25 سم 14 غمد الفرنسية بحيث غيض من غمد هو في شريحة صحية نسبيا من الشريان الأورطي البطني.
- توسيع موقع استئصال الشرايين بشكل متسلسل عبر سلك شديد .035 بوصة باستخدام 8 و 10 و 12 متوسعات الأب بالتتابع. ثم، أدخل قشر 14 Fr بعيدا غمد تحت التوجيه بالمنظار، وضمان تقدم تلميح دون مقاومة.
- إدارة بولوس الهيبارين (~ 100 U / كجم وزن الجسم) لهدف ACT من 250 إلى 300 ثانية. وتشمل مضادات التخثر البديلة ثنائية الطول وأرغاتروبان.
- استخدام قسطرة ذيل الخنزير للعبور إلى LV باستخدام 0.035 "J سلك يميل. إزالة سلك J والتحقق من LVEDP.
- شكل غيض من تبادل طول 0.018 "الأسلاك المدرجة في عدة وإدراجه في LV بحيث يشكل منحنى مستقر في قمة LV.
- تأكد ACT هو في الهدف (250 إلى 300 ق) قبل الإدراج12،13.
- قم بإزالة قسطرة ذيل الخنزير وأدخل المضخة عن طريق تحميل السلك على التجويف الأحمر التحميلي الذي تم تجميعه مسبقا (مثل EasyGuide) حتى يخرج بالقرب من الملصق.
- قم بإزالة التجويف الأحمر التحميلي عن طريق سحب الملصق برفق أثناء حمل القسطرة.
- تقدم الجهاز بزيادات صغيرة تحت التوجيه بالمنظار الفلوري إلى LV عبر سلك 0.018 بوصة.
- وضع المضخة في LV مع مدخل 4 سم تحت الصمام الأبهري وتأكد من أنها خالية من chordae مترال. يمكن أن تكون قريبة جدا من قمة يسبب PVCs واثار "إنذارات الشفط". إزالة السلك .018 "وبمجرد إزالتها، بدء تشغيل المضخة. إزالة الركود الزائد بحيث تقع المضخة ضد انحناء أقل من الشريان الأورطي.
- مراقبة وحدة التحكم للتأكد من أن تيار المحرك هو النابض ويتم عرض الموجي الأبهري. إذا تم عرض شكل موجي البطين، قد تحتاج المضخة إلى سحبها إلى الخلف.
- إذا كان الجهاز بحاجة إلى تركه في الموقع، فقم بإزالة غمد البازلاء وأدخل غمد إعادة التمركز الذي تم تحميله مسبقا على الجهاز.
- تحقق من موضع الجهاز على التنظير الفلوري وأشكال الموجات على وحدة التحكم مرة أخرى.
- بالبات (أو الشعور مع دوبلر) نبضات الشريان الطرف السفلي البعيدة بما في ذلك بيديس dorsalis والظنبوب الخلفي قبل وبعد إدخال الجهاز. توثيق هذا بشكل مناسب في السجل الطبي للمريض.
- إذا لم يتم الحصول على البقول أو الضواهر، ففكر في أخذ صورة وعائية للأطراف السفلية باستخدام منفذ إعادة إدخال السلك الموجود على جانب الجهاز أو استخدام منفذ آخر لضمان تدفق غير معرقلة إلى الطرف السفلي.
- إذا تم إعاقة التدفق ، ضع غمد التروية قبل نقل المريض إلى وحدة العناية المركزة. في المرضى الذين يعانون من PAD الذين هم في خطر كبير لتدفق الانسداد، والنظر بقوة إدراج غمد التروية قبل وضع غمد الأب 14 (أي بعد الخطوة 1.4 المذكورة أعلاه).
- مراقبة المرضى الذين عولجوا ب PVAD في وحدة الرعاية الحرجة (CCU) من قبل الموظفين المدربين على استخدامه.
2. الرعاية بعد الإجراءات
- تطبيق خلع الملابس العقيمة.
- ضع الجهاز بزاوية 45 درجة عند دخول الجلد (يمكن أن يكون الشاش الموجود أسفل غمد إعادة التمركز مفيدا للحفاظ على هذه الزاوية). قد يؤدي الفشل في القيام بذلك إلى ناز عملية استئصال الشرايين، مما يؤدي إلى تشكيل ورم دموي. ومن المفيد أيضا وضع الغرز مع الضغط إلى الأمام لتجنب هجرة الجهاز ومنع النزيف.
ملاحظة: تأمين الطرف السفلي مع عدم الحركة الركبة يمكن أيضا الحد من هجرة الجهاز كتذكير للمريض عدم الانحناء / تحريك الطرف المعني. وينبغي عدم تثبيت هذا بإحكام شديد حتى لا يعرض التداول للخطر. - الاستمرار في إجراء فحوصات النبض الروتينية (واضح أو دوبلر).
3. تحديد المواقع
- استخدم مخطط صدى القلب عبر الصدر بجانب السرير لتأكيد موضع الجهاز المناسب إما قبل النقل أو فور الوصول إلى وحدة العناية المركزة القلبية، اعتمادا على توافر نقطة الرعاية بالموجات فوق الصوتية.
- استخدم طريقة عرض محور طويل شبه نجمي لتقييم موضع الجهاز. يمكن أيضا استخدام طريقة عرض subxyphoid إذا كان عرض المحور الطويل شبه النجمي غير قابل للحصول عليه. يجب أن يكون القياس من الصمام الأبهري إلى مدخل الجهاز مثاليا 3-4 سم لتحديد المواقع المناسبة للجهاز.
- استخدم مخططات صدى القلب لملاحظة موضع الجهاز من حيث صلته بالصمام التاجي.
- عندما يحتاج الجهاز إلى تغيير موضعه، قم بإيقاف تشغيل الجهاز إلى P2، فك آلية القفل على الغطاء العقيم للتقدم أو التراجع عن الجهاز. يمكن للمرء أن عزم الدوران كما تقدم أو التراجع إذا كان ذيل الخنزير أو مدخل قريب جدا من الصمام التاجي.
- قفل الجهاز في الموضع الجديد وتوثيق الموضع الجديد.
- بعد ذلك، قم بزيادة الجهاز إلى المستوى المطلوب من الدعم.
- بعد زيادة مستوى الدعم، إعادة تقييم موضع الجهاز كما يمكن للجهاز القفز إلى الأمام عند زيادة السرعة.
ملاحظة: إذا تم سحب الجهاز مرة أخرى عبر الصمام الأبهري، فمن الأفضل إعادة وضعه في مختبر الكاث تحت توجيه التنظير الفلوري.
4. وطم
- النظر في الفطم عندما vasopressors / inotropes هي في جرعات منخفضة أو فطم تماما قبالة. وينبغي رصد الديناميكا الدموية باستمرار للحفاظ على CPO > 0.6 W. مراقبة بعناية الديناميكا الدموية البطين الأيمن (RV) بهدف الحفاظ على ضغط الأذين الأيمن (RAP) <12 ملم زئبق ومؤشر نبض الشريان الرئوي (PAPI) >1.014. فكر أيضا في الحصول على درجة الحموضة والتشبع الوريدي المختلط واللاكتات كل ساعتين إلى 6 ساعات لمراقبة عمل القلب وتشويش الأعضاء النهائية.
- خفض الطاقة بنسبة 1-2 مستويات على مدى 2 ساعة، مشيرا إلى CPO، PAPI، RAP، MAP والبول الناتج. إذا انخفض CPO <0.6 واط، يبدأ راب في الزيادة، ينخفض إنتاج البول > 20 مل/ ساعة أو MAP <60 ملم زئبق، وزيادة الطاقة إلى المستوى السابق.
5. إزالة12
- استخدام أجهزة إغلاق الأوعية الدموية لإغلاق موقع الوصول إلى استئصال الشرايين مع النشر الكامل للجهاز الذي يتم تنفيذه عند إزالة غمد كبير تتحمل14. مؤقتة منطاد الغدد القطنية الداخلية الوعائية أو "تقنية إغلاق الحقل الجاف" هو وسيلة فعالة وآمنة لضمان hemostasis من موقع الوصول تتحمل كبيرة15.
- اطلب إلى P1 وسحب الجهاز إلى الشريان الأورطي متبوعا بالتغيير إلى P0 وفصل الجهاز عن وحدة التحكم أثناء سحب القسطرة من الجسم.
- لاحظ أنه لا ينبغي ترك الجهاز عبر الصمام الأبهري في P0 بسبب خطر قلس الأبهر.
- إذا أخذ في الاعتبار hemostasis اليدوي، انتظر حتى ACT <150 وعقد 3 دقائق من الضغط لكل حجم الفرنسية.
النتائج
الجدول 1 يبين سلامة وفعالية زرع PVAD35،36،37،38،39،40.
تحسين نتائج PVAD
وتعد هذه البرامج تدخلا كثيف الموارد يتطلب خبرة وخبرة كبيرة لتحسين النتائج. وينبغي ...
Discussion
تقليل مخاطر ومضاعفات PVAD (الجدول 2)
يمكن تحييد الفوائد الحيوية للPVAD بشكل كبير إذا حدثت مضاعفات من الوصول إلى الآبار الكبيرة ، مثل النزيف الكبير وإقفارية الأطراف الحادة28،29. وبالتالي فمن الضروري للحد من مخاطر ومضاعفات الجهاز.
من أجل ت...
Disclosures
الدكتورة آديتيا بهارادواج هي مستشارة، وبروكتور، وعضو في مكتب المتحدثين في أبيوميد.
الدكتور مير بصير هو مستشار لآبوت الأوعية الدموية، Abiomed، نظام القلب والأوعية الدموية، شيسي، Procyrion وزول.
Acknowledgements
اي
Materials
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
References
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved