需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
经皮心室辅助装置治疗急性心肌梗死并发心源性休克
摘要
经皮心室辅助装置越来越多地用于急性心肌梗死和心源性休克患者。在本文中,我们讨论了这些装置的作用机制和血流动力学效应。我们还审查了这些复杂设备的植入,管理和断奶的算法和最佳实践。
摘要
心源性休克被定义为持续性低血压,伴有终末器官灌注不足的证据。经皮心室辅助装置 (PVAD) 用于治疗心源性休克,以改善血流动力学。Impella是目前最常见的PVAD,并主动将血液从左心室泵入主动脉。PVAD可卸下左心室,增加心输出量并改善冠状动脉灌注。在可行的情况下,通常将 PVAD 放置在心导管插入实验室,通过股动脉进行荧光镜引导。在严重外周动脉疾病的情况下,PVAD可以通过替代通道植入。在本文中,我们总结了PVAD的作用机制以及支持其在治疗心源性休克中的应用的数据。
引言
心源性休克 (CS) 定义为持续性低血压(收缩压 <90 mmHg 持续 >30 分钟,或需要血管加压药或正性肌力药物)、终末器官灌注不足(尿量 <30 mL/h,四肢或乳酸冷> 2 mmol/L)、肺淤血(肺毛细血管楔形压 (PCWP) ≥ 15 mmHg)和心脏功能下降(心脏指数 <2.2) 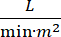 1, 2.由于原发性心脏疾病。急性心肌梗死(AMI)是CS3的最常见病因。CS 发生在 5-10% 的 AMI 中,历史上与显著的死亡率相关3、4。机械循环支持 (MCS) 装置,如主动脉内球囊泵 (IABP)、经皮心室辅助装置 (PVAD)、体外膜肺氧合 (ECMO) 和经皮左心房到主动脉装置,常用于 CS5患者。常规使用IABP显示AMI-CS1的临床结局或生存率没有改善。鉴于与AMI-CS相关的不良结局,在AMI-CS中进行试验的困难以及在AMI-CS中使用IABP的阴性结果,临床医生越来越多地寻求其他形式的MCS。
1, 2.由于原发性心脏疾病。急性心肌梗死(AMI)是CS3的最常见病因。CS 发生在 5-10% 的 AMI 中,历史上与显著的死亡率相关3、4。机械循环支持 (MCS) 装置,如主动脉内球囊泵 (IABP)、经皮心室辅助装置 (PVAD)、体外膜肺氧合 (ECMO) 和经皮左心房到主动脉装置,常用于 CS5患者。常规使用IABP显示AMI-CS1的临床结局或生存率没有改善。鉴于与AMI-CS相关的不良结局,在AMI-CS中进行试验的困难以及在AMI-CS中使用IABP的阴性结果,临床医生越来越多地寻求其他形式的MCS。
PVAD 越来越多地用于 AMI-CS6患者。在本文中,我们将主要讨论Impella CP,这是目前最常用的PVAD6。该装置利用轴流阿基米德螺杆泵,该泵主动且连续地将血液从左心室(LV)推入升主动脉(图1)。该装置最常放置在心导管插入实验室,通过股动脉进行透视引导。或者,可以在必要时通过腋窝或经腔通道植入7,8。
研究方案
该协议是我们机构的护理标准。
1. 插入PVAD(例如,Impella CP)
- 在荧光透视和超声引导下,使用微穿刺针9、10获得股骨头下半部分的普通股骨通路。定位微穿刺鞘并获取股动脉血管造影以确认适当的动脉切开术位置11。
- 在股动脉中插入6 Fr鞘。
- 如果担心髂股疾病,在腹主动脉下部插入尾纤导管,并对髂股系统进行血管造影,以确保没有可能阻止PVAD插入的显着外周动脉疾病(PAD)。如果髂动脉有中度疾病或钙化,请考虑使用更长的25 cm 14法国鞘,以使鞘的尖端位于腹主动脉相对健康的部分。
- 使用 8、10 和 12 Fr 扩张器在坚硬的 0.035" 导线上连续扩张动脉切开部位。然后,在荧光镜引导下插入14 Fr剥离鞘,确保尖端无阻力地前进。
- 给予肝素推注(约 100 U/kg 体重),ACT 目标为 250 至 300 秒。替代性抗凝治疗包括比伐卢定和阿加曲班。
- 使用尾纤导管通过 .035" J 尖头导线穿过左心室。卸下J线并检查LVEDP。
- 对套件中包含的交换长度为0.018"的导线的尖端进行整形,并将其插入LV中,使其在LV顶点形成稳定的曲线。
- 在插入之前,请确保ACT处于目标(250至300秒)12,13。
- 取下尾纤导管,通过将导线加载到预组装的红色管腔(例如,EasyGuide)上插入泵,直到它离开标签附近。
- 通过在握住导管的同时轻轻拉动标签来去除加载的红色腔。
- 在荧光引导下,在 0.018" 导线上以小增量将器件推进到 LV 中。
- 将泵置于左心室,其入口位于主动脉瓣下方4厘米处,并确保其没有二尖瓣脊索。太靠近顶点可能会导致PVC并触发"吸力警报"。取下 .018" 电线,卸下后,启动泵。消除多余的松弛,使泵靠在主动脉的较小曲率上。
- 监视控制台以确保电机电流脉动并显示主动脉波形。如果显示心室波形,则可能需要将泵拉回。
- 如果设备需要留在原位,请取下剥离的护套,然后插入预装在设备上的重新定位护套。
- 再次检查荧光透视仪上的设备位置和控制台上的波形。
- 在装置插入之前和之后触诊(或用多普勒感觉)下肢远端动脉脉搏,包括足背和胫骨后部。在患者的病历中适当地记录这一点。
- 如果无法获得脉搏或多普勒,请考虑使用位于设备侧面的导线重新引入端口或使用其他通道进行下肢血管造影,以确保无阻塞性血流到下肢。
- 如果血流受阻,在将患者转移到 CCU 之前放置再灌注鞘。对于梗阻性血流风险较高的 PAD 患者,强烈建议考虑在放置 14 Fr 鞘之前插入再灌注鞘(即,在上述步骤 1.4 之后)。
- 由经过使用培训的人员在重症监护病房(CCU)中监测接受PVAD治疗的患者。
2. 术后护理
- 使用无菌敷料。
- 进入皮肤时,将设备定位为45°角(重新定位鞘下方的纱布有助于保持此角度)。如果不这样做,可能导致动脉切开术渗出,导致血肿的形成。将缝合线与前向压力放置也有帮助,以避免设备迁移并防止出血。
注意:用膝关节固定器固定下肢也可以限制装置的迁移,以提醒患者不要弯曲/移动受影响的肢体。这不应该被固定得太紧,以免影响血液循环。 - 继续进行常规脉搏检查(可触及或多普勒)。
3. 定位
- 根据护理点超声检查的可用性,在转移前或到达心脏ICU后立即使用床旁经胸超声检查确认适当的设备位置。
- 使用胸骨旁长轴视图评估设备位置。如果无法获得胸骨旁长轴视图,也可以使用伤寒下视图。理想情况下,从主动脉瓣到设备入口的测量值应为3-4 cm,以便正确定位设备。
- 使用超声心动图记录设备的位置,因为它与二尖瓣有关。
- 当设备需要重新定位时,将设备调低至P2,拧下无菌盖上的锁定机构以前进或收回设备。如果尾纤或入口离二尖瓣太近,则可以将扭矩作为前进或缩回。
- 将设备锁定在新位置并记录新位置。
- 在此之后,将设备增加到所需的支持级别。
- 增加支撑级别后,重新评估设备位置,因为当速度增加时,设备可以向前跳跃。
注意:如果设备已通过主动脉瓣拉回,则最好在导管室在荧光镜引导下进行重新定位。
4. 断奶
- 当血管加压药/正性肌力药物处于低剂量或完全断奶时,考虑断奶。应持续监测血流动力学以维持CPO>0.6 W.仔细监测右心室(RV)血流动力学,目标是维持右心房压力(RAP)<12mmHg和肺动脉肺活量指数(PAPI)>1.014。还要考虑每 2-6 小时采集一次 pH 值、混合静脉饱和度和乳酸盐,以监测心脏工作和终末器官灌注。
- 在 2 小时内将功率降低 1-2 个水平,注意 CPO、PAPI、RAP、MAP 和尿量。如果CPO下降到<0.6 W,RAP开始增加,尿量下降到20 mL / h>或MAP<60 mmHg,将功率增加到以前的水平。
5. 移除12
- 使用血管闭合装置关闭动脉切开术进入部位,并在移除大孔鞘时执行装置的完全展开14。临时血管内球囊填塞或"干场闭合技术"是确保大孔15进入部位止血的有效且安全的方法。
- 将设备调低至 P1 并将设备拉回主动脉,然后更改为 P0,并在将导管从体内拔出时断开设备与控制台的连接。
- 请注意,由于存在主动脉瓣反流的风险,该装置不应在 P0 处穿过主动脉瓣。
- 如果考虑手动止血,请等到ACT<150,并保持3分钟的压力。
结果
表1显示了PVAD植入的安全性和有效性35、36、37、38、39、40。
优化 PVAD 结果
PVAD是一种资源密集型干预措施,需要大量的经验和专业知识来优化结果。应考虑以下最佳做法:
1. 在休?...
讨论
尽量减少PVAD的风险和并发症(表2)
如果发生大口径通路的并发症,例如大出血和急性肢体缺血28,29,PVAD的血流动力学益处可以显着中和。因此,必须最大限度地降低设备的风险和并发症。
为了减少进入部位并发症并减少进入尝试的次数,在获得股动脉通路时应使用超声和透视引导10,30。
披露声明
Aditya Bharadwaj博士是Abiomed的顾问,监考员和演讲者局成员。
Mir Basir博士是Abbott Vascular,Abiomed,Cardiovascular System,Chiesi,Procyrion和Zoll的顾问。
致谢
没有
材料
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
参考文献
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。