Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование чрескожных желудочковых вспомогательных устройств при остром инфаркте миокарда, осложненном кардиогенным шоком
В этой статье
Резюме
Чрескожные желудочковые вспомогательные устройства все чаще используются у пациентов с острым инфарктом миокарда и кардиогенным шоком. Здесь мы обсуждаем механизм действия и гемодинамические эффекты таких устройств. Мы также рассматриваем алгоритмы и лучшие практики для имплантации, управления и отъема этих сложных устройств.
Аннотация
Кардиогенный шок определяется как стойкая гипотензия, сопровождающаяся признаками гипоперфузии конечных органов. Чрескожные желудочковые вспомогательные устройства (ПВАД) используются для лечения кардиогенного шока в целях улучшения гемодинамики. Импелла в настоящее время является наиболее распространенной PVAD и активно перекачивает кровь из левого желудочка в аорту. ПВАД разгружают левый желудочек, увеличивают сердечный выброс и улучшают коронарную перфузию. ПВАД обычно помещают в лабораторию катетеризации сердца под флюороскопическим руководством через бедренную артерию, когда это возможно. В случаях тяжелого заболевания периферических артерий ПВАД могут быть имплантированы через альтернативный доступ. В данной статье мы обобщим механизм действия PVAD и данные, подтверждающие их применение при лечении кардиогенного шока.
Введение
Кардиогенный шок (КС) определяется как стойкая гипотензия (систолическое артериальное давление <90 мм рт.ст. в течение >30 минут, или потребность в вазопрессорах или инотропах), гипоперфузия конечного органа (диурез <30 мл/ч, прохладные конечности или лактат > 2 ммоль/л), застой в легких (легочное капиллярное клиновое давление (PCWP) ≥ 15 мм рт.ст.) и снижение сердечной деятельности (сердечный индекс <2,2) 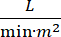 1, 2 из-за первичного сердечного расстройства. Острый инфаркт миокарда (ОИМ) является наиболее распространенной причиной CS3. КС встречается в 5-10% ОИМ и исторически была связана со значительной смертностью3,4. Устройства механической поддержки кровообращения (MCS), такие как внутриаортальный баллонный насос (IABP), чрескожные желудочковые вспомогательные устройства (PVAD), экстракорпоральная мембранная оксигенация (ЭКМО) и чрескожные левые предсердные до аортальных устройств, часто используются у пациентов с CS5. Рутинное применение IABP не продемонстрировало улучшения клинических результатов или выживаемости в AMI-CS1. Учитывая плохие результаты, связанные с AMI-CS, трудности в проведении испытаний в AMI-CS и отрицательные результаты использования IABP при AMI-CS, клиницисты все чаще обращаются к другим формам MCS.
1, 2 из-за первичного сердечного расстройства. Острый инфаркт миокарда (ОИМ) является наиболее распространенной причиной CS3. КС встречается в 5-10% ОИМ и исторически была связана со значительной смертностью3,4. Устройства механической поддержки кровообращения (MCS), такие как внутриаортальный баллонный насос (IABP), чрескожные желудочковые вспомогательные устройства (PVAD), экстракорпоральная мембранная оксигенация (ЭКМО) и чрескожные левые предсердные до аортальных устройств, часто используются у пациентов с CS5. Рутинное применение IABP не продемонстрировало улучшения клинических результатов или выживаемости в AMI-CS1. Учитывая плохие результаты, связанные с AMI-CS, трудности в проведении испытаний в AMI-CS и отрицательные результаты использования IABP при AMI-CS, клиницисты все чаще обращаются к другим формам MCS.
ПВАД все чаще используются у пациентов с AMI-CS6. В этой статье мы сосредоточим наше обсуждение в первую очередь на Impella CP, который является наиболее распространенным PVAD, используемым в настоящее время6. В этом устройстве используется осевой винтовой насос Архимеда, который активно и непрерывно продвигает кровь из левого желудочка (LV) в восходящую аорту(рисунок 1). Аппарат чаще всего помещается в лабораторию катетеризации сердца под флюороскопическим контролем через бедренную артерию. Альтернативно, он может быть имплантирован через подмышечный или транскавальный доступ принеобходимости7,8.
протокол
Этот протокол является стандартом ухода в нашем учреждении.
1. Вставка PVAD (например, Impella CP)
- Получить общий бедренный доступ над нижней половиной головки бедренной кости под флюороскопическим и ультразвуковым наведением с помощью микропунктурной иглы9,10. Расположите микропунктурную оболочку и получите ангиограмму бедренной артерии для подтверждения соответствующего расположения артериотомии11.
- Вставьте оболочку 6 Fr в бедренную артерию.
- Если есть опасения по поводу подвздошно-бедренной болезни, вставьте катетер косички в нижнюю часть брюшной аорты и выполните ангиограмму подвздошно-бедренной системы, чтобы убедиться, что нет значительного заболевания периферических артерий (PAD), которое может препятствовать введению PVAD. Если есть умеренное заболевание или кальцификация подвздошных артерий, рассмотрите возможность использования более длинной французской оболочки 25 см 14, чтобы кончик оболочки находился в относительно здоровом сегменте брюшной аорты.
- Последовательно расширяйте участок артериотомии по жесткой проволоке 0,035 дюйма с помощью 8, 10 и 12 расширителей Fr последовательно. Затем вставьте оболочку 14 Fr peel away под флюороскопическим наведением, гарантируя, что наконечник продвигается без сопротивления.
- Вводите гепариновый болюс (~ 100 Ед / кг массы тела) для цели ACT от 250 до 300 с. К альтернативным антикоагуляциям относятся бивалирудин и аргатробан.
- Используйте катетер с косичкой, чтобы перейти в LV с помощью провода с наконечником J 0,035 дюйма. Извлеките провод J и проверьте LVEDP.
- Придайте форму наконечнику провода длиной 0,018 дюйма, входящего в комплект, и вставьте его в LV так, чтобы он образовывал стабильную кривую на вершине LV.
- Убедитесь, что ACT находится на цели (от 250 до 300 с) перед вставкой12,13.
- Снимите катетер с косичкой и вставьте насос, загрузив провод на предварительно собранный загрузочный красный просвет (например, EasyGuide) до тех пор, пока он не выйдет рядом с этикеткой.
- Удалите красный просвет нагрузки, осторожно потянув за этикетку, удерживая катетер.
- Выдвигайте устройство небольшими шагами под флюороскопическим наведением в РН по проводу 0,018 дюйма.
- Поместите насос в LV с его входным отверстием на 4 см ниже аортального клапана и убедитесь, что он свободен от митральных хорд. Нахождение слишком близко к вершине может вызвать ПВХ и вызвать «сигналы всасывания». Извлеките провод .018" и после снятия запустите насос. Удалите лишнюю слабину, чтобы насос опирался на меньшую кривизну аорты.
- Следите за консолью, чтобы убедиться, что ток двигателя пульсирует и отображается форма сигнала аорты. Если отображается форма желудочкового сигнала, насос, возможно, придется оттянуть назад.
- Если устройство необходимо оставить на месте, снимите оболочку и вставьте предварительно загруженную на устройство оболочку для перемещения.
- Еще раз проверьте положение прибора при рентгеноскопии и формы сигналов на консоли.
- Пальпать (или ощущать с помощью допплера) дистальные артериальные импульсы нижних конечностей, включая дорсалис педиса и заднюю большеберцовую кость до и после введения устройства. Задокументируйте это соответствующим образом в медицинской карте пациента.
- Если импульсы или допплеры не могут быть получены, рассмотрите возможность получения ангиограммы нижних конечностей с использованием проводного повторного введения порта, расположенного на боковой стороне устройства, или с использованием другого доступа для обеспечения необструктивного потока к нижней конечности.
- Если поток затруднен, поместите реперфузионную оболочку перед переводом пациента в CCU. У пациентов с PAD, которые подвергаются высокому риску обструктивного течения, настоятельно рассмотрите возможность введения реперфузионной оболочки до размещения оболочки 14 Fr (т. Е. После шага 1.4, перечисленного выше).
- Наблюдение за пациентами, получавшими PVAD в отделении интенсивной терапии (CCU), персоналом, обученным его использованию.
2. Постпроцессуальный уход
- Нанесите стерильную повязку.
- Расположите устройство под углом 45° при входе в кожу (марля под изменяющейся оболочкой может быть полезна для поддержания этого угла). Неспособность сделать это может привести к тому, что артериотомия сочится, что приводит к образованию гематомы. Также полезно накладывать швы с передним давлением, чтобы избежать миграции устройства и предотвратить кровотечение.
ПРИМЕЧАНИЕ: Закрепление нижней конечности с помощью иммобилайзера коленного сустава также может ограничить миграцию устройства в качестве напоминания пациенту о том, чтобы он не сгибал / не двигал пораженной конечностью. Это не должно быть закреплено слишком плотно, чтобы не поставить под угрозу кровообращение. - Продолжайте выполнять рутинные проверки пульса (пальпируемые или допплеровские).
3. Позиционирование
- Используйте прикроватную трансторакальную эхокардиограмму для подтверждения соответствующего положения устройства либо до перевода, либо сразу по прибытии в кардиологическое отделение интенсивной терапии, в зависимости от наличия ультразвука в месте оказания медицинской помощи.
- Используйте вид парастернальной длинной оси для оценки положения устройства. Субксифоидный вид также может быть использован, если вид парастернальной длинной оси недоступен. Измерение от аортального клапана до входного отверстия прибора в идеале должно составлять 3-4 см для правильного позиционирования прибора.
- Используйте эхокардиограммы, чтобы отметить положение устройства, поскольку оно относится к митральному клапану.
- Когда устройство необходимо переместить, поверните устройство до P2, открутите запирающий механизм на стерильной крышке, чтобы продвинуть или убрать устройство. Можно крутить как наступающий, так и втягивающийся, если косичка или входное отверстие находится слишком близко к митральному клапану.
- Зафиксируйте устройство в новом положении и задокументируйте новое положение.
- После этого увеличьте устройство до нужного уровня поддержки.
- После повышения уровня поддержки переоцените положение устройства, так как устройство может прыгать вперед при увеличении скорости.
ПРИМЕЧАНИЕ: Если устройство было оттянуто назад через аортальный клапан, перемещение лучше проводить в катетерной лаборатории под руководством рентгеноскопии.
4. Отлучение от груди
- Рассмотрите возможность отлучения от груди, когда вазопрессоры / инотропы находятся в низких дозах или полностью отлучены от груди. Гемодинамику следует постоянно контролировать для поддержания CPO > 0,6 Вт. Тщательно контролировать гемодинамику правого желудочка (RV) с целью поддержания давления правого предсердия (RAP) <12 мм рт.ст., а индекс пульсации легочной артерии (PAPI) >1,014. Также рассмотрите возможность получения рН, смешанных венозных насыщений и лактата каждые 2-6 часов для контроля сердечной работы и перфузии конечного органа.
- Уменьшают мощность на 1-2 уровня в течение 2 часов, отмечая CPO, PAPI, RAP, MAP и выход мочи. Если CPO падает <0,6 Вт, RAP начинает увеличиваться, диурез падает > 20 мл /ч или MAP <60 мм рт.ст., увеличивают мощность до прежнего уровня.
5. Удаление12
- Используют сосудистые замыкающие устройства для закрытия места доступа к артериотомии с полным развертыванием устройства, выполняемым при удалении оболочки большого отверстия14. Временная эндоваскулярная баллонная тампонада или «техника закрытия сухого поля» является эффективным и безопасным способом обеспечения гемостаза участка доступа к большому отверстию15.
- Наберите до P1 и оттяните устройство обратно в аорту, а затем измените его на P0 и отсоедините устройство от консоли, когда катетер вытащится из корпуса.
- Обратите внимание, что устройство не следует оставлять поперек аортального клапана при Р0 из-за риска регургитации аорты.
- Если вы рассматриваете ручной гемостаз, подождите, пока ACT не <150 и удерживайте 3 минуты давления на французский размер.
Результаты
В таблице 1 показана безопасность и эффективность имплантации PVAD35,36,37,38,39,40.
Оптимизация результатов PVAD
ПВАД представляют собой ресурсоемкое в?...
Обсуждение
Минимизация рисков и осложнений PVAD (Таблица 2)
Гемодинамические преимущества PVAD могут быть значительно нейтрализованы, если возникают осложнения от доступа с большим отверстием, такие как сильное кровотечение и острая ишемия конечностей28,29. Т...
Раскрытие информации
Д-р Адитья Бхарадвадж является консультантом, проктором и членом Бюро спикеров Abiomed.
Доктор Мир Басир является консультантом Abbott Vascular, Abiomed, Cardiovascular System, Chiesi, Procyrion и Zoll.
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Ссылки
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены