Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kardiyojenik Şokun Karmaşıklaştırdığı Akut Miyokard Enfarktüsünde Perkütan Ventrikül Destek Cihazlarının Kullanılması
Bu Makalede
Özet
Akut miyokard infarktüsü ve kardiyojenik şok hastalarında perkütan ventrikül destek cihazları giderek daha fazla kullanılmaktadır. Burada, bu tür cihazların etki mekanizmasını ve hemodinamik etkilerini tartışıyoruz. Ayrıca, bu karmaşık cihazların implantasyonu, yönetimi ve toklaştırılması için algoritmaları ve en iyi uygulamaları gözden geçiriyoruz.
Özet
Kardiyojenik şok, son organ hipo-perfüzyonu kanıtı eşliğinde kalıcı hipotensiyon olarak tanımlanır. Perkütan ventrikül destek cihazları (PVAD' lar) hemodinamik gelişmek amacıyla kardiyojenik şokun tedavisinde kullanılır. Impella şu anda en yaygın PVAD'dır ve aktif olarak sol ventrikülden aort içine kan pompalar. PVAD'lar sol ventrikülü boşaltır, kardiyak çıkışı arttırır ve koroner perfüzyonu iyileştirir. PVAD'lar tipik olarak mümkün olduğunda femoral arter yoluyla floroskopik rehberlik altında kardiyak kateterizasyon laboratuvarına yerleştirilir. Şiddetli periferik arteriyel hastalık durumlarında, PVAD'ler alternatif bir erişim yoluyla implante edilebilir. Bu yazıda PVAD'ın etki mekanizmasını ve kardiyojenik şok tedavisinde kullanımlarını destekleyen verileri özetliyoruz.
Giriş
Kardiyojenik şok (CS) kalıcı hipotansiyon (sistolik kan basıncı <90 mmHg >30 dakika, veya vazopresör veya inotrop ihtiyacı), son organ hipo-perfüzyonu (idrar çıkışı <30 mL/h, soğuk ekstremiteler veya laktat > 2 mmol/L), pulmoner tıkanıklık (pulmoner kılcal kama basıncı (PCWP) ≥ 15 mmHg) ve kardiyak performansı düşürme (kardiyak indeks <2,2) 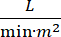 1, Primer kalp rahatsızlığı nedeniyle 2. Akut miyokard infarktüsü (AMI) CS3'ünen yaygın nedenidir. CS, AMI'nin% 5-10'unda görülür ve tarihsel olarak önemli mortalite3,4ile ilişkilendirilmiştir. CS5'lihastalarda aort içi balon pompası (IABP), perkütan ventrikül destek cihazları (PVAD), ekstrakorpozal membran oksijenasyonu (ECMO) ve perkütan sol atriyal gibi mekanik dolaşım destek (MCS) cihazları sıklıkla kullanılmaktadır. IABP'nin rutin kullanımı, AMI-CS1'deklinik sonuçlarda veya sağkalımda iyileşme göstermemektedir. AMI-CS ile ilişkili kötü sonuçlar, AMI-CS'de denemelerin yapılmasındaki zorluklar ve AMI-CS'de IABP kullanımının olumsuz sonuçları göz önüne alındığında, klinisyenler giderek daha fazla MCS'nin diğer formlarına bakıyorlar.
1, Primer kalp rahatsızlığı nedeniyle 2. Akut miyokard infarktüsü (AMI) CS3'ünen yaygın nedenidir. CS, AMI'nin% 5-10'unda görülür ve tarihsel olarak önemli mortalite3,4ile ilişkilendirilmiştir. CS5'lihastalarda aort içi balon pompası (IABP), perkütan ventrikül destek cihazları (PVAD), ekstrakorpozal membran oksijenasyonu (ECMO) ve perkütan sol atriyal gibi mekanik dolaşım destek (MCS) cihazları sıklıkla kullanılmaktadır. IABP'nin rutin kullanımı, AMI-CS1'deklinik sonuçlarda veya sağkalımda iyileşme göstermemektedir. AMI-CS ile ilişkili kötü sonuçlar, AMI-CS'de denemelerin yapılmasındaki zorluklar ve AMI-CS'de IABP kullanımının olumsuz sonuçları göz önüne alındığında, klinisyenler giderek daha fazla MCS'nin diğer formlarına bakıyorlar.
PVAD'ler AMI-CS6'lıhastalarda giderek daha fazla kullanılmaktadır. Bu yazıda, tartışmamızı öncelikle şu anda kullanılan en yaygın PVAD olan Impella CP ' ye odaklayacağız6. Bu cihaz, sol ventrikülden (LV) yükselen aort içine aktif ve sürekli olarak kan iten eksenel akışlı Arşimet vidalı pompa kullanır (Şekil 1). Cihaz en sık femoral arter yoluyla floroskopik rehberlik altında kardiyak kateterizasyon laboratuvarına yerleştirilir. Alternatif olarak, gerektiğinde bir aksiller veya transkaval erişim yoluylaimplanteedilebilir7,8.
Protokol
Bu protokol kurumumuzdaki bakım standardıdır.
1. PVAD'ın yerleştirilmesi (örneğin, Impella CP)
- Bir mikro delinme iğnesi kullanarak floroskopik ve ultrason rehberliği altında femoral başın alt yarısında yaygın femoral erişim eldeedin 9,10. Mikro delinme kılıfını yerleştirin ve uygun arteriotomi yerini doğrulamak için femoral arter anjiyogramı elde edin11.
- Uyluk atardamarına 6 Fr kılıf yerleştirin.
- İlio-femoral hastalık endişesi varsa, abdominal aortun alt kısmına bir pigtail kateter yerleştirin ve PVAD takılmasını önleyebilecek önemli bir periferik arter hastalığı (PAD) olmadığından emin olmak için iliofemoral sistemin anjiyogramını yapın. Orta derecede hastalık veya iliak arterlerde kireçlenme varsa, kılıfanın ucunun karın aortunun nispeten sağlıklı bir bölümünde olması için daha uzun bir 25 cm 14 Fransız kılıfi kullanmayı düşünün.
- Arteriotomi bölgesini 8, 10 ve 12 Fr dilatörleri kullanarak 12 sıralı olarak sert bir .035" tel üzerinde seri olarak genişletin. Daha sonra, 14 Fr kabuğunu floroskopik rehberlik altında yerleştirin ve ucun direnç olmadan ilerlemesini sağlayın.
- 250 ila 300 s ACT hedefi için heparin bolus (~100 U/kg vücut ağırlığı) uygulayın. Alternatif antikoagülasyon bivalirudin ve argatroban içerir.
- .035" J uçlu bir tel kullanarak LV'ye geçmek için bir pigtail kateter kullanın. J kabloyu çıkarın ve bir LVEDP'yi kontrol edin.
- Kitte bulunan 0,018" telin değişim uzunluğunun ucunu şekillendirin ve LV apeksinde kararlı bir eğri oluşturan LV'ye yerleştirin.
- 12,13eklemeden önce ACT'nin hedefte (250 ila300s) olduğundan emin olun.
- Pigtail kateterini çıkarın ve teli önceden monte edilmiş yükleme kırmızı lümeninin (örneğin EasyGuide) etiketin yakınından çıkana kadar yükleyerek pompayı takın.
- Kateteri tutarken etiketi hafifçe çekerek yükleme kırmızı lümenini çıkarın.
- Cihazı floroskopik rehberlik altında küçük artışlarla 0,018" tel üzerinden LV'ye ilerletin.
- Pompayı aort kapağının 4 cm altına girişi ile LV'ye yerleştirin ve mitral konkordatodan arındırılmış olduğundan emin olun. Tepeye çok yakın olmak PVC'lere neden olabilir ve "emiş alarmlarını" tetikleyebilir. .018" kabloyu çıkarın ve çıkarıldıktan sonra pompayı çalıştırın. Pompanın aortu daha az eğriliğine dayanması için fazla bolluğu çıkarın.
- Motor akımının pulsatile olduğundan ve aort dalga biçiminin görüntülendiğinden emin olmak için konsolu izleyin. Ventrikül dalga formu görüntülenirse, pompanın geri çekilmesi gerekebilir.
- Cihazın yerinde bırakılması gerekiyorsa, tavus kılıfi çıkarın ve yeniden konumlandırma kılıfi cihaza önceden yüklenmiş olarak yerleştirin.
- Floroskopideki cihaz konumunu ve konsoldaki dalga biçimlerini tekrar kontrol edin.
- Palpate (veya Doppler ile duyu), cihazın takılması öncesinde ve sonrasında dorsalis pedis ve posterior tibial dahil olmak üzere distal alt ekstremite arteriyel darbeleri. Bunu hastanın tıbbi kaydında uygun şekilde belgele.
- Darbeler veya doppler elde edilemezse, cihazın yan tarafında bulunan tel yeniden giriş portu veya alt ekstremiteye engelleyici olmayan akış sağlamak için başka bir erişim kullanarak daha düşük bir ekstremite anjiyogram almayı düşünün.
- Akış tıkanmışsa, hastayı CCU'ya transfer etmeden önce bir reperfüzyon kılıfı yerleştirin. Obstrüktif akış riski yüksek olan PAD'li hastalarda, 14 Fr kılıfının yerleştirilmesinden önce reperfüzyon kılıfını eklemeyi kesinlikle düşünün (yani, yukarıda listelenen 1.4 adımdan sonra).
- Kritik bakım ünitesinde (CCU) PVAD ile tedavi edilen hastaları, kullanımı konusunda eğitimli personel tarafından izleyin.
2. Prosedür sonrası bakım
- Steril pansuman uygulayın.
- Cilde girerken cihazı 45° açıyla konumlandırın (yeniden konumlandırma kılıfa altındaki gazlı bez bu açıyı korumak için yardımcı olabilir). Bunun yapılmaması arteriotomi sızıntısına neden olarak hematom oluşumuna neden olabilir. Cihaz göçünü önlemek ve kanamayı önlemek için dikişlerin ileri basınçla yerleştirilmesi de faydalıdır.
NOT: Alt ekstremiteyi diz hareketsizleştirici ile sabitlemek, hastaya etkili uzvu bükmemelerini/hareket ettirmemelerini hatırlatmak için cihaz geçişini de sınırlayabilir. Bu, dolaşımı tehlikeye atmayacak şekilde çok sıkı sabitlenmemelidir. - Rutin nabız kontrolleri yapmaya devam edin (hissedilebilir veya Doppler).
3. Konumlandırma
- Bir bakım noktası ultrasonunun mevcudiyetine bağlı olarak, transferden önce veya kardiyak yoğun bakıma varışta uygun cihaz konumunu doğrulamak için başucu transtorasik ekokardiyogram kullanın.
- Cihaz konumunu değerlendirmek için parasternal uzun eksen görünümü kullanın. Parasternal uzun eksen görünümü elde edilemezse, subksipoid görünümü de kullanılabilir. Aort kapağından cihaz girişine kadar bir ölçüm, cihazın uygun şekilde konumlandırılması için ideal olarak 3-4 cm olmalıdır.
- Mitral kapakla ilgili olarak cihazın konumunu not etmek için ekokardiyogramları kullanın.
- Bir cihazın yeniden konumlandırılması gerektiğinde, cihazı P2'ye kısın, cihazı ilerletmek veya geri çekmek için steril kapak üzerindeki kilitleme mekanizmasını sökün. Domuz kuyruğu veya giriş mitral valf çok yakınsa, ilerleyen veya geri çekilen olarak torklanabilir.
- Cihazı yeni konuma kilitleyin ve yeni konumu belgeleyin.
- Bunu takiben, cihazı istediğiniz destek seviyesine çıkarın.
- Destek düzeyini artırdıktan sonra, hız arttığında cihaz ileri atlayabildiğinden cihaz konumunu yeniden değerlendirin.
NOT: Cihaz aort kapağı boyunca geri çekilmişse, yeniden konumlandırma floroskopi rehberliğinde kath laboratuvarında daha iyi yapılır.
4. Weaning
- Vazopresörler / inotroplar düşük dozlarda olduğunda veya tamamen kesildiğinde kesmeyi düşünün. 0,6 W'lık bir CPO > korumak için hemodi > Ayrıca kardiyak çalışmayı ve son organ perfüzyonunu izlemek için her 2-6 saatte bir pH, karışık venöz doygunluk ve laktat elde etmeyi düşünün.
- CPO, PAPI, RAP, MAP ve idrar çıkışına dikkat ederek gücü 2 saat boyunca 1-2 seviye azaltın. CPO 0.6 W < düşerse RAP artmaya başlar, idrar çıkışı 20 mL/s'> veya MAP <60 mmHg'ye düşer, gücü önceki seviyeye yükseltir.
5. Kaldırma12
- Büyük delik kılıfi çıkarıldığında gerçekleştirilen cihazın tam dağıtımı ile arteriotomi erişim bölgesini kapatmak için vasküler kapatma cihazlarını kullanın14. Geçici endovasküler balon tamponatı veya "kuru alan kapatma tekniği", büyük delikli erişim sitesinin hemostazını sağlamanın etkili ve güvenli bir yoludur15.
- P1'e çevirin ve cihazı aort içine geri çekin ve ardından P0'a değiştirin ve kateter gövdeden çıkarılırken cihazın konsoldan bağlantısını kesin.
- Aort kusma riski nedeniyle cihazın P0'daki aort kapağı boyunca bırakılmaması gerektiğini unutmayın.
- Manuel hemostaz düşünüyorsanız, ACT <150'ye kadar bekleyin ve Fransız boyutu başına 3 dakika basınç tutun.
Sonuçlar
Tablo 1, PVAD implantasyonunun 35, 36 ,37,38,39,40'ıngüvenliğini ve etkinliğini gösterir.
PVAD Sonuçlarını En İyi Duruma Getirme
PVAD'ler, sonuçları optimize etmek için önemli deneyim ve uzmanlık gerektiren kaynak ağırlıklı bir müdahaledir. A?...
Tartışmalar
PVAD'ın Risk ve Komplikasyonlarını En Aza indirmek (Tablo 2)
PVAD'ın hemodinamik yararları, majör kanama ve akut uzuv iskemisi28,29gibi büyük delikli erişimden kaynaklanan komplikasyonlar meydana gelirse önemli ölçüde nötralize edilebilir. Bu nedenle cihazın riskini ve komplikasyonlarını en aza indirmek önemlidir.
Erişim bölgesi komplikasyonlarını azaltmak ve erişim girişimlerinin sayısını...
Açıklamalar
Dr. Aditya Bharadwaj, Abiomed Konuşmacılar Bürosu'nun danışmanı, proktörü ve üyesidir.
Dr. Mir Basir Abbott Vasküler, Abiomed, Kardiyovasküler Sistem, Chiesi, Procyrion ve Zoll için danışmandır.
Teşekkürler
Hiç kimse
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Referanslar
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır